Опубликовано в журнале:
«Трудный пациент», 2010, Том 8, № 8, с. 4-8Современные принципы лечения больных с абсцедирующими формами воспалительных заболеваний придатков матки
В.А.Лебедев, В.М. Пашков, И.А.Клиндухов
Московская медицинская академия им. И.М.Сеченова
Кафедра акушерства и гинекологии №2 лечебного факультетаВоспалительный процесс придатков матки по-прежнему занимает первое место в структуре гинекологической заболеваемости. Причем, почти у каждой десятой больной диагностируются гнойные воспалительные образования маточных труб и яичников. Особое социальное значение проблеме придает тот факт, что значительное повышение заболеваемости в последнее десятилетие отмечено среди молодых женщин, ещё не реализовавших свою генеративную функцию. В возрастной группе от 18 до 24 лет она увеличилась в 1,4 раза, а в группе от 2 5 до 29 лет - в 1,8 раза. До недавнего времени любая абсцедирующая форма воспалительного заболевания придатков матки являлась практически абсолютным показанием к их удалению, что приводило к утрате или значительному снижению фертильности [9].
Широкое внедрение в клиническую медицину высокоэффективных антибактериальных и иммунокорригирующих препаратов, успехи эндоскопической хирургии, разработка новых технологий инвазивных вмешательств послужило стимулом к развитию органосберегающих методик лечения больных с гнойными воспалительными заболеваниями придатков матки [1,8].
Мы провели обследование и лечение 68 больных в возрасте от 22 до 35 лет (28,4±3,2 лет) с абсцедирующими формами воспалительного процесса придатков матки. В анамнезе у обследованных больных отмечались неоднократные внутриматочные вмешательства, эпизоды воспалительного процесса гениталий, использование ВМК (у 7 пациенток - более 4 лет).
Диагноз гнойного воспалительного заболевания придатков матки (абсцедирующая форма) ставился на основании клинических проявлений: выраженные боли в нижних отделах живота, гипертермия до 37,5-38,5°С, симптомы интоксикации; данных общего обследования (болезненность нижних отделов живота, перитонеальные симптомы), данных специального гинекологического исследования (утолщенные, болезненные придатки матки, тубоовариальные образования).
Правильной постановке диагноза способствовали результаты трансвагинальной эхографии. При этом визуализировались расширенные маточные трубы с эхоплотной капсулой, заполненные анэхогенным содержимым со среднедисперсной эхопозитивной взвесью (у 42 больных). В ткани яичников определялись жидкостные полости, внутренняя структура которых была представлена хаотично расположенной мелкодисперсной взвесью на фоне повышенного уровня звукопроводности (отражение от гнойного экссудата); рядом с абсцессом яичника обнаруживалась ткань функционирующего яичника (наличие фолликулярного аппарата). Данная эхографическая картина установлена у 26 пациенток. Лабораторные данные также подтверждали наличие гнойного воспалительного процесса придатков матки: лейкоцитоз (более 15 109/л), палочкоядерный сдвиг формулы крови влево.
Исследование микрофлоры цервикального канала обследованных пациенток позволило выявить полимикробный пейзаж, в основном представленный факультативными анаэробами. Наиболее часто встречались грамположительные кокки (Streptococcus pyogenus, Staphylococcus aureus, Staphylococcus epidermidis), грамотрицательные кокки - Escherichia coli. При общем и местном снижении иммунитета данная флора, являющаяся условно патогенной, имеет большое значение в генезе воспалительных процессов придатков матки [9]. Из патогенной флоры у обследованных больных также были установлены микроорганизмы, входящие в группу ИППП (хламидии, микоплазмы, уреаплазмы, циомегаловирусы).
У всех больных, кроме бактериологического подтверждения этиологии заболевания, было проведено определение чувствительности выделенных микроорганизмов к антибиотикам, что необходимо для проведения успешной антибактериальной терапии.
Исследования иммунного статуса включало определение фенотипа лимфоцитов методом иммуноферментного анализа с помощью моноклональных антител (ООО «Сорбент», Москва) к структурам CD3+ (Т-лифоциты), CD4+ (Т-хелперы) CD8+ (Т-цитотоксические лимфоциты), CD 16+ (NK-клетки), CD20+ (В-лифоциты). Количественный анализ проводили на люминесцентном микроскопе «Люмам» («ЛОМО», Россия).
Реализация органосберегающего подхода к лечению больных абсцедирующими формами воспалительных заболеваний придатков матки не противоречит основополагающим принципам гнойной хирургии. Во-первых, постулат «ubi pus, ibi incisio» не отвергается. Полная эвакуация гноя и санация органа у наших больных достигалась не за счет широкого разреза, а путем применения средств ультразвуковой хирургии. Во-вторых, у всех обследованных больных проводилась комплексная этиотропная и патогенетически обоснованная терапия, воздействующая на основные звенья воспалительного процесса (рис. 1).
Рис. 1. Основные патогенетические механизмы гнойного воспаления придатков матки и «точки приложения» этиотропной и патогенетической терапии.
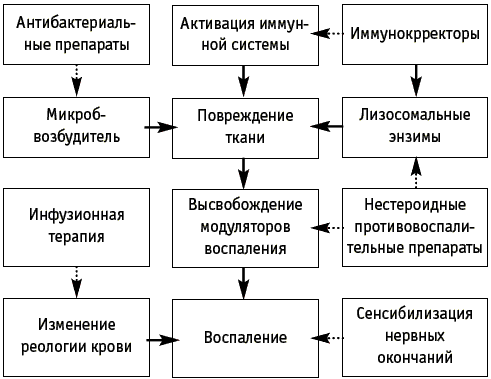
Поэтому, исходя из вышеизложенного, мы применяли следующую тактику ведения больных с абсцедирующими формами воспалительных заболеваний придатков матки: сначала проводили активное дренирование гнойных образований под контролем трансвагинальной эхографии, после которого применяли патогенетически обоснованную терапию: антибактериальную, ин-фузионную, препараты для воздействия на активность медиаторов и модуляторов воспаления, а также иммуномодулирующую терапию.
Активное дренирование гнойных образований придатков матки под контролем трансвагинального ультразвукового сканирования является простым, наименее инвазивным и, вместе с тем, достаточно эффективным способом эвакуации гноя и санации очага. Данная методика малоинвазивной хирургии была успешно применена у всех обследованных больных. При этом было эвакуировано от 10 до 40 мл гнойной жидкости.
Антибактериальная терапия при гнойном поражении придатков матки является этиотропным лечением. Всем больным антибактериальная терапия проводилась с учётом необходимых условий. А таковыми для успешной антибактериальной терапии являются:
- Точная верификация диагноза по нозологическим формам с обязательным бактериологическим подтверждением этиологии заболевания и определением чувствительности выделенных микроорганизмов к антибиотикам.
- Устранение факторов, препятствующих лечению, т. е. всем больным нами было проведено активное дренирование гнойных образований придатков матки под контролем трансвагинального ультразвукового сканирования.
- Выбор оптимального препарата производили с учётом его спектра активности, переносимости конкретной пациенткой, фармакокинетических особенностей препарата.
- Адекватной продолжительностью лечения мы считали длительность введения антибактериальных препаратов, которую прекращали через трое суток после исчезновения основных клинических проявлений острого воспалительного процесса (лихорадки, перитонеальных симптомов, лейкоцитоза).
Однако состояние больных абсцедируюшими формами воспалительных заболеваний придатков матки требует проведения этиотропного лечения, не дожидаясь информации о характере возбудителя и его чувствительности. Поэтому антибактериальную терапию мы начинали сразу, при поступлении больных в гинекологический стационар, с препаратов широкого спектра действия, принимая во внимание, что за развитие гнойного воспаления ответственны ассоциации аэробных бактерий (39,3%), ассоциации анаэробных бактерий (33,5%) смешанные аэробно-анаэробные ассоциации (16,1%) и лишь в каждом десятом случае - моноинфекция [9, 12]. Клинический опыт показывает, что наиболее эффективны комбинации двух и более антибактериальных препаратов синергического действия.
Этиотропное лечение начинали с внутривенного введения антибактериальных препаратов. Позже антибиотики вводили внутримышечно или перорально. Сочетание пиперациллин-гентамицин мы применяли при инфекциях, вызванных грамотрицательными аэробными палочками и кокками. Комбинация клиндамицин-гентамицин обладает наибольшим спектром противомикробной активности и признана «золотым стандартом» для лечения смешанных инфекций. Данное сочетание антибактериальных средств (или же гентамицин в комбинации с цефатоксимом) мы использовали при лечении тяжёлых форм гнойной инфекции, связанных с внутриматочными вмешательствами или ВМК. При специфической этиологии воспалительного процесса мы применяли сочетание доксициклина-цефокситин, которое обладает выраженной активностью по отношению к хламидиям и гонококкам, включая пенициллиназопродуцирующие штаммы последних [2].
Другими важными направлениями патогенетической терапии следует считать детоксикацию, включая комплекс мер по улучшению микроциркуляции и реологии крови; воздействие на медиаторы и модуляторы воспаления; дифференцированную иммунокоррекцию.
Инфузионная терапия снижает уровень эндогенной интоксикации, способствует поддержанию оптимальных параметров гемодинамики, реологических свойств, объёма, белкового и ионного состава циркулирующей крови. Эффект детоксикации достигается за счёт гиперволемической гемодилюции. Использование растворов с более высокой, чем у плазмы, осмоляльностью (гиперосмоляльные растворы солей, глюкозы маннита, мочевины) или с более высоким коллоидно-онкотическим давлением (гиперонкотические коллоидные растворы или их комбинации) позволяет добиться перераспределения жидкости между сосудистым руслом и тканями.
Инфузионную терапию начинают с введения коллоидных растворов (полиглюкин, реополиглюкин, гелофузин). Они снижают вязкость крови, способствуют восстановлению кровотока в капиллярах, тормозят агрегацию форменных элементов крови, обеспечивают детоксикационный и диуретический эффекты. Другим важным компонентом инфузионной терапии являются простые и сложные солевые растворы, введение которых необходимо для нормализации водно-электролитного баланса. Общий объём инфузионной терапии у обследованных нами больных составлял от 1,5 до 2 л в сутки при соотношении коллоидных и кристаллоидных растворов 2:1. Инфузионную терапию продолжали 2-3 суток.
Воздействие на активность медиаторов и модуляторов воспаления достигается за счёт назначения нестероидных противовоспалительных препаратов (НПВП). Они оказывают влияние на основные патогенетические механизмы воспалительных реакций:
- уменьшают проницаемость капилляров, вследствие чего снижается интенсивность экссудативных проявлений воспалительных реакций [3];
- стабилизируют мембраны лизосом, что приводит к ограничению выхода в клетку и за её пределы лизосомальных гидролаз, способных повреждать любые тканевые компоненты;
- тормозят выработку АТФ и других макроэргических соединений, что приводит к угнетению воспалительной реакции;
- тормозят синтез и/или инактивируют медиаторы воспаления (простагландины, брадикинин, лейкотриены, гистамин, серотонин, лимфокины и т. д.), что определяет наличие болеутоляющих и жаропонижающих свойств препаратов этой группы;
- вызывают модификацию молекулярной конформации субстратов воспаления, препятствуя их вступлению в химические реакции с повреждающими факторами;
- тормозят пролиферативную фазу воспаления и, благодаря цитостатическому действию, уменьшают поствоспалительный склеротический процесс.
Группа НПВП включает салицилаты (ацетилсалициловая кислота), пиразолоны (анальгин), производные индолуксусной (метиндол), фенилуксусной (диклофенак), пропионовой (напросин), антраниловой (понстан, клотам) кислот, оксикамы (роксикам). Выбор препарата осуществляли в зависимости от клинической ситуации: для купирования лихорадки мы назначали аспирин и парацетамол, с целью обезболивания - анальгин или кеторолак, для достижения противовоспалительного эффекта - диклофенак или индометацин, преимущественно в форме ректальных суппозиториев.
Иммунокорригирующую терапию начинают на ранних этапах развития заболевания, сразу же после эвакуации воспалительного экссудата и дренирования гнойной полости. Задачами иммунотерапии являются: повышение эффективности, переносимости, безопасности всего комплекса лечебных мероприятий, функциональную активность и восстановление иммунной системы больного, предотвращение рецидивов заболеваниях [11].
Новым отечественным иммунокорригирующим препаратом является Полиоксидоний®. Данный препарат представляет собой уникальную полимерную молекулу, обладающую многогранным положительным воздействием на организм человека. Это воздействие заключается в иммуномодулирующем, детоксицирующем, антиоксидантном, мембраностабилизирующем эффектах [4-7,10].
Полиоксидоний® является физиологически активным соединением с молекулярной массой 100 kD и обладает выраженной иммуномодулирующей активностью. По своей химической структуре он является сополимером N-окси 1,4-этиленпиперазина и (N-карбоксиэтил-) 1,4-этиленпиперазиния бромида.
Препарат обладает иммуномодулирующим действием, увеличивает резистентность организма в отношении локальных и генерализованных инфекций. Основой механизма иммуномодулирующего действия Полиоксидония® является прямое воздействие на фагоцитирующие клетки и естественные киллеры, а также стимуляция антителообразования.
Иммуномодулирующий эффект связан со способностью Полиоксидония® нормализовать функциональную активность клеток моноцитарно-макрофагальной системы, активация клеток которой ведёт к повышению функциональной активности практически всех звеньев защиты организма от инфекции:
- факторов естественной резистентности: нейтрофилов, моноцитов, макрофагов, NK-клеток;
- факторов приобретенного иммунитета: гуморального и клеточного.
Детоксицирующее действие связано с особенностями химической структуры Полиоксидония®, который, являясь высокомолекулярным веществом, содержит на своей поверхности большое количество активных группировок. В силу этого Полиоксидоний® обладает способностью сорбировать различные токсические вещества, в том числе микробной природы.
Антиоксидантное и мембраностабилизирующее свойства Полиоксидония® также тесно связаны с особенностями его химической структуры. Полиоксидоний® повышает устойчивость мембран клеток к цитотоксическому действию лекарственных препаратов и химических веществ, снижает их токсичность.
Полиоксидоний® характеризуется высокой биодоступностью (89%), достигая максимальной концентрации в крови при внутримышечном введении через 40 минут, быстро распределяется по всем органам и тканям. Период полураспределения в организме при внутривенном введении - 25 мин, полувыведения (медленная фаза) - 25,4 ч, при внутримышечном введении -36,2 ч. В организме препарат гидролизуется и выводится преимущественно через почки.
Полиоксидоний® оказывает влияние на все звенья защиты организма от чужеродных агентов антигенной природы, повышая пониженные и понижая повышенные показатели иммунитета, т. е. является истинным им- муномодулятором. Мишенями для Полиоксидония® являются клетки фагоцитарной системы и естественные киллеры. Он может стимулировать или оказывать костимулирующий эффект на продукцию этими клетками IL 1., IL 6, TNF-a. и интерферона. Другим важным свойством Полиоксидония® является его способность усиливать способность фагоцитов убивать бактерии. При недостаточности гуморального иммунитета Полиоксидоний® существенно усиливает антителообразование. Помимо иммуномодулирующего эффекта, Полиоксидоний® характеризуется наличием детоксицирующей, антиоксидантной и мембраностабилизирующей активности. Это делает его незаменимым препаратом в комплексном лечении острых и хронических инфекций любой этиологии.
Показано, что под влиянием Полиоксидония® приходят в движение все звенья защиты организма от чужеродных агентов антигенной природы: фагоцитоз, Т- и В-система иммунитета, причем первичными мишенями для действия Полиоксидония® являются нейтрофилы, моноциты/макрофаги и естественные киллеры. По механизму действия на факторы иммунной защиты Полиоксидоний® является классическим примером иммуномодулятора: он исправляет нарушенные, не действуя на нормальные показатели иммунитета. Особенно чётко это проявляется на модели цитокинов и естественных киллеров. Так, например, при исходно пониженных или средних уровнях Полиоксидоний® может повысить продукцию фактора некроза опухоли, при исходно повышенном уровне указанного показателя он несколько понижает его продукцию. Механизмом действия обоснованы показания для клинического применения Полиоксидония®.
Полиоксидоний® разрешен к медицинскому применению у детей и взрослых в трех лекарственных формах: в виде инъекций , суппозиториев и таблеток.
Инъекционная форма Полиоксидония® нашла широкое применение в комплексном лечении при ряде хронических инфекционно-воспалительных процессов любой локализации и этиологии. Показана высокая клиническая эффективность этого иммуномодулятора в лечении хирургических инфекций, инфекций урогенитального, желудочно-кишечного и бронхолегочного трактов. Полиоксидоний® хорошо взаимодействует с антибактериальными, противогрибковыми и противовирусными препаратами, а также с интерферонами и индукторами интерферонов. При совместном применении антибиотика и иммуномодулятора формируется «двойной» удар: по этиологическому и патогенетическому механизмам развития заболевания. Полиоксидоний® стимулирует функциональную активность клеток иммунной системы: непосредственно - нейтрофилов, моноцитов/макрофагов и естественных киллеров, опосредованно - клеточный и гуморальный иммунитет. Именно от клеточного и гуморального иммунитета в конечном итоге зависит элиминация возбудителя из организма, а антимикробный препарат приводит к гибели возбудителя или понижает его функциональную активность. Следует также отметить, что большим преимуществом Полиоксидония® по сравнению с другими иммуномодуляторами является многогранность его положительного воздействия на организм человека и возможность использования в острый период заболевания. Как уже упоминалось, помимо иммуномодулирующего эффекта Полиоксидоний® обладает детоксицирующими, антиоксидантными и мембранопротекторными свойствами, которые делают его препаратом первого выбора при лечении заболеваний, связанных с нарушениями иммунной системы.
С целью оценки клинической эффективности применения препарата Полиоксидоний® в комплексной терапии больных с абсцедирующими формами воспалительных заболеваний придатков матки все обследованные пациентки были разделены на две группы, сопоставимые по выраженности клинических симптомов и иммунологических параметров, локализации патологического процесса и применению компонентов лечения. Первую (основную) группу составили 32 пациентки, которым в комплекс терапии, кроме антибактериальных, дезинтоксикационных средств, а также препаратов, воздействующих на медиаторы и модуляторы воспаления, включили применение Полиоксидония®, во второй -контрольной - группе (36 женщин) было использовано общепринятое лечение.
Полиоксидоний® вводили по следующей схеме. При купировании острого воспалительного процесса в первые два дня применяли по 6 мг внутримышечно каждый день, в последующие дни (с 3-го по 11-й) - по 6 мг через день.
Критериями эффективности проведенной терапии были: общее самочувствие, длительность лихорадки, выраженность болевого синдрома динамика перитонеальных симптомов; показатели лейкоцитоза и активности острофазовых реактантов крови, а также иммунологические показатели.
Дренирование гнойных воспалительных образований под контролем трансвагинальной эхографии и проведение комплексной этиотропной и патогенетической терапии у всех обследованных больных оказалось эффективным. После проведённой малоинвазивной хирургии и комплексного лечения у всех больных отмечалось уменьшение объема образований в области гениталий и инфильтративных перифокальных воспалительных изменений, определяемых при бимануальном исследовании.
Однако темпы улучшения состояния, динамика исчезновения общих и местных клинических симптомов заболевания, острофазовые показатели крови и иммунологические параметры оказались различными у пациенток основной и контрольной групп.
Так, у пациенток основной группы длительность лихорадки составила 2 дня, у больных контрольной группы -3-4 дня. Количество лейкоцитов и активность острофазовых показателей крови снизилось и нормализовалось у пациенток первой группы в течение 3 дней, в то время как у больных второй - через 5-6 дней.
Контрольная трансвагинальная эхография позволила оценить клинический эффект проведенного лечения и установить более быстрое исчезновение ультразвуковых признаков острого воспалительного процесса придатков матки, полное исчезновение очага гнойного воспаления, полость которого замещается грануляционной тканью, у пациенток основной группы. Это свидетельствует о системном воздействии препарата Полиоксидоний®.
Иммунологические показатели также существенно различались у больных, получавших и не получавших Полиоксидоний®.
Показатели CD3+, CD4+, CD8+, CD16+, CD20+ у пациенток основной и контрольной групп до начала лечения не различались. При этом отмечалось снижение CD3+, CD4+, CD8+ лимфоцитов и повышение CD16+, CD20+ клеточных элементов до начала реализации лечебных мероприятий (малоинвазивного хирургического вмешательства и комплексной этиотропной и патогенетической терапии). После проведенного лечения отмечено статистически достоверное повышение показателей CD3+, CD4+ у пациенток основной группы по сравнению с контрольной.
Таким образом, применение иммуномодулирующего препарата Полиоксидоний® в комплексной терапии больных с абсцедирующими формами воспалительных заболеваний придатков матки приводит к повышению эффективности лечебных мероприятий. Это выражается в ускорении темпов исчезновения общих и местных симптомов заболевания, эхографических признаках воспаления, а также способствует нормализации иммунного статуса обследованных пациенток. Иммуномодулятор Полиоксидоний® целесообразно включать в комплекс терапии больных с гнойными воспалительными заболеваниями придатков матки.
ЛИТЕРАТУРА
1. Адамян Л.В., Козаченко А.В. Современные подходы к хирургическому лечению гнойно-воспалительных образований органов малого таза. В кн.: Эндоскопия в гинекологии / Под редакцией В.И. Кулакова, Л.В. Адамян. М.: 1999; 418-24.
2. Гомберг М. А., Соловьев А. М Алгоритмы диагностики и лечения наиболее распространенных инфекций, передаваемых половым путем // Трудный пациент. 2004; 5: 2: 3-8.
3. Курбанова Д.Ф. Клиническое значение исследования экспрессии генов цитокинов для оценкиэффективности хирургического лечения больных гнойным воспалением придатков матки // Вопросы гинекологии, акушерства и перинатологии. 2002; 1 (1): 56-59.
4. Петров Р.В., Хаитов P.M., Некрасов А.В. и др. Полиоксидоний: механизм действия и клиническое применение // Медицинская иммунология. 2000; 2: 3: 271-278.
5. Петров Р.В., Хаитов P.M., Некрасов А.В. и др. Полиоксидоний -препарат нового поколения иммуномодуляторов с известной структурой и механизмом действия // Иммунология. 2000; 5: 24-29.
6. Пинегин Б.В., Некрасов А.В., Хаитов P.M. Имуномодулятор полиоксидоний: механизмы действия и аспекты клинического применения // Цитокины и воспаление. 2004; 3: 3:41-47.
7. Пинегин Б. В., Сараф А. С. Иммуномодуляторы в лечении инфекционно-воспалительных процессов урогенитального тракта //Лечащий врач. 2008; 9:1:45-50.
8. Стрижаков А.Н., Давыдов А.И., Курбанова Д.Ф. Патогенетическое обоснование хирургического лечения больных гнойными воспалительными тубо-овариальными образованиями В сб. «Актуальные вопросы акушерства, гинекологии и перинатологии», Москва - Сургут, 2001; 240-249.
9. Стрижаков А.Н., Подзолкова Н.М. Гнойные воспалительные заболевания придатков матки. М.: Медицина, 1996.
10. Хаитов Р. М., Пинегин Б. В. Полиоксидоний: новые аспекты применения. Новые лекарства. 2003; 3:154-162.
11. Шабашова Н.В. Иммунитет и «скрытые инфекции» Медлайн-Экспресс, 2004; 4:10-12.
12. Brook I. Bacterial synergy in pelvic inflammatory disease // Arch Gynecol 1987; 241 (6): 133-43.
| Апрель 2012 г. |