Опубликовано в журнале:
РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ. ТОМ 15, № 4, 2007Комплексное лечение боли
ММА имени И.М. Сеченова
К.м.н. А.Н. БариновБоль - самая частая причина обращения пациента за медицинской помощью. Болевой синдром является основной причиной снижения качества жизни больных при большинстве заболеваний и может доминировать в их клинической картине - быть основным, а иногда и единственным симптомом болезни. При этом способность переживать боль является важнейшим защитным механизмом, обеспечивающим выживание, обучение и адаптацию живых организмов к изменяющимся условиям внешней среды. Боль не только информирует о тканевом повреждении, но и вызывает рефлекторные и поведенческие реакции, позволяющие свести повреждающее воздействие к минимуму. Так, острая боль в суставе предупреждает о развитии воспаления и побуждает ограничить или изменить траекторию движения, чтобы не травмировать поврежденный сустав. Острая боль в спине предупреждает о повреждении опорно-двигательного аппарата и побуждает уменьшить физическую нагрузку и занять позу, облегчающую страдания. В случае реального повреждения тканей развиваются острая боль и повышенная чувствительность (гипералгезия), которые носят защитный характер и в норме полностью регрессируют после заживления, что биологически оправдано. В ряде случаев боль регрессирует до заживления тканей (например, при гематомах, порезах, ссадинах), такие боли называют транзиторными. Боль, которая связана с активацией болевых рецепторов (ноцицепторов) после тканевого повреждения и соответствует степени тканевого повреждения и длительности действия повреждающих факторов, а затем полностью регрессирует после заживления, называется ноцицептивной.
В противоположность ноцицептивным болям, неприятные сенсорные ощущения могут сохраняться или появляться после заживления: в этом случае они не несут защитной функции, а являются причиной страдания. Появление таких болей обычно связано с поражением периферической или центральной нервной систем, и они относятся к хроническим. Хроническая боль рассматривается как боль, которая "оторвалась" от основного заболевания и приобрела "надорганный" характер. Международная ассоциация по изучению боли определяет хроническую боль, как "...боль, которая продолжается сверх нормального периода заживления". Существуют различные подходы в оценке длительности хронической боли. По мнению экспертов Международной ассоциации по изучению боли, о хронической боли следует говорить в тех случаях, когда ее длительность составляет не менее 3 мес.
Процесс хронизации боли начинается с самого ее начала. Чем длительнее и интенсивнее болит тот или иной участок тела, тем сильнее "растормаживается" тот отдел нервной системы, который "контролирует" больной участок. Каждый новый приступ боли проторяет и облегчает дорогу для следующего болевого пароксизма. Если в начале заболевания боль в спине возникает, к примеру, при подъеме тяжести больше 50 кг, то по мере развития болезни порог снижается до 10 кг, потом - до 3 кг, а вскоре обострения боли провоцируются уже просто неловким движением или эмоциональным стрессом. Срабатывает так называемая "болевая память".
Поэтому главным отличием хронической боли от острой является не временный фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
В организме параллельно существуют и взаимодействуют две противоположные системы - ноцицептивная (проводящая боль) и антиноцицептивная (подавляющая проведение и восприятие боли). Нарушение баланса между этими двумя системами в сторону активации ноцицептивной системы или подавления активности анти- ноцицептивной системы и приводит к развитию хронических болевых синдромов.
В настоящее время накапливается все больше свидетельств того, что в основе патофизиологических процессов развития хронических болевых синдромов лежит индивидуальная генетически обусловленная пред-расположенность (рис. 1). Генетической детерминированностью хронизации болевых синдромов, возможно, объясняется тот факт, что одно и то же заболевание у разных людей может протекать по-разному: в одних случаях боль переходит в хроническую форму, в других - нет. Выявляются связи полиморфизма ряда генов, кодирующих:
более 50 нейротрансмиттеров, их рецепторов и переносчиков, 8 ионных каналов и их субъединиц. 15 провоспалительных цитокинов и их рецепторов, около 15 нейротрофических факторов и их рецепторов, более 15 внутриклеточных мессенджеров с развитием отдельных видов хронической и невропатической боли, а также с резистентностью болевых синдромов к терапии. Уже можно с уверенностью говорить об участии генов, кодирующих ваниллоидный TPRV-1 рецептор, интерлейкин-1α,интерлейкин-6, в генезе хронической боли. Возникающий после тканевого повреждения дисбаланс нейромедиаторов с преобладанием проалгогенных пептидов "запускает" механизмы патологических пластических процессов в периферической и центральной нервных системах, приводящих к формированию хронических болевых синдромов.
Рис. 1. Генетическая предрасположенность к хронизации боли
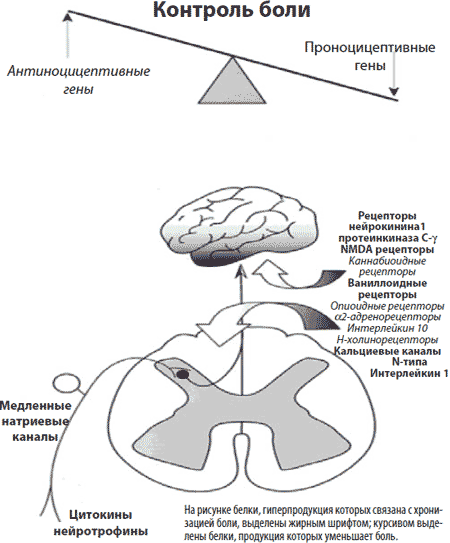
Основной гипотезой возникновения хронического болевого синдрома считается центральная модификация входящего сенсорного импульса. Теория центральной модификации сенсорного импульса предполагает наличие нескольких синапсов на пути сенсорного стимула в кору головного мозга, наиболее важными из которых являются задние рога спинного мозга, стволовые структуры, таламус и сама кора. Согласно теории воротного контроля на каждом из вышеперечисленных уровней на импульс оказывается возбуждающее или тормозящее воздействие со стороны коллатеральных аксонов, а также восходящих или нисходящих путей ноцицептивной и антиноцицептивной систем.
Наиболее важными нейромедиаторами, оказывающими воздействие на уровне задних рогов спинного мозга, являются субстанция Р (индуцирующая болевой импульс) и эндогенные опиоиды, например, метэнкефалин (ингибирующие болевой импульс). Также возможно тормозное влияние со стороны кортикоспинального тракта за счет нейротрансмиттера глицина. Это может быть основой анальгетического действия баклофена при невропатическом болевом синдроме. На уровне задних рогов спинного мозга оказывают воздействие самые сильнодействующие из всех известных групп обезболивающих средств - наркотические анальгетики. Эффективность наркотических анальгетиков (сходных по своей структуре с эндогенными опиоидами) оказывается наиболее высокой в острой стадии развития болевого синдрома, когда афферентный сенсорный приток еще не преодолел спинальный уровень передачи ноцицептивного импульса. При хронической боли опиаты оказываются неэффективными.
На уровне ствола мозга ингибирующее воздействие оказывается серотонинергическими и норадренергическими структурами. Умеренная кратковременная недостаточность серотонинергических структур приводит к развитию тревоги и боли, при длительно существующем дефиците серотонина может развиваться депрессия. Этим объясняется выраженное анальгетическое действие малых доз антидепрессантов при хроническом болевом синдроме даже при отсутствии антидепрессивного действия. Однако более высокая эффективность трициклических антидепрессантов по сравнению с ингибиторами обратного захвата серотонина может свидетельствовать о большей роли норадренергических структур в формировании хронической боли.
Следующий синаптический уровень включает в себя таламус, лимбическую систему и прилежащие субкор-тикальные и кортикальные структуры головного мозга. Здесь происходит субъективная оценка болевого ощу-щения, о которой говорилось выше. Нейротрансмиттеры, оказывающие ингибирующее воздействие на проведение ноцицептивной информации из субкортикальных структур в кору, мало изучены, одним из них является γ-аминомасляная кислота. Предполагается, что именно на этом уровне оказывают анальгетическое действие антиконвульсанты.
Хронизация боли развивается, когда происходит сенситизация последнего кортико-кортикального синаптического уровня афферентным сенсорным притоком. Полагают, что эта трансформация происходит в течение 6 месяцев, что дает практикующему врачу "терапевтическое окно" для назначения специфической анальгетической терапии.
Главной особенностью хронических болевых синдромов является их высокая плацебо-зависимость. Это обусловлено высокой степенью субъективизма восприятия болевого ощущения, зависящего от пола, возраста, культурных национальных традиций, воспитания и, наконец, эмоционального состояния. Именно ввиду высокой плацебо-зависимости лечение хронической боли представляет собой чрезвычайно сложную задачу для практикующих врачей, прежде всего потому, что требует от них максимально внимательного отношения к пациенту, искреннего сочувствия, установления доверительных взаимоотношений и взаимной симпатии - в общем, всего того, что подразумевается под понятием "плацебо". Если все это по каким-либо причинам невозможно, лучше сразу переадресовать больного другому специалисту, иначе в лучшем случае на фоне проводимой терапии не будет наблюдаться положительной динамики, а в худшем - можно столкнуться с эффектом "ноцебо" (психологически обусловленным ухудшением состояния). Но и установление эмпатии между врачом и пациентом не может гарантировать выздоровление больного. Главная проблема плацебо-эффекта заключается в его кратковременности - анальгетическое действие плацебо не будет длиться бесконечно, и через несколько недель приема нового препарата боли вернутся к исходному уровню, даже при повышении дозы. Этот процесс обусловлен не развитием привыкания или толерантности к препарату, а истощением психо-физиологических механизмов аутоаналгезии, лежащих в основе плацебо-эффекта. Таким образом, подбор адекватной терапии при хронических болевых синдромах может растягиваться на долгие месяцы - ведь для того, чтобы убедиться в том, что препарат подобран правильно, потребуется несколько недель, за которые в большинстве случаев истощается плацебо-эффект.
Хронические болевые синдромы отмечаются при различных заболеваниях нервной системы и могут раз-виваться через общие патофизиологические механизмы. Кроме того, один механизм может участвовать в развитии нескольких симптомов, а один и тот же симптом у разных больных может быть связан с различными патофизиологическими механизмами. Следует отметить и то, что механизмы, обусловливающие определенный симптом, могут меняется в течение заболевания. Таким образом, у пациентов с хронической болью сложно определить механизмы развития болевого синдрома на основании этиологических факторов, вызвавших основное заболевание, или на основе локализации и выраженности симптомов. Однако без идентификации патофизиологических механизмов невозможно выработать оптимальную стратегию лечения пациентов с болью. Такая идентификация, в свою очередь, строится на основе знания клинических проявлений и анализа их связи с различными патофизиологическими механизмами, на которые можно воздействовать путем подбора патогенетически обоснованной терапии.
Исходя из описанных нейрофизиологических, нейрохимических, психологических компонентов ноцицеп-тивной и антиноцицептивной систем основные терапевтические подходы к лечению хронической боли могут быть сформулированы следующим образом:
- Выявление и оценка сопровождающих боль сенсорных, двигательных, вегетативных, соматических и психических расстройств.
- Раннее начало симптоматической анальгетической терапии с целью предупреждения развития и хронизации боли.
- Уточнение этиологии и локализации поражения, воздействие на источник и причину боли: 1) устранение источника боли и восстановление поврежденных тканей; 2) воздействие на периферические компоненты боли - соматические (устранение воспаления, отека и др.) и нейрохимические стимуляторы болевых рецепторов; наиболее отчетливый эффект при этом имеют препараты, влияющие на синтез простагландинов (ненаркотические анальгетики, парацетамол, нестероидные противовоспалительные средства) и обеспечивающие снижение концентрации субстанции P в терминалях волокон, проводящих болевую импульсацию (препараты стручкового перца для наружного применения - капсаицин, капсин и др.).
- Воздействие на проведение болевой афферентации: 1) торможение проведения болевой импульсации по периферическим нервам и в узлу заднего колена - УЗК (введение локальных анестетиков, алкогольная и феноловая денервация, перерезка периферических нервов, ганглиэктомия); 2) хирургическое стереотаксическое разрушение соответствующих восходящих путей и ядер таламуса, а также электрическая стимуляция задних столбов и различных церебральных структур через постоянно вживленные электроды.
- Воздействие на процессы, происходящие в задних рогах. Кроме аппликаций препаратов стручкового перца, снижающих концентрацию субстанции P в задних рогах, используют ряд других способов терапии: 1) введение опиатов системно или локально (эпидурально или субдурально), что обеспечивает усиление энкефалинергического торможения болевой импульсации; 2) электростимуляцию и другие методы физической стимуляции (физиопроцедуры, акупунктура, чрескожная электронейростимуляция, массаж и др.), вызывающие торможение ноцицептивных нейронов заднего рога путем активации энкефалинергических нейронов; 3) при-менение препаратов, воздействующих на ГАМК-ергические структуры для снижения возбудимости нейронов заднего рога (баклофен, тизанидин, габапентин); 4) применение противосудорожных препаратов (карбамазепин, дифенин, ламотриджин, вальпроаты и бензодиазепины), тормозящих проведение нервных импульсов по чувствительным нервам и обладающих агонистическим действием на ГАМК-ергические рецепторы нейронов задних рогов и клеток ядра спинномозгового пути тройничного нерва (эти препараты особенно эффективны при невралгиях); 5) применение препаратов агонистов α2-адренорецепторов; 6) использование блокаторов обратного захвата серотонина, повышающих концентрацию этого нейротрансмиттера в ядрах ретикулярной формации мозгового ствола, из которых исходят нисходящие тормозящие пути, воздействующие на интернейроны заднего рога (флуоксетин, амитриптилин); 7) применение принципиально нового класса препаратов - SNEPCO (Selective NEuronal Potassium Channel Opener - селективных нейрональных открывателей калиевых каналов), оказывающих воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя (флупиртин, катадолон); 8) использование антагонистов NMDA-рецепторов, "стирающих" болевую память (кетамин, декстраметорфан).
- Воздействие на восприятие боли: 1) влияние на психологические (и одновременно на нейрохимические) компоненты боли с применением психотропных фармакологических препаратов (антидепрессанты, транквилизаторы, нейролептики); 2) использование психотерапевтических методов.
- Воздействие на сопутствующие расстройства: 1) устранение симпатической активации при вегетативно поддерживаемых хронических болевых синдромах, например, при эритромелалгии, комплексном регионарном болевом синдроме и т.д. (симпатолитические средства, симпатэктомия); 2) восстановление нормального паттерна проведения афферентации по нервному волокну при невропатических болях (метаболическая те-рапия - витамины группы В, карнитин; сосудистая терапия - антиоксиданты, антиагреганты, вазоактивные препараты и т.д.).
Отдельным аспектом проблемы боли является тактика ведения больных. Нестероидные противовоспали-тельные препараты (НПВП) продолжают активно использоваться в качестве препаратов первого ряда при лечении как острых, так и хронических болевых синдромов различной этиологии ввиду их доступности и высокой эффективности. Препараты ибупрофена (Нурофен, Нурофен Форте) являются "золотым стандар-том" терапии боли, в частности при заболеваниях опорно-двигательного аппарата, которые встречаются в популяции с частотой примерно 56% и занимают второе место по распространенности среди острых болевых синдромов после головной боли. При болевых синдромах особо эффективен Нурофен Форте, в 1 таблетке которого содержится 400 мг ибупрофена. Препарат проявляет выраженное анальгезирующее, жаропонижающее и противовоспалительное действие. В суточной дозе 1200 мг действует преимущественно как анальгетик, что обеспечивает максимальный эффект в купировании болей. Рекомендуется применять по 1 таблетке, но не более 3 табл. (1200 мг) в сутки в течение 2-3 дней. При необходимости курс может быть продлен до 7 дней. В некоторых случаях для усиления анальгетического эффекта возможна комбинация Нурофена Форте с парацетамолом и трамадолом в течение двух дней.
В структуре распространенности хронических болевых синдромов суставные и скелетно-мышечные боли занимают первое место. Для предупреждения развития и хронизации боли необходимо как можно более раннее начало симптоматической анальгетической терапии НПВП (например, Нурофеном). Следует помнить, что НПВП особенно эффективны на ранних стадиях развития боли. Именно на этом раннем этапе - этапе острой и подострой боли с помощью традиционных НПВП (Нурофен и др.) возможно воздействовать на периферические компоненты болевого синдрома - соматические (устранение воспаления, отека и др.) и нейрохимические стимуляторы болевых рецепторов.
В дальнейшем, когда включаются центральные патофизиологические механизмы боли, необходимо при-менение лекарственных средств из арсенала описанных выше препаратов и методов лечения в зависимости от конкретной нозологической формы и механизмов развития болевого синдрома. Так, наличие жгучих болей и аллодинии может быть показанием к применению габапентина и антидепрессантов. Антиконвульсанты особенно эффективны при невропатических болевых синдромах, таких как невралгия тройничного нерва или при преобладании в клинической картине стреляющих болей и дизестезий, а препараты класса SNEPCO - при болевых синдромах, сопровождающихся спазмом мышц. Назначение агонистов α2-адренорецепторов оправдано при наличии сосудистых нарушений в зоне боли, например, когда пораженная конечность приобретает цианотичный оттенок и становится горячей на ощупь вследствие открытия артерио-венозных шунтов (при комплексном регионарном болевом синдроме, эритромелалгии).
Показано, что этиотропное лечение, воздействующее на первопричину возникновения невропатического болевого синдрома, далеко не всегда бывает столь же эффективным, как патогенетическая терапия, направленная на патофизиологические механизмы развития болевого синдрома. Однако это вовсе не означает, что этиотропная терапия проводиться не должна. Более того, иногда начало этиотропной терапии усугубляет имеющийся болевой синдром (инсулиновый неврит Джордана при диабетической невропатии и т.д.), но это лишь обусловливает необходимость назначения адъювантных анальгетиков. Основные группы препаратов, применяющиеся в лечении острых и хронических болевых синдромов, показаны в таблице 1.
Таблица 1. Лекарства, обладающие анальгетическим эффектом
Препараты Доза Нестероидные противовоспалительные средства Ибупрофен
Кетопрофен
Мелоксикам200-400 мг/сут.
160-320 мг/сут.
15-30 мг/сут.Антидепрессанты ТЦА Амитриптилин
Имизин50-150 мг/сут.
50-150 мг/сут.СИОЗС Флуоксетин
Серталин
Пароксетин20 мг/сут.
50 мг/сут.
20 мг/сут.СИОЗС и Н Венлафаксин
Дулоксетин75-225 мг/сут.
30-60 мг/сут.Антиконвульсанты Блокаторы натриевых каналов Карбамазепин
Окскарбазепин
Ламотриджин400-1200 мг/сут.
300-1800 мг/сут.
200-400 мг/сут.Препараты, воздействующие на кальциевые каналы Габапентин
Прегабалин900-3600 мг/сут.
100-600 мг/сут.Препараты с множественным механизмом действия Топирамат 100-800 мг/сут. Антиаритмические препараты Мексилетин
Лидокаин225-675 мг/сут.
1-5 мг/кг в/в 2 часаОпиоидные анальгетики Трамадол
Фентанил
Оксикодон100-400 мг/сут.
ТТС 25-150 мкг/ч
10-60 мг/сут.Антагонисты NMDA рецепторов Декстрометорфан 400 мг/сут. Местные анестетики Лидокаин 5% ТТС Агонисты ваниллоидных рецепторов Капсаицин 0,075% крем Указанные препараты могут применяться в зависимости от конкретной клинической ситуации отдельно или, что бывает чаще при хронических болях, сочетанно. Концепция "доказательной медицины", приобретающая все большую популярность в настоящее время, призывает стандартизировать клинический подход к лечению хронической боли на основе результатов двойных слепых рандомизированных плацебо-контролируемых исследований. Однако в настоящее время лишь немногие исследования эффективности препаратов при хронических болевых синдромах отвечают вышеуказанным требованиям. Спектр предлагаемой анальгетической терапии хронических болевых синдромов за последние годы увеличивается в геометрической прогрессии. Новые препараты имеют значительно меньше побочных эффектов, однако по эффективности обезболивающего действия не превосходят традиционно использующиеся трициклические антидепрессанты и антиконвульсанты, в то время, как стоимость лечения этими препаратами значительно выше. Проведенный анализ литературных данных показывает, что наибольшее число авторов отдают предпочтение трициклическим антидепрессантам, далее следуют габапентин и другие антиконвульсанты, менее эффективными препаратами показали себя трамадол и селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН), и капсаицин, наконец, на последнем месте оказались декстрометорфан и селективные ингибиторы обратного захвата серотонина (СИОЗС).
Имеющийся сегодня опыт доказал необходимость обследования и лечения пациентов с хроническими бо-лями в специализированных центрах стационарного или амбулаторного типа. В будущем, возможно, будет разработан комплексный междисциплинарный подход к диагностике и лечению боли, включающий сопоставление нейрофизиологических и клинических характеристик хронического болевого синдрома с особенностями генотипа пациента для оптимизации подбора анальгетической терапии, а также использование направленной генотерапии для коррекции дисфункции ноцицептивной и антиноцицептивной систем.
| Декабрь 2009 г. |