Подробная информация об услугах израильской на сайте dr-kazansky.com. |
Опубликовано в журнале:
«Проблемы репродукции», 2007, №2, с. 28-34Лечение предменструального синдрома препаратом на основе сухого экстракта авраамова дерева
В.Н. Прилепская, А.В. Ледина, А.В. Тагиева, Ф.С. Ревазова
Научный центр акушерства, гинекологии и перинатологии РАМН, МоскваИзучена эффективность и переносимость препарата агнукастон при лечении женщин репродуктивного возраста, страдающих предменструальным синдромом средней и тяжелой форм. Показано, что агнукастон, созданный на основе экстракта авраамова дерева, является эффективным и приемлемым средством для лечения предменструального синдрома.
Ключевые слова: предменструальный синдром, Vitex agnus castus, авраамово дерево, прутняк, агнукастон.
Предменструальный синдром (ПМС) — распространенная патология [1], частота которой колеблется в широких пределах — от 25 до 90% [2, 3] причем 2—19% женщин страдают тяжелыми формами ПМС [1, 4].
Для терапии ПМС используются ингибиторы пролактина гестагены и гормональные контрацептивы, витамины, диуретики, антидепрессанты, а также психотерапия, физические факторы, лечебная физкультура, фитопрепараты.
Созданные на основе лекарственных растений препараты лучше переносятся, реже вызывают серьезные неблагоприятные явления и аллергические реакции, при этом по эффективности они сравнимы с современными лекарственными препаратами.
Наиболее часто из растительных препаратов для лечения ПМС применяются препараты, приготовленные из авраамова дерева. Плоды этого растения содержат иридоиды и флавоноиды, а листья и цветки — соединения, по структуре сходные со структурой половых гормонов, а по механизму действия — с желтым телом [11—13]. Входящие в состав экстракта авраамова дерева бициклические детерпены и другие активные компоненты обладают допамин-, холинергической, пролактинингибирующей, слабой эстроген-ной активностью, они могут связывать опиоидные рецепторы, β-эндорфины [13—18].
Допаминергический эффект экстракта авраамова дерева исследовался и был подтвержден в эксперименте на животных и в клинических испытаниях [8, 16].
Важно, что при использовании экстракта авраамова дерева снижение продукции пролактина происходит без прямого воздействия на уровень ФСГ и прогестерона [14].
В гинекологии препараты, содержащие экстракт авраамова дерева, рекомендуется применять для лечения циклической масталгии, фиброзно-кистозной мастопатии, нарушений менструального цикла, ПМС [19—25]. Научная, основанная на данных клинических исследований оценка эффективности экстракта авраамова дерева при лечении гинекологической патологии стала возможной также относительно недавно.
Целью исследования явилось изучение эффективности и переносимости препарата агнукастон при лечении женщин репродуктивного возраста, страдающих средней тяжести и тяжелыми формами ПМС.
Исследование было начато в октябре 2003 г. и проводилось в соответствии с международными стандартами качественной клинической практики (ICH-GCP), Хельсинкской декларации и было одобрено Комитетом по этике при Федеральном агентстве контроля качества, эффективности, безопасности лекарственных средств и Этическим комитетом Научного центра акушерства, гинекологии и перинатологии РАМН. Мониторирование исследования проводилось в соответствии с требованиями ICN-GCP Guidelines. Дизайн исследования: проспективное открытое несравнительное моноцентровое (фаза IV).
Дизайн исследования. Исследование продолжалось приблизительно 6 менструальных циклов и включало два этапа. Длительность I этапа (период включения) составила приблизительно 3 мес. До начала исследования женщины трижды посетили исследовательский центр с визитами, на основании которых оценивалась степень тяжести ПМС, определялись критерии включения и исключения.
На скрининговом визите пациенткам были разъяснены цель, задачи исследования, женщины подписали информированное согласие, кроме того, были даны разъяснения и рекомендации по правильному заполнению документации.
Трижды, до начала исследования (визит 1), до начала лечения (визит 3) и после окончания лечения (визит 4) пациентки заполняли шкалу самооценки опросника симптомов предменструального напряжения (СПМН-опросника), которая представляет опробованную психологическую анкету [29] для оценки жалоб и включает 36 эмоциональных и соматических симптомов с возможными вариантами ответов «да/нет». В исследование были включены пациентки, у которых при заполнении опросников количество ответов «да» было ≥18.
Кроме того, во время всего периода исследования пациентки ежедневно заполняли стандартизованные ПМС-дневники, в которых самостоятельно оценивали 18 симптомов ПМС (перепады настроения, депрессия, раздражительность, беспокойство, вспыльчивость, приступы плаксивости, отеки конечностей, нагрубание молочных желез, боли в молочных железах, вздутие живота, боли внизу живота, в пояснице, головная боль, усталость, изменение аппетита, тяга к сладкому/соленому, бессонница) (табл. 1).
Таблица 1. Ежедневный дневник пациентки
Есть ли у Вас сейчас менструальное кровотечение Да Нет Жалобы до, во время и после менструального кровотечения уровень симптомов
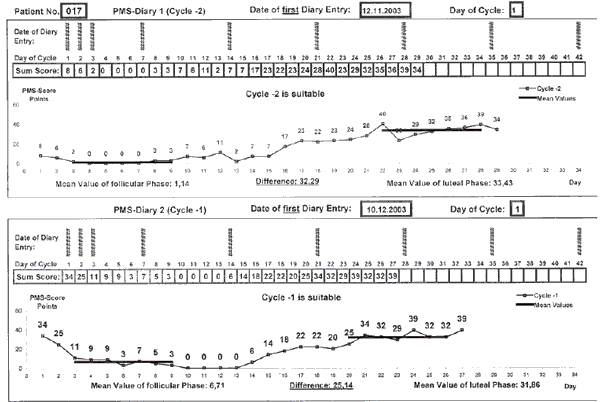
отсутствует (0) слабый (1) умеренный (2) сильный (3) Перепады настроения Депрессия/Уныние Напряжение/Раздражительность Беспокойство/Нервозность Гнев/Агрессия/Вспыльчивость Приступы плаксивости Отеки конечностей Болезненность/Нагрубание молочных желез Боли в молочных железах Вздутие живота Схваткообразные боли внизу живота Генерализованные тупые и острые боли Боли в пояснице Головная боль Усталость Повышенный/сниженный аппетит Тяга к сладкому/соленому Бессонница Заполняется исследователем Число отметок х0 х1 х2 х3 Сумма Общая сумма Интенсивность симптомов оценивалась по 4-балльной шкале. Для определения тяжести ПМС и эффективности лечения подсчитывали средний суммарный показатель этих симптомов за первые 7 дней цикла и за 7 дней перед менструацией (лютеиновая фаза) в каждом цикле баллы вносились в специально разработанную для исследования Excel-программу. В исследование были включены только те пациентки, у которых разница баллов в течение указанных 7 дней 1-й и 2-й фаз менструального цикла была выше 16 баллов (рис. 1).
Рис. 1. Пример подсчета разницы баллов в Excel-программе для определения тяжести ПМС.
Длительность II этапа (период лечения) составила 3 менструальных цикла. Пациентки ежедневно принимали препарат и заполняли дневники. Контроль осуществлялся путем телефонных контактов, а также во время заключительного визита после окончания лечения. Женщины посещали врачей в 1—3-й день менструального цикла; все изменения состояния за время наблюдения фиксировались в медицинских документах, неблагоприятные явления расценивались как осложнения или побочные эффекты.
В случае если пациентка досрочно выбывала из исследования, оценка показателей ПМС-днев-ников и СПМН-опросников производилась по LOCF-принципу (last—observation—carried—for-ward principle), т.е. при заполнении пропущенные данные были заменены наихудшей возможной оценкой. Таким образом, осуществлялась консервативная стратегия в отношении оценки данных.
Критерии включения/исключения. В период набора с целью определения соответствия пациенток критериям включения/исключения все женщины прошли обследование, которое включало тщательный сбор анамнеза, проведение клинического и биохимического анализов крови, анализ мочи, УЗИ органов малого таза и молочных желез, гинекологическое обследование. Клинически значимые отклонения от нормативных показателей выявлены не были.
В исследование были включены пациентки, которые соответствовали следующим критериям: возраст 18—45 лет; отсутствие серьезной соматической патологии; продолжительность большинства менструальных циклов в течение 12 мес 28— 32±2 дня; наличие подписанного пациентками информированного согласия; наличие заполненной шкалы самооценки СПМН-опросника с суммой баллов ≥18.
Критерии исключения из исследования: прием в течение 6 предыдущих месяцев гормональных контрацептивов, гормонов гипоталамуса, гипофиза и их ингибиторов, нейролептиков и антидепрессантов, ингибиторов обратного захвата серотонина, ингибиторов пролактина; любое психиатрическое лечение; наличие эндокринных заболеваний (сахарный диабет, гиперпролактинемия (>20 нг/мл), гипо/гипертиреоз, опухоль гипофиза); хронические заболевания почек, печени, язва желудка в активной стадии, синдром мальабсорбции, гиперсекреция желчных кислот; эндометриоз, заболевания молочных желез, галакторея, беременность, кормление грудью, желание забеременеть; предшествующее началу исследования хирургическое лечение, любое лечение ПМС в период набора.
МАТЕРИАЛ И МЕТОДЫ
Для проведения статистического анализа было необходимо оценить эффективность лечения у 100 пациенток из 120 отобранных. По разным причинам из исследования выбыли 20% женщин.
Для оценки эффективности лечения было использовано несколько шкал, и лечебный эффект показал α=0,05 со статистической значимостью 95%.
Для оценки эффективности препарата главный показатель эффективности (первичная конечная точка) определялся по изменению средних суммарных показателей ПМС-дневников после 3 циклов лечения в сравнении с соответствующими показателями до лечения. С этой целью каждые 7 дней перед менструацией суммировались результаты 18 симптомов, указанных в ПМС-дневнике в баллах. Средний суммарный показатель этих 7 дней, рассчитанный в исходном цикле и в последнем, 3-м цикле лечения, был взят для сравнения и оценки результатов лечения.
Второстепенными показателями эффективности (вторичные конечные точки) являлись несколько параметров:
- Изменения средней суммарной величины (средняя арифметическая от суммы баллов) ПМС-дневников после 1-го и 2-го менструальных циклов в период лечения в сравнении с исходным состоянием. Подсчет разницы значений до и после лечения был аналогичным оценке первичной конечной точки (∆ цикл 0 — цикл 1 и ∆ цикл 0 — цикл 2 соответственно).
- Доля респондеров, рассчитанная на основе ПМС-дневников после 3 мес лечения. При этом пациентка определялась как респондер, если у нее на фоне лечения наблюдалось клиническое улучшение и, по данным оценки дневников, средний суммарный показатель после 3 циклов лечения уменьшился на 40% и более в сравнении с исходными данными.
- Изменение среднего суммарного показателя шкалы самооценки СПМН-опросника после 3 циклов лечения в сравнении с исходными данными.
- Доля респондеров, рассчитанная на основе шкалы самооценки СПМН-опросника после 3 циклов лечения.
Схема лечения. Всем пациенткам был выдан препарат агнукастон («Bionorica AG», Германия) в таблетках, покрытых оболочкой, расфасованных по 130 таблеток в бутылки из темного стекла. Каждая таблетка содержала 40 мг экстракта Vitex agnus castus. Препарат принимался ежедневно по 1 таблетке в течение 3 менструальных циклов (около 3 мес).
РЕЗУЛЬТАТЫ
В период отбора пациенток для предварительного определения соответствия критериям включения/исключения была опрошена 161 женщина, из них 21 пациентка на этапе предварительного опроса не вошла в исследование (прескрининговые потери).
Из 140 пациенток, подписавших информированное согласие, 19 пациенток также были исключены из исследования в связи с тем, что 15 — не соответствовали критериям включения/исключения, 1 пациентка не явилась для получения препарата, 3 — прекратили исследование вследствие завершения набора. После обследования и предварительной оценки дневников лечение было назначено 121 пациентке с подтвержденным диагнозом ПМС. Позднее в связи с нарушением протокола (неправильное заполнение дневников) 3 женщины были исключены из статистического анализа.
Таким образом, эффективность лечения оценивалась у 118 пациенток. Полностью завершили исследование 106 пациенток (12 выбыли в связи с возникшими неблагоприятными явлениями).
К началу исследования средний возраст пациенток составил 29,7±7,2 года, большинство пациенток (99%) не курили и все включенные в исследование не принимали регулярно алкоголь (табл. 2). Основная оценка эффективности проводилась, по данным ПМС-дневников, путем сравнения интенсивности 18 симптомов, выраженных в баллах. Средние суммарные показатели дневников после 1, 2, 3 циклов в сравнении с исходными данными указывали на то, что в процессе лечения выраженность жалоб постепенно уменьшалась.
Таблица 2. Характеристика пациенток, которым было назначено лечение (n=121)
Показатель Демографические показатели средние минимальные медиана максимальны Возраст, годы 29,7±7,2 18,0 29,0 45,0 Рост, см 166,5±5,4 150,0 167,0 179,0 Масса тела, кг 61,5±10,7 44,0 59,0 103,0 ИМТ, кг/м2 22,2±3,6 17,5 21,1 35,6 Так, средний суммарный показатель перед началом лечения (исходные данные) варьировал от 10,9 до 47,9 балла и в среднем составил 22,8±6,6 балла, а после лечения показатель снизился примерно до середины исходного уровня — от 0,0 до 35,9 балла и в среднем составил 10,2±8,0 балла.
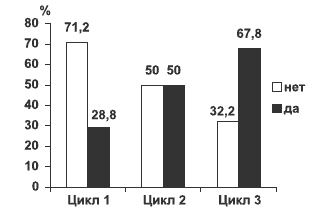
Следующим оцениваемым показателем было определение количества женщин, у которых наступило клиническое улучшение на фоне терапии, рассчитанное на основе ПМС-дневников после 3 мес лечения (рис. 2). У 28,8% женщин через 1 мес отмечен положительный эффект от лечения, что отразилось в уменьшении суммарного показателя ПМС-дневников. К окончанию лечения 67,8% имели значительное клиническое улучшение состояния, средний суммарный показатель по ПМС-дневникам снизился на 40% и более по сравнению с исходным (вторичная конечная точка).
Рис. 2. Доля респондеров, рассчитанная на основе ПМС-дневников после 3 мес лечения (n=118) (вторичная конечная точка эффективности).
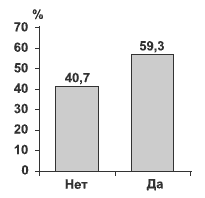
По данным СПМН-опросников, после 3 циклов лечения у 70 (59,3%) пациенток произошло значительное улучшение состояния (рис. 3).
Рис. 3. Доля респондеров, рассчитанная на основе шкалы самооценки СПМН-опросника после 3 циклов лечения (n=118).
Оценка безопасности препарата проводилась по определению частоты и интенсивности побочных эффектов и являлась одной из основных задач исследования. Побочные реакции и неблагоприятные явления различной степени выраженности на фоне лечения наблюдались у 30 (24,8%) из 121 пациентки, включенных в фазу лечения.
Все неблагоприятные явления фиксировались в медицинских документах (в дневниках, в амбулаторных картах, индивидуальных регистрационных формах).
В связи с побочными реакциями, которые были расценены как возникшие вследствие приема препарата, 12 (9,9%) пациенток досрочно прекратили его прием и были исключены из исследования, а 18 (14,9%) пациенток продолжили лечение и полностью завершили исследование. Серьезные побочные реакции в период терапии не были зарегистрированы ни у одной женщины.
При детальном изучении характера побочных эффектов и неблагоприятных явлений, возникших во время лечения (вне зависимости от связи с приемом препарата), было установлено, что у пациенток преобладали различные гастроинтестинальные симптомы (42,4% из числа всех неблагоприятных явлений), такие как боли в животе, диарея, метеоризм и др. Следующими по частоте симптомами были головная боль (24,2%), кожно-аллергические реакции (зуд, покраснение; 15,2%).
Степень выраженности большинства (69,7%) неблагоприятных явлений из всех зарегистрированных была слабой или умеренной. При этом 68,2% из обнаруженных неблагоприятных явлений были расценены пациентками как не связанные с лечением, и только 1/3 (31,8%) неблагоприятных явлений из зарегистрированных пациентки считали как возможно или вероятно связанные с приемом препарата (табл. 3).
Таблица 3. Характеристика побочных явлений и их связь с лечением (n=66)
Зарегистрированные неблагоприятные
явленияKоличество абс. % Интенсивность неблагоприятных проявлений: незначительная 8 12,1 умеренная 38 57,6 выраженная 20 30,3 Связь неблагоприятных явлений с приемом препарата: нет 45 68,2 возможно 16 24,2 вероятно 5 7,6 Серьезные неблагоприятные явления 0 0 Большинство побочных реакций и неблагоприятных явлений (50%) возникли в течение 1-го месяца приема препарата, впоследствии их частота снизилась и во 2-м цикле лечения составила 16,7%, в 3-м цикле — 22,7% (из всех возникших неблагоприятных явлений).
ОБСУЖДЕНИЕ
Проведенное в соответствии с международными стандартами надлежащей клинической практики исследование подтвердило эффективность препарата агнукастон при лечении средней тяжести и тяжелых форм ПМС. При этом диагноз был подтвержден оценкой дневников, которые женщины самостоятельно заполняли ежедневно в течение 2 менструальных циклов перед началом обследования и лечения.
Эффективность авраамова дерева при лечении ПМС подтверждена рядом клинических исследований [19, 20, 27]. Показана эффективность препаратов, созданных на основе экстракта авраамова дерева, при лечении циклической масталгии, ПМС, а также при нарушениях менструального цикла, предменструальном синдроме [26, 30, 31]. Во всех проведенных ранее исследованиях эффективности препаратов, созданных на основе экстракта авраамова дерева, которые назначались с целью лечения масталгии, было выявлено уменьшение болезненности молочных желез, длительности периода перед менструацией, когда пациентки испытывали боль или дискомфорт в молочных железах в течение курса лечения, начиная уже с 1-го цикла приема препарата [20, 26, 27].
Отличие проведенного нами исследования состояло в том, что в группу наблюдения впервые были включены пациентки, страдающие умеренно выраженными и тяжелыми проявлениями ПМС.
По этическим соображениям и ввиду серьезности и тяжести заболевания настоящее исследование проводилось без плацебо-контроля, что явилось недостатком данного исследования, однако не противоречило принципам надлежащей клинической практики (GCP). Тем не менее дальнейшие исследования эффективности экстракта авраамова дерева при лечении ПМС тяжелого течения планируется проводить с группой плацебо по специально разработанному протоколу.
ЛИТЕРАТУРА
1. Sterneld Â., Swindle R., Chawla À. et al. Obstet Gynecol 2002;99:1014— 1024.
2. Singh Â.B., Berman B.M., Simpson R.L. et al. Am J Health Med 1998;4:75—79.
3. Steiner Ì. J Psychiatry Neurosci 2000;45:459—468.
4. Wittchen H.U., Becker Å., Liebt R. et al. Psychol Меd 2002;32:19—132.
5. Аmerican Psychiatric Association. Diagnostic and Statistical Manual of Mental Disoders, 4-th ed. Washington, DC. Am Psychiat Ass 1994.
6. Íî Ê.Y., Thorner Ì.Î. Drugs1988;36:67—82.
7. Mansel R.E., Dogliotti L. Lancet 1990;27:190—193.
8. Kilicdag E.B., Tarim E., Bagis T. et al. Int J Gyn Obstet 2004;85:292— 293.
9. Регистр лекарственных средств России (энциклопедия лекарств). М 2002;9:170—171.
10. Pravidel. Novartis Pfarma GmbH Germany 2004.
11. Brickell C.(ed). London: Dorling Kindersley 1989.
12. Du Mee V.A.C. Aust J Med Herbalism 1993;5:63—65.
13. Christoffel V., Spengler B., Abel G. et al. Proceedings of the 6th Annual Symposium on complementary. Health Care UK;199.
14. Jarry H., Christoffel V., Spengler B. et al. Phytotherapie (Munchen) 1999.
15. Merz P.G., Gorkow C., Schrodter A. et al. Exp Clin Endocr Diabet 1996;104:6:447—453.
16. Wuttke W., Gorkow Ch., Jarry H. Darmstadt: Steinkopff Verlag 1995;81—91.
17. Hoberg E. Swiss Federal Institute of Technology. Zurich 1999.
18. Brugisser R., Burkard W., Simmen U., Schaffner W. Phytotherapie 1999;20:3:154—158.
19. Lauritzen Ch., Reuter H.D., Repges R. et al. Phytomedicine1997;4:183— 189.
20. Wuttke W., Splitt G., Gorkow C., Sieder C. Geb Fra 1997;57:569—574.
21. Propping D., Katzorke T., Belkien L. Therapiewoche 1988;38:2992— 3001.
22. Liebl A. Gynacology 1992;5:147—154.
23. Coeugniet E., Elek E., Kuchnast R. Arztez Naturheilverf 1986;27:619— 622.
24. Dittmar F.W., Bohnert K-J., Peeters M. et al. Gynakology 1992;5:60— 68.
25. Peters-Welte C., Albrecht M. Gynakology 1994;7:49.
26. Halaska M., Beles P., Gorkow C., Sieder C. Breast 1999;8:4:175—181.
27. Schellenberg R. BMJ 2001;322:134—137.
28. Àtmaca Ì., Êumru S., Tezcan E. Human Psychopharmacol Clin Exp 2003;18:191—195.
29. Steiner M., Haskett R.F., Carroll B.J. Acta Psychiat Scand 1980;62:177— 190.
30. Mergner R. Kassenarzt 1992;7:51—59.
31. Mortola J.F. Drug 1994;10:160—169.
| Февраль 2009 г. |