Опубликовано в журнале:
РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ, ТОМ 16, № 25, 2008Иммунокорригирующие свойства фитопрепарата Тонзилгон Н
Д.б.н. Л.П. Коваленко1, Е.В. Шипаева1, к.м.н. И.И. Кольченко2
ГУ НИИ фармакологии им. В.В. Закусова РАМН, ООО "Бионорика", МоскваВведение
В настоящее время препарат растительного происхождения Тонзилгон Н (Бионорика А.Г., Германия) успешно применяется при различных инфекционных заболеваниях у детей и взрослых пациентов. У часто болеющих детей препарат Тонзилгон Н наиболее эффективен при назофарингите, остром и хроническом тонзиллите и фарингите. Острые и хронические тонзиллиты - одни из самых распространенных заболеваний, встречающихся в педиатрической практике, в осложненных случаях необходимо оперативное вмешательство. Однако по данным литературы тонзиллэктомия нередко назначается при недостаточных показаниях, кроме того имеются негативные последствия применения антибиотиков, в частности антибиотикорезистентность и аллергические реакции [2,3]. Острые респираторные заболевания (ОРЗ) вызывают различные нарушения иммунной системы, поэтому в профилактике и реабилитации больных используют иммуномодуляторы, которые оказывают направленное действие на разные звенья иммунной системы и малотоксичные препараты, обладающие поликомпонентным действием.
Препарат Тонзилгон Н обладает антиоксидантными свойствами и выраженным противовоспалительным действием. Было отмечено, что применение Тонзилгона Н способствует повышению противовирусного иммунитета преимущественно за счет увеличения продукции α-ИФ и γ-ИФ [6]. При лечении тонзиллита, ларингита, фарингита и ринита иммунотропное действие препарата Тонзилгона Н также заключается в стимуляции неспецифического иммунного ответа организма за счет повышения фагоцитарной активности макрофагов и гранулоцитов. У часто болеющих ОРЗ детей на фоне лечения Тонзилгоном Н было отмечено повышение фагоцитарной активности, повышение концентраций IgA и IgM в сыворотке крови и уменьшение дисиммуноглобулинемии [3,6]. Однако механизмы и пути реализации этих эффектов остаются еще не до конца изученными. В частности, нет современных публикаций по влиянию препарата на гуморальный и клеточный иммунный ответ в условиях иммунодефицита.
Цель исследования: оценка иммунокорригирующих свойств растительного препарата Тонзилгона Н в экспериментах на мышах с вторичным иммунодефицитом, вызванным введением циклофосфамида.
Материалы и методы исследования
Изучение иммунокоригирующего действия Тонзилгона Н на модели вторичного иммунодефицита, вызванного введением циклофосфамида, проводили с использованием методов оценки функциональной активности гуморального и клеточного иммунного ответа, согласно "Методическим указаниям по оценке иммунотоксического действия фармакологических средств" [4] и "Методическим указаниям по изучению иммунотропной активности фармакологических веществ" [5]. В работе использовали самцов мышей линии СВА и гибридов F1 (СВА*С57ВL/6), полученных из питомника РАМН "Столбовая", после двухнедельного карантина в виварии института. Животных содержали в стандартных условиях со свободным доступом к корму и воде. В качестве основного корма были использованы специализированные брикетированные гранулированные корма фирмы "МЭСТ", кроме того, животных докармливали свежими овощами и творогом. Подготовка к работе первичных данных и расчеты проводились в среде пакета статистических программ (PSP) STATISTICA (версия 6.0) для WINDOWS. Статистический анализ данных проводился с помощью t-критерия Стьюдента.
Влияние Тонзилгона Н на гуморальный иммунитет при вторичном иммунодефиците, вызванном введением циклофосфамида, изучали, применяя реакцию гемагглютинации (поставленную в микротитраторе Такачи, РПГА). Реакция основана на способности антител, содержащихся в сыворотке крови иммунизированных животных, агглютинировать эритроциты барана (ЭБ), используемые в качестве антигена.
Вторичный иммунодефицит индуцировали внутрибрюшинным (в/б) введением (однократно) мышам линии СВА алкилирующего агента - циклофосфамида (Sigma) в дозе 200 мг/кг, контрольным интактным животным аналогичным образом вводили соответствующий объем растворителя - воды для инъекций. Через 24 часа после введения циклофосфамида (ЦФ) мышам опытных групп перорально трехкратно вводили Тонзилгон Н, взвешенный в 1% растворе крахмала, в дозах 7 мг/кг и 70 мг/кг животным интактной контрольной группы и контрольным животным с иммунодефицитом вводили аналогичным образом соответствующий объем 1% раствора крахмала. На 4-е сутки после введения ЦФ животных контрольных и опытных групп иммунизировали внутрибрюшинно эритроцитами барана (ЭБ) в дозе 5х107 клеток. Через 7 дней после иммунизации животных забивали декапитацией и получали сыворотку крови. Титр антител (наибольшее разведение сыворотки, при котором наблюдается отчетливая агглютинация ЭБ) выражали величиной log2T, где Т -титр антител исследуемой сыворотки.
Изучение действия Тонзилгона Н на клеточный иммунный ответ мышей с вторичным иммунодефицитом, также вызванным в/б введением 200 мг/кг ЦФ проводили на мышах гибридах F1 (СВА*С57ВL/6). Через 24 часа после введения ЦФ мышам опытных групп перорально трехкратно вводили Тонзилгон Н в дозах 7 мг/кг и 70 мг/кг животным контрольных групп соответствующий объем 1% раствора крахмала. Клеточный иммунный ответ изучали по реакции гиперчувствительности замедленного типа. Для этого на 4-е сутки после введения циклофосфамида мышей контрольной и опытных групп иммунизировали подкожно 1*107 ЭБ в объеме 100 мкл. Разрешающую дозу антигена, 1*108 ЭБ в объеме 20 мкл, вводили на 5 день после сенсибилизации под апоневротическую пластинку правой задней конечности, в контрлатеральную лапу -соответственно 20 мкл физиологического раствора. Учет интенсивности воспалительной реакции проводили через 24 часа после разрешающей дозы антигена. Мышей забивали, обе лапы отрезали на уровне голеностопного сустава и взвешивали их на торсионных весах. Затем подсчитывали индекс реакции (Ир) по формуле:
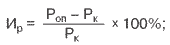
где Pоп- масса стопы задней лапы, в подушечку которой вводили ЭБ;
Рk - масса стопы контрольной лапы.Результаты и их обсуждение
У мышей контрольной группы линии СВА вторичный иммунодефицит, вызванный введением ЦФ проявлялся в достоверном угнетении гуморального иммунного ответа на ЭБ на 28,1% по сравнению с интактными мышами (табл. 1, рис. 1). После 3-х кратного перорального введения Тонзилгона Н в дозах 7 мг/кг и 70 мг/кг происходило значимое увеличение показателей антителообразования до уровня, наблюдаемого у интактных мышей.
Таблица 1. Влияние Тонзилгона Н на гуморальный иммунный ответ (РПГА) при пероральном введении препарата в течение 3-х дней мышам СВА с иммунодефицитом, вызванным введением циклофосфамида
Группа Величина иммунного ответа при антигенной нагрузке 5*106 ЭБ Количество животных в группе Интактные 5,7±0,2 10 Контроль Циклофосфамид 200 мг/кг 4,1±0,3* 10 Тонзилгон Н 7 мг/кг Циклофосфамид 200 мг/кг 5,3±0,3# 10 Тонзилгон Н 70 мг/кг Циклофосфамид 200 мг/кг 5,8±0,4# 10
Примечание: В таблице представлены средние величины титра антител в log2
*- разница различий с интактной группой с уровнем значимости р<0,001
#- разница различий с контрольной группой с уровнем значимости р<0,01Рис. 1. Влияние Тонзилгона Н на гуморальный иммунный ответ (РПГА) при пероральном введении препарата в течение 3-х дней мышам СВА с иммунодефицитом, вызванным введением циклофосфамида
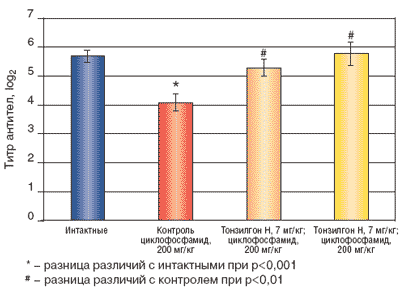
Результаты опытов по изучению действия Тонзилгона Н на клеточный иммунный ответ мышей с вторичным иммунодефицитом представлены в таблице 2 и на рисунке 2. Введение циклофосфамида мышам гибридам F1 (СВАхС57ВL/6) контрольной группы достоверно подавляло клеточный иммунный ответ на 25,8% по сравнению с группой интактных животных. После введения Тонзилгона Н в дозах 7 и 70 мг/кг мышам с вторичным иммунодефицитом обнаружено статистически достоверное восстановление клеточного иммунного ответа до показателей интактных мышей. Таким образом, полученные экспериментальные данные свидетельствуют о наличии иммунокорригирующих свойств у растительного препарата Тонзилгон Н.
Рис. 2. Влияние Тонзилгона Н на клеточный иммунный ответ (ГЗТ) при пероральном введении препарата в течение 3-х дней мышам F1 (CBA*C57BL/6) с иммунодефицитом, вызванным введением циклофосфамида
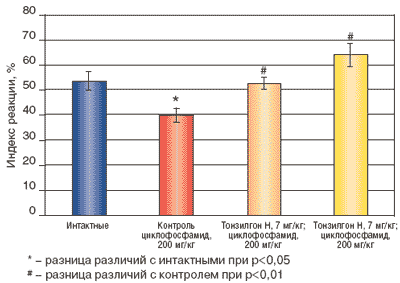
Таблица 2. Влияние Тонзилгона Н на клеточный иммунный ответ (ГЗТ) при пероральном введении препарата в течение 3-х дней мышам F1(CBA*C57BL/6) с иммунодефицитом, вызванным введением циклофосфамида
Группа животных Индекс реакции: 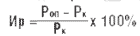
Количество животных в группе Интактные 53,4±4,0 10 Контроль Циклофосфамид 200 мг/кг 39,6±2,6* 9 Тонзилгон Н 7 мг/кг Циклофосфамид 200 мг/кг 52,7±2,4# 10 Тонзилгон Н 70 мг/кг Циклофосфамид 200 мг/кг 63,9±4,8# 10
Примечание:
*- разница различий с интактной группой с уровнем значимости р<0,05;
#- разница различий с контрольной группой с уровнем значимости р<0,01Известно, что различные механизмы нарушений иммунного ответа сопровождаются последовательным возникновением признаков иммунодефицитной, аллергической, аутоиммунной и онкологической патологии. Инфекции, травмы, хронические физиологически и психические стрессы вызывают у ослабленных пациентов состояние вторичного иммунодефицита. Поэтому актуальным остается поиск препаратов с поликомпонентным механизмом действия, которые способны восстановить иммунный ответ.
Иммунокорригирующие свойства Тонзилгона Н обусловлены тем, что в состав препарата входят следующие биологически активные компоненты растительного происхождения: Althaeae radix (корень алтея), Chamomillae flores (цветки ромашки), Equiseti herba (трава хвоща), Juglandis folia (листья грецкого ореха), Achillea millefotium (трава тысячелистника), Quercus cortex (кора дуба), Taraxaci herba (трава одуванчика лекарственного). Кроме того, входящие в состав Тонзилгона Н компоненты обладают выраженным антиоксидантным, противовоспалительным и бактерицидным действием.
В частности известно, что полисахариды Althaeae radix (корень алтея) представлены слизистым веществом, в состав полисахаридной фракции слизи входят остатки галактозы, глюкозы арабинозы, рамнозы и галактуроновой кислоты. Корень алтея обладает противокашлевым и иммуностимулирующим действием и широко применяется при респираторных заболеваниях. Внутрижелудочное введение полисахаридной фракции, выделенной из водного экстракта Althaeae radix, при введении лабораторным животным в дозе 50 мг/кг подавляет интенсивность и частоту кашля, индуцированного механическим раздражением ларингофарингиальной и трахеобронхиальной слизистой. Причем противокашлевая активность полисахаридной фракции была более выраженной, чем эффективность преноксдиазина (prenoxdiazine), вводимого в дозе 30 мг/кг. Известно, что водный экстракт Althaeae radix обладает иммуностимулирующими свойствами в отношении моноцитов человека in vitro. Внутрибрюшинное введение слизистых полисахаридов мышам в дозе 10 мг/кг повышает в 2,2 раза фагоцитарную активность макрофагов. При введении мышам полисахаридов алтея одновременно с иммунизацией эритроцитами барана или после нее происходило увеличение в 2-3 раза количества антителообразующих клеток в селезенке и относительной массы селезенки, усиление в 3 раза интенсивности фагоцитоза эритроцитов барана, стимуляция интенсивности клеточной реакции гиперчувствительности замедленного типа [14].
Taraxaci herba (трава одуванчика лекарственного) содержит каратиноиды: тараксантин, лютеин, флавоксантин, инулин, сесквитерпеновые лактоны, тритерпеновые спирты, витамин С, холин, никотиновую кислоту, сапонины, железо, кальций, марганец (24%) и фосфор. Было показано иммуномодуляторное влияние Taraxaci herba на неспецифический, гуморальный и клеточный иммунный ответ мышей с иммунодепрессией, вызванной ожогами, происходило восстановление параметров иммунной системы [10]. Также было отмечено восстановление функциональной активности перитонеальных макрофагов мышей после токсического действия кадмия [9].
Chamomillae flores (цветки ромашки) обладают противовоспалительным, противоаллергическим, спазмолитическим, антибактериальным, противовирусным, противоязвенным, антиоксидантным и др. действиями. В состав Chamomillae flores входят терпеноиды (chemazulen, bisabolol, sesquiterpenes), флаваноиды (апигенин, лютеолин, кверцетин) и другие биологически активные вещества, определяющие большой круг фармакологической активности растения. Bisabolol подавляет развитие индометацинового, стресс- и алкаголь-индуцированного язвообразования. Также было показано ускорение заживления язв. Флавоноиды обуславливают противовоспалительные и спазмолитические свойства Chamomillae flores, также in vitro была показана их иммуностимулирующая активность [8].
Equisetiherba (травахвоща) содержит аскорбиновую кислоту (до 0,19%), каротин, сапонин эквизетонин (около 5%), флавоноиды (кверцетин, изокверцитин, кемпферол, лютеолин, эквизетрин), жиры, никотин, кремниевую (до 25%), аконитовую, яблочную, щавелевую кислоты, горечи, дубильные и смолистые вещества, минеральные соли, фенолкарбоновые кислоты, ситостерол. Выделенный из растения 5-глюкозидлютеолин проявляет антимикробные и противовоспалительные свойства. При каррагенан-индуцированном воспалении у крыс экстракт в дозе 50 мг/кг уменьшал отек лапы крыс на 2 и 4 ч после введения каррагенана. Трава хвоща полевого, проявляет выраженный иммуномодулирующий эффект: при применении препарата верифицированы достоверное повышение (до показателей физиологической нормы) уровня В-лимфоцитов в периферической крови, некоторое повышение уровня Т-лимфоцитов, нормализация хелперно-супрессорного соотношения за счет повышения содержания Т-хелперов и снижения Т-супрессоров в крови [11].
Juglandis folia (листья грецкого ореха) содержат дубильные вещества, эфирное масло, гидроюглон, быстро окисляющийся в юглон, обладающий бактерицидным действием, каротин, витамины С, РР, В1, альдегиды, алкалоиды, флавоноиды, кумарины, антоцианы, хиноны. Из листьев грецкого ореха дистилляцией выделяют 26 терпеноидных веществ: 21 монотерпенов, 2 сесквитерпена, 1 дитерпен и 2 компонента - производных терпеноидов. Листья грецкого ореха обладают бактерицидным, тонизирующим, противовоспалительным действием [12].
Achillea millefotium (трава тысячелистника) содержит горький гликозид ахиллеин, эфирное масло, в состав которого входят азулены, сложные эфиры, туйол, цинеол, кариофиллен, камфора, муравьиная, изовалериановая, уксусная кислоты, флавоноиды. В траве также содержатся дубильные вещества, смолы, каротин, витамины С, К, фитонциды, инулин, алкалоиды и др. Растение обладает противовоспалительными, кровоостанавливающим и бактерицидным, спазмолитическим, противоаллергическим, противоязвенным и желчегонным действием. Спазмолитическое действие связано с содержащимися в растении флавоноидами и составными компонентами эфирного масла. Также было установлено, что экстракт тысячелистника проявляет выраженную антифунгальную активность в отношении T. ajelloi и M. gypseum [1].
Quercus cortex (кора дуба) содержит 10-20% дубильных веществ - производных галловой и эллаговой кислот; 13-14% пентозанов; до 6% пектиновых веществ; кверцетин, катехины, слизь, крахмал и флобафен. Комплекс биологически активных веществ коры дуба обладает вяжущим, противовоспалительным и противомикробным действием. Противомикробное и противопротозойное действие связано как с производными галловой кислоты, так и с наличием катехинов. Кверцитин (3,5,7,3'4'-пентаоксифлавон) является одним из наиболее мощных антиоксидантов. Кверцитин обладает противовоспалительным и противоотечным действием: блокирует выработку гистамина, серотонина и лейкотриенов, стабилизирует клеточные мембраны, снижает проницаемость капилляров. Известно, что добавление в пищу кверцитина значительно уменьшает период течения заболеваний верхних респираторных путей [13]. Добавление в культуру клеток водного экстракта Quercus cortex, содержащего эллагиевую кислоту увеличивало выживаемость тимоцитов мыши [7].
Таким образом, полученные нами экспериментальные данные согласуются с данными литературы и подтверждают наличие у препарата Тонзилгона Н иммунокорригирующих свойств. Кроме того, важно отметить, что проведенные нами эксперименты продемонстрировали синергизм компонентов фитопрепарата в комбинированном экстракте.
Литература
1. Бадалян С.М., Топчян А.В. Исследование природных противогрибковых средств растительного происхождения.// Успехи медицинской микологии. М.- 2003, С. 88-90.
2. Дрынов Г.И., Иванюшина OX, Дьякова Ф.Н. Профитктика и терапия респираторных инфекций при проведении курса специфической иммунотерапии. //Лечащий врач. -2001.- №3.С.45-47.
3. Дрынов Г.И., Иванюшина O.K., Дьякова Ф.Н.. Результаты лечения детей с хроническим тонзиллитом препаратом Тонзилгон Н//Детский доктор.-2001.- №1. С.67-69.
4. Методические указания по оценке иммунотоксического действия фармакологических веществ - в Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ под общей редакцией члена-корреспондента РАМН, профессора Р.У. Хабриева, М. Медицина.- 2005. С.70- 86.
5. Методические указания по изучению иммунотропной активности фармакологических веществ - в Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ под общей редакцией члена-корреспондента РАМН, профессора Р.У. Хабриева, М. Медицина.-2005.- С. 501- 514.
6. Смирнова Г.И. Опыт применения Синупрета и Тонзилгона Н для профилактики и лечения острых респираторных заболеваний у часто болеющих детей.//Детский доктор.-2001.-№1.-С. 25-29.
7. Drozd J., Anuszewska E. The influence of plant raw materials, containing ellagic acid and selected antibiotics on immunological response in mice.//Acta Pol. Pharm.-2005.- Vol. 62, N 3.- P. 237-240.
8. Fritz W. R, Fintelmann V. //Herbal Medicine, Thieme MedicalPublshers; 2 edition. -2000.- Р. 40-46.
9. Kim H.M., Lee E.H., Shin T.Y. et al. Taraxacum officinale restores inhibition of nitric oxide production by cadmium in mouse peritoneal macrophages.//Immunopharmacol. Immunotoxicol.-1998. -N 2. -Р. 283-297.
10. Luo Z. The use of Chinese traditional medicines to improve impaired immune functions in scald mice.//Zhonghua Zheng Xing Shao Shang Wai Ke Za Zhi.-1993.-N1.-P. 56-58.
11. Monte F.H.M.; Santos J nior J.G.; Russi M. et al. Antinociceptive and anti-inflammatory properties of the hydroalcoholic extract of stems from Equisetum arvense L. in mice.// Pharmacological Research.-2004, Vol. 49.-N 3. -P. 239-243.
12. NahrstedtA, Vetter U, Hammerschmidt F.J. Composition of the Steam Distillation Product from the Leaves of Juglans regia.// Planta Med.-1981.- Vol. 42.- N8.- P. 313-332.
13. Nieman D.C., Henson D.A., Gross S.J., Quercetin reduces illness but not immune perturbations after intensive exercise.// Med. Sci.Sports Exerc.-2007.- Vol. 39.- N 9.-P. 1561-1569.
14. Nosal'ova G. Antitussive efficacy of the complex extract and the polysaccharide of marshmallow (Althaea officinalis L. var. Robusta).//Pharmazie.- 1992.- N 47. -Р. 224-226.
| Февраль 2009 г. |