Опубликовано в:
«РМЖ» »» 2013 № 5
Длительное применение нимесулида в реальной клинической практике: вопросы безопасности
К.м.н. И.З. Гайдукова, профессор А.П. Ребров, О.Л. Полянская, М.Ю. Спицина
ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» МЗ РФ
Достоинства и недостатки нестероидных противовоспалительных препаратов, особенности нимесулида
Нестероидные противовоспалительные препараты (НПВП) являются наиболее часто применяемыми в реальной клинической практике лекарственными средствами. Сочетание анальгетического, противовоспалительного и жаропонижающего действий обусловили востребованность указанных препаратов при лечении большого числа заболеваний. При этом в лечении разных нозологических форм НПВП занимают различное место. При ряде заболеваний НПВП являются в первую очередь симптоматическими средствами (например, при онкологических заболеваниях), хотя справедливости ради следует отметить, что у ряда НПВП (например, нимесулида и целекоксиба) имеется способность замедлять неоангиогенез и тормозить рост опухоли [1]. При острой боли в позвоночнике противовоспалительные препараты наряду с анальгетиками применяются короткими курсами до уменьшения болевого синдрома и локального воспаления.
В ряде работ было показано, что простые анальгетики (парацетамол) обладают сопоставимым или меньшим обезболивающим эффектом, чем НПВП у данной категории больных [2]. Существуют заболевания, для которых НПВП рассматриваются в качестве болезнь-модифицирующих (базисных) препаратов. К таким заболеваниям относят спондилоартриты (СпА). СпА - это группа системных воспалительных заболеваний, для которых характерно частое вовлечение в воспалительный процесс крестцово-подвздошных сочленений, позвоночника, наличие периферического моно- или олиго-артрита, серонегативность по ревматоидному фактору, отсутствие ревматоидных узелков, семейные случаи заболевания, ассоциация с HLA-B27 антигеном, частое развитие энтезитов, типичные внесуставные проявления (увеит, поражение кожи и слизистых оболочек, воспалительные заболевания кишечника и т.д.) [3].
По данным некоторых исследований, НПВП являются препаратами, применение которых тормозит прогрессирование формирования синдесмофитов у пациентов со СпА, причем указанный положительный эффект напрямую связан с индексом потребления НПВП, отражающим кратность и длительность приема того или иного препарата данной группы [4].
НПВП, согласно рекомендациям Международного общества оценки спондилоартритов - ASAS/EULAR (the Assessment of Spondyloarthritis International Society/European Lique Against Rheumatism), являются препаратами первой линии в лечении аксиального СпА при наличии боли и скованности. Причем пациентам с персистирующей активностью и сохранением симптомов заболевания показано длительное применение НПВП. При назначении НПВП должен учитываться риск возникновения сердечно-сосудистой, желудочно-кишечной и почечной патологии [5].
Нежелательные явления, ассоциирующиеся с приемом НПВП, из которых наиболее значимыми являются ульцерогенный, гепато- и нефротоксические эффекты, неблагоприятное влияние препаратов на сердечно-сосудистую систему, существенно ограничивают их длительное применение [6, 7].
В рекомендациях ряда ревматологических обществ имеются указания на применение НПВП в минимально эффективных дозах в течение короткого времени или рекомендуется их замена на анальгетики [7]. Таким образом, когда речь идет о лечении пациентов со СпА, наблюдается некоторое противоречие в имеющихся рекомендациях: с одной стороны, НПВП являются болезнь-модифицирующими препаратами для данной группы пациентов и должны применяться длительно, с другой -возможные побочные эффекты НПВП делают необходимым прием данных препаратов минимальными дозами и курсами.
Какие требования предъявляются к оптимальному противовоспалительному препарату для лечения СпА? Во-первых, необходим быстрый противовоспалительный и обезболивающий эффект, сохраняющийся длительно. Во-вторых, препарат должен применяться внутрь и обладать высокой безопасностью. В популяции пациентов со СпА риск быстрого обострения сердечнососудистых заболеваний (в частности, сердечной недостаточности) меньше, чем при других заболеваниях суставов (пациенты в основном моложе 50 лет). В то же время при длительном приеме НПВП этот риск может повышаться [8], что потребует для терапии при наличии сердечно-сосудистой патологии поиска наиболее безопасного средства, а также мониторинга состояния сердечно-сосудистой системы. При длительном приеме НПВП риск желудочно-кишечных осложнений возрастает. Его можно уменьшить путем применения препаратов селективных или частично селективных в отношении циклооксигеназы-2 (ЦОГ-2). При высоком риске осложнений следует принимать комбинацию таких препаратов с ингибитором протонной помпы. Профилактика гепато- и нефротоксических эффектов при длительном применении НПВП представляется наиболее трудной задачей, т.к. эти побочные эффекты труднопредсказуемы и могут возникать у лиц с отсутствием факторов риска в анамнезе [9-13].
В условиях современной клинической практики одним из наиболее привлекательных НПВП для постоянного приема является нимесулид (Найз®) - препарат для приема внутрь с частично селективным воздействием на циклооксигеназу-2 (ЦОГ-2), невысоким риском осложнений со стороны сердечно-сосудистой системы и минимальными гепато- и нефротоксическими эффектами. За 28 лет применения (с 1985 г) нимесулид достаточно хорошо изучен и нашел широкое применение в мировой клинической практике [14]. Препарат используется почти в 50 странах мира.
По данным фармацевтической компании Helsinn Healthcare SA, к 2005 г в мире было проведено около 450 млн терапевтических курсов нимесулида [15-17]. Группой по изучению эффективности нимесулида (Consensus Report Group on Nimesulid, 2006) были обозначены основные достоинства препарата, позволяющие применять его в клинической практике: высокий профиль безопасности относительно осложнений со стороны желудочно-кишечного тракта (ЖКТ), высокая кардиоваскулярная безопасность, выраженный противовоспалительный и анальгетический эффект при наличии быстрого начала действия (через 30 мин. после приема) [15].
Указанные свойства препарата основаны не только на преимущественном подавлении активности ЦОГ-2, но и на эффектах, не связанных с подавлением активности ЦОГ. Эти эффекты заключаются в способности препарата контролировать провоспалительные медиаторы, синтез которых происходит под воздействием 3,5-аденозинмонофосфата; в способности воздействовать на дегрануляцию тучных клеток, уменьшая выброс гистамина и соляной кислоты слизистой желудка. Они обусловлены и биохимическими свойствами препарата -высокая липофильность и щелочные свойства молекулы нимесулида затрудняют ее проникновение в слизистую оболочку верхних отделов ЖКТ, исключая контактное раздражающее действие [15, 16, 18-21]. Максимальная суточная доза препарата Найз® составляет 200 мг
Вместе с тем известно, что часть врачей и пациентов отказываются от применения нимесулида из-за имеющихся сообщений о его негативном влиянии на функцию печени и почек [9, 22-24]. Всего описано около 200 случаев гепатотоксических эффектов нимесулида, из которых тяжелым был 81 случай. Из этого следует, что острая печеночная недостаточность при приеме нимесулида является непредсказуемым эффектом препарата и может развиться как при его длительном применении, так и после нескольких приемов. При этом общая частота развития нежелательных явлений со стороны печени является низкой.
По данным Traversa G. и соавт. (2003), частота изменения функции печени больных, принимавших НПВП в период с 1997 по 2001 г, составила 29,8 на 100 тыс. пациенто-лет (n=400 000). Частота относительного риска развития патологии печени при применении нимесулида была равна 1,4 (95% ДИ; 1,0-2,1) по сравнению с таковой у пациентов, не принимавших НПВП более 12 мес. Частота поражения печени достигла 35,3 на 100 тыс. пациенто-лет на фоне лечения нимесулидом, 39,2 - при применении диклофенака, 66,8 - кеторолака и 44,6 -ибупрофена [25]. Таким образом, описанные 200 случаев острого печеночного повреждения на 450 млн курсов применения препарата следует рассматривать как редкий эффект, который (согласно заключениям ряда обществ по изучению безопасности лекарственных препаратов) не может быть основанием для запрещения применения нимесулида в клинической практике.
При применении нимесулида в литературе описаны снижение скорости клубочковой фильтрации (СКФ) и развитие тубуло-интерстициального нефрита [9-13]. При наличии отдельных клинических случаев острого почечного повреждения [9, 23] общая частота встречаемости нарушения функции почек при длительном лечении нимесулидом неизвестна.
Наиболее опасным нежелательным явлением, которое определяет летальность пациентов, применяющих НПВП, остаются желудочно-кишечные кровотечения. Несмотря на принимаемые меры профилактики, ежегодно регистрируются тысячи случаев новых желудочно-кишечных кровотечений, ассоциирующихся с приемом НПВП [26].
По данным Laporte J. и соавт. (2004), зарегистрировано 401,4 случая кровотечений в верхних отделах ЖКТ на 1 млн жителей в возрасте старше 18 лет. Частота риска желудочно-кишечных кровотечений при применении нимесулида составила 3,2 (95% ДИ: 1,9, 5,6), а при применении мелоксикама - 5,7 (95% ДИ: 2,2, 15,0) [27]. В Институте ревматологии РАМН (г. Москва) было выполнено исследование, в котором 200 мг нимесулида или 100 мг диклофенака натрия назначались пациентам непосредственно после лечения по поводу язвенной болезни желудка или эрозивного гастрита. Рецидив язвы через 2 мес. наблюдения возник лишь у 1 больного, получавшего нимесулид (5,6%), и у 1/3 (33,3%) больных, леченных диклофенаком (р<0,05) [17, 28, 29].
Следует отметить, что за счет редкости гепато- и нефротоксических эффектов и высокого профиля безопасности в отношении желудочно-кишечных и кардио-васкулярных осложнений соотношение польза/риск нимесулида остается неизменно высоким, несмотря на указанные случаи острого почечного и печеночного повреждения. Эти данные явились основой заключения группы по изучению нимесулида (Consensus Report Group on Nimesulid (2006)), в котором не было рекомендовано исключать препарат из клинической практики.
Вместе с тем известно, что безрецептурный отпуск нимесулида в Российской Федерации приводит к тому, что часть пациентов принимает препарат, нарушая рекомендованный режим дозирования. Поэтому нам представлялся интересным анализ особенностей приема нимесулида у пациентов со СпА в реальной клинической практике с изучением информированности пациентов о побочных эффектах препарата и вопросов безопасности его применения, в т.ч. и при нарушении рекомендованных схем.
Целью настоящего исследования явилось изучение частоты встречаемости нарушения функции печени и/или почек у пациентов с аксиальнымСпА, принимающих нимесулид (Найз®), и их ассоциации с особенностями применения препарата в реальной клинической практике.
Материалы и методы
В исследование включено 96 пациентов (18-50 лет), находившихся на лечении в ревматологическом отделении областной клинической больницы г Саратова в 2010-2013 гг. Диагноз аксиального СпА устанавливали на основании соответствия пациента классификационным критериям ASAS (the Assessment of Spondyloarthritis International Society) [30, 31]. Пациентам проводили общеклиническое обследование, исследовали общий анализ крови (ОАК), общий анализ мочи (ОАМ), С-РБ высокочувствительным методом c применением реактивов фирмы Diasis; общий белок, альбумины, мочевину, креатинин, глюкозу, билирубин, аспартат- и аланинамино-трансферазу сыворотки крови. У части больных исследовали суточную протеинурию, выполняли УЗИ почек, дуплексное исследование почечных артерий. Наличие гипостенурии констатировали в случае снижения удельного веса утренней мочи менее 1018 у.е. на фоне сухоядения. СКФ рассчитывали по формуле MDRD (Modification of Renal Disease Study) [32]. Активность СпА определяли путем расчета индекса BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [29].
Были проанализированы терапия, которую пациенты получали на амбулаторном этапе до момента госпитализации, и рекомендации их лечащих врачей при выписке. Наличие хронической болезни почек (ХБП) констатировали на основании рекомендаций K/DOQI (2002) [33]. Пациентам, принимавшим нимесулид (Найз®), предоставляли вопросник, уточняющий длительность, кратность приема и применяемые дозировки препарата.
Протокол исследования одобрен этическим комитетом ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» МЗ РФ.
Статистическую обработку осуществляли с использованием программ Microsoft Office Exсel 2007 (Microsoft Corp., США) и Statistica 8.0 (StatSoft Inc., США). Характер распределения данных оценивали графическим методом и с использованием критерия Шапиро-Уилка. Описание признаков, имеющих нормальное распределение, представлено в виде M±SD, где М - среднее арифметическое, SD - стандартное отклонение; для признаков с распределением, отличным от нормального, результаты представлены в виде Ме [Q1; Q3], где Me - медиана, Q1 и Q3 - 1-й и 3-й квартили. Для обработки данных с нормальным типом распределения использовали параметрические методы: t-тест для независимых группировок, парный t-тест. При характере распределения данных, отличном от нормального, применяли непараметрические методы: критерий Манна-Уитни, критерий Вальда-Вольфовица, критерий х2, критерий Вилкоксона, критерий знаков. При сравнении более чем двух независимых группировок использовали методы дисперсионного анализа: параметрический дисперсионный анализ для нормально распределенных данных и ранговый анализ вариаций по Краскелу-Уоллису для данных с распределением, отличным от нормального [34].
Результаты и обсуждение
В исследование были включены 53 пациента (мужчины), их средний возраст составил 42,3±10,5 года, длительность заболевания - 14,1±8 лет (55,2%). Большинство пациентов имели высокую активность заболевания: у 85 (88,54%) пациентов BASDAI>4, С-РБ - 12,44 [2,2; 26,2] мг/л, СОЭ - 18 [14; 24] мм/ч.
Все пациенты отмечали наличие боли воспалительного характера в спине (ежедневно) и применяли для лечения НПВП.
Признаки ХБП установили у 77 (80,2%) пациентов со СпА. Снижение СКФ в диапазоне от 60 до 89 мл/мин/1,73м2 выявили у 39 (40,6%) больных, снижение от 30 до 59 мл/мин/1,73м2 - у 6 (6,25%). Гипостенурия установлена у 56 (58,33%), протеинурия - у 36 (37,5%) больных. Артериальная гипертензия выявлена у 30 (31,25%) пациентов, сахарный диабет - у 2 (2,08%). По данным популяционных исследований, частота выявления ХБП в общей популяции составляет 39% [ДИ 31; 47] [35] (различия с частотой встречаемости ХБП у пациентов со СпА достоверны, p<0,05). Взаимосвязи между степенью снижения СКФ и активностью СпА не установлено. Следовательно, возник вопрос о взаимосвязи выявленных изменений с приемом НПВП.
Наиболее часто применяемым в обследованной группе НПВП был нимесулид - его принимали 70 (72,92%) пациентов. Средний возраст 35 (50%) пациентов (мужчин), применявших нимесулид, составил 41,43±10,95 года, длительность заболевания -13,72±9,14 года.
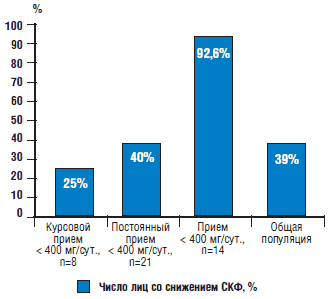
Рис. 1. Число лиц со снижением СКФ у пациентов с различными режимами дозирования нимесулида
Примечание:
• Частота встречаемости ХБП в общей популяции – данные Clase C.M., Garg A.X. Kiberd B.A. Prevalence of low glomerular filtration rate in nondiabetic Americans: NHANES III // J Am Soc Nephrol. 2002. Vol. 13. Р. 1338–1349 [35].
• Различия между частотой снижения СКФ у пациентов, принимающих нимесулид более 400 мг/сут., и у пациентов из других групп достоверны (p<0,05)
При анализе режима дозирования нимесулида установили, что 18 пациентов принимают препарат от 6 мес. до 1 года, 12 - от 1 года до 3 лет, 22 - более 3 и менее 10 лет, 6 - более 10 лет. 8 пациентов принимают препарат курсами по 10 дней несколько раз в год, 12 - несколько раз в неделю, 26 - постоянно, 24 пациента уточнить режим дозирования затруднились (принимают в режиме «по требованию»). 24 пациента обычно принимают 200 мг препарата в сутки, 34 - 400 мг/сут., 12 - более 500 мг/сут. При сильных болях 18 (25,7%) пациентов принимают от 500 до 800 мг/сут., 2 (2,85%) - более 800 мг/сут. Дозы свыше 200 мг/сут. пациенты принимали самостоятельно, несмотря на рекомендации врачей. 22 (31,43%) пациента отметили, что превышают дозу 400 мг/сут. несколько раз в год, 3 (4,2%) - несколько раз в месяц, 2 (2,85%) нарушают режим дозирования постоянно.
Таким образом, 27 (38,57%) пациентов из 70 нарушали рекомендованный режим применения препарата. 42 пациента отметили, что информированы лечащим врачом о возможных побочных эффектах препарата и недопустимости превышения его терапевтических дозировок. 22 пациента наиболее значимым считали ульцерогенный эффект препарата, 16 - гепатотоксический, 9 - негативное влияние на сердечно-сосудистую систему, 2 - способность негативно влиять на гемопоэз, 10 - способность нарушать работу почек.
На амбулаторном этапе 26 пациентов контролировали ОАК и биохимический профиль крови 1 раз в 2-6 нед., 16 - 1 раз в 2-6 мес., 10 - 1 раз в 6-12 мес., 18 - реже 1 раза в год. Следует отметить, что все пациенты сочетали прием нимесулида с ингибиторами протонной помпы (омепразол). Повышение печеночных ферментов до 2 норм установили у 4 пациентов, у 1 пациента - до 4 норм.
У пациентов со СпА без патологии мочевыводящих путей (ПМВП) и кардиоваскулярных заболеваний (за исключением артериальной гипертензии I-II стадий), принимавших нимесулид, (n=66), признаки ХБП установили у 52 (78,78%) больных. Изолированное снижение СКФ<89 мл/мин/1,73 м2 в данной группе выявили у 24 (36,36%) пациентов, менее 60 мл/мин/1,73 м2 - у 4 (6,06%). Протеинурия выявлена у 23 (34,84%) пациентов, гипостенурия - у 40 (60,6%).
Интересен тот факт, что степень снижения СКФ ассоциировалась c особенностями применения препарата. Установлена взаимосвязь между длительностью приема нимесулида и СКФ (R Спирмена = -0,34, p=0,02) (рис. 1). При этом СКФ у 8 пациентов, применявших нимесулид курсами несколько раз в год и не превышавших рекомендованную дозировку, составила 93,2 мл/мин./1,73 м2, а снижение ХБП менее 89 мл/мин/1,73 м2 установили у 2 больных. У 21 пациента, принимавшего нимесулид несколько раз в неделю и постоянно в дозировке, не превышавшей 400 мг/сут., СКФ составила 84,1 мл/мин/1,73 м2, снижение СКФ от 60 до 89 мл/мин/1,73 м2 установлено у 12 пациентов. У 14 пациентов, принимавших препарат несколько раз в неделю и постоянно в дозировке, превышавшей 400 мг/сут., СКФ составила 68,2 мл/мин./1,73 м2, а снижение ХБП менее 89 мл/мин./1,73 м2 установили у 13 пациентов, из них у 3 СКФ составила менее 60 мл/мин./1,73 м2. Различия между значениями СКФ пациентов, принимавших нимесулид по 200-400 мг/сут. и более 400 мг/сут., достоверны (p<0,05). У 1 пациента, принимавшего нимесулид в течение 3 лет в дозировке 400 мг/сут. ежедневно, установлено наличие микрогематурии, купировавшейся в течение 7 сут. после отмены препарата, СКФ у него составляла 94 мл/мин./1,73 м2.
Анализ приведенных выше данных показал несколько интересных особенностей применения нимесулида в реальной практике. Во-первых, установлено, что практически каждый 4-й пациент, длительно применяющий нимесулид, регулярно превышает его терапевтическую дозировку. При этом пациенты, включенные в исследование, были достаточно хорошо информированы о сути заболевания, получаемом препарате, возможных побочных эффектах, достаточно регулярно контролируют ОАК, биохимический профиль крови.
При этом даже на фоне длительного приема препарата, в т.ч. в дозах, превышавших рекомендованные, отмечено минимальное повышение уровня печеночных ферментов лишь в 7,14% случаев. Повышение уровня ферментов купировалось в течение 1 нед. после отмены препарата. Серьезных нежелательных явлений установлено не было.
Ретроспективный анализ полученных данных показал, что курсовой прием препарата несколько раз в год ассоциируется с формированием ХБП в 25% случаев (частота встречаемости ХБП в популяции составляет 39% [35, 36]), постоянный длительный прием нимесулида в дозе 400 мг/сут. сочетается с формированием I стадии ХБП не более чем у 40% пациентов (различия с частотой встречаемости ХБП в общей популяции не установлено). Прием препарата в дозировках, превышающих рекомендованные, приводит к более значимому уменьшению тяжести ХБП (до II стадии), что наблюдается с высокой частотой - снижение СКФ установили у 92,85% пациентов.
Вместе с тем ухудшение функции почек может быть вызвано не только приемом НПВП, но и персистирующим воспалением. Отсутствие взаимосвязи между степенью активности СпА и снижением СКФ может быть обусловлено тем, что в исследование были включены только пациенты с высокой активностью заболевания. Следовательно, исключить влияние на функцию почек персистирующего воспаления без выполнения исследования с включением пациентов с различной степенью активности СпА и группы здоровых лиц невозможно.
Заключение
Анализ данных литературы и результатов реальной клинической практики позволяет заключить, что:
Вывод: при условии соблюдения существующих рекомендаций по применению нимесулид (Найз®) при высокой эффективности обладает и высоким профилем безопасности, в т. ч. и при длительном приеме у пациентов с аксиальным СпА.
- Большинство пациентов со СпА, принимающих нимесулид длительно, информировано врачами о возможных побочных эффектах препарата, регулярно контролируют ОАК, параметры функции печени и почек; все пациенты сочетают прием нимесулида с ингибиторами протонной помпы.
- Каждый 4-й пациент со СпА регулярно превышает рекомендованные дозировки нимесулида. При этом серьезных нежелательных явлений отмечено не было.
- Степень выраженности снижения СКФ у пациентов со СпА взаимосвязана с особенностями приема НПВП (нимесулида). У пациентов, принимающих препарат курсами в рекомендованных дозах, частота развития ХБП ниже популяционного уровня; у пациентов, принимающих препарат постоянно в дозе, не превышающей 400 мг/сут., развитие ХБП наблюдается чаще, чем при курсовом приеме, но не превышает частоту встречаемости в популяции.
- У пациентов со СпА, из-за болевого синдрома длительно принимающих нимесулид в дозах, превышающих рекомендованные терапевтические, ХБП выявляется с высокой частотой. Данные пациенты нуждаются в коррекции терапии путем ее усиления биологическими агентами или анальгетиками с постоянным контролем функции почек и проведением нефропротективной терапии.
- Длительный прием нимесулида в максимально рекомендованных дозах ассоциируется с минимальными обратимыми нарушениями функции печени в 7% случаев.
Список использованной литературы
- Masferrer J.L, LeahyK.M., KokiA.T., ZweifelB.S., SettleS.L., WoernerB.M. et al. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors // Cancer Res. 2000 Mar 1. Vol. 60 (5). Р. 1306-1311.
- Pincus T., Koch G., Lei H., Mangal B., Sokka T., Moskowitz R. et al. Patient Preference for Placebo, Acetaminophen (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patients with knee or hip osteoarthritis //Annals of the rheumatic diseases. 2004 Aug. Vol. 63 (8). Р. 931-939.
- Насонов Е.Л., Насонова В.А.. Ревматология. М.: ГЕОТАР-Медиа 2005.
- Poddubnyy D., Haibel H., Listing J, Mrker-Hermann E., Zeidler H., Braun J. et al. Influence of NSAIDs intake on the radiographic spinal progression over two years in patients with early axial spon-dyloarthritis // Ann Rheum Dis. 2011. Vol. 70 (Suppl 3). Р. 128.
- Zochling J., van der Heijde D., Burgos-Vargas R., Collantes E, Davis J.C. Jr., Dijkmans B. et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis // Ann Rheum Dis. 2006 Apr. Vol. 65 (4). Р. 442-452.
- White A.P., Arnold P.M., Norvell D.C., Ecker E, Fehlings M.G. Pharmacologic management of chronic low back pain: synthesis of the evidence // Spine. 2011 Oct 1. Vol. 36 (21 Suppl). Р. 131-143.
- Brattwall M., Turan I., Jakobsson J. Musculoskeletal pain: prescription of NSAID and weak opioid by primary health care physicians in Sweden 2004-2008 - a retrospective patient record review // J Pain Res. 2010. Vol. 3. Р. 131-135.
- Ребров АП., Гайдукова И.З., Поддубный Д.А. Кардиоваскулярная патология у больных анкилозирующим спондилитом // Научно-практическая ревматология. 2012. № 51 (2). С. 100-105.
- Weiss P., Mouallem M., Bruck R., Hassin D., Tanay A., Brickman C.M. et al. Nimesulide-induced hepatitis and acute liver failure // Isr Med Assoc J. 1999 Oct. Vol. 1 (2). Р. 89-91.
- Whelton A., Hamilton C.W. Nonsteroidal anti-inflammatory drugs: effects on kidney function //J Clin Pharmacol. 1991 Jul. Vol. 31 (7). Р. 588-598.
- Aronoff G.R. Nonsteroidal anti-inflammatory drug induced renal syndromes // J Ky Med Assoc 1992 Jul. Vol. 90 (7). Р. 336-339.
- Ejaz P., Bhojani K., Joshi V.R. NSAIDs and kidney// The Journal of the Association of Physicians of India. 2004 Aug. Vol. 52. Р. 632-640.
- Adam O., Vetter-Kerkhoff C., Schlondorff D. [Renal side-effects of non-steroidal antirheumatic drugs] // Med Klin (Munich). 1994 Jun 15. Vol. 89 (6). Р. 305-311.
- Mattia C., Ciarcia S., Muhindo A., Coluzzi F. [Nimesulide: 25 years later] // Minerva Med. 2010 Aug. Vol. 101 (4). Р. 285-293.
- Rainsford K.D. Nimesulide - a multifactorial approach to inflammation and pain: scientific and clinical consensus// Current medical research and opinion. 2006 Jun. Vol. 22 (6). Р. 1161-1170.
- Rainsford K.D. Current status of the therapeutic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide // Inflammopharmacology. 2006 Aug. Vol. 14 (3-4). Р. 120-137.
- Каратеев А.Е. Нестероидные противовоспалительные препараты в современной клинической практике: «за» больше, чем «против» // Современная ревматология. 2008. № 1. С. 70-77.
- Ward A., Brogden R.N. Nimesulide. A preliminary review of its pharmacological properties and therapeutic efficacy in inflammation and pain states // Drugs. 1988 Dec Vol. 36 (6). Р. 732-753.
- Aho M., Kokki H., Nikanne E. Nimesulide versus Ibuprofen for Postoperative Tonsillectomy Pain: A Double-Blind, Randomised, Active Comparator-Controlled Clinical Trial// Clin Drug Investig. 2003. Vol. 23 (10). Р. 651-660.
- Dallegri F., Ottonello L. Are there any Differences among Non-SteroidalAnti-Inflammatory Drugs? Focus on Nimesulide // Clin Drug Investig. 2007 Dec. Vol. 27. Suppl 1. Р. 15-22.
- Loh J.S., Ong C.W. Efficacy of nimesulide versus meloxcam in the control of pain, swelling and trismus following extraction of impacted lower third molar [Int. J. Oral Maxillofac. Surg. 39 (2010) 580-584] // Int J Oral Maxillofac Surg. 2011 Jan. Vol. 40 (1). Р. 125.
- Van Steenbergen W, Peeters P., De Bondt J., Staessen D., Buscher H., Laporta T. et al. Nimesulide-induced acute hepatits: evidence from six cases// J Hepatol. 1998 Jul. Vol. 29 (1). Р. 135-141.
- Page M, Christin F, Hayi-Slayman D, Baillon J.J., Ber C.E., Delafosse B. et al. [Acute liver falure due to a treatment by nimesulide: another case and review] //Ann Fr Anesth Reanim. 2008 Sep. Vol. 27 (9). Р. 742-746.
- Rodrigo L, de Francisco R, Perez-Pariente J.M., Cadahia V., Tojo R, Rodriguez M. et al. Nime-sulide-induced severe hemolytic anemia and acute liver failure leading to liver transplantation // Scandinavian journal of gastroenterology. 2002 Nov. Vol. 37 (11). Р. 1341-1343.
- Traversa G, Bianchi C, Da Cas R, Abraha I., Menniti-Ippolito F, Venegoni M. Cohort study of hepatotoxicity associated with nimesulide and other non-steroidal anti-inflammatory drugs // Bmj. 2003 Jul 5. Vol. 327 (7405). Р. 18-22.
- Singh G. Recent considerations in nonsteroidal anti-inflammatory drug gastropathy // The American journal of medicine. 1998 Jul 27. Vol. 105 (1B). Р. 31-38.
- Laporte J.R., Ibanez L., VidalX., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents// Drug Saf. 2004. Vol. 277 (6). Р. 411-420.
- Каратеев А.Е, Каратеев Д.Е, Насонов Е.Л. Гастродуоденальная переносимость нимесулида (Нимесил, Berlin Chemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ-2 ингибиторов у больных с высоким риском развития НПВП-индуцированных гастропатий // Научно-практическая ревматология. 2003. № 1. С. 45-48.
- Garrett S., Jenkinson T., Kennedy L.G., Whitelock H., Gaisford P., Calin A. A new approach to defining disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index// J Rheumatol. 1994 Dec. Vol. 21 (12). Р. 2286-2291.
- Rudwaleit M., Landewe R., van der Heijde D., Listing J, Brandt J, Braun J. et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondy-loarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal // Ann Rheum Dis. 2009 Jun. Vol. 68 (6). Р. 770-776.
- Rudwaleit M., van der Heijde D., Landewe R., Listing J., Akkoc N., Brandt J. et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondy-loarthritis (part II): validation and final selection //Ann Rheum Dis. 2009 Jun. Vol. 68 (6). Р. 777-783.
- Levey AS,. Bosch J.P., Lewis J.B., Greene T., Rogers N., Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new predicton equaton. Modification of Diet in Renal Disease Study Group //Annals of internal medicine. 1999 Mar 16. Vol. 130 (6). Р. 461-470.
- K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification // American journal of kidney diseases : the official journal of the National Kidney Foundation. 2002 Feb. Vol. 39 (2 Suppl 1). Р. 1-266.
- Реброва О.Ю. и соавт. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. М.: Медиа Сфера, 2002.
- Clase C.M., Garg AX, Kiberd B.A. Prevalence of low glomerular filtration rate in nondiabetic Americans: Third National Health and Nutrition Examination Survey (NHANES III) // J Am Soc Nephrol. 2002 May. Vol. 13 (5). Р. 1338-1349.
- Guidelines for the Clinical Evaluation of Anti-Inflammatory and Antirheumatic Drugs (Adults and Children). Appendix 5 of the FDA. 1988.
| Июль 2013 г. |