Опубликовано в журнале:
«Фарматека»; № 4; 2009; стр. 17-25.НИМЕСУЛИД: ВОПРОСЫ БЕЗОПАСНОСТИ И ВОЗМОЖНОСТЬ ДЛИТЕЛЬНОГО ПРИМЕНЕНИЯ
А.Е. Каратеев
ГУ "Институт ревматологии" РАМН, МоскваХроническая боль, в т. ч. при ревматических заболеваниях, оказывает выраженное негативное влияние на качество жизни больных, ведет к потере трудоспособности и социальной активности. Рассматривается место нестероидных противовоспалительных средств, в частности нимесулида, в лечении хронического болевого синдрома при заболеваниях опорно-двигательного аппарата. Подробно обсуждаются вопросы безопасности нимесулида в сравнении с другими НПВС. Сделан вывод, что нимесулид - препарат с весьма благоприятным сочетанием мощного анальгетического, противовоспалительного действия и хорошей переносимости. Клинические исследования и большой опыт применения этого препарата в реальной клинической практике показывают, что риск развития побочных эффектов при длительном использовании нимесулида суммарно ниже, чем при применении традиционных (неселективных) НПВС. Поэтому нимесулид представляется препаратом выбора лечения ХБ, связанной с поражением суставов и позвоночника.
Ключевые слова: ревматические заболевания, нестероидные противовоспалительные средства (НПВС), нимесулид, побочные явления, НПВС-гастропатияЗначение хронической боли и место НПВС в ее лечении
Боль является наиболее тягостным проявлением заболеваний человека, определяющим основные страдания и снижение качества жизни. По современным представлениям, это не только неприятный симптом, но и важнейший фактор, серьезно влияющий на жизненный прогноз. Хорошо известно, что неадекватное обезболивание после тяжелых травм и в послеоперационном периоде существенно увеличивает риск развития таких жизнеугрожающих состояний, как респираторный дистресс-синдром, парез кишечника, кардиоваскулярные катастрофы [1—4].
Важнейшей причиной потери трудоспособности и социальной активности в современной популяции является хроническая боль (ХБ), связанная с заболеваниями суставов и позвоночника. ХБ тесно ассоциируется с такими патологическими состояниями, как депрессия, нарушения сна, развитие и дестабилизация сердечно-сосудистых заболеваний. Фармакотерапия хронических болевых синдромов различного генеза является серьезным финансовым бременем для общества и государства. Поэтому глобальная проблема ХБ привлекает все большее внимание представителей многих медицинских специальностей и организаторов медицины [5—8].
Четким подтверждением роли ХБ как важнейшего фактора, влияющего на жизненный прогноз, стала работа австралийских ученых Zhu K. и соавт. (2007). В течение 5 лет они наблюдали когорту из 1484 пожилых женщин (старше 70 лет) с ХБ в нижней части спины. Среди этих пациенток 21,7 % исходно и 26,9 % в конце периода наблюдения испытывали эти боли ежедневно. Результаты наблюдения показали, что в данной подгруппе риск гибели от инфаркта миокарда и ишемического инсульта был более чем в 2 раза выше (относительный риск — 2,13) в сравнении с пациентками, испытывавшими боли реже, чем 1 раз в день [9].
Эти данные имеют принципиальное значение, поскольку многие больные пожилого возраста, испытывающие ХБ, имеют сопутствующую патологию сердечно-сосудистой системы. Анализ коморбидных заболеваний у 15 тыс. жителей США в возрасте 65 лет и старше, страдающих остеоартрозом (ОА), показал, что у 80 % из них имеется артериальная гипертензия (АГ), у 31,3 % - сахарный диабет, у 38 % -признаки сердечной недостаточности (СН), у 16,9 % - ишемическая болезнь сердца, у 17,3 % -цереброваскулярные нарушения [10].
Поэтому быстрое и максимально полное купирование боли относится к числу первоочередных задач фармакотерапии большинства острых и хронических заболеваний. Не будет преувеличением сказать, что, с точки зрения пациента, эффективность купирования боли является важнейшим критерием качества медицинской помощи и квалификации лечащего врача.
Важнейшим классом лекарств, используемых для патогенетической терапии болевого синдрома (особенно в ситуациях, когда развитие боли тесно связано с процессами тканевого воспаления), являются нестероидные противовоспалительные средства (НПВС). Их отличают хорошо доказанная эффективность, предсказуемость фармакологического действия, доступность и удобство применения [11, 12].
Особое значение НПВС имеют в комплексной терапии ревматических заболеваний (РЗ), при которых боль и воспаление являются основными симптомами поражения суставов и позвоночника. Только для них характерно сочетание анальгетического, противовоспалительного и жаропонижающего эффектов, обеспечивающих контроль практически всех основных симптомов, характерных для поражения суставов и позвоночника. Поэтому, по мнению ведущих экспертов, назначение НПВС не просто желательно, но и определенно показано всем больным РЗ, испытывающим боли, связанные с острым или хроническим поражением опорно-двигательного аппарата [11-17].
Эффективность, доступность и удобство применения сделали НПВС наиболее популярным классом лекарственных препаратов. Так, в США 70 % людей старше 65 лет принимают эти препараты не реже 1 раза в неделю. По данным на 2001 г., в этой стране ежегодно выписывалось около 100 млн рецептов на НПВС на сумму более 5 млрд долл. В Дании, где общая численность населения составляет 4 614 800 человек, с 1997 по 2005 г. НПВС были назначены 2 663 766 жителям, т. е. 57,8 % [18, 19]. В нашей стране, где в настоящее время насчитывается 141,7 млн жителей, за 2007 г. было продано свыше 105 млн упаковок различных НПВС и более 11 млн упаковок "кардиологического" аспирина.
Фармакологические свойства и эффективность нимесулида
Одним из наиболее популярных НПВС в России является нимесулид [20-23]. Этот препарат удачно сочетает быстрое обезболивающее и выраженное противовоспалительное действие, что особенно ценно для симптоматической терапии РЗ. Важнейшим достоинством нимесулида является наличие на отечественном фармрынке весьма доступных по цене генериков, таких как Найз®, эффективность и хорошая переносимость которого доказаны серией пострегистрационных исследований.
Нимесулид - весьма эффективное и удобное средство для купирования острой боли. В отличие от многих других НПВС молекула нимесулида обладает "щелочными" свойствами, что затрудняет ее проникновение в слизистую верхних отделов желудочно-кишечного тракта (ЖКТ), существенно снижая вероятность контактного раздражения. С другой стороны, благодаря своим химическим свойствам нимесулид может легко проникать и накапливаться в очагах воспаления (например, в воспаленном суставе) в концентрации, большей, чем в плазме крови [24, 25].
Нимесулид отличает высокая биодоступность. Уже через 30 минут после приема внутрь его концентрация в крови составляет 25-80 % от максимального уровня и отмечается обезболивающий эффект. Пик концентрации препарата, а соответственно, и максимальное анальгетическое действие достигаются через 1-3 часа [24, 25].
Основное фармакологическое действие НПВС определяется блокадой циклооксигеназы (ЦОГ) типа 2 - фермента, активно синтезирующегося в очагах повреждения и воспаления клетками воспалительного ответа и отвечающего за синтез важнейших медиаторов боли и воспаления - простагландинов. В то же время ассоциированные с приемом НПВС осложнения (прежде всего со стороны ЖКТ) в основном определяются блокадой "структурной" формы циклооксигеназы - ЦОГ типа 1, играющей важную роль в поддержании многих параметров гомеостаза человеческого организма. Тем не менее ЦОГ-1 также принимает участие в воспалительном процессе, поэтому локальное подавление ее активности в области повреждения следует рассматривать как позитивный момент. Нимесулид, обладающий умеренной селективностью в отношении ЦОГ-2, относительно слабо воздействуя на "структурную" ЦОГ-1 слизистой оболочки желудка, эффективно блокирует ее активность в очагах воспаления и тканевого повреждения [24-26].
Необходимо отметить, что нимесулид имеет ряд фармакологических эффектов, не зависимых от класс-специфического влияния на активность ЦОГ и во многом определяющих его терапевтические достоинства. Он способен блокировать синтез основных провоспалительных цитокинов (интерликин-6, фактор некроза опухоли α), подавлять активность металлопротеиназ (ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при остеоартрозе), оказывать антигистаминное действие, а также вызывать блокаду фермента фосфодиэстеразы IV, снижая активность клеток воспалительной агрессии - макрофагов и нейтрофилов [26-29].
Быстрые и мощные обезболивающий и противовоспалительный эффекты нимесулида хорошо подтверждены данными многочисленных клинических исследований. Важным доказательством целесообразности назначения этого препарата при ургентном обезболивании стал успешный опыт его использования в анестезиологической практике. Это демонстрирует, в частности, работа Binning A. и соавт. (2007). В ходе этого исследования 94 больным, перенесшим артроскопическую операцию, в качестве анальгетика на 3 дня назначались нимесулид 200 мг, напроксен 1000 мг или плацебо. Полученные результаты показали, что оба НПВС достоверно превосходили плацебо, при этом нимесулид обеспечивал более выраженный обезболивающий эффект в первые 6 часов после операции [30].
При острой ревматической патологии - плечелопаточном периартрите, бурситах и тендинитах - нимесулид показал сходный (или несколько более высокий) эффект в отношении купирования боли и восстановления функции опорно-двигательной системы по сравнению с высокими дозами "традиционных" НПВС - диклофенака и напроксена [31, 32]. Так, в исследовании Wober W. 122 больных с плечелопаточным периартритом в течение 14 дней принимали нимесулид 200 мг/сут или диклофенак 150 мг/сут. В конце периода наблюдения "хороший" или "отличный" эффект терапии несколько чаще отмечался у получавших нимесулид (82,3 против 78,0 %). Субъективная оценка пациентов в отношении переносимости лекарств демонстрировала еще более значимое преимущество нимесулида. Так, 96,8 % больных считали, что нимесулид переносится "хорошо" или "отлично", в то время как аналогичную оценку диклофенаку дали лишь 72,9 % пациентов (р < 0,05).
Важным аспектом ургентного применения нимесулида является купирование неспецифической боли в нижней части спины. По данным исследования, проведенного в Финляндии (n = 102), нимесулид 100 мг, назначавшийся 2 раза в сутки, превосходил ибупрофен в дозе 600 мг, назначавшийся 3 раза в сутки, как по выраженности обезболивающего эффекта, так и по восстановлению функции позвоночника. К 10-му дню от начала лечения на фоне приема нимесулида отмечено более чем двукратное улучшение функциональной активности. Среди пациентов, принимавших этот препарат, индекс Остверсти в среднем снизился с 38 до 15 баллов (-23), что достоверно отличалось от эффекта ибупрофена - с 35 до 20 (-15; р = 0,02). Немаловажно, что нимесулид существенно реже (примерно в 2 раза - 7 против 13 %) вызывал побочные эффекты со стороны ЖКТ по сравнению с препаратом контроля [33].
Принципиальное значение имеют отечественные исследования, демонстрирующие высокий терапевтический потенциал нимесулида при остром и хроническом подагрическом артрите. Это метаболическое заболевание характеризуется весьма интенсивной болью, связанной с микрокристаллическим воспалением, и часто воспринимается как своеобразная "модель" для оценки эффективности НПВС. Необходимо отметить, что успех применения нимесулида при остром подагрическом артрите определяется не только его анальгетической эффективностью, но в первую очередь выраженным противовоспалительным действием. Весьма вероятно, что важную роль в этой ситуации может играть подавление активности мононуклеарных клеток (прежде всего макрофагов), опосредованное специфической способностью нимесулида влиять на фосфодиэстеразу VI. Очень важно, что назначение этого препарата позволяло добиваться обратного развития клиники артрита даже у пациентов, у которых была недостаточно эффективной предшествующая терапия высокими дозами диклофенака [34].
Нимесулид, как было отмечено выше, обладает способностью блокировать активность металлопротеиназ, играющих важнейшую роль в патогенезе разрушения суставного хряща. Этот фармакологический эффект определяет целесообразность применения этого препарата при остеоартрозе. Снижение концентрации маркеров катаболизма хрящевой ткани отражает позитивное влияние нимесулида на деградацию хряща у больных с ОА коленных и тазобедренных суставов [35, 36].
Ценную информацию об эффективности нимесулида при РЗ дает российский опыт применения этого препарата при раннем ревматоидном артрите (РА). Нами было проведено 4-недельное рандомизированное исследование эффективности нимесулида в суточных дозах 400 и 200 мг у 268 больных РА. Препаратом сравнения являлся диклофенак в дозах 200 и 100 мг. По результатам исследования, во всех группах отмечено статистически достоверное снижение числа воспаленных суставов и утренней скованности. При этом нимесулид оказался несколько эффективнее по обезболивающему действию: снижение уровня боли на 50 % и более (по ВАШ) отмечено у 44,8 и 40,8 % больных соответственно, более чем у трети пациентов - существенное (на 50 % и более) улучшение общего самочувствия. У пятерых больных на фоне монотерапии НПВС отмечено полное исчезновение клинических проявлений артрита [37].
Таким образом, преимущества использования НПВС в целом и нимесулида в частности при кратковременном лечении боли не вызывает сомнений. Совершенно иная ситуация возникает, когда речь идет о длительном применении НПВС. И проблема здесь связана не с эффективностью этих препаратов, в целом устраивающей врачей, а с их переносимостью.
Известно расхожее пожелание, касающееся использования НПВС: "минимальные дозы в течение минимального времени". К сожалению, в реальной клинической практике выполнение его весьма затруднительно, а во многих случаях невозможно.
Конечно, применение НПВС позволяет добиться лишь симптоматического улучшения, но не замедлить прогрессирование заболевания. Достижение "стратегического" эффекта при РЗ базируется на использовании иных лекарственных средств. Так, при РА -это раннее комплексное применение базисных противовоспалительных препаратов, включая биологические агенты; при ОА - комбинация немедикаментозных методов (образовательные программы, снижение массы тела, применение ортезов и др.) и фармакотерапии (хондропротекторы, препараты гиалуроновой кислоты, локальное введение глюкокортикоидов).
Однако достижение ремиссии или существенного улучшения состояния больных на фоне современной комплексной терапии требует месяцев, а порой и нескольких лет. Так, при РА даже на фоне применения комбинации биологических препаратов и цитостатиков у 50-60 % больных сохраняются умеренно выраженные суставные боли и, следовательно, потребность в обезболивающей симптоматической терапии [38].
С другой стороны, существенную часть пациентов с РЗ в реальной клинической практике составляют лица, длительно страдающие этими заболеваниями, у которых активная патогенетическая терапия не позволила достичь значительного успеха, а порой - и это бывает нередко -вообще не проводилась. Это инвалидизированные больные, имеющие выраженные деформации суставов, у которых даже адекватная современная терапия не позволяет полностью купировать суставные боли и симптоматическое лечение становится важнейшим направлением фармакотерапии.
Для этих больных НПВС незаменимы, поскольку их использование обеспечивает стабильный уровень обезболивания и улучшение общего самочувствия. Серия длительных масштабных исследований продолжительностью от 6 до 18 месяцев (таких как VIGOR, CLASS, TARGET и MEDAL) четко показала, что применение НПВС позволяет достичь 25-30 % снижения выраженности боли и улучшения общего самочувствия у пациентов с хроническими РЗ. При этом частота случаев неэффективности терапии не превышала 12-15 %. Очень важно, что в отличие от опиоидов НПВС не вызывают привыкания и не теряют своей эффективности при длительном использовании.
Безопасность и переносимость нимесулида
В ряде случаев на фоне приема НПВС могут возникать серьезные класс-специфические побочные эффекты, риск развития которых существенно увеличивается в зависимости от длительности использования препаратов. Среди этих осложнений наиболее известна т. н. НПВС-гастропатия -патология верхних отделов ЖКТ, связанная с системным влиянием НПВС и характеризующаяся развитием эрозий, язв и опасных осложнений -желудочно-кишечных кровотечений (ЖКК) и перфораций. Риск этой патологии у пациентов, регулярно принимающих НПВС, возрастает по сравнению с общей популяцией более чем в 4 раза (примерно 0,5-1,0 случай на 100 пациенто-лет). Больные, регулярно принимающие НПВС, погибают от подобных осложнений в 2-3 раза чаще, чем лица, не получающие НПВС и/или низкие дозы аспирина [39-42].
Самым частым осложнением со стороны ЖКТ, возникающим на фоне приема НПВС, является диспепсия. Различные неприятные симптомы -гастралгии, чувство тяжести и жжения в эпигастрии, тошнота, возникают у 20-30 % больных, регулярно использующих эти препараты. К счастью, данная патология не ассоциируется с опасными исходами, однако существенно влияет на качество жизни, ведет к ощутимым материальным потерям (связанным с необходимостью приема препаратов для купирования диспепсии) и является частой причиной (-10 %) прерывания терапии [43].
Куда более серьезной проблемой использования НПВС является опасность развития класс-специфических осложнений со стороны сердечнососудистой системы. К ним относятся дестабилизация АГ, прогрессирование СН и повышение риска кардиоваскулярных катастроф [12].
Материалы РКИ и данные мета-анализов свидетельствуют о том, что к возрастанию артериального давления (АД) может вести прием как традиционных, так и селективные НПВС [44]. Johnson A. и соавт., обобщив результаты 50 исследований, показали, что прием НПВС приводит к увеличению АД в среднем на 5 мм рт. ст. Этот эффект оказался более выраженным у пациентов, получавших антигипертензивную терапию, чем у лиц с исходно нормальным АД [45]. Результаты рандомизированных клинических исследований свидетельствуют, что индометацин, пироксикам и напроксен (в средних дозах), а также ибупрофен (в высокой дозе) способны снижать эффективность β-адреноблокаторов, диуретиков, ингибиторов АПФ и в меньшей степени - антагонистов кальция [46-48]. К сожалению, применение селективных НПВС (коксибов) не решает эту проблему: по данным мета-анализа Aw T.J. (2005), при их использовании отмечено такое же увеличение систолического и диастолического АД, как и при лечении традиционными неселективными НПВС [49].
В настоящее время не вызывает сомнения тот факт, что применение НПВС может ассоциироваться с повышением риска развития кардиоваскулярных катастроф. Если оценивать результаты проспективных исследований, то абсолютная частота серьезных осложнений со стороны сердечнососудистой системы превышает аналогичные показатели опасной лекарственной патологии со стороны ЖКТ. Это четко подтверждают данные наиболее крупного на сегодняшний день исследования безопасности НПВС -программы MEDAL. В ходе MEDAL 34701 больной ОА или РА в течение 18 месяцев принимал селективный НПВС (эторикоксиб 60 и 90 мг) или диклофенак 150 мг/сут. Оказалось, что суммарная частота серьезных осложнений со стороны ЖКТ (язвы, ЖКК, перфорации) составила 1,0 % на фоне приема эторикоксиба и 1,4 % в контрольной группе. В то же время кардио-васкулярные осложнения отмечены у 1,9 % пациентов в каждой из групп, а цереброваскулярные - у 0,53 и 0,48 % больных соответственно [50].
Важно подчеркнуть, что нежелательные эффекты НПВС являются серьезной, но вполне разрешимой проблемой. Дело в том, что подавляющее большинство опасных осложнений возникает у больных с т. н. факторами риска. Для НПВС-гастропатии -это пожилой возраст (старше 65 лет), язвенный анамнез и сопутствующий прием препаратов, влияющих на свертываемость крови (наиболее часто -низкие дозы аспирина). Для кардио-васкулярных катастроф - наличие некомпенсированной адекватным лечением АГ, СН, ишемической болезни сердца, а также заболеваний и патологических состояний, сопровождающихся повышенным риском развития сосудистых тромбозов.
Тщательный учет факторов риска и рациональное применение адекватных методов профилактики позволяют свести риск развития осложнений к минимуму. И нимесулид в этом плане является более безопасным, чем многие другие представители группы НПВС. Так, ирландский исследователь Bradbury F. оценил частоту осложнений со стороны ЖКТ при использовании в реальной клинической практике диклофенака (n = 3553), нимесулида (n = 3807) и ибупрофена (n = 1470). Большая часть больных (77,8 %) получала НПВС не более 14 дней. Оказалось, что суммарная частота гастроинтестинальных осложнений при использовании нимесулида не отличалась от таковой при применении ибупрофена (8,1 и 8,6 %), но была существенно меньше в сравнении с диклофенаком (2,1 %; р < 0,05) [51].
Conforti A. и соавт. оценили число сообщений о серьезных нежелательных эффектах, связанных с приемом различных НПВС. В ходе этого исследования было проанализировано 10 608 подобных сообщений (19882000). Согласно полученным данным, нимесулид вызывал серьезные осложнения со стороны ЖКТ в 2 раза реже, чем иные НПВС. Число сообщений, связанных с этим препаратом, составило 10,4 %, в то время как с диклофенаком - 21,2 %, кетопрофеном - 21,7, пироксикамом - 18,6 % [52].
Опасность развития ЖКК на фоне приема нимесулида в реальной клинической практике оценивалась в масштабном эпидемиологическом исследовании Laporte J. и соавт. Анализ включал 2813 эпизодов ЖКК, а контроль составили 7193 больных без данного осложнения, соответствующих по полу и возрасту. Нимесулид показал себя более безопасным препаратом, чем ряд других популярных в Европе НПВС: относительный риск ЖКК для нимесулида составил 3,2, для диклофенака - 3,7, мелоксикама - 5,7, а рофекоксиба - 7,2 [53].
Несколько работ, подтвердивших высокий уровень безопасности нимесулида в отношении ЖКТ, было проведено и в нашей стране. Наиболее масштабным из них стало исследование Минушкина О.Н., в котором был проведен анализ данных многоцентрового исследования эффективности и безопасности нимесулида (n = 600). Оказалось, что при длительности непрерывного приема препарата от 1 до 3 месяцев, суммарная частота осложнений со стороны ЖКТ составила примерно 9 %, при этом не было отмечено эпизодов ЖКК или перфорации язвы, хотя не менее 10 % исследуемых больных имели язвенный анамнез [54].
В отечественном исследовании эффективности НПВС при раннем РА (его результаты были представлены выше) серьезная патология ЖКТ -язвы и множественные эрозии желудка или 12-перстной кишки - на фоне приема нимесулида была выявлена лишь у 2 (1,3 %) пациентов, а среди принимавших диклофенак - у 7 (5,9 %; р = 0,042) [37].
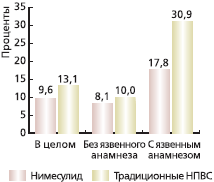
Мы провели ретроспективный анализ частоты выявления язв желудка и/или 12-перстной кишки у больных, принимавших нимесулид. Материалом для этого исследования послужили данные кабинета эндоскопии Института ревматологии РАМН (директор - академик РАМН Насонов Е.Л.). Хотя эта работа не была организованным исследованием, тем не менее данное наблюдение отражает переносимость препаратов в реальной клинической практике. Так, с 2000 по 2007 г. эндоскопическое исследование прошел 591 больной с различными РЗ, не менее 1 месяца до проведения эзофагогастродуоденоскопии (ЭГДС) принимавший нимесулид. Контроль составил 4931 аналогичный больной, прошедший ЭГДС (1998-2007) и получавший различные традиционные НПВС (81,7 % - диклофенак). Больные направлялись лечащими врачами из-за наличия тех или иных показаний для проведения ЭГДС. Частота выявленных язв представлена на рисунке. В целом риск этой патологии был существенно меньше среди получавших нимесулид: 9,6 против 13,1 % (p < 0,05). Для уточнения влияния такого важного фактора риска, как язвенный анамнез (он отмечен у 16 и 15 % пациентов соответственно), мы провели дополнительный анализ. Оказалось, что частота язв у больных с язвенным анамнезом, получавших нимесулид, была почти в 2 раза ниже по сравнению с теми, кто принимал неселективные НПВС.
Рис. Частота выявления язв желудка и/или двенадцатиперстной кишки у больных, принимавших нимесулид (n = 591) и или традиционные НПВС (n = 4931): данные ГУ ИР РАМН 1998-2007 гг.
Высокая безопасность нимесулида у больных с факторами риска НПВС-гастропатии подтверждается и следующей нашей работой. Согласно плану этого исследования, нимесулид в дозе 200 мг был назначен 20 больным, непосредственно перед этим проходившим курсовое противоязвенное лечение по поводу язвы или множественных (более 10) эрозий желудка и/или 12-перстной кишки, возникших при использовании других НПВС. Группу контроля составили 20 больных, соответствующих по возрасту, полу и диагнозу основного заболевания, которым после устранения НПВС-гастропатии назначался диклофенак в ректальных свечах. Рецидив эрозивно-язвенного поражения за 2 месяца наблюдения отмечен лишь у 1 (5,6 %) больного, получавшего нимесулид, и у 33,3 % пациентов, лечившихся диклофенаком (р < 0,05) [55].
В последние годы в мировой литературе обсуждается вопрос о гепатотоксичности ряда препаратов из группы НПВС. Необходимо отметить, что это осложнение отмечается примерно у 1 из 10 тыс. больных (т. е. является очень редким) [56]. Что касается нимесулида, то с 1985 по 2000 г. зарегистрировано всего лишь 192 значимых осложнения со стороны печени, ассоциированных с приемом этого препарата, причем серьезным был признан только 81 эпизод. С учетом того, что к 2000 г. нимесулидом было пролечено 280 млн больных, суммарная частота опасных гепатотоксических реакций при его назначении составляла 0,1 на 100 тыс. курсов терапии [57-59].
Тем не менее контролирующие органы ряда европейских стран, последней из которых была Ирландия, прекратили использование нимесулида на своей территории, ориентируясь на отдельные спонтанные сообщения о тяжелых гепатотоксических реакциях. Так, в Ирландии это решение обосновывается 53 эпизодами гепатотоксических реакций (за 12 лет использования нимесулида в Ирландии), 9 из которых привели к развитию острой печеночной недостаточности, закончившейся летальным исходом у 4 больных [60].
Вопрос о гепатотоксичности нимесулида был рассмотрен EMEA (European Medicines Agency) - основным органом Евросоюза, осуществляющим контроль за использованием лекарственных средств в Европе. После оценки имеющихся данных EMEA пришла к выводу (Пресс-релиз от 21.09.2007), что в настоящее время нет достаточных оснований для прекращения использования нимесулида. В то же время принято компромиссное решение рекомендовать ограничить использование нимесулида в странах Европы курсом не более 15 дней в дозе, не превышающей 200 мг/сут, а потому изъять из продажи все упаковки нимесулида, содержащие более 30 стандартных доз (в таблетках или саше) [61].
Однако объективная оценка имеющихся данных показывает, что гепатотоксичность нимесулида не выше, чем у других препаратов из группы НПВС [56].
Следует отметить, что серьезных эпидемиологических работ по изучению сравнительной гепатотоксичности различных НПВС относительно немного. Среди них для оценки гепатотоксичности нимесулида принципиальное значение имеет масштабное исследование, проведенное в Италии Traversa G. и соавт. (2003). Авторы оценили частоту гепатотоксических реакций у 397 537 пациентов за период с 1997 по 2001 г., при этом суммарная частота данных осложнений у больных, принимавших НПВС, составила 29,8 на 100 тыс. пациенто-лет. Относительный риск развития патологии печени достигал 1,4 по сравнению с лицами, не принимавшими НПВС более 12 месяцев. Анализ взаимосвязи между развитием гепатотоксических реакций и приемом конкретных препаратов из группы НПВС показал, что частота этих осложнений при использовании нимесулида составила 35,3 на 100 тыс. человеко-лет, что было ниже, чем на фоне приема диклофенака, кеторолака и ибупрофена: 39,2; 66,8 и 44,6 на 100 тыс. пациенто-лет соответственно. Суммарно на 48 294 пациенто-года приема нимесулида отмечено 16 эпизодов поражения печени, один из которых закончился летальным исходом [62].
Результаты проспективных исследований эффективности и переносимости нимесулида демонстрируют, что отрицательная динамика изменений лабораторных биохимических показателей, свидетельствующая о повреждении печени, отмечается с такой же частотой, как и при использовании других НПВС. В частности, при назначении нимесулида коротким курсом (не более 30 дней) повышение АЛТ и АСТ в 2 и более раз отмечается лишь у 0,4 % больных, а при длительном (до года) приеме препарата частота подобных изменений не превышает 1,5 % [57].
Важную информацию для определения реальной гепатотоксичности нимесулида дает опыт его применения у больных подагрой. У этого контингента очень часто отмечается сочетание неблагоприятных факторов, способствующих развитию или утяжелению патологии печени: метаболические нарушения, частое сопутствующее поражение печени (жировой гепатоз) и желчного пузыря (желчнокаменная болезнь), прием алкоголя и пищи, содержащей большое количество жиров. Мы провели оценку влияния нимесулида на биохимические показатели функции печени у 81 мужчины с подагрическим артритом, находившегося на лечении в клинике Института ревматологии с января 2003 по июнь 2004 г. и принимавшего в качестве обезболивающего и противовоспалительного препарата нимесулид по 100-400 мг/сут. Полученные нами данные показали, что у больных подагрой при лечении нимесулидом не отмечено отрицательной динамики биохимических показателей, свидетельствующих о повреждении печеночных клеток или холестазе. Практически у всех пациентов с исходным существенным повышением уровня АЛТ, т. е. имеющих повышенный риск гепатотоксических реакций, прием нимесулида не приводил к ухудшению ситуации. Эти данные позволяют говорить об отсутствии существенной гепато-токсичности нимесулида и предполагать возможность его безопасного использования даже при наличии признаков сопутствующей патологии печени [20].
Вопрос о необходимости принятия каких-либо мер, связанных с публикацией решения EMEA, был предметом специального обсуждения на ежегодной конференции Института ревматологии РАМН, прошедшей в ноябре 2007 г. В ходе специального заседания были рассмотрены российские и зарубежные данные, касающиеся гепатотоксичности нимесулида. По мнению ведущих российских экспертов-ревматологов, отражающему позицию Ассоциации ревматологов России (АРР), на сегодняшний день нет каких-либо серьезных оснований для ограничения использования этого препарата в нашей стране [63].
Данные о влиянии нимесулида на сердечно-сосудистую систему немногочисленны. Риск развития инфаркта миокарда на фоне приема этого препарата изучался, вероятно, лишь в одном большом популяционном исследовании, проведенном в Финляндии. В ходе этой работы было оценено 33 309 случаев инфаркта миокарда, а соответствующий контроль составили 138 949 лиц. Для нимесулида относительный риск развития этого тяжелого осложнения достигал 1,69, т. е. оказался близким к соответствующим значениям для мелоксикама, набуметона, этодалака и неселективных НПВС [64].
По нашим данным, у больных подагрой нимесулид не вызывал повышения АД, в т. ч. у лиц, исходно страдавших АГ [65].
Важные данные были получены в ходе исследования, проведенного под руководством Мазурова В.И. План работы предусматривал оценку влияния нимесулида и диклофенака на АД (по данным суточного мониторирования) у 40 больных ОА и АГ. Через месяц терапии нимесулид в отличие от диклофенака не вызывал дестабилизации АД. Соответствующая динамика систолического АД для нимесулида составила в среднем от 143 до 140, а для диклофенака - от 147 до 156 мм рт. ст. (p < 0,05) [66].
Имеются минимум три хорошо организованных исследования, в которых эффективность и безопасность нимесулида изучались в течение длительного времени. Первым из них стала работа германских исследователей Locker P. и соавт. [67], в которой 199 больных ОА принимали нимесулид 200 мг или этодолак 600 мг в течение 3 месяцев. Оценка эффективности терапии показала преимущества нимесулида: при его применении ее оценили как "хорошую" или "превосходную" 80 % больных, а при лечении препаратом сравнения - 68 %. Частота побочных эффектов была фактически одинаковой, при этом следует учесть, что этодолак (в России он не зарегистрирован) относится к селективным НПВС и считается препаратом с очень хорошей переносимостью. Следующее крупное исследование провели Huskisson E. и соавт. В этой работе нимесулид 200 мг/сут или диклофенак 150 мг/сут в течение 6 месяцев получали 279 больных ОА. По основным критериям эффективности - улучшению самочувствия больных и изменению функционального индекса Лекена - оба препарата значимо не различались. Однако переносимость нимесулида оказалась достоверно лучше: развитие побочных эффектов со стороны ЖКТ отмечено у 36 и 47 % больных соответственно (p < 0,05) [68]. Наиболее крупным и длительным на сегодняшний день исследованием стала работа Kriegel W. и соавт., которые оценивали эффективность и безопасность нимесулида 200 мг и напроксена 750 мг у 370 больных ОА в течение 12 месяцев. Как и в предыдущем исследовании, эффективность обоих НПВС оказалась сопоставимой с некоторым преимуществом нимесулида: снижение индекса WOMAC в конце периода наблюдения составило 22,5 и 19,9 % соответственно. Частота побочных эффектов со стороны ЖКТ при использовании нимесулида также оказалась ниже - суммарно 47,5 против 54,5 % у получавших напроксен [69]. Необходимо отметить, что ни в одном из этих исследований не отмечено существенного роста частоты кардиоваскулярных осложнений при использовании нимесулида в сравнении с другими НПВС.
Заключение
Таким образом, нимесулид - препарат с весьма благоприятным сочетанием мощного анальгетического, противовоспалительного действия и хорошей переносимости. Клинические исследования и большой опыт применения этого препарата в реальной клинической практике показывают, что риск развития побочных эффектов при длительном использовании нимесулида суммарно ниже, чем при применении традиционных (неселективных) НПВС. Поэтому нимесулид представляется препаратом выбора лечения ХБ, связанной с поражением суставов и позвоночника. Важнейшим фактором, определяющим целесообразность использования генериков нимесулида (таких как прекрасно зарекомендовавший себя в нашей стране Найз®), является финансовая доступность, что имеет принципиальное значение для длительного применения НПВС у социально незащищенных групп пациентов с хроническими ревматическими заболеваниями.
ЛИТЕРАТУРА
1. Schug S, Manopas A. Update on the role of non-opioids for postoperative pain treatment. Best Pract Res Clin Anaesthesiol 2007;21(1):15-30.
2. Овечкин А.М., Свиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы. Региональная анестезия и лечение острой боли. 2006. № 1. С. 61-75.
3. Rodgers A, Walker N, Shug S. Reduction postoperative mortality and morbidity with epidural or spinal anesthesia: results from overview of randomized trial. BMJ 2000;321:1-12.
4. Camu F, Van Lersberghe C, Lauwers M. Cardiovascular risks and benefits of perioperative nonsteroidal anti-inflammatory drug treatment. Drugs 1992;44(Suppl. 5):42-51.
5. Phillips DM. JCAHO pain standart are unveiled. JAMA 2000;284:428-29.
6. ClarkJD. Chronic pain prevalence and analgestic prescribing in a general medical population. J Pain Symp Manag 2002;23:131-37.
7. NIH GUIDE. Directions in pain research. I. United States Government Printing Office, Washington DC. September 1998.
8. Roy R. Mitchael T. Survey of chronic pain in an elderly population. Can Fam Physician 1986;32:513-16.
9. Zhu K, Devine A, Dick I, et al. Association of back pain frequency with mortality, coronary heart events, mobility, and quality of life in elderly women. Spine 2007;32(18): 2012-18.
10. Wang P, Avorn J, Brookhart M, et al. Effect of noncardiovascular comorbidites on atihypertensive use in elderly hypertensives. Hypertension 2005;46:273-79.
11. Насонов Е.Л. Нестероидные противоспалительные препараты (Перспективы применения в медицине). М, 2000. 142 с.
12. Насонов Е.Л., Лазебник Л.Б., Беленков Ю.Н. и др. Применение нестероидным противовоспалительных препаратов. Клинические рекомендации. М., 2006. 88 с.
13. Cooper R, Booker C, Spanswick C. What is pain management, and what its relevance to the rheumatologist? Rheumatology (Oxford) 2003;42:1133-37.
14. Fitzcharles M-A, Almahrezi A, Shir Y. Pain. Understanding and challengers for the Rheumatologist. Arthritis Rheum 2005;52:3685-92.
15. Brooks P, Day R. Non-steroidal anti-inflammatory drugs: differences and similarities. N. Engl J Med 1993;324: 1716-25.
16. Brune K, Hinz B. The discovery and development of anti-inflammatory drugs. Arthritis Rheum 2004;50:2391-99.
17. Emery P. Considerations for nonsteroidal anti-inflammatory drug therapy: benefits. Scand J Rheumatol 1996;25(Suppl. 105):5-12.
18. Lain L. Approaches to nonsteroidal antiinflammatory drug use in high-risk patient. Gastroenterology 2001;120:594-606.
19. Fosbol E, Gislason G, Jacobsen S, et al. The pattern of use of non-steroidal anti-inflammatory drugs (NSAIDs) from 1997 to 2005: a nationwide study on 4.6 million people. Pharmacoepidemiol Drug Saf 2008;17(8):822-33.
20. Каратеев А.Е., Барскова В.Г. Безопасность нимесулида: эмоции или взвешанная оценка? //Consilium medicum. 2007. № 9. С. 60-64.
21. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные. РМЖ. 2001. № 15. С. 6-8.
22. Бадокин В.В. Применение нимесулида в ревматологической практике// Фарматека. 2006. № 6. С. 32-36.
23. Балабанова Р.М., Белов Б.С., Чичасова Н.В. и др. Эффективность нимесулида при ревматоидном артрите // Фарматека. 2004. № 7. С. 55-58.
24. Rainsford K. Nimesulide - a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin 2006;22(6):1161-70.
25. Rainsford K. Current status of the therapeutic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide. Inflammopharmacology 2006;14(3-4): 120-37.
26. Bennett A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases. In: Therapeutic Roles of Selective COX-2 Inhibitors. Editors Vein J.R., Botting R.M., William Harvey Press: 524-540.
27. Ferreira SH. The role of interleukins and nitric oxid in the mediation of inflammatory pain and its control by peripheral analgesics. Drugs 1993;46(Suppl. 1):1-9.
28. Pelletier JP, Mineau F, Fernandes JC, et al. Two NSAIDs, nimesulide and naproxen, can reduce the synthesis of urokinase and IL-6 while increasing PAI-1, in human OA synovial fibroblasts. Clin Exp Rheumatol 1997;15:393-98.
29. Barracchini A, Franceschini N, Amicosante G, et al. Can non-steroidal anti-inflammatory drugs act as metalloproteinase modulators? An in-vitro study of inhibition of collagenase activity. J Pharm Pharmacol 1998;50: 1417-23.
30. Binning A. Nimesulide in the treatment of postoperative pain: a double-blind, comparative study in patients undergoing arthroscopic knee surgery. Clin J Pain 2007;23(7):565-70.
31. Wober W.Comparative efficacy and safety of nimesulide and diclofenac in patients with acute shoulder, and a meta-analysis of controlled studies with nimesulide. Rheumatology (Oxford) 1999;38(Suppl. 1):33-38.
32. Wober W, Rahlfs V, Buchl N, et al. Comparative efficacy and safety of the non-steroidal anti-inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis. Int J Clin Pract 1998;52(3):169-75.
33. Pohjolainen T, Jekunen A, Autio L, et al. Treatment of acute low back pain with the COX-2-selective anti-inflammatory drug nimesulide: results of a randomized, double-blind comparative trial versus ibuprofen. Spine 2000;25(12):1579-85.
34. Барскова В.Г., Якунина И.А., Насонова В.А. Применение нимесила при подагрическом артрите // Терапевтический архив. 2003. № 5. С. 60-64.
35. Kullich W, Niksic F, Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study. Int J Clin Pract 2002;(Suppl. 128):24-30.
36. Manicourt DH, Bevilacqua M, Righini V, et al. Comparative effect of nimesulide and ibuprofen on the urinary levels of collagen type II C-telopeptide degradation products and on the serum levels of hyaluronan and matrix metalloproteinases-3 and -13 in patients with flare-up of osteoarthritis. Drugs RD 2005;6(5):261-71.
37. Каратеев А.Е., Каратеев Д.Е., Лучихина Е.Л. и др. Эффективность и безопасность монотерапии высокими дозами НПВС при раннем артрите // РМЖ. 2006. № 16. С. 24-29.
38.Alonso-Ruiz A, Pijoan J, Ansuategui E, et al. Tumor necrosis factor alpha drugs in rheumatoid arthritis: systematic review and metaanalysis of efficacy and safety. BMC Musculoskelet Disord 2008;9:52.
39. Fries J, Kristen N, Bennet M, et al. The rise and decline of nonsteroidal anti-inflammatory drag-associated gastropathy in rheumatoid arthritis. Arthritis Rheum 2004;50:2433-40.
40.Singh G. Recent consideration in nonsteroidal anti-inflammatory drug gastropathy. Am J Med 1998;105:31-38.
41. Lipworth L, Friis S, Blot WJ, et al. A population-based cohort study of mortality among users of ibuprofen in Denmark. Am J Ther 2004;11:156-63.
42. Сороцкая В.Н., Каратеев А.Е. Желудочно-кишечные осложнения как одна из причин смерти больных ревматическими заболеваниями // Научно-практическая ревматология. 2005. № 4. С. 34-38.
43. Каратеев А.Е., Насонов Е.Л., Корешков Г.Г. НПВС-индуцированная диспепсия: распространенность и возможность медикаментозной коррекции // Научно-практическая ревматология. 2003. № 5. С. 76-78.
44. Pope J, Anderson JJ, Felson DT. A metaanalysis of the effects of nonsteroidal anti-inflammatory drugs on blood pressure. Arch Intern Med 1993;153:477-84.
45. Johnson AG. Nguyen TV, Day RO. Do nonsteroidal anti-inflammatory drugs affect blood pressure? A meta-analysis. Ann Intern Med 1994;121:289-300.
46. Polonia J, Boaventura I, Gama G, et al. Influence of non-steroidal anti-inflammatory drugs on renal function and 24h ambulatory blood pressure-reducing effects of enalapril and nifedipine gastrointestinal therapeutic system in hypertensive patients. J Hypertens 1995;13(8):925-31.
47. Morgan T, Anderson A, Bertram D, et al. Effect of indomethacin on blood pressure in elderly people with essential hypertension well controlled on amlodipine or enalapril. Am J Hypertens 2000;13(11):1161-67.
48. Sowers J, White W, Pitt B, et al. The Effects of cyclooxygenase-2 inhibitors and nonsteroidal anti-inflammatory therapy on 24-hour blood pressure in patients with hypertension, osteoarthritis, and type 2 diabetes mellitus. Arch Intern Med 2005;165(2): 161-68.
49.Aw T-J, Haas S, Liew D. Meta-analysis of cyclooxygenase-2 inhibitors and their effects on blood pressure. Arch Intern Med 2005;165:490-96.
50. Cannon C, Curtis S, FitzGerald G, et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet 2006;18:368(9549):1771-81.
51. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice. Int J Clin Pract 2004;144(Suppl.):27-32.
52. Conforti A, Leone R, Moretti U, et al. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area. Drug Saf 2001;24:1081-90.
53. Laporte J, Ibanez L, Vidal X, et al. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Safety 2004;27:411-20.
54. Минушкин О.Н. Использование препарата "Найз" у больных, страдающих сочетанной патологией суставов и поражением верхних отделов желудочно-кишечного тракта // Научо-практическая ревматология.2003. № 5. С. 72-76.
55. Каратеев А.Е., Каратеев Д.Е., Насонов Е.Л. Гастродуоденальная переносимость нимесулида (НИМЕСИЛ, Berlin Chemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ-2 ингибиторов у больных с высоким риском развития НПВС-индуцированных гастропатий // Научно-практическая ревматология. 2003. № 1. С. 45-48.
56. Каратеев А.Е., Насонова В.А. НПВС-ассоциированная гепатопатия: проблема нимесулида // Научно-практическая ревматология. 2004. № 1. С. 34-37.
57. Boelsterli U. Nimesulide and hepatic adverse affects: roles of reactive metabolites and host factors. Int J Clin Pract 2002;128:30-36.
58. Boelsterli U. Mechanisms of NSAID-induced hepatotoxicity: focus on nimesulide. Drug Saf 2002;25:633-48.
59. HELSINN's response. На сайте: HELSINN, 2002, 12.
60. Irish Board Suspends Marketing of Drugs Containing Nimesulide
61. Press release. European Medicines Agency recommends restricted use of nimesulid-containing medicinal products. Doc. Ref. EMEA/432604/2007
62. Traversa G, Bianchi C, Da Cas R, et al.
Cohort study of hepatotoxity associated with nimesulide and other non-steroidal anti-inflammatory drugs. BMJ 2003;327:18-22.
63. БОЛЬ: информационный портал. Новости: Казнить или помиловать нимесулид?
64. Helin-Salmivaara A, Virtanen A, Veslainen R, et al. NSAID use and the risk of hospitalisation for first myocardial infarction in the general population: a national case-control study from Finland. Eur Heart 2006;27:1657-63.
65. Барскова В.Г., Насонова В.А., Цапина Т.Н. и др. Эффективность и безопасность применения нимесила у больных с подагрическим артритом // Клиническая медицина. 2004. Т. 82. № 12. С. 49-54.
66. Мазуров В.И., Лила А.М. Отчет о результатах пилотного исследования по сравнительной оценке влияния найза (нимесулида) и диклофенака на гемодинамические показатели у больных остеоартрозом в сочетании с эссенциальной артериальной гипертензией, кафедра терапии 1 им. Э.Э. Эйхвальда с курсом ревматологии Медицинской академии последипломного образования. СПб., 2007 г.
67. Licker P, Pawlowski C, Friedrich I, et al. Double-blind, randomised, multi-centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee. Eur J Rheumatol Inflamm 1994;14(2):29-38.
68. Huskisson E, Macciocchi A, Rahlfs V, et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study. Curr Ther Res 1999;60:253-65.
69. Kriegel W, Korff K, Ehrlich J, et al. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis. Int J Clin Pract 2001;55(8):510-14.
| Октябрь 2010 г. |