За малые деньги по выгодным ценам. |
Опубликовано в журнале:
«Русский медицинский журнал», 2007, Том 15, №26, с. 1-8Как повысить безопасность и эффективность «антиартрозной» терапии у пациентов с соматической патологией
К.м.н. А.В. Наумов, профессор А.Л. Верткин, к.м.н. О.И. Мендель, А.А. Аллилуев, В.С. Филимонов
МГМСУПроблема «старения» общества диктует необходимость продления активной и качественной жизни человека, что позволит, с одной стороны, обеспечить необходимый социальный уровень, а с другой – снизить все возрастающие затраты на содержание и лечение нетрудоспособных пожилых людей.
Инволютивные изменения органов и систем человеческого организма, частые побочные эффекты медикаментозного лечения, наличие конкурирующей и сопутствующей патологии – вот только лишь небольшое перечисление проблем, с которыми практический врач сталкивается ежедневно. А если учесть, что по мере старения увеличивается процент больных с двумя и более основными заболеваниями, то нетрудно представить и междисциплинарное значение данного вопроса.
Национальной академией наук США предложен термин «неизбежные спутники старения» для обозначения основных процессов, происходящих в организме человека с возрастом. Этот термин включает в себя три патологии: деменцию, остеоартроз (ОА) и остеопороз (ОП) [Manton KG, et al. Chronic disability trends in elderly United States populations 1982–1994, 1997].
По мнению экспертов International Association on the Study of Pain, каждый седьмой пациент в возрасте старше 40 лет, обращающийся за плановой амбулаторной помощью, предъявляет жалобы на боли в суставах. Статистика же у лиц пожилого и старческого возраста еще более неутешительна. Так, примерно 50% пожилых людей испытывают затруднения при ходьбе и подъеме по лестнице, более 15% страдают явным ограничением подвижности, а после 75 лет эта цифра увеличивается до 30%. Причиной, без преувеличения можно сказать, этой трагедии является наличие прогрессирующих дегенеративно–дистрофических поражений хрящевой структуры суставов или деформирующий остеоартроз.
ОА – это гетерогенная группа заболеваний различной этиологии, имеющих одинаковые биологические, морфологические и клинические исходы, при которых в патологический процесс вовлекается не только суставной хрящ, но и весь сустав, включая субхондральную кость, связки, капсулу, синовиальную мембрану и периартикулярные мышцы. В патогенезе ОА ведущее место занимают нарушения нормальных процессов деградации и синтеза хондроцитов, внеклеточного матрикса и субхондральной кости. Появились убедительные доказательства генетической предрасположенности к заболеванию, биомеханических и метаболических изменений, локальной воспалительной реакции и т.д. [Felson D.T., Lowrens R.C. et al. Ann. Intern. Med. 2000; 133: 635–646].
Ключевым звеном в развитии ОА становится приобретенный дефицит хрящевой ткани. При расстройстве функции хондроцитов или их гибели происходит репаративная регенерация и пролиферация неполноценных хондроцитов. Новые клетки с чрезвычайно активным метаболизмом продуцируют протеогликаны, коллаген и гиалуроновую кислоту со сниженными агрегационными свойствами. Неполноценные и нестабильные протеогликаны легко покидают матрикс. Синтез и секреция указанных ферментов стимулируются провоспалительным цитокином интерлейкином–1. Стабилизирующее действие, напротив, оказывают факторы роста (инсулиноподобный фактор роста и др.), которые модулируют и катаболический, и анаболический путь метаболизма хондроцитов.
Изменение состава основного вещества хряща приводит к разволокнению и расщеплению матрикса, уменьшению его гидрофильности и, как следствие, снижению эластичности и стойкости к нагрузке. Особое значение имеют паталогические процессы, происходящие в субхондральной кости, где выявляются микропереломы субхондральных трабекул, усиление костеобразования и остеофитоз. Весь этот процесс сопровождается воспалительными реакциями. О важной роли воспаления в развитии ОА свидетельствуют: наличие гиперплазии и мононуклеарной инфильтрации синовиальной оболочки, неотличимой от таковой при ревматоидном артрите; увеличение экспрессии онкопротеинов и фактора транскрипции NF–kB, регулирующего синтез провоспалительных медиаторов; определенная связь между стойким повышением уровня С–реактивного белка (СРБ) и прогрессированием ОА.
Остеоартроз – самая распространенная форма поражения суставов [Л.И. Алексеева, 1999] и должен рассматриваться как междисциплинарная проблема.
Во–первых, на фоне остеоартроза наблюдается отчетливая дестабилизация течения разнообразной соматической патологии, во–вторых – попытки самолечения, преимущественно от безысходности, вызывают дополнительные медицинские проблемы и обращения пациентов за помощью в разные медицинские учреждения, в–третьих – высокая частота лекарственных осложнений от неправильного выбора и применения препаратов, использующихся для снятия хронического болевого синдрома в суставах, в–четвертых – невозможность обеспечения необходимого мониторинга за огромным числом пациентов со стороны специалистов–ревматологов. Это в свою очередь ведет к уменьшению продолжительности жизни пациентов. Эти данные подтверждены исследованиями Monson (1976), где показано, что практически все пациенты с деформирующим ОА имеют более одной соматической патологии что и обуславливает меньшую продолжительность их жизни в среднем на 8–10 лет [Carman, 1989, Cerhan 1995].
Нами в терапевтической клинике проведен скрининг больных на выявление деформирующего ОА коленных суставов у 1200 пациентов с различными соматическими заболеваниями – 326 мужчин, средний возраст которых составил 62,4±7,3 года, и 874 женщины, средний возраст которых – 63,6±8,7 года (табл. 1).
Таблица 1. Клиническая характеристика больных
Показатели Мужчины Женщины n = 326 (27,2%) 874 (72,8%) Средний возраст 62,4±7,3 63,6 ±8,7 Имеют болевой синдром в коленном или тазобедренном суставе 217 (66,6%) 684 (78,3%) Ограничение подвижности, боль при ходьбе 164 (50,3%) 487 (55,7%) Узелки Гебердена–Бушара 76 (23,3%) 127 (14,5%) Рентгенологические изменения 178 (54,6%) 532 (60,8%) Ранее диагностированный ОА 48 (14,7%) 84 (9,6%) У всех пациентов было проведено выявление клинических симптомов ОА, анализ клинической картины по шкале WOMAC, рентгенологическое исследование коленного или тазобедренного сустава, анализировались лечебные и профилактические мероприятия, направленные на лечение болевых синдромов, связанных с данной патологией. До проведения скрининга лишь у 14,7% мужчин и 9,6% женщин был диагностирован деформирующий ОА (коксоарторз или гоноартроз). Жалобы на боли в одном из крупных суставов (тазобедренном или коленном) были у 901 (75,1%) пациента, в том числе 63,1% отмечали утреннюю скованность, длящуюся не более 1 часа, а 54,3% – ограничение подвижности и боль при ходьбе. Узелки Гебердена–Бушара были обнаружены у 16,9% пациентов. Суммарный бал болевого синдрома и функциональной недостаточности по шкале WOMAC составили 356,4±46,4 и 948,8±39,7 соответственно. При рентгенологическом исследовании диагноз ОА был установлен у 710 (59,2%) пациентов, причем у женщин несколько чаще, чем у мужчин. При рентгенологическом исследовании диагноз ОА был установлен у 710 (59,2%) пациентов, причем у женщин несколько чаще, чем у мужчин. Оценка терапии, получаемой этими пациентами, выявила, что 71,3% из них постоянно вынужденно принимают НПВП, в то время как препараты, содержащие хондроитин сульфат и глюкозамин, принимают лишь 54 (4,5%) пациентов.
Таким образом, более двух третей больных с хроническими соматическими заболеваниями страдают болями в коленных или тазобедренных суставах, а 60% из них имеют рентгенологические признаки ОА. Оценка по шкале WOMAC демонстрирует наличие как выраженного болевого синдрома, так и значительную степень функциональных ограничений у данных пациентов. Тщательный опрос пациентов показал, что нередко обострение суставного синдрома предшествовало обострению основного заболевания, по поводу которого пациент и поступил в клинику (гипертонической болезни, ИБС, сердечной недостаточности и т.д.).
Какова же должна быть тактика лечения пациентов с сочетанной соматической и дегенеративной суставной патологией?
Для определения индивидуальной лечебной тактики пациенту с остеоартрозом должно быть проведено комплексное обследование с учетом сопутствующей патологии, оценка риска сердечно–сосудистых событий (инсульт, инфаркт), оценка скорости прогрессирования остеоартроза на основании клинических и рентгенологических данных. При планировании комплексной терапии необходимо учитывать весь спектр сопутствующих заболеваний, которые могут иметь место у пациента к моменту манифестации остеоартроза.
Необходимо учитывать, что антиартрозная терапия будет добавлена к ряду уже назначенных препаратов для лечения соматической патологии, что повышает требования к лечению в аспекте комплаенса, т.е. терапия должна быть эффективной, безопасной и с минимально возможным количеством принимаемых лекарств.
Основными задачами в лечении ОА являются: уменьшение боли, подавление воспаления, замедление прогрессирования заболевания, предотвращение развития деформаций и инвалидности, снижение риска обострений и поражения новых суставов и улучшение качества жизни.
До настоящего времени самым распространенным методом лекарственной терапии ОА является применение препаратов первой группы, в частности НПВП (нестероидных противовоспалительных препаратов), которые достаточно эффективно купируют симптомы ОА. Однако, несмотря на несомненную клиническую эффективность, применение НПВП имеет свои ограничения. Известно, что даже кратковременный прием НПВП в небольших дозах может приводить к развитию побочных эффектов, которые в целом встречаются примерно в 25% случаев, а у 5% больных могут представлять серьезную угрозу для жизни. Особенно высок риск развития побочных эффектов у лиц пожилого и старческого возраста, которые составляют более 60% потребителей НПВП.
В клинической практике используется два класса НПВП: неселективные НПВП и селективные НПВП (ингибиторы ЦОГ–2). Из препаратов группы неселективных НПВП чаще используются производные уксусной кислоты – диклофенак, кеторолак, производные арилпропионовой кислоты – ибупрофен, напроксен, кетопрофен, производные оксикамов – пироксикам, лорноксикам. К селективным НПВП относят нимесулид, мелоксикам, целекоксиб. Противовоспалительное, анальгетическое и жаропонижающее действие НПВП связывают с их способностью ингибировать ЦОГ–2, в то время как наиболее часто встречающиеся побочные эффекты (поражение ЖКТ, почек, нарушение агрегации тромбоцитов) – с подавлением активности ЦОГ–1. Относительный риск тяжелых желудочно–кишечных осложнений существенно выше на фоне приема препаратов, обладающих низкой селективностью в отношении ЦОГ–2 – индометацин, диклофенак, пироксикам, ибупрофен и т.д. (табл. 2). Так, только в США ежегодно 107000 человек госпитализируются, а 16 000 погибают из–за НПВП–индуцированных осложнений со стороны ЖКТ. В связи с этим EULAR и ACR рекомендует при лечении больных с повышенным риском со стороны ЖКТ отдавать предпочтение селективным ингибиторам ЦОГ–2, а в случае использования неселективных НПВП применять их совместно с гастропротекторами (в том числе ингибиторами протонной помпы).
Таблица 2. Признаки, характерные для НПВП–гастропатии
- Язвы желудка развиваются чаще, чем дуоденальные
- Язвы часто развиваются в отсутствии явных симптомов
- Высокая частота (80%) тяжелых осложнений, которые также развиваются без предшествующих симптомов
- Риск госпитализаций по поводу НПВП–индуцированных язв у пациентов, принимающих НПВП, в 2,5–5,5 раз выше, чем в популяции
[Singh. Am J Med. 1998; 105(suppl. B): 31S–38S]НПВП могут приводить к повышению АД у больных с артериальной гипертензией (4–6 мм рт.ст.), снижать эффективность гипотензивной терапии – ингибиторов АПФ, β–блокаторов, мочегонных средств [Johnson AG, et al. Ann.Intern.Med.1994;121:289–300]. По данным Page J., Henry D., прием НПВП в течение 7 дней удваивает вероятность (OR=2,1) госпитализации по поводу сердечной недостаточности (СН); прием НПВП пациентами с заболеваниями сердца в анамнезе увеличивает (в 10 раз) вероятность (OR=10,5) госпитализации по поводу СН по сравнению с пациентами, не принимающими НПВП (OR=1,6). Вероятность госпитализации по поводу СН связана с дозой НПВП; с приемом НПВП связано 19% госпитализаций по поводу СН; НПВП–индуцированная СН может иметь более важное медицинское значение, чем НПВП–гастропатия [Arch Intern Med 2000; 160:777–784].
Более того, для некоторых НПВП характерным является негативное воздействие на хрящ в виде блокады синтеза протеогликанов и, как следствие, прогрессирование болезни. Показано, что в наибольшей степени отрицательно на хрящ при ОА влияют производные индол/инденуксусной кислоты (индометацин), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также на -30% ускоряют прогрессирование ОА (по данным рентгенографии). Все неселективные НПВП снижают синтез ГАГ, необходимых для регенерации хряща.
В свою очередь селективные ингибиторы ЦОГ–2 (нимесулид, мелоксикам, целекоксиб) лучше переносятся пожилыми пациентами с ОА вследствие реального уменьшения частоты побочных явлений со стороны желудочно–кишечного тракта, почек, печени. Известно, что НПВП, более селективные в отношении ЦОГ–2, чем ЦОГ–1, проявляют и меньшую нефротоксическую активность.
Однако селективные ингибиторы ЦОГ–2 необходимо с осторожностью применять у пациентов с сердечно–сосудистыми заболеваниями. Кроме того, эти препараты не влияют на синтез ГАГ, подавляя ЦОГ–2, они способны положительно влиять на ремоделирование костной ткани, так как активация остеокластов происходит при активном участии именно ЦОГ–2. В 2006 году был опубликован мета–анализ, продемонстрировавший повышение риска инфаркта миокарда при приеме селективных ингибиторов ЦОГ–2 по сравнению с плацебо [Kearney PM, Baigent C, Godwin J, Halls H,Emberson JR, Patrono C. Do selective cyclooxygenase2 inhibitors and traditional nonsteroidal antiinflammatory drugs increasethe risk of atherothrombosis? Meta–analysis of randomised trials. BMJ. 2006;332:1302–1308].
Для традиционных НПВП также были получены сведения о повышении сердечно–сосудистого риска, они были опубликованы как в вышеупомянутом мета–анализе РКИ, так и систематическом обзоре обсервационных исследований [McGettigan P, Henry D. Cardiovascular risk and inhibitionof cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA. 2006;296: 1633–1644] и в анализе реестра [Gislason GH, Jacobsen S, Rasmussen JN, Rasmussen S, Buch P, Friberg J, Schramm TK, Abildstrom SZ, Kober L, Madsen M, Torp–Pedersen C. Risk of death or reinfarction associated with the use of selective cyclooxygenase–2 inhibitors and nonselective nonsteroidal anti–inflammatory drugs after acute myocardial infarction. Circulation. 2006;113: 2906–2913].
Суммируя результаты этих публикаций, можно отметить, что для ибупрофена отмечено повышение риска повторных инфарктов миокарда и риска смерти (по результатам анализа реестра), но риск увеличения числа сосудистых осложнений не возрастал. Для диклофенака отмечено статистически значимое повышение риска по всем параметрам, включая повторные инфаркты миокарда и увеличение смертности, а для напроксена не отмечено значимого повышения риска сердечно–сосудистых осложнений. Согласно рекомендациям EULAR, у пациентов с риском сердечно–сосудистых осложнений для снижения риска сердечно–сосудистых осложнений рекомендовано использование НПВП (как селективных, так и неселективных) совместно с низкими дозами ацетилсалициловой кислоты. По ряду данных исключение составляет комбинация ацетилсалициловая кислота + ибупрофен, при которой риск развития инфаркта миокарда не только не снижается, но даже возрастает [Singh G., Graham D., Wang H. et al. Concomitant aspirin use reduces the risk of acute myocar-dial infarction in users of cyclooxygenase–2 selective and some non–selective nonsteroiidal anti–inflammatory drugs – abstr. EULAR 2006]. Этот факт объясняют конкурентными взаимоотношениями ибупрофена и ацетилсалициловой кислоты за место связывания с молекулой ЦОГ–1 в результате чего ибупрофен нивелирует антитромбоцитарные эффекты ацетилсалициловой кислоты (Castella–Lawson F. еt al.). В исследовании было продемонстрировано, что у пациентов с сердечно–сосудистыми заболеваниями, получающих ацетилсалициловую кислоту вместе с ибупрофеном, риск смерти от СС причин значительно выше (на 73%), чем у больных, принимающих только аспирин в низких дозах [MacDonald T.M., Wei L. Effect of ibuprofen on cardio protective effect of aspirin / Lancet 2003, 361, 573–574].
Американская ассоциация сердца отмечает, что для НПВП и селективных ингибиторов ЦОГ–2, как и для многих других лекарственных препаратов, существует проблема баланса между эффективностью и безопасностью, и предлагает ступенчатый подход к лечению больных со скелетно–мышечными заболеваниями и высоким риском сердечно–сосудистой патологии, который предусматривает назначение селективных ЦОГ–2 лишь в случаях крайней необходимости у пациентов с кардиоваскулярной патологией.
Таким образом, назначение препаратов из группы НПВП (как селективных, так и неселективных) связано с повышением риска осложнений фармакотерапии у пациентов с ОА и соматической патологией.
Последние годы важное место в терапии остеоартроза занимают так называемые симптоматические препараты медленного действия, с возможной структурно–модифицирующей активностью. К ним относятся: глюкозамин (ГА) и хондроитин сульфат (ХС), диацериин (ингибитор интерлейкина – 1), препараты гиалуроновой кислоты для внутрисуставных инъекций и экстракты авокадо и сои.
К сожалению, на сегодня нет строгих доказательств структурного действия на хрящ данных веществ, поэтому наиболее принято их классифицировать как симптоматические препараты медленного действия (Symptomatic slow acting drugs for osteoarthritis – SYSA-DOA: EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Тем не менее, в отношении ряда лекарственных средств SYSADOA накоплена достаточная доказательная база, позволяющая рекомендовать их в комплексной терапии остеоартроза (табл. 3).
Таблица 3. Симптоматические препараты медленного действия с точки зрения доказательной медицины (EULAR, 2003)
Препарат Количество исследований (принятых к анализу в данном обзоре) Количество исследований с позитивным эффектом перед плацебо Уровень доказательности в отношении модификации симптомов Глюкозамин 8 6 ІА Хондроитин 5 5 ІА Диацериин 1 1 ІВ Экстракт из авокадо и сои 3 3 ІВ Экстракт из морских организмов 2 2 Не указывается Суммируя результаты клинических исследований для препаратов данной группы (EULAR, 2003), характерными для них являются противовоспалительный эффект, сравнимый с НПВП и позволяющий снизить дозу последних, возможность сочетания с парацетамолом и НПВП; длительное последействие, отсутствие побочных эффектов [Насонов Е.Л., 2003]. При этом они способствуют замедлению прогрессирования ОА (по данным рентгенологических исследований). Помимо доказанного лечебного действия, эти препараты характеризуются прекрасной переносимостью и высокой безопасностью.
Глюкозамин (ГА). ГА не связывается с белками крови, а следовательно, не вытесняет из такой связи другие ЛС и лишен многих отрицательных фармакокинетических взаимодействий. Период полувыведения радиоактивно меченого ГА составляет около 70 ч после перорального приема и около 60 ч после внутримышечного введения. Как ГС, так и ГГ диссоциируют в желудке, далее свободный ГА поступает в тонкий кишечник, где всасывается до 90% вещества. ГА безопасен при приеме в очень высоких дозах и не влияет на уровень гликозилированного гемоглобина в исследовании у больных сахарным диабетом 2–го типа. Безопасность ГА подтверждается данными клинических исследований. Анализ числа побочных эффектов представлен в 37 публикациях. В этих исследованиях приняли участие 3173 больных, которые принимали ГА от 21 до 1095 дней, и не было выявлено ни одного серьезного или угрожающего жизни побочного эффекта. В большинстве клинических исследований частота побочных эффектов при приеме ГА не превышала таковую при приеме плацебо. В 13 из 18 РКИ, сравнивавших ГА с плацебо, побочные эффекты отмечали реже в группе ГА. В среднем соотношение числа побочных эффектов в группах, получавших глюкозамин и плацебо, составило 0,76. Аналогичные данные получены в результате мета–анализа, где относительный риск (ОР) побочных эффектов при сравнении ГС и плацебо составил 0,8. Фармакоэкономический анализ лечения пациентов с гонартрозом по результатам ряда исследований показал, что использование ГС может приводить к экономии средств за счет более высокой эффективности и меньшего числа побочных эффектов (экономия на каждого пациента составляет €11 при продолжительности терапии 90 дней и €110 при сроке лечения 150 дней).
Хондроитин сульфат (ХС). ХС является безопасным веществом, его LD50 при пероральном приеме превышает 10 г/кг. ХС обладает незначительными антикоагулянтными свойствами, которые практически не проявляются при приеме внутрь. Частота побочных эффектов ХС в клинических исследованиях сопоставима с плацебо. За рубежом проведено не менее 20 исследований ХС при ОА, их результаты были обобщены в 3 мета–анализах и систематических обзорах. В мета–анализе Leeb B.F., Schweitzer H., Montag K., Smolen J.S. было включено 7 исследований ХС при ОА (703 человека, 372 получали ХС). Оценивались симптоматические эффекты ХС при лечении продолжительностью от 3 до 12 месяцев в дозах от 800 до 2000 мг/сут. Основной вывод: ХС эффективен для уменьшения боли при ОА, боль значимо уменьшалось только к 4–му месяцу от начала терапии. Примерно 65% больных испытывали большее облегчение при приеме ХС, чем при приеме плацебо. Частота побочных эффектов была очень низкой, и не превышала таковую в группах плацебо. Фармакоэкономический анализ, выполненный в ряде исследований, продемонстрировал «значительно большую эффективность на единицу затрат» при применении ХС, чем при использовании НПВП, несмотря на то, что расходы на лекарственную терапию с включением ХС почти в 4 раза превышали затраты на «стандартное» лечение.
ХС и Г оказывают разнообразное, но не совсем идентичное фармакологическое действие на различные структуры сустава, в том числе на метаболизм хряща, и при совместном применении ХС и Г дополняют и усиливают действие друг друга. Более высокая эффективность комбинированных препаратов хондроитин сульфата и глюкозамина по сравнению с монопрепаратами доказана в ряде экспериментальных и клинических исследований.
Заслуживает внимания исследование GAIT, результаты которого были предложены на конгрессах EULAR и ACR в 2006 г. Первая фаза исследования представляла собой 24–недельное многоцентровое рандомизированное плацебо–контролируемое двойное слепое клиническое испытание в 5 параллельных группах: (1) глюкозамин гидрохлорид 500 мг 3 раза в сутки, (2) хондроитин сульфат 400 мг 3 раза в сутки, (3) комбинация глюкозамина и хондроитина сульфата в вышеуказанных дозах, (4) целекоксиб 200 мг в сутки и (5) плацебо. Все пациенты могли принимать до 4000 мг парацетамола в сутки для дополнительной анальгезии при необходимости.
При оценке влияния терапии на болевой синдром через 6 месяцев лечения было установлено, что у пациентов с интенсивным болевым синдромом (301–400 мм по WOMAC) эффективность комбинированной терапии (ХС + ГГ) была достоверно выше по сравнению с плацебо и монотерапией ХС и ГГ.
Нами было проведено исследование по изучению симптоматического и структурно–модифицирующего действия препарата АРТРА, содержащего и хондроитин сульфат, и глюкозамин в дозировке по 500 мг каждого.
В исследование было включено 60 больных с остеоартрозом коленных суставов со ІІ–ІІI рентгенологической стадией заболевания, средний возраст которых составил 62,3±4,7 лет. В исследование специально были включены пациенты, у которых ранее остеоартроз диагностирован не был.
Пациенты были рандомизированы на две одинаковые по численности (n=30) группы, в зависимости от проводимой терапии. Пациенты в группах были сопоставимы по возрасту, полу, распространенности отдельных терапевтических нозологий (табл. 4, 5), интенсивности болевого синдрома и степени функциональных ограничений. На момент исследования ряд пациентов принимали НПВП, причем число данных пациентов в группах было сопоставимо.
Таблица 4. Общая характеристика больных, включенных в открытое рандомизированное клиническое исследование по оценке эффективности и безопасности препарата АРТРА при остеоартрозе коленных суставов и соматической патологии
Характеристика 1 группа АРТРА + НПВП
n=302 группа НПВП
n=30Возраст 63,3±5,4 62,4±6,8 Пол М/Ж 18/12 17/13 Боль WOMAC 386,3 325,6 Функциональная недостаточность WOMAC 954,7 923,4 Таблица 5. Сопутствующая патология у пациентов с ОА коленных суставов, включенных в открытое рандомизированное клиническое исследование по оценке эффективности и безопасности препарата АРТРА
Сопутствующие заболевания I группа II группа Артериальная гипертензия 19 (63,3%) 17 (56,7%) ИБС (Постинфарктный кардиосклероз и/или НК І–ІІ функц. кл.) 6 (20%) 5 (16,7%) Сахарный диабет 2 типа 5 (16,7%) 4 (13,3%) Язвенная болезнь в анамнезе 11 (36,7%) 9 (30%) Варикозная болезнь вен нижних конечностей 1 (3,3%) 6 (20%) Дизайн исследования: в 1–й группе – всем пациентам назначен препарат АРТРА; пациенты продолжали получать ранее применяемые НПВП, в ходе исследования НПВП отменялись пациентам при отсутствии болевого синдрома и нерецидивировании последнего без терапии НПВП. Режим дозирования АРТРА: по 1 таблетке 2 раза в сутки в течение трех первых недель; по 1 таблетке 1 раз в сутки в течение 6 месяцев. Во 2–й группе – пациенты продолжали получать ранее назначенные НПВП, в ходе исследования НПВП отменялись пациентам при отсутствии болевого синдрома и не рецидивировании последнего без терапии НПВП.
Эффективность терапии оценивалась через 1, 3 и 6 месяцев наблюдения: у всех пациентов проводился анализ по шкале WOMAC (боль, нарушение функции), оценивалась скорость ходьбы 15 метров. После окончания лечения больным предлагалось оценить эффективность терапии по критериям: плохо, удовлетворительно, хорошо, отлично.
Методами оценки безопасности терапии явились: анализ частоты развития НПВП–гастропатии по клиническим и инструментальным (ЭГДС) данным исходно и через 6 месяцев наблюдения, динамика уровня САД (систолического артериального давления), холтеровское исследование (частота болевой и безболевой ишемии миокарда).
С целью оценки структурно–модифицирующего эффекта АРТРА всем пациентам была выполнена МРТ коленного сустава на старте исследования и через 9 месяцев. Исследование проводилось на магнитно–резонансном томографе «Sonata» фирмы Siemens с напряженностью магнитного поля 1,5 Тл. 2002 г. выпуска. Плоскости сканирования – фронтальная, сагиттальная. Толщина срезов – 3–5 мм. Расстояние между срезами – 1 мм. В качестве оценки изменений хрящевой структуры сустава проводилась оценка высоты суставного хряща в латеральных и медиальных срезах сустава в трех локализациях, также оценивалась площадь суставной поверхности.
Результаты исследования
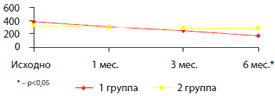
Симптом–модифицирующее действие АРТРА. Оценка динамики болевого синдрома (WOMAC боли) продемонстрировала, что у пациентов, принимавших АРТРА, уже через 3 месяца терапии наблюдался больший регресс болевого синдрома по сравнению с группой контроля (рис. 1). Через 6 месяцев терапии у пациентов 1 группы уровень интенсивности болевого синдрома был достоверно ниже, чем у пациентов 2 группы, 178,3±37,2 против 287,4±42,8 (р=0,02).
Рис. 1. Динамика болевого синдрома (WOMAC боли)
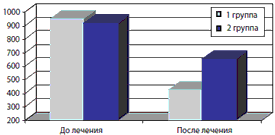
Оценка функциональной недостаточности по шкале WOMAC на старте исследования не выявила значимых различий между группами наблюдения. В обеих группах через 6 месяцев терапии мы наблюдали достоверное снижение балла функциональной недостаточности, однако в первой группе средний балл составил 427,3, во 2–й – 658,9 (р=0,002) (рис. 2).
Рис. 2. Динамика функциональной недостаточности
Таким образом, у пациентов, получающих АРТРА, после окончания запланированного срока наблюдения отмечалась достоверно большая динамика нивелирования болевого синдрома и улучшения функциональной способности.
Влияние АРТРА на состояние хрящевой ткани коленных суставов. Визуальная оценка сустава, проведенная врачом МРТ, до лечения и через 9 месяцев терапии выявила в 1 группе 60% пациентов с положительной динамикой, 30% – с отсутствием динамики и 10% с отрицательной динамикой, во 2 группе 63,3% пациентов с отрицательной динамикой и 36,7% с отсутствием динамики.
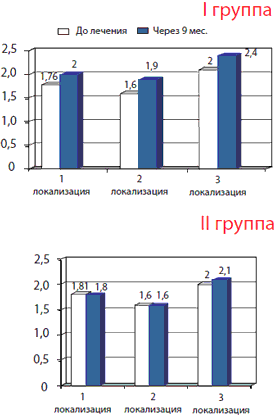
Анализ высоты суставного хряща в латеральном срезе (рис. 3) у пациентов, принимавших АРТРА, продемонстрировал положительную динамику во всех точках подсчета, площадь суставной поверхности за период наблюдения увеличилась в среднем на 40 мм2. В противоположность этому, во второй группе, где пациенты принимали только НПВП, в 1 и 2 локализации отмечена отрицательная динамика, площадь суставной поверхности уменьшилась в среднем на 6 мм2. Анализ высоты суставного хряща в медиальном срезе показал аналогичные результаты в группах.
Рис. 3. Динамика высоты суставного хряща в латеральном срезе при МРТ
(Открытое рандомизированное клиническое исследование по изучению эффективности и безопасности препарата АРТРА у больных с остеоартрозом коленных суставов на фоне соматическойТ.о., больший положительный эффект с позиций клинической картины в группе пациентов, получающих АРТРА, подтвержден данными МРТ исследования, которое выявило увеличение площади суставной поверхности и прирост высоты хряща в исследуемых точках.
С практической точки зрения, в оценке эффективности и безопасности терапии ОА у пациентов с соматической патологией важной представлялась оценка потребности больного в обезболивающих препаратах и число случаев развития НПВП – гастропатии и диспепсии (табл. 6). Методами оценки безопасности терапии явились: оценка частоты развития НПВП–гастропатии по клиническим признакам (диспепсия) на протяжении всего курса терапии и данным ЭГДС через 6 месяцев лечения.
Таблица 6. Потребность в НПВП и частота гастропатии в группах
1 группа (n=30) 2 группа (n=30) Потребность в НПВП, к–во человек в начале лечения 26 (86,7%) 27 (90%) Потребность в НПВП, к–во человек в конце лечения (6 месяцев) 7 (23,3%) 22 (73,3%) НПВП–гастропатии и диспепсия (все случаи) 6 (20%) 13 (43,3%) Как видно из таблицы 6, в группе больных, принимавших препарат АРТРА, к концу лечения только 23,3% пациентов нуждались в дополнительном приеме НПВП против 73,3% в группе контроля, что, по–видимому, и повлияло на более низкую частоту у них случаев НПВП – гастропатии. Случаи диспепсии и эрозивно–язвенные поражения в группе больных, получавших АРТРА, выявлены лишь у 20% пациентов против 43,3% в группе пациентов, получавших только НПВП. Таким образом, включение в терапию пациентов с ОА препарата АРТРА в 2 раза снижает вероятность развития нежелательных побочных явлений со стороны ЖКТ у больных, принимающих НПВП.
Одной из задач исследования явилась оценка состояния сердечно–сосудистой системы у пациентов с ОА, страдающих сопутствующей соматической патологией. Оценивались динамика САД (систолического АД) и частота БИ (болевой ишемии) и ББИ (безболевой ишемии) миокарда по данным холтеровского исследования (в начале и через 6 месяцев исследования). Так, у пациентов 1–й группы, получавших АРТРА, мы наблюдали большую положительную динамику уровня САД. Разница среднесуточного САД до начала терапии и через 6 месяце наблюдения составила: в 1–й группе – 7,3 мм рт.ст (р<0,05), во 2–й группе – 3,6 мм рт.ст (р>0,05). Также мы отметили меньшее число эпизодов как болевой, так и безболевой ишемии миокарда, по данным холтеровского мониторирования.
Важно отметить фармакоэкономическую выгоду включения в схему лечения пациентов с ОА и соматической патологией хондропротекторов (АРТРА): частота повторных госпитализаций в группе больных, получавших АРТРА, была значительно меньше, чем в группе пациентов, получавших только НПВП. Так, в 1–й группе в течение 9 месяцев (года) наблюдения было 16 госпитализаций у 13 пациентов, тогда как во 2–й группе число госпитализаций составило 38 у 23–х пациентов.
Таким образом, включение препарата АРТРА в терапию пациентов с остеоартрозом и хроническими терапевтическими заболеваниями позволяет:
- Быстрее добиться обезболивающего эффекта;
- Улучшить состояние хрящевой ткани пораженного сустава (по данным МРТ);
- Снизить риск осложнений фармакотерапии ОА (со стороны ЖКТ и сердечно–сосудистой системы);
- Снизить риск дестабилизации соматической патологии (ИБС, артериальной гипертонии и т.д.);
- Повысить качество жизни пациента;
- Сократить затраты на лечение (в том числе за счет сокращения числа госпитализаций).
Суммируя приведенные выше данные и рекомендации ELUAR и ACR, можно представить алгоритм выбора терапии ОА (табл. 7).
Таблица 7. Алгоритм выбора терапии при ОА
Фармакотерапия остеоартроза
Метод Лекарственные препараты Указания Уровень доказательности Локальная терапия Мази и гели на основе НПВП Должны применяться в комплексной терапии ІВ Кортикостероиды Не более 3–4 инъекций в год. Внутрисуставно и периартикулярно ІВ Препараты гиалуроновой кислоты для внутрисуставных инъекций Инъекции осуществляет только врач со специальными навыками внутрисуставных инъекций ІВ Системная терапия Симптоматические препараты быстрого действия Простые анальгетики Ацетоминофен Препарат первой линии. При неэффективности или непереносимости НПВП опиоидные анальгетики (ІВ) ІВ Неселективные НПВП Диклофенак, лорноксикам и т.д. Необходима оценка риска НПВП– гастропатии. Избегать назначения препарата с доказанным отрицательным действием на синтез протеогликанов ІА Селективные НПВП Нимесулид, целекоксиб При риске побочных эффектов от приема неселективных НПВП ІА Симптоматические препараты медленного действия «Хондропротекторы» Глюкозамин Предпочтителен выбор комбинированных препаратов (например, АРТРА). Имеют эффект последействия ІА Хондроитин ІА Сочетание остеоартроза и остеопороза Фармакотерапия ОА Выбор препаратов тот же – Препараты многопланового воздействия на костную ткань Препараты кальция и витамина D3 Предпочтительней комбинированные препараты Для костной ткани ІА; в отношении хрящевой ткани - D Антирезорбтивные препараты Кальцитонин Обладает обезболивающей активностью, возможно, протективным действием в отношении хрящевой ткани Для костной ткани ІА; в отношении хрящевой ткани - D
| Февраль 2014 г. |