Опубликовано в журнале:
ПРАКТИЧЕСКАЯ МЕДИЦИНА. 7 (39) ноябрь 2009 г.Пробиотики в профилактике антибиотик-ассоциированных диарей у детей
И.Н. Захарова, Э.Б. Мумладзе, В.И. Свинцицкая, В.В. Кучерова, Ю.А. Дмитриева
Российская медицинская академия последипломного образования, г. Москва
Тушинская детская городская больница, г. МоскваЕжегодно, согласно данным ВОЗ, регистрируется 1 -1,2 млрд. заболеваний, сопровождающихся диареей, в год, а 5 000 000 случаев заканчивается летальным исходом. В России ежегодно заболевают диареей 500 000 детей (схема 1). Одной из частых причин развития диареи является применение антибиотиков (АБ), часто назначаемых в амбулаторных условиях. Для антибиотик-ассоциированной диареи (ААД), согласно определению ВОЗ, характерно учащение стула (более 3 раз в сутки), возникшее на фоне антибиотикотерапии или в течение 2 месяцев после ее окончания, сопровождающееся увеличением объема, изменением консистенции, появлением патологических примесей в виде слизи, зелени и крови. По данным различных авторов, ААД развивается у 5-30% лиц, получающих антибиотики [1]. Точных данных о частоте ААД у детей нет, поскольку чаще всего в этом случае педиатры диагностируют антибиотик-ассоциированный дисбактериоз кишечника (схема 2). ААД может иметь легкое течение, а отмена антибиотика приводит к купированию симптомов. Однако существуют тяжелые формы ААД, называемые псевдомембранозным колитом (ПМК). ПМК - острое, тяжелое заболевание толстой кишки, связанное с применением анти-биотиков и/или с хирургическим вмешательством на кишечнике, характеризующееся образованием на слизистой оболочке округлых фибринозных бляшек, сливающихся между собой, на фоне воспалительно-геморрагических изменений.
Схема 1. Этиологическая структура диарей (ВОЗ)
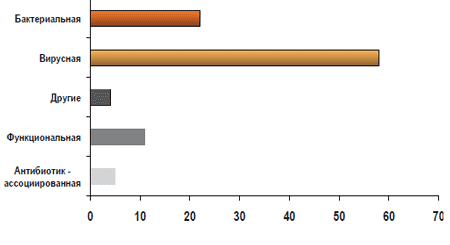
Схема 2. Антибиотико-ассоциированная диарея
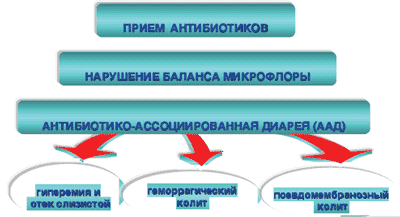
Практически все антибиотики, особенно активные в отношении анаэробов, способны вызывать ААД. Риск ААД возрастает при применении клиндамицина, линкомицина, аминопенициллинов, цефалоспоринов II и III поколения. По данным L. McFarland (1993), ААД встречается в 5-10% случаев при применении ампициллина, в 10-25% - цефалоспоринов II поколения, и лишь в 2-5% случаев при использовании других антибиотиков, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин) [2].
ААД этиологически может быть связана c воздействием различных микробов: Clostridium difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureu, а также грибов рода Candida. Однако наиболее тяжелые формы ААД и псевдомембранозного колита обусловлены Clostridium difficile.
К факторам риска развития псевдомембранозного колита, обусловленного Clostridium difficile, относятся [3]:
- группа антибиотика, путь его выведения (чаще препараты, выводящиеся желчью, - цефтриаксон), длительность лечения, повторные курсы, комбинированная терапия;
- возраст больных (до 5 лет и старше 60 лет частота обнаружения Clostridium difficile увеличивается);
- длительная госпитализация больного (прямо пропорциональна частоте колонизации Clostridium difficile), пребывание в одной палате с больным, имеющим манифестную форму инфекции;
- наличие тяжелых сопутствующих заболеваний (патология ЖКТ, иммунодефицитные состояния, почечная недостаточность, онкология);
- проводимые медицинские манипуляции (операции, инвазивные процедуры).Clostridium difficile - грамположительный анаэроб, обнаружен впервые в 1935 г. Hall и O'Tolle в кале новорожденных. В 1977 г. доказана роль Clostridium difficile в развитии ААД [4]. Известно, что токсигенные штаммы Clostridium difficile продуцируют 2 вида экзотоксина. У токсина А менее выражено цитотоксическое действие [5]. Токсин В (цитотоксин) оказывает летальное действие, значительно превосходящее действие токсина А. Так как эпителиальные клетки кишечника не содержат рецепторов к токсину В, он может действовать после повреждения эпителия токсином А или других факторов. За счет действия токсина А нарушается проницаемость эпителиального слоя, что создает условия для проникновения токсина В в слизистую оболочку. Оба токсина, обладая синергичным действием, вызывают воспалительную реакцию в слизистой толстой кишки посредством активации выработки и секреции моноцитами цитокинов с секрецией экссудата, содержащего большое количество белка, нейтрофилов, моноцитов и слущенных энтероцитов. Кроме того, токсин А увеличивает проницаемость энтероцитов для других микроорганизмов (протей, сальмонелла, эшерихии), что значительно облегчает микробную транслокацию.
В патогенезе ААД, обусловленной Clostridium difficile, имеют значение следующие механизмы развития диареи:
- секреторный (воздействие энтеротоксина и желчных кислот);
- осмотический (нарушение обмена углеводов);
- экссудативный (воспалительная экссудация в просвет кишечника).В клинической картине ААД обращает на себя внимание появление водянистой диареи, схваткообразных болей в животе, уменьшающихся после стула, в ряде случаев - повышение температуры, лейкоцитоз в крови, появление лейкоцитов в кале. Возможно развитие эксикоза с гипопротеинемией и вторичной экссудативной энтеропатией. Может быть холероподобный вариант с летальным исходом.
Основным фактором в развитии ААД является нарушение состава микрофлоры кишечника, что приводит к снижению его колонизационной резистентности. Использование пробиотиков, колонизирующих кишечную стенку и ограничивающих избыточный рост патогенных бактерий, является одним из перспективных методов профилактики и лечения ААД, благодаря их влиянию на организм человека (схема 4).
Схема 4. Влияние пробиотиков на организм человека
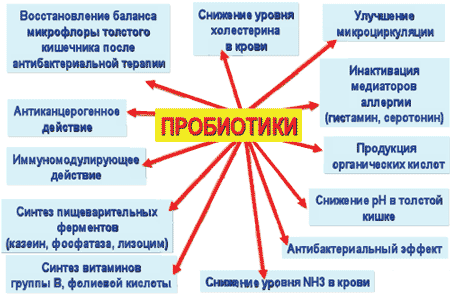
Профилактический и лечебный механизм действия пробиотиков сводится к следующему:
- продукция антимикробных субстанций (бактериоцинов, лизоцима, проглютамата, пероксида) и конкурентное взаимодействие с патогенными и условно-патогенными микроорганизмами;
- синтез цитопротективных веществ (аргинин, глютамин, полиамины);
- снижение рН толстокишечного содержимого;
- стимуляция иммунного ответа (синтез sIgA, IgG, gjdsitybt синтеза цитокинов (IL-4, IL-10), усиление фагоцитоза);
- стимуляция секреции муцина;
- подавление эпителиальной адгезии и транслокации патогенов;
- стимуляция апоптоза.Конкуренция пробиотиков за рецепторы слизистой не только уменьшает адгезию, но и рост энтеротоксичных грамотрицательных анаэробов. В настоящее время опубликованы результаты мета-анализа, основанного на 6 рандомизированных исследованиях, посвященного применению пробиотиков для профилактики и лечения диареи, вызванной антибиотиками. В мета-анализ включено 766 пациентов (376 в основной группе и 390 в контрольной группе). Большинство исследований подтвердило укорочение продолжительности диареи при применении пробиотиков примерно на 1 сутки. Наиболее эффективными оказались по мере убывания: Lactobacillus rhamnosus (LGG), Saccharomyces boulardii, B.lactis, Streptococcus thermophilus.
Целью нашей работы явилось изучение эффективности препарата "Йогулакт" для профилактики и лечения ААД у детей, получавших антибиотикотерапию. "Йогулакт" в капсулах представляет собой биологически активную добавку к пище, являющуюся дополнительным источником пробиотических микроорганизмов. К преимуществам "Йогулакта" как пробиотика относятся возможность применения у детей, начиная с 3-месячного возраста, а также удобство применения - всего один раз в день (таблица 1).
Таблица 1. Состав "Йогулакта" в капсулах (2x109 КОЕ/капсула)
Ингредиенты В каждой капсуле (мг) Lactobacillus acidophilus 9,00 Lactobacillus rhamnosus 5,00 Культура йогурта (Streptococcus thermophilus, Lactobacillus delbrueckii (bulgaricus) 20,00 Входящие в состав "Йогулакта" лактобактерии поддерживают и регулируют равновесие кишечной микрофлоры. Препарат устойчив ко многим антибиотическим средствам, поэтому с профилактической целью оправдано его применение во время антибиотикотерапии.
Оценка клинической и лабораторной эффективности "Йогулакта" проводилась по единому протоколу с информированным согласием родителей. На каждого больного была составлена индивидуальная карта. Всем детям проводилось исследование клинического анализа крови, мочи на 1 и 34 день исследования и бактериологическое исследование кала на 1, 34, 48 день исследования.
Нами обследовано 30 детей в возрасте от 3 месяцев до 8 лет, из них 9 мальчиков (30%) и 21 девочка (70%). 17 детям проведено 3-кратное микробиологическое исследование кала, 10 детям - 2-кратное исследование, 3 детям - однократное (родители отказались от повторных обследований по причине, не касающейся приема препарата). Все больные наблюдались в условиях Тушинской городской детской больницы г. Москвы. Исследование проводилось в период с апреля по декабрь 2008 г. Среди обследованных дети до года составили 46,7% (14 детей), от 1 года до 7 лет - 50% (15 детей), 3,3% (1 ребенок) составили дети старше 7 лет. В исследование вошли дети, получавшие антибиотикотерапию по поводу инфекции мочевой системы, пиелонефрита, осложненного течения ОРВИ, ОРВИ у детей с нефротической формой гломерулонефрита.
Большая часть исследуемых детей (63,3% - 19 детей) получали "Йогулакт" на фоне антибиотикотерапии во время исследования (пенициллины, цефалоспорины 1,2 поколения, макролиды). Около трети больных (36,7% - 11 детей) получали "Йогулакт" с целью профилактики ААД через 1-2 недели окончания антибиотикотерапии (таблица 2).
Таблица 2. Частота применения различных антибиотиков у исследуемых больных
Характеристика антибиотиков Пробиотики во время антибиотикотерапии Пробиотики после окончания антибиотикотерапии Абс. число % Абс.ч. % Пенициллины в/м 2 10,5% - - Ко-амоксикав внутрь 4 21,0% 4 36,4% Цефалоспорины в/м (цефазолин, цефабол, цефтриаксон) 10 52,6% 6 54,5% Супракс внутрь 1 5,3% 1 9,1% Макролиды 2 10,5% - - Уросептики (фурагин) 11 36,7% - - До поступления в стационар дети не получали пробиотики. До начала терапии "Йогулактом", на фоне проводимой антибиотикотерапии все больные имели функциональные нарушения со стороны ЖКТ, связанные с дисбактериозом кишечника. На фоне применения "Йогулакта" уже на 4 день терапии отмечена существенная положительная динамика клинических симптомов функциональных нарушений со стороны ЖКТ, а к 19 дню лечения отмечено полное отсутствие жалоб у 100% пациентов (рисунок 4).
Анализируя характеристику стула обследованных детей до назначения "Йогулакта", нами выявлено у 3 детей (10%) наличие плотного "овечьего" стула, "замазкообразного" - у 5 больных (16,6%), кашицеобразного, непереваренного - у 10 детей (33,3%), разжиженного, с примесью слизи - у 1 ребенка (3,3%). Через месяц после начала приема "Йогулакта" у всех детей стул нормализовался, что позволяет считать "Йогулакт" высокоэффективным средством профилактики и лечения ААД у детей.
У всех пациентов до и после назначения "Йогулакта" осуществлялось бактериологическое исследование микрофлоры кишечника. Все включенные в исследование пациенты были распределены на группы в зависимости от степени тяжести дисбактериоза кишечника (таблица 3). Распределение по степеням тяжести проводилось в соответствии с классификацией, предложенной профессором К. Ладодо в 1991 г. и дополненной П. Щербаковым в 1998 г.
Таблица 3. Распределение дисбактериоза по степени тяжести
Степень До лечения На 34 день исследования На 48 день исследования n* % n* % n* % Общее число пациентов 30 100% 27 100% 17 100% I - - - - - - II 10 33,3 19 70,4 1 5,9 III 11 36,7 - - - - IV 9 30 2 7,4 2 11,8 N показатели - - 6 22,2 14 82,3 Полученные данные свидетельствуют о полной нормализации кишечной микрофлоры у 6 детей (22,2%) на 34 день исследования и у 14 детей (82,3%) на 48 день от начала терапии. Улучшение показателей микрофлоры кишечника было выявлено у 17 детей из 27 обследованных (63%) на 34 день исследования: у 7 детей (26%) отмечался переход из IV во II степень дисбактериоза, у 10 детей (37 %) - из III во II степень.
Только у 2 детей (7,4%) на 34 день и у 1 ребенка (5,8%) на 48 день исследования сохранялась II степень выраженности дисбактериоза. У 2 детей на 34 (7,4 %) и 48 (11,6 %) дни сохранялась IV степень, что, возможно, связано с присоединившейся ротавирусной инфекцией и вторичным нарушением микрофлоры кишечника.
На 34 и 48 день исследования ни у кого из обследованных больных не отмечалось возобновления клинических проявлений функциональных нарушений со стороны ЖКТ, свидетельствующих о нарушении кишечного микробиоценоза. Препарат "Йогулакт" хорошо переносился больными, побочных и нежелательных явлений при его приеме нами отмечено не было.
Таким образом, проведенные исследования позволили отметить, что "Йогулакт":
хорошо переносился больными: не было выявлено ни одного случая развития нежелательных и побочных явлений; позволяет более быстро и эффективно ликвидировать клинические симптомы функциональных нарушений со стороны ЖКТ, таких как снижение аппетита, вздутие живота, повышенное газообразование у больных, нарушения характера стула (запоры, диарея); является высокоэффективным препаратом для профилактики ААД у детей, получающих антибиотикотерапию; способен оказывать хороший эффект в плане коррекции дисбактериоза кишечника у детей. ЛИТЕРАТУРА
1. Bartlett J.G. Antibiotic-associated diarrhea. N Engl J Med 2002; 346: 334-9.
2. McFarland L.V. Diarrhea acquired in the hospital. Gastroenterol Clin North Am 1993; 22: 563-77.
3. Малов В.А. Антибиотикоассоцированные диареи. Клиническая микробиология и антимикробная химиотерапия 2002; 1(4): 27.
4. Осипенко М.Ф., Бикбулатова Е.А. Антибиотико-ассоциированная диарея. Фарматека 2007; 13: 89-90.
5. Torres J., Jennische E., Lange S. Enterotoxins from Cl.difficile; diarrhoeogenic potency and morphological effects in the rat intestine. Gut 1990; 31: 781-5.
| Август 2010 г. |