Опубликовано в журнале:
«РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ» Неврология; ТОМ 17; № 6; 2009; стр. 1-7.Возможности применения комбинированного препарата Омарон у больных с ишемическим инсультом, ассоциированным с артериальной гипертонией и атеросклеротическим стенозом сонных артерий
К.м.н. И.М. Смирнова, И.А. Лазукина, Н.И. Карелина, к.м.н. О.М. Поликутина, Н.С. Базуева, А.Н. Нехорошева
Кемеровский кардиологический центрИшемические нарушения мозгового кровообращения остаются одной из важных проблем современной клинической неврологии и занимают ведущее место среди причин инвалидизации и смертности населения. На фоне впечатляющих темпов снижения смертности от инсульта за последние 20 лет в таких странах, как Канада, Япония, США (8% в год), в России наблюдается повышение уровня смертности (4% в год).
Проблема церебрального инсульта имеет не только медицинское значение, но и социально-экономическое, т.к. инсульт является основной причиной инвалидизации населения: по данным Национального регистра, 31% пациентов, перенесших инсульт, требуют постоянного ухода, 20% не могут самостоятельно ходить и только 20% возвращаются к прежней работе.
В Москве количество острых нарушений мозгового кровообращения (ОНМК) составляет от 100 до 120 случаев в сутки, что соответствует 36-44 тыс. больных в год. Особая демографическая ситуация в Кузбассе в условиях концентрации предприятий угольной, химической, металлургической промышленности, а также резко континентальный климат Сибири, привели к росту распространенности цереброваскулярных заболеваний.
Общее количество больных с ОНМК, пролеченных в стационарах г Кемерово, увеличилось за три последних года на 28%, при этом около 60% составили пациенты до 60 лет. Число больных, впервые признанных инвалидами, в 2007 году в г Кемерово возросло на 28% по сравнению с 2004 годом.
Год 2004 2005 2006 2007 Летальность (%) 18,6 19,9 21 20 В нашей стране темпы роста смертности от инсульта особенно велики у лиц работоспособного возраста до 64 лет, в среднем на 5% в год.
Среди последствий перенесенного ишемического инсульта (ИИ), наряду с двигательными, вестибулярными и речевыми расстройствами, большую долю занимают когнитивные нарушения, в том числе достигающие степени деменции, которые существенно ухудшают качество жизни больных.
Постинсультными когнитивными расстройствами принято называть нарушения памяти и других высших мозговых функций, которые возникли или достигли клинической значимости после инсульта. В качестве основных причин когнитивных нарушений у больных ИИ обсуждаются поражение стратегических для когнитивной деятельности отделов головного мозга, развитие «мультиинфарктного состояния», обширные поражения белого вещества (лейкоареоз), сопутствующие нейродегенеративные заболевания.
По данным, полученным T. Tatemichi с соавт., риск возникновения постинсультной деменции выше при инсультах, возникших на фоне атеросклеротического поражения крупных сосудов.
Нередко выраженное снижение умственной работоспособности и концентрации внимания, нарушение способности сосредоточиться являются следствием тревожно-депрессивных расстройств. Известно, что более 50% пациентов в раннем восстановительном периоде инсульта страдают тревожно-депрессивными расстройствами.
Тревожно-депрессивные нарушения связаны со сложными патогенетическими реакциями, возникающими при инсульте. Запуск «ишемического каскада» приводит к развитию оксидантного стресса, повышению активности глутаматергических, серотонинергических и норадренергических рецепторов. При этом высвобождается большое количество нейромедиаторов, являющихся катализаторами депрессивных и эмоциональных реакций. Расстройства эмоциональной сферы у больных с церебральной ишемией затрудняют проведение реабилитационных мероприятий.
Одними из ведущих этиологических факторов ИИ являются: атеросклеротическое поражение экстракраниальных артерий и артериальная гипертония. Наиболее часто атеросклероз поражает артерии среднего калибра в местах разветвления (например, бифуркация сонной артерии). Это объясняется особенностями гемодинамики - напряженным турбулентным кровотоком, травматизацией эндотелия, застоем крови.
По данным МЗ РФ, общая смертность от инсульта в стране остается одной из самых высоких в мире и составляет 123 на 100 тыс. населения, в странах Западной Европы - в три раза меньше (37-47 на 100 тыс.).
Атеротромбоз или атеротромбэмболия из экстракраниальных артерий являются причиной ИИ в 45-50% случаев, при этом имеет значение не только степень стеноза артерии, но и структура атеросклеротической бляшки.
Артериальная гипертония является наиболее значительным модифицируемым фактором риска развития ИИ, повышая вероятность его развития в 3-4 раза. При длительно существующей артериальной гипертонии просвет мозговых сосудов суживается: сначала - тонически, а затем - вследствие морфоструктурных изменений (гипертрофия мышечной оболочки, гиперэластоз, миоэластофиброз, пролиферация соединительнотканных элементов). То есть создаются условия для прогрессирования атеросклероза. Артериальная гипертония в сочетании с атеросклерозом диагностируется более чем у 70% больных инсультом.
Кроме того, артериальная гипертония вызывает комплекс функциональных расстройств, проявляющихся нарушением системы ауторегуляции мозгового кровотока. Возможности ауторегуляции мозгового кровотока резко снижаются при некомпенсированной артериальной гипертонии, особенно при большой вариабельности артериального давления (АД) в течение суток.
Таким образом, функциональные и морфологические изменения церебральных сосудов, усугубляя друг друга, приводят к глобальной катастрофе -ОНМК. В остром и раннем восстановительном периоде ОНМК оправдана медленная, плавная нормализация АД.
В условиях нарушенной ауторегуляции при снижении АД не происходит адекватного расширения артерий головного мозга, падает перфузионное давление в ишемизированной ткани, что может привести к прогрессированию хронической церебральной ишемии, а у ряда больных - к усугублению неврологического дефицита. Поэтому подбор адекватной гипотензивной терапии у больных с ИИ на фоне артериальной гипертонии и церебрального атеросклероза крайне важно сочетать с назначением препаратов, обладающих потенциальным нейропротективным, ноотропным, метаболическим и вазоактивным эффектами.
Действие ноотропных и вазоактивных препаратов при ишемическом инсульте направлено на уменьшение выраженности отдаленных последствий ишемии. В данный момент проводится более 20 международных исследований, изучающих эффективность препаратов различных фармакологических групп с потенциальными нейропротективными свойствами.
К препаратам с нейропротективным эффектом относятся антиоксиданты и антигипоксанты (мексидол, эмоксипин, цитофлавин, витамины Е, С), нейротрофические препараты (рацетамы, актовегин), нейромодуляторы (глицин и др.с), нейропептиды (церебролизин).
В связи с этиопатогенетической гетерогенностью цереброваскулярных заболеваний (ЦВЗ), прежде всего ишемического инсульта (ИИ), в основе которой лежат многообразные причины и механизмы развития ишемических нарушений мозгового кровообращения, лечение больных требует одновременного назначения препаратов с различными фармакоэффектами - от гипотензивных до ноотропных. Больные одномоментно принимают большое количество таблеток, обостряется проблема полипрагмазии.
В настоящее время одним из наиболее перспективных методов фармакотерапии является применение препаратов с многовекторным воздействием, влияющим, например, одновременно на уровень кровоснабжения и метаболизм головного мозга.
В 2007 году на российском фармацевтическом рынке появился препарат Омарон («О строе М ышление, А ктивная Р ечь, О тличное Н астроение») с мультимодальным эффектом, воздействующий одновременно на метаболические процессы и кровоснабжение головного мозга. При этом Омарон нивелирует побочные эффекты составляющих компонентов: возбуждающий эффект пирацетама и седативный циннаризина.
Пирацетам - ноотропный препарат, синтезированный аналог γ-аминомасляной кислоты, улучшает утилизацию глюкозы в коре головного мозга, усиливает церебральную холинергическую проводимость, микроциркуляцию в ишемизированных зонах, ингибирует агрегацию тромбоцитов, улучшает интегративную деятельность мозга.
Циннаризин - производное пиперазина, блокатор кальциевых каналов IV класса с преимущественным влиянием на сосуды головного мозга, снижает тонус гладкой мускулатуры артериол, уменьшает реакцию на эндогенные вазоконстрикторы, повышает устойчивость тканей к гипоксии, благоприятно влияет на коронарное и периферическое кровообращение, существенно не влияет на системную гемодинамику.
Препарат Омарон отличается удобной дозировкой (400 мг пирацетама, 25 мг циннаризина) и доступной ценой, выпускается в упаковках по 90, 60 и 30 таблеток. Производится на заводе «Нижфарм» (группа компаний STADA - международный фармацевтический холдинг головной офис в Германии; такая интеграция расширяет спектр препаратов и является гарантией качества). Завод «Нижфарм» первым в России получил сертификат о соответствии системы обеспечения качества международным стандартам GMP.
Большое количество (более 50) препаратов с потенциальными нейропротективными свойствами продемонстрировало различную степень эффективности в доклинических экспериментальных исследованиях, но не показало положительных результатов при клиническом применении. Одной из основных причин неудачи было отсутствие общепринятых стандартов исследований нейропротекции.
Мишенью большинства исследований препаратов был какой-либо один аспект сложных ишемических нарушений. В будущем предполагается разработка препаратов с множественным воздействием на различные звенья ишемического каскада. Данный мультимодальный подход может быть достижим при помощи комбинации нескольких препаратов.
Цель
Изучить влияние Омарона на регресс неврологического дефицита у больных с ишемическим инсультом, ассоциированным с артериальной гипертонией и атеросклеротическим стенозом сонных артерий.
Материалы и методы
Исследование эффективности препарата Омарон проводилось в специализированном неврологическом отделении для лечения больных с острым нарушением мозгового кровообращения Кемеровского кардиологического центра. В исследовании участвовало 60 больных.
Критерии включения:
Пациенты обоего пола от 30 до 70 лет Ишемический инсульт в бассейне переднего и заднего кровообращения Период заболевания - первые 5 суток Речевые нарушения, не достигающие тотальной степени Фоновые заболевания - атеросклеротический стеноз ВСА любой степени, гипертоническая болезнь Критерии исключения:
Геморрагический инсульт Давность более 5 суток Глубокая степень двигательного дефицита (гемиплегия) Тотальная афазия Уровень сознания по шкале Глазго менее 12 баллов Индивидуальная непереносимость компонентов препарата Другие заболевания в стадии декомпенсации Психические заболевания В исследование включено 60 больных с ишемическим инсультом (21 мужчина, 39 женщин) в возрасте от 43 до 60 лет.
Возраст больных (лет) Основная группа Контрольная группа Абс. число % Абс. число % 43-50 3 10 5 16 51-55 12 40 14 47 56-60 15 50 11 37 Всего 30 100 30 100 Сформированы две однородные группы больных, которым назначалась базовая медикаментозная терапия (реополиглюкин, пентоксифиллин, по показаниям низкомолекулярный гепарин, дополнительно - гипотензивная, антиаритмическая терапия), симптоматическая терапия - миорелаксанты, анальгетики, антибиотики, физические методы реабилитации, групповая психотерапия. Больным основной группы (n=30) назначался Омарон по 1 таблетке три раза в сутки в течение 30 дней, в контрольной группе (n=30) ноотропы и селективные блокаторы кальциевых каналов не назначались.
Больным проводили клинико-неврологическое исследование в динамике: при поступлении, через 15 и 30 дней. Состояние больных оценивали с помощью объективной оценки неврологического дефицита по шкале Лайонса. Психологическое тестирование выполняли всем пациентам с использованием краткой шкалы оценки когнитивного дефицита (MMSE), которая позволяет исследовать внимание, краткосрочную и отсроченную слухо-речевую память, счет, письмо, праксис, зрительно-пространственную ориентацию [Folstein M.F. et al., 1975]. Степень тревожно-депрессивного расстройства определялась по госпитальной шкале тревоги и депрессии [Zigmond A., 1983].
Проводили дуплексное сканирование (ДС) брахиоцефальных артерий с цветным картированием кровотока и импульсной допплерографией на аппарате «Sonos-2500» (фирма «Hewlett Packard», США) линейным датчиком 7 Мгц. У всех больных выявлены атеросклеротические изменения экстракраниального отдела сонных артерий различной степени выраженности.
Всем больным проводили транскраниальную допплерографию (ТКДГ) с функциональными пробами на аппарате «Angiodin 2» (фирма «DMS», Франция), регистрировалась линейная скорость кровотока (ЛСК) в средней мозговой артерии (СМА) в сегменте М1, рассчитывали показатели цереброваскулярной реактивности (ЦВР) на гиперкапническую пробу (Кр+) и гипокапническую пробу (К-), показатели ауторегуляции, полученные при оценке каротидного компрессионного теста (коэффициент овершута).
Суточное мониторирование АД проводили с помощью системы АВРМ - 04 Meditech (Венгрия) с оценкой систолического и диастолического АД днем и ночью, вариабельности АД.
Основные характеристики клинических групп представлены в таблице 1.
Таблица 1. Основные характеристики клинических групп
Признак Омарон Контрольная группа Общее число больных 30 30 Мужчины 12 9 Женщины 18 21 Средний возраст 50,5 (43-60) 51 (44-60) Локализация очага: Система правой СМА 31% 29% Система левой СМА 18% 19% Вертебробазилярный бассейн 51% 52% Неврологический дефицит: Шкала Лайонса баллы 6,8 6,6 Когнитивные, тревожно-депрессивные расстройства: MMSE/среднее/баллы 26,9(±2,1) 26,4(±2,9) Госпитал. шкала тревоги /среднее/баллы 9,1(±1,4) 8,6(±2,6) Госпитал. шкала депрессии /среднее/баллы 11,8(±2,9) 12,1(±3,1) Стенозы ВСА/среднее/ 24% 27% Полученные в ходе клинического исследования результаты были обработаны на ЭВМ типа IBM - PC c помощью программной системы «STATISTICA for Windows».
Результаты и обсуждение
Пациенты основной и контрольной групп предъявляли жалобы на снижение силы в конечностях, нарушение речи, головокружение, головные боли, нарушение сна. К моменту выписки из отделения число больных, предъявляющих жалобы, значительно сократилось (табл. 2).
Таблица 2. Динамика жалоб в группе пациентов, получавших Омарон, и контрольной группе
Жалобы До лечения После лечения До лечения После лечения Абс. % Абс. % Абс. % Абс. % Слабость в конечностях 15 50 11 37 14 47 11 37 Нарушение речи 5 17 3 10 6 20 4 13 Головокружение 14 47 1 3* 16 54 9 30 Головная боль 17 57 3 10* 20 67 7 23 Нарушение сна 11 37 2 7* 9 30 6 20 * р<0,01На фоне лечения Омароном достоверно уменьшилось число больных с головной болью, головокружением, нарушением сна (р<0,01). Достоверной динамики в восстановлении двигательных и речевых нарушений за период лечения получено не было в обеих группах.
В таблице 3 представлена динамика изменения неврологического статуса, выраженного в баллах, за время лечения в стационаре, которая свидетельствует о достоверно лучшем функциональном исходе раннего восстановительного периода ишемического инсульта у больных, получавших Омарон.
Таблица 3. Динамика неврологического статуса на фоне лечения
Шкала До лечения После лечения До лечения После лечения Лайонса 6,8 3,5* 6,6 4,7* * р<0,05 - достоверность различий между группамиНеврологический дефицит в основной группе после лечения суммарно уменьшился по шкале Лайонса на 46,1%, в контрольной группе на 26,5% (рис. 1).
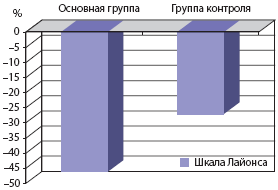
Рис. 1. Уменьшение неврологического дефицита (%) после леченияПоказатели шкалы MMSE у пациентов в основной группе до лечения в среднем составили 26,9±2,1 балла. У 16 (54%) пациентов не было обнаружено значимого нарушения когнитивных функций (28-30 баллов), у 13 (43%) - выявлены преддементные когнитивные нарушения (24-27 баллов), один больной имел деменцию легкой степени (20-23 балла). Средний балл по шкале MMSE у пациентов контрольной группы до лечения соответствовал 26,4±2,9. Большинство пациентов (57%) не имели когнитивных нарушений (28-30 баллов), у 11 (37%) больных диагностированы преддементные когнитивные нарушения, у 2 - деменция легкой степени (табл. 4).
Таблица 4. Динамика когнитивных нарушений
MMSE (баллы) До лечения После лечения До лечения После лечения Абс. % Абс. % Абс. % Абс. % 20-23 1 3,3 0 0 2 6,6 2 6,6 24-27 13 43,3 4 13,3 11 36,6 9 30 28-30 16 53,4 26 86,7 17 56,8 19 63,4 Среднее 26,7 - 28,4* - 26,4 - 27,5 - *р<0,05 в сравнении с той же группой на момент стартаПосле лечения у пациентов первой группы, получавших Омарон, отмечено достоверное увеличение количества баллов по шкале MMSE до 28,4±1,6 (р<0,05), в контрольной группе после лечения среднее значение MMSE достоверно не изменилось.
В первой группе частота случаев выявления когнитивного дефицита по окончании лечения снизилась на 28,5%, а в группе контроля - на 7% (рис. 2).
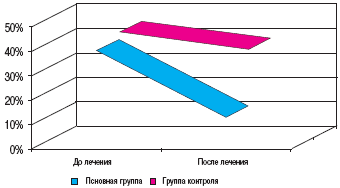
Рис. 2. Динамика выявления когнитивного дефицитаТревожно-депрессивные расстройства одинаково часто встречались до лечения в обеих группах (табл. 5). После лечения число пациентов с эмоционально-волевыми нарушениями уменьшилось в основной и контрольной группах, однако на фоне лечения Омароном эффективность коррекции достоверно выше.
Таблица 5. Динамика эмоционально-волевых нарушений
Синдром До лечения После лечения До лечения После лечения Абс. % Абс. % Абс. % Абс. % Депрессия 18 60 4 13* 17 57 8 27* Тревога 19 63 6 20* 16 53 11 37* * р<0,01 - достоверность различий между группамиТаким образом, улучшение состояния когнитивных функций и эмоциональной сферы у больных с преддементными когнитивными нарушениями и легкой деменцией в восстановительном периоде ишемического инсульта свидетельствует о способности препарата Омарон положительно влиять на высшие мозговые функции , способствовать восстановлению когнитивного дефицита.
При проведении суточного мониторирования АД максимальное суточное АД при поступлении составило 176±10,8 мм рт.ст. в основной группе и 169±14,7 мм рт.ст. в группе контроля.
При поступлении в стационар у больных первой группы среднее САД днем имело значение 164±12,8 мм рт.ст., во второй группе - 156±17,1 мм рт.ст. После проведенного курса лечения среднее САД у больных, получавших Омарон, составило 136±11,8 мм рт.ст., в контрольной группе - 145±16,3. Отмечалось достоверное снижение САД (р<0,01) на 18,2% у пациентов первой группы, во второй группе значимой динамики не наблюдалось (разница 4,1%).
Среднее дневное ДАД достоверно снижалось у больных на фоне лечения Омароном (р<0,05). Так, среднее дневное ДАД в начале исследования составило 98±14,2 мм рт.ст., по окончании исследования - 84±12,4 мм рт.ст., в контрольной группе отмечалась незначимая динамика среднего дневного ДАД: 89±13,1 и 85±12,6 мм рт.ст. (табл. 6, рис. 3).
Таблица 6. Показатели СМАД в динамике
Группы Среднее САД днем (мм рт.ст.) Среднее ДАД днем (мм рт.ст.) До лечения После лечения До лечения После лечения Основная группа 164±12,8 136±16,8* 99±14,2 84±12,4** Группа контроля 156±17,1 145±16,3 89±13,1 85±12,6 *р<0,01; **р<0,05
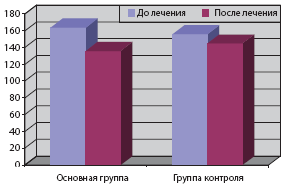
Рис. 3а. Динамика САД днем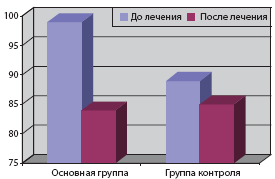
Рис. 3б. Динамика ДАД днемКак известно, у больных, перенесших ишемический инсульт, ассоциированный с артериальной гипертонией и атеросклеротическим поражением экстракраниальных артерий, страдает ауторегуляция мозгового кровотока в результате снижения дилатационного потенциала сосудов мозга. Эффективная гипотензивная терапия должна обеспечивать минимальное колебание АД в течение суток. У больных с недостаточным ночным снижением АД (non-dippers), повышением АД в ночные часы (night-peakers) и чрезмерным ночным снижением АД (over-dippers) увеличивается риск развития осложнений, включая повторные нарушения мозгового кровообращения.
Вариабельность САД у больных первой группы при поступлении составляла 18,4±5,1 мм рт.ст., ДАД -14,7±3,1 мм рт.ст., во второй группе 16,8±4,6 и 13,9±2,8 соответственно. В динамике после лечения наблюдалось достоверное снижение вариабельности АД у больных в группе опыта: САД до 14,8±2,1 (р<0,05), ДАД до 9,8±3,3 мм рт.ст. (p<0,05). В контрольной группе достоверного снижения вариабельности АД не выявлено.
Показатель, отражающий максимальный подъем АД в течение суток, отражает гипертензионную нагрузку на сердечно-сосудистую систему и имеет значение в оценке тяжести течения артериальной гипертонии и угрозы неврологических осложнений. На фоне лечения Омароном пики колебания максимальных цифр АД сглаживались и артериальная гипертония принимала благоприятное течение.
Таким образом, Омарон положительно влияет на динамику основных показателей суточного мониторирования АД , что подтверждает высокую эффективность препарата в лечении пациентов с ишемическим инсультом.
По данным цветного дуплексного сканирования экстракраниальных артерий у всех больных выявлены атеросклеротические поражения ВСА в виде утолщения комплекса интима-медиа и/или стенозов менее 50%. Отсутствие аналогичных изменений в позвоночных артериях, вероятно, обусловлено тем, что при АГ в первую очередь изменяются артерии каротидного бассейна и интракраниального русла. Выявленные структурные изменения в магистральных артериях головы не приводили к существенным нарушениям объемного кровотока по ним.
По данным ТКДГ у больных первой и второй групп до лечения отмечалось незначительное снижение ЛСК в СМА, при повторном проведении ТКДГ не отмечено достоверного увеличения ЛСК в обеих группах. При проведении функциональной ТКДГ коэффициенты ЦВР на Кр+ и Кр- нагрузку и индекс вазомоторной реактивности (ИВМР) были снижены у больных обеих групп, что указывает на истощение вазодилатационного резерва мозговых артерий. По окончании лечения положительная динамика индекса ЦВР выявлена в первой и второй группах. Однако у пациентов, получавших Омарон, она оказалась наиболее выраженной (табл. 7).
Таблица 7. Динамика показателей цереброваскулярной реактивности
Коэффициенты ЦВР До лечения После лечения До лечения После лечения ИВМР 56,9±4,8 64,1±6,3* 57,8±6,6 60,7±5,4 Кр+ 1,23±0,22 1,36±0,16* 1,24±0,13 1,29±0,18 Кр- 0,66±0,15 0,68±0,13 0,67±0,16 0,69±0,17 * р<0,05Показатели ауторегуляции при проведении каротидного компрессионного теста с определением коэффициента овершута до лечения были снижены у всех пациентов (I группа - 1,19±0,41; II группа - 1,21±0,23); после лечения выявлена достоверная положительная динамика (р<0,05) в группе больных на фоне лечения Омароном (I группа - 1,34±0,22; II группа - 1,27±0,25).
Выводы
Результаты исследования подтвердили клиническую эффективность многовекторного препарата Омарон:
1. На фоне лечения Омароном купировались жалобы больных на головные боли, головокружение, нарушение сна, достоверно уменьшился неврологический дефицит, выраженный в баллах, что привело к улучшению функционального исхода раннего восстановительного периода ишемического инсульта.
2. Курсовое лечение Омароном достоверно улучшает суммарные показатели когнитивных функций (по шкале ММSE), положительно влияет на эмоционально-волевую сферу, уменьшает тревожно-депрессивные расстройства.
3. Инструментальные методы исследования достоверно подтверждают положительное влияние Омарона на основные показатели суточного мониторирования АД, уменьшение вариабельности АД, что минимизирует риск развития осложнений гипотензивной терапии у пациентов с ишемическим инсультом.
4. Данные ТКДГ указывают на улучшение показателей мозговой ауторегуляции и нормализацию коэффициентов цереброваскулярной реактивности после лечения Омароном.
5. Омарон отличается хорошей переносимостью: побочные эффекты и аллергические реакции отсутствовали, что доказывает безопасность препарата.Таким образом, комбинированный препарат Омарон эффективен в комплексном лечении больных с ишемическим инсультом, ассоциированным с артериальной гипертонией и атеросклеротическим стенозом сонных артерий.
Литература
1. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии.- М.: Медицина, 1997.
2. Виберс Д.О., Фейгин В.Л., Браун Р.Д.// Руководство по цереброваскулярным заболеваниям. Пер. с англ. М., 1999.
3. Виленский Б.С. Инсульт: профилактика, диагностика и лечение. С.-Пб., 2002.
4. Ворлоу Ч.П., М.С. Деннис и др. // Инсульт. Практическое руководство для ведения больных. Пер. с англ. СПб., 1998.
5. Воробьева О.В. Возможности использования препарата Омарон для лечения цереброваскулярной болезни. Медицинский вестник, 2007, №14.
6. Гусев Е.И., Гехт А.Б. Реабилитация в неврологии. М., 2000.
7. Джибладзе Д.Н. Патология сонных артерий и проблема ишемического инсульта. Москва, 2002).
8. Левин О.С., Дамулин И.В. Диффузные изменения белого вещества и проблема сосудистой деменции //Достижения в нейрогериатрии/ Под ред. Н.Н. Яхно, И.В. Дамулина. - М.: ММА, 1995.
9. Одинак М.М., Вознюк И.А., Янишевский С.Н. Инсульт. Вопросы этиологии, патогенеза, алгоритмы диагностики и терапии. СПб.: ВМедА, 2005.
10. Скворцова В. Нейропротективная терапия ишемического инсульта. Журн. Врач. 2004, 6.
11. Скворцова В.И., Евзельман М.А Ишемический инсульт. Орел, 2006.
12. Федин А.И., Румянцева С.А. Избранные вопросы базисной интенсивной терапии нарушений мозгового кровообращения. Методические указания. Москва, 2002.
13. Шевченко О.П., Праскурничий Е.А., Яхно Н.Н., Парфенов В.А Артериальная гипертония и церебральный инсульт. М., 2001.
14. Barnett HJM, Mohr JP et al. Stroke. Pathophysiology, diagnosis and management. New York, 1992.
15. Cummings J.L Vascular subkortikal dementias: clinical aspects// In: Vascular dementia. Ethiologikal, pathogenetik, clinical and treatment aspects. Ed/ By L.A. Carlson, C.G. Gottfries.-Basel etc.: S. Karger.- 1994.
16. Erkinjuntti T., Roman G., Gauthier S. at al. Emerging therapies for vascular dementia and vascular cognitive impairment.// Stroke.-2004/
17. Hallet M. Brain Res. Rev. 2001.
18. Hershey L.A., Olszewski W.A. Ishemic vascular dementia. //In Handbook of Demented Illnesses. Ed by J.C. Mooris.- New York ect.: Marcel Dekker, Inc. -1994.
19. Hijdra A. Vascular Dementia. Neurology in Clinical Practice. Chartert 70. The Dementias. Butterworth-Heinemann, 2000.
20. Sarti C., Rastenyte D., Tuomilehto J. International trends in mortality from stroke, Stroke 2000.
21. T. Tatemichi, Foulkes M.A. et al. Dementia in stroke survivors in the Stroke Data Bank cohort: Prevalence, incidence, risk factors. Stroke. 1996. - Vol. 21.
22. Thomm T.J. Stroke mortality trends: an international perspective. Ann Epedemiol, 1993.
23. Yatsu P.M. et al. Stroke: 100 Maxims. St. Louis etc. 1995.
| Июнь 2010 г. |