ЗАЛДИАР (ТРАМАДОЛ/АЦЕТАМИНОФЕН) В ЛЕЧЕНИИ ХРОНИЧЕСКОЙ БОЛИ ПРИ ОСТЕОАРТРОЗЕ.
Л.П.Ананьева, Старовойтова М.Н., Десинова О.В., Д.А.Гукасян, Л.Н.Денисов
Институт ревматологии РАМН (Директор - академик РАМН Насонов Е.Л.)Проблема хронической боли актуальна для здравоохранения из-за широкой распространенности. Примерно 55% людей в мире страдают хронической болью [11]. Недавно были опубликованы результаты изучения хронического болевого синдрома в Европе, в котором участвовало 16 стран. Анкетирование проводилось только у лиц с болью умеренной и сильной интенсивности (5 и более баллов при оценке по 0-10 бальной шкале). Оказалось, что в Европе распространенность выраженных хронических болевых синдромов колебалась от 11 до 30% и в среднем ставила 19% [8]. При этом средняя продолжительность такого болевого синдрома составляла 7 лет, и подавляющее большинство страдали более двух лет. Каждый пятый больной терял работу, и у каждого пятого развивалась депрессия, связанная с болью. Особенно часто хронические болевые синдромы сопровождают заболевания опорно-двигательного аппарата. Так, ведущими причинами хронической боли были артриты и остеоартрит (34%), патология межпозвоночного диска (15%), ревматоидный артрит (8%). Наиболее часто боли локализовались в коленных (16%) и плечевых суставах (9%), а также в других суставах (10%), в нижней части спины (24%). Подавляющее большинство опрошенных (78%) пытались принимать предписанные медикаментозные средства, и 52% продолжали лечиться в момент интервьюирования. При этом две трети больных сообщили, что боль у них недостаточно подавлена и две трети были готовы попробовать новые средства. Эти данные убедительно показывают масштабность проблемы хронической боли и подтверждают уже сформировавшееся мнение, что для лечения болевых синдромов, особенно тяжелых, делается еще недостаточно. Необходимо улучшение качества помощи страдающим от хронической боли больным. В Европе большое место в комплексном решении этой проблемы занимают врачи общей практики, к которым обращаются около 70 % больных, а также ортопеды, невропатологи и ревматологи.
Принципы и методы лечения хронического болевого синдрома, связанного с различными заболеваниями, имеют много общего. Курация боли направлена, в первую очередь на определение основного заболевания, обуславливающего возникновение боли, т.е. на выяснение причины боли. Для подбора адекватной аналгетической терапии необходима оценка состояния больного и измерение интенсивности боли в динамике. Важно определить реальную цель лечения и обсудить ее с пациентом. В большинстве случаев цель заключается в уменьшении интенсивности боли (насколько возможно) и ее длительности, улучшении функциональных способностей больного и улучшении адаптации пациента к повседневной жизни [5].
В борьбе с нераковой («незлокачественной») или неонкологической болью принципы лечения боли отчасти заимствуются из опыта онкологов (например, «аналгетическая лестница» ВОЗ), но в силу многих причин не могут быть просто перенесены в ревматологическую практику. Так, у больных ревматологического профиля уменьшение интенсивности боли невозможно без патогенетической противоревматической терапии, которая подавляет хроническое аутоиммунное воспаление, лежащее в основе повреждающих процессов, вызывающих боль. Поэтому среди методов лечения хронического болевого синдрома у ревматологических больных на первом месте стоит системная фармакотерапия, включающая так называемые болезнь-модифицирующие и «базисные» препараты, кортикостероиды, хондропротекторы и др. Эффект системной фармакотерапии хорошо дополняют локальные воздействия (внутрисуставное введение лекарств, наложение мазей и гелей, а также трансдермальных терапевтических систем), а также с физиотерапевтические методы. Но иногда проходит много месяцев, прежде, чем удается подавить активность основного заболевания, и в этот длительный период больному приходится бороться с хронической болью. Патогенетическая терапия, даже при высокой эффективности, не всегда в достаточной степени подавляет клинические проявления заболевания и, в частности, болевые ощущения. Особенно это касается длительно болеющих людей, у которых многолетний патологический процесс в суставах сопровождается развитием необратимых деструктивных изменений, приводящих к «декомпенсации» функции суставов. Развитие необратимых структурных изменений в суставах закономерно связано с нарастанием болевого синдрома, который нередко достигает значительной интенсивности. В таких ситуациях возникает необходимость усиления именно обезболивающих воздействий и, зачастую, подключения лекарственных препаратов с обязательным анальгетическим эффектом. На поздних стадиях ревматических заболеваний анальгетики, как и в онкологии, по сути являются паллиативной помощью и применяются согласно "лестнице аналгетиков", когда нарастание интенсивности боли служит основанием последовательного (ступенчатого) применения все более сильных анальгетиков.
Как показало цитируемое выше исследование хронической боли в Европе, чаще всего пациентам с целью обезболивания назначаются нестероидные противовоспалительные средства (44% больных), парацетамол (23%) и слабые опиоиды (18%). Парацетамол считается препаратом первой ступени и назначается при слабой и умеренной боли, не связанной с воспалением. Парацетамол является неопиоидным анальгетиком центрального действия, по-видимому, блокирующий циклооксигеназу (ЦОГ) в структурах ЦНС. Отсутствие влияния парацетамола на синтез простагландинов в периферических тканях объясняет то, что он не оказывает отрицательного действия на слизистую ЖКТ и водносолевой обмен (задержка натрия и воды). При более выраженной боли и при воспалительных явлениях назначаются НПВП и, в частности, коксибы (вторая ступень аналгетической лестницы). При сильных болях и неэффективности парацетамола и НПВП используют опиоиды (третья ступень).
В выборе лекарственного средства современные врачи ориентируются на общепринятые клинические рекомендации. Для лечения остеоартроза крупных суставов наиболее известными были рекомендации Европейской лиги по борьбе с ревматизмом 2000г. [4]. Согласно этим рекоменлациям, наряду с парацетамолом, широко назначались НПВП, которые в России были препаратами первой линии. За последние несколько лет рекомендации по лечению мышечно-скелетных болей претерпели существенные изменения. С появлением селективных ингибиторов циклооксигеназы-2 (коксибов), имеющих меньший повреждающий потенциал в отношении желудочно-кишечного тракта, эти препараты получили преимущество над НПВП у больных с лекарственными гастропатиями. В более поздних рекомендациях акцент сместился на коксибы и неселективные НПВП как основу фармакологической терапии [15]. После накопления достаточного большого опыта использования коксибов и неселективных НПВП стало очевидным, что при длительном применении эти препараты могут оказывать токсический эффект не только на желудочнокишечный тракт, но и другие внутренние органы - сердце, почки, печень. Это послужило основанием для рекомендаций по ограничению применения этого класса препаратов для длительного применения. Так, влиятельные организации в США (Food and Drug Аdministration) и Европе (European Medicines Agency) пришли к заключению о несомненном повышении кардиоваскулярного риска у больных, принимающих НПВП, особенно такого ингибитора ЦОГ-2, как рофекоксиб, и настоятельно рекомендовала ограничить использование всех НПВП исходя из принципа назначения возможно меньшей дозы на возможно короткий период [12, 14 ]. Врачи общей практики оказались в трудном положении, поскольку общепринятые рекомендации в свете новых данных фактически теряли силу, а новые рекомендации официальными организациями пока не предложены. В сложившейся ситуации врачи должны находить альтернативные варианты анальгетической терапии, заменяя НПВП или комбинируя их более низкие дозы с другими препаратами.
Повышение эффективность лечения острой и хронической боли достигается применением комбинации болеутоляющих средств, имеющих разные, но взаимодополняющие механизмы и временные характеристики действия. Главной целью комбинирования лекарственных средств является достижение большей болеутоляющей активности, по сравнению с каждым из лекарств, входящих в комбинацию [17]. Усиление аналгезии возможно при меньших дозах каждого из активных компонентов, что потенциально улучшает переносимость и характеристики безопасности используемых аналгетиков. Наиболее часто комбинируются нестероидные противовоспалительные средства и парацетамол со слабыми опиоидами. Комбинации парацетамола с опиоидами рекомендованы ВОЗ для лечения умеренной и сильной боли. В этой связи значительно увеличился интерес к опиоидным анальгетикам, которые по сравнению с НПВП, оказывают значительно меньшие органотоксические воздействия [10]. Этот интерес нашел свое отражение в последних рекомендациях Европейской Лиги борьбы с ревматизмом (EULAR) по лечению остеоартроза тазобедренных суставов. Опиоидные аналгетики рассматриваются как полезная альтернатива НПВП и коксибам в случаях непереносимости, неэффективности или противопоказаниях к их назначению (бронхиальная астма, высокий риск сердечнососудистых событий, язвы, кровотечения или прободения кишечника) [21]. Указанные рекомендации основаны на данных литературы и мнениях экспертов, которые свидетельствуют об отсутствии у опиоидов кардиоваскулярных осложнений и негативного влияния на почки и слизистую желудочно-кишечного тракта, свойственных НПВП. Действовавшая в течение нескольких лет Рабочая Группа по курации боли (Working Group on Pain Management, WGPM) предложила свой алгоритм лечения боли при остеоартрозе у больных с такими факторами риска, как кардиоваскулярный и желудочнокишечный (рис.1). Согласно рекомендациям WGPM при умеренной и сильной боли вначале применяют слабые опиоиды, а при их неэффективности используют более активные опиоидные анальгетики (цит. по SA Schug, 2007 [19]).
Рекомендации по лечению больных остеоартрозом с факторами риска
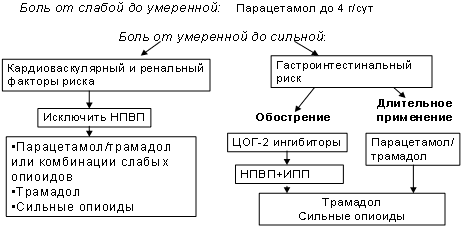
К слабым опиоидам, не включенным в список наркотических средств, относится трамадола гидрохлорид. В последние годы он стал шире применяться при лечении остеоартрита, поскольку не вызывает желудочнокишечных проблем, осложнений со стороны почек и не повреждает суставной хрящ [7].
Трамадол является слабым опиоидным аналгетиком центрального действия. Аналгетический эффект обусловлен неселективным агонистическим взаимодействием с опиоидными мю-, дельта- и каппа- рецепторами (с большей тропностью к мю- рецепторам). Он обладает также действием на моноаминергическую систему, участвующую в регуляции болевых стимулов. В терапевтических дозировках трамадол практически не оказывает влияния на показатели гемодинамики, не угнетает функцию дыхания, слабо влияет на перистальтику желудочно-кишечного тракта. При правильном назначении и контролируемом применении привыкание и лекарственная зависимость возникают крайне редко (примерно 2,5 случая на миллион принимавших препарат) [ 9 ].
При заболеваниях опорно-двигательного аппарата слабые опиоиды (в основном трамадол гидрохлорид) в нашей стране используют редко: при необратимых изменениях при ОА, при ишемических повреждениях, сопровождающихся некрозами тканей (васкулиты), при тяжелых осложнениях (герпес зостер, остеопоретические переломы). В России сильные опиоиды для лечения неонкологической боли практически не применяются.
Недавно в практику был внедрен комбинированный препарат Залдиар, включающий фиксированные дозы трамадола гидрохлорида и парацетамола. Одна таблетка содержит 37,5мг трамадола и 325 мг парацетамола. Препарат рекомендован для лечения умеренной и сильной боли различного генеза и может быть определен как средство второй ступени для пациентов, которым требуется большая эффективность, чем та, которую могут обеспечить парацетамол или НПВП. Всасывание трамадола происходит медленнее, чем парацетамола. Среднее время полувыведения трамадола составляет 4,7-5,1 ч, парацетамола 2-3ч. Синергизм аналгетического действия двух активных веществ в небольших дозах снижает риск развития побочных эффектов. В России Залдиар подлежит предметно-количественному учету и выписывается врачом на рецептурном бланке 148-1/у.
Показания к применению Залдиара довольно широки - травмы, боли у онкологических больных, мышечно-скелетные боли, послеоперационный период, обезболивание при проведении болезненных диагностических и лечебных манипуляций и др. Залдиар назначается в тех случаях, когда желательно сочетание быстрого начала и большой продолжительности анальгетического действия. Такие ситуации могут возникать при острой боли или у больных с хроническими заболеваниями, которые отличаются изменчивостью интенсивности болей.
Введению комбинированного аналгетика Залдиар в широкую клиническую практику способствовала хорошая доказательная база. Был проведен целый ряд серьезных клинических испытаний и у больных с мышечно-скелетными болями. Трамадол/парацетамол сравнивали с плацебо, с монотерапией трамадолом и с комбинацией кодеин/парацетамол [2, 16, 20]. При болях в спине, при остеоартрите и фибромиалгии средняя суточная доза трамадола/парацетамола составляла 3-4 таблетки в сутки. Эти испытания показали эффективность и безопасность комбинации трамадол/парацетамол при кратковременном применении (7-14 дней). В ряде испытаний трамадол/парацетамол (в сравнении с плацебо) применялся в качестве добавочного аналгетика у больных, получающих стабильную дозу НПВП [13,18]. В этих исследованиях также была доказана эффективность комбинации по сравнению с плацебо. Эффективность длительного применения оценивалась и в более длительных испытаниях [6]. Было также проведено двойное слепое, рандомизированное мультицентровое испытание трамадола/парацетамола (309 больных) и широко известной комбинации кодеин/парацетамол (153 больных) в параллельных группах в течение 4 недель при хронической боли в пояснице и болей при остеоартрозе [16]. Была показана сходная эффективность и сходный профиль побочных эффектов (при этом трамадол/парацетамол достоверно реже вызывал запоры и сонливость). Средние суточные дозы составили для трамадола/парацетамола 131 мг/1133 мг (3,5 таблетки) и кодеина/парацетамола 105 мг/1054 (3,5 таблетки). После окончания этого исследования 311 пациентов продолжили прием трамадола/парацетамола в открытом 23-х месячном испытании, которое показало возможность поддержания длительной адекватной аналгезии. При этом не было снижения эффективности или увеличения суточных доз препарата (т.е. не было развития толерантности), переносимость оставалась хорошей даже после двух лет лечения, не было ни одного случая развития пристрастия или синдрома отмены [3]. В долгосрочных исследованиях эффективности трамадола/парацетамола нередко отмечались нежелательные явления, наиболее частыми были рвота, тошнота, головокружение, головная боль и сонливость, которые по степени интенсивности были выражены в умеренной и слабой степени. В одном случае сообщалось о развитии синдрома отмены.
В России об успешном применении короткого (7-дневного) курса Залдиара для лечения суставных болей сообщали Осипова и соавт.[1]. Опыт более длительного применения слабых опиоидов для лечения больных остеоартрозом в России отсутствует. В контексте повышения интереса к применению слабых опиоидов для лечения хронических мышечно-скелетных болей нам представилось интересным получить собственный опыт длительного использования Залдиара. С этой целью было предпринято исследование по изучению эффективности и безопасности монотерапии анальгетическим препаратом Залдиар при хроническом болевом синдроме средней и сильной интенсивности у больных первичным остеоартрозом коленных и/или тазобедренных суставов при длительном - 45 дней - приеме в амбулаторных условиях.
В открытое однофазное проспективное исследование было включено 30 больных, подписавших информированное согласие. Средний возраст пациентов колебался от 45 до 80 лет, в среднем 62 ± 10, преобладали женщины - 29 человек, и один мужчина. У большинства больных была третья (66%) или четвертая (13%) рентгенологическая стадия артроза (по Келлгрену). Повышение индекса массы тела отмечено у большинства больных, среднее значение индекса массы тела составило 31,3± 6,9 кг. У 75% больных имелись сопутствующие заболевания, от 1 до 5 (чаще всего артериальная гипертензия) у одного больного.
Критериями включения в исследованиие были: достоверный диагноз остеоартроза коленных (допускалось сочетание с артрозом тазобедренных) суставов, наличие умеренной и сильной боли (не менее 50 мм по ВАШ), которая не купировалась обычной терапией НПВП и/или парацетамолом в течение предшествующих четырех недель. Весь период испытания (45 дней) пациенты вели «Дневник», в котором ежедневно фиксировали интенсивность болевого синдрома, дозу Залдиара и эффект лечения. Пациенты определяли дозу препарата самостоятельно, учитывая рекомендации: разовая доза 1-2 таблетки, интервал между приемами - не менее 6 часов, максимальная суточная доза - не более 8 таблеток. Во время исследования не разрешались другие вмешательства по поводу остаоартроза. Специально оговаривалось, что если максимальная доза (8 таблеток) Залдиара не будет вызывать желаемой аналгезии, допускается дополнительный прием парацетамола (до 1.5 г в сутки). Не включались в испытание пациенты с традиционными противопоказаниями для приема аналгетиков, входящих в состав Залдиара.
В процесс исследования проведены: оценка интенсивности боли по визуальной аналоговой шкале (ВАШ) перед приемом препарата, через 2 недели приема и после 45 дней приема; учет минимальной, средней и максимальной суточных доз (мг); оценка субъективного впечатления больных об эффекте обезболивания, а также оценка эффекта терапии врачом. Эффект оценивался как «очень хороший», «хороший», «удовлетворительный», «незначительный», «нет эффекта». Достижение хорошего и удовлетворительного эффекта расценивалось как адекватное обезболивание.
Основным конечным показателем эффективности в отношении динамики симптомов было изменение индекса WOMAC. (Индекс остеоартрита WOMAC, предложенный университетами Western Ontario и McMaster; версия индекса боли по ВАШ). Симптомы оценивались по показателю болевой и функциональной шкалы WOMAC на исходном уровне, через 3 недели и 6 недель. Обязательными были лабораторные исследования (каждый визит): гемоглобин (Hb), СОЭ, билирубин, трансаминазы -аланиновая (АЛТ) и аспарагиновая (АСТ), креатинин, щелочная фосфатаза (ЩФ).
Проведена регистрация побочных симптомов, связанных с приемом исследуемого препарата, и оценка степени их выраженности в баллах по шкале: 0- нет нежелательных реакций, 1 - слабо, 2- умеренно, 3- сильно выражены; а также оценка частоты нежелательных реакций в процентах. Через несколько недель после окончания лечения пациенты были специально опрошены для выявления признаков синдрома отмены.
Результаты
Испытание закончили 26 больных. По оценке врача отличный эффект отмечен у 3,3% больных, хороший - у 60%, удовлетворительный - у 26,7%, не было эффекта - у 15,7%. По оценке больных хороший эффект отметили 63,3% больных, удовлетворительный - 26,6 %, без эффекта-6,6%, ухудшение-3,3% (у одной больной при развитии нежелательной реакции значительной выраженности). Таким образом, и по оценке врача, и по оценке больного лечение у многих было эффективным - в 86,7- 89,9% случаев.. Положительная динамика боли и ограничения подвижности по шкале WOMAC (в мм) приведены на рисунке 1 и положительная динамика затруднений в выполнении повседневной деятельности (по шкале WOMAC, в мм) - на рисунке 2.В сутки, в среднем, больные принимали по 3 таблетки Залдиара, при этом средняя суточная доза трамадола составила 131 мг и парацетамола -1137 мг. Отмечено нарастание эффекта от лечения к концу исследования, при этом суточная доза Залдиара не увеличилась. Более того, отмечена тенденция к снижению суточной дозы Залдиара к концу исследования (рис.3). Ни один больной не использовал дополнительно другие аналгетики.
Изменений в данных лабораторного обследования после монотерапии Залдиаром не было отмечено (рис.4).
Оценка переносимости.
Оценка переносимости проведена у всех 30 пациентов. Нежелательные эффекты были отмечены у 21 (70%) больного из 30, четыре пациента (13%) прекратили прием Залдиара из-за побочных действий (головокружение, тошнота). Выраженность нежелательных реакций была оценена на 1 балл у 9 больных (42,8%), на 2 балла - у 10 больных (48%), на 3 балла - всего в двух случаях (но обе пациентки прекратили прием препарата). Несмотря на то, что нежелательные реакции возникали часто, у подавляющего большинства они были выражены слабо или умеренно. Самыми частыми нежелательными явлениями были головокружение (47%), и сонливость (33%).Частота основных нежелательных явлений при приеме Залдиара (n=30)
Проявления n % Головокружения 14 47 Сонливость 10 33 Сухость во рту 10 33 Тошнота 6 20 Запоры 2 6,6 Потливость 2 6,6 Парестезии 1 3,3 Слабость 1 3,3 Потеря аппетита 1 3,3 Почти в половине случаев (48%) побочные действия возникли в первые сутки приема препарата и у 81% - на первой неделе лечения. У закончивших полный 6-недельный курс лечения нежелательные реакции развились в 17 случаях (из 26, т.е в 65%). Продолжительность побочных реакций колебалась от 1 до 45 дней, в среднем 8 дней. Важно отметить, что побочные действия Залдиара у большинства больных (у 13, т.е. в 76% случаев) исчезли самопроизвольно несмотря на продолжение приема Залдиара, и к концу исследования сохранялись только у 4 больных. Эти четыре пациента расценили побочные действия как слабо выраженные и продолжили прием Залдиара в связи с хорошим обезболиванием. После окончания терапии признаков синдрома отмены не было отмечено ни у одного больного. В некоторых исследованиях, преимущественно краткосрочных, общая частота побочных действий была ниже, чем в нашем, в других - аналогична. Многие авторы отмечают, что нежелательные явления чаще развиваются в первые дни приема препарата и имеют умеренную или слабую выраженность; обратимы; практически не встречаются тяжелые жизненноугрожающие осложнения терапии.
Заключение. При исследовании анальгетической активности Залдиара в режиме монотерапии адекватное обезболивание было достигнуто в большинстве случаев - почти в 90%. Т.о. Залдиар является эффективным препаратом для купирования умеренной и сильной боли при остеоартрозе крупных суставов. Средняя суточная доза Залдиара составила 3 таблетки. На фоне 6-недельного лечения необходимости повышения дозы не возникло, т.е. развития толерантности не наблюдалось. Нежелательные явления носили слабый или умеренно выраженный характер. Спектр побочных реакций был характерен для слабых опиоидов - головокружение, сонливость, тошнота. Отличительной особенностью побочных реакций был их обратимый характер - они самостоятельно прошли у 76% больных. У пациентов, выбывших из испытания, нежелательные реакции полностью купировались в течение первых суток после прекращения приема препарата (без дополнительного лечения). Не наблюдалось жизненно опасных нежелательных реакций. Некоторые больные предпочли испытывать слабо выраженные нежелательные реакции (сонливость, тошнота, потливость), но не отменять препарат, поскольку были удовлетворены анальгетическим его эффектом. Таким образом, комбинированный аналгетик Залдиар может быть рекомендован для лечения хронического болевого синдрома в режиме монотерапии в течение длительного времени (до полутора месяцев) у больных остеоартрозом крупных суставов.
Поскольку входящий в состав Залдиара трамадола гидрохлорид потенциально может вызвать синдром отмены при длительном применении, нельзя отменять препарат сразу, целесообразно снижать дозу медленно. Имеющиеся в настоящее время данные клинических испытаний свидетельствуют о том, что риск развития зависимости/злоупотребления при приеме трамадола очень мал. В отношении Залдиара таких данных нет. Тем не менее с большой осторожностью следует назначать Залдиар пациентам с опиоидной зависимостью в анамнезе, с травмами головы, наклонностью к судорожным реакциям, при повышенном внутричерепном давлении, а также расстройствами гепато-билиарной системы, так как входящий в комбинацию парацетамол может оказывать гепатотоксическое действие в высоких дозах.
Литература к статье по Залдиару (Л.П.Ананьева и соавт.)
1. Осипова Н.А., Петрова В.В., Лукьянов М.В. Российсикй опыт применения комбинированного аналгетика Залдиара при боли в суставах. // Российский медицинский журнал, 2006, т.14.- N25.- с.1815-1819
2. Adler L, C. McDonald, C.O'Brien, M.Wilson. A comparasion of one-daily Tramadol with normal release Tramadol in the treatment of pain on osteoarthritis.// J. Rheumatol. 2002, 29;10: 2196-2199
3. Alwine LK; TRAMAP-ANAG-006 Study Group. Long term (2 years) analgesic efficacy of tramadol/acetaminophen tablets. Annals of the rheumatic diseases. Annual European Congress of Rheumatology 2000; 59 (Suppl 1): 136 (POS 301).
4. Altman RD e.a. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcomittee on Osteoarthritis Guideline. Arthr Rheum, 2000, 43: 1905-1915
5. American Pain Society. Principles of Analgesic Use in the Treatment of Acute Pain and Cancer Pain. Glenview, IL: American Pain Society, 1999
6. Babul N, Noveck R, Chipman H, et al. Efficacy and safety of extended-release, once-daily tramadol in chronic pain: a randomized 12-week clinical trial in osteoarthritis of the knee. J Pain Symptom Manage. 2004;28:59-71.
7. Bamigbade TA, Langford RM. The clinical use of tramadol hydrochloride. Pain Rev 1998; 5:155-182.
8. Breivik H., Colett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur.J.Pain., 2006, 10: 287-333).
9. Cicero TJ, Inciardi JA, Adams EA e.a. Rates of abuse of Tramadol remain unchanged with the introduction of new branded and generic products: results of abuse monitoring system, 1994-2004 // Pharmacoepidemiol Drug Saf, 2005, 14: 851-859
10. Chou R, Clark E, Helfand M. Comparative efficacy and safety of ling-acting oral opioids for chronic non-cancer pain: a systematic review. J.Pain Symptom Manage. 2003; 26: 10261048
11. International Association for the Study of Pain. How prevalent is chronic pain? In: Pain Clinical Updates, 2003; XI: 1-4
12. EMEA (European Medicines Agency), 2005.
13. Emkey R, Rosenthal N, Wu SC, Jordan D, Kamin M; CAPSS-114 Study Group. Efficacy and safety of tramadol/acetaminophen tablets (Ultracet) as add-on therapy for osteoarthritis pain in subjects receiving a COX-2 nonsteroidal anti-inflammatory drug: a multicenter, randomized, double-blind, placebo-controlled trial. J Rheumatol. 2004;31:150-156.
14. FDA (Food and Drug Administration), 2005.
15. Jordan K M, Arden N K, Doherty M e.a. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann Rheum Dis 2003;62:1145-1155. doi: 10.1136/ard.2003.011742
16. Mullican WS, Lacy JR. Tramadol/acetaminophen combination tablets and codeine/acetaminophen combination capsules for the management of chronic pain: a comparative trial. // Clin Ther 2001; 23: 1429-1445
17. Raffa R.B. Pharmacology of oral combination analgesics: rational therapy for pain // J. Clin. Pharmacy and Therapeutics, 2001,-v.26.-257-264
18. Silverfield JC, Kamin M, Wu SC, Rosenthal N. Tramadol/acetaminophen combination tablets for the treatment of osteoarthritis flare pain: a multicenter outpatient, randomized, double-blind, placebo-controlled, parallel-group, add-on study. Clin Ther. 2002;24:282-297.
19. S.A.Schug The role of Tramadol in current treatment strategies for musculoskeletal pain // Therapeutics and Clinical Risk Management 2007:3 (5) 717-723
20. Wilder-Smith CH, Hill L, Spargo K e.a. Treatment of severe pain from osteoarthritis with slow-release Tramadol or dihydrocodeine in combination with NSAIDs: a randomized study comparing analgesia, antiniciception and gastrointestinal effects. Pain, 2001, 91:32-31
21. Zhang W, Doherty M, Arden N, Bannwarth B e.a. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). // Ann Rheum Dis. 2005 May; 64(5):669-81. Epub 2004 Oct 7ЗАЛДИАР (ТРАМАДОЛ/АЦЕТАМИНОФЕН) В ЛЕЧЕНИИ ХРОНИЧЕСКОЙ БОЛИ ПРИ ОСТЕОАРТРОЗЕ.
Л.П.Ананьева, Старовойтова М.Н., Десинова О.В., Д.А.Гукасян, Л.Н.Денисов Институт ревматологии РАМН (Директор - академик РАМН Насонов Е.Л.), 2005 год
В открытое однофазное проспективное исследование было включено 30 больных, подписавших информированное согласие. Средний возраст пациентов колебался от 45 до 80 лет, в среднем 62 ± 10, преобладали женщины - 29 человек, и один мужчина. У большинства больных была третья (66%) или четвертая (13%) рентгенологическая стадия артроза (по Келлгрену). Повышение индекса массы тела отмечено у большинства больных, среднее значение индекса массы тела составило 31,3± 6,9 кг. У 75% больных имелись сопутствующие заболевания, от 1 до 5 (чаще всего артериальная гипертензия) у одного больного.
Результаты
Испытание закончили 26 больных. По оценке врача отличный эффект отмечен у 3,3% больных, хороший - у 60%, удовлетворительный - у 26,7%, не было эффекта - у 15,7%. По оценке больных хороший эффект отметили 63,3% больных, удовлетворительный - 26,6 %, без эффекта-6,6%, ухудшение-3,3% (у одной больной при развитии нежелательной реакции значительной выраженности). Таким образом, и по оценке врача, и по оценке больного лечение у многих было эффективным - в 86,7- 89,9% случаев.. Положительная динамика боли и ограничения подвижности по шкале WOMAC (в мм) приведены на рисунке 1 и положительная динамика затруднений в выполнении повседневной деятельности (по шкале WOMAC, в мм) - на рисунке 2.В сутки, в среднем, больные принимали по 3 таблетки Залдиара, при этом средняя суточная доза трамадола составила 131 мг и парацетамола -1137 мг. Отмечено нарастание эффекта от лечения к концу исследования, при этом суточная доза Залдиара не увеличилась. Более того, отмечена тенденция к снижению суточной дозы Залдиара к концу исследования (рис.3). Ни один больной не использовал дополнительно другие аналгетики.
| Апрель 2008 г. |