Опубликовано в журнале:
«ЖУРНАЛ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ»; 2005; 45; 1259-1267Фармакокинетика длительно-действующего налтрексона у больных с незначительным или умеренным нарушением функций печени
Райан 3. Тёрнклифф,1* Джой Л. Дунбар,1 Гунъ Минг Донг,1 Бернард. Л. Силверман,1 Элиот У. Эрлих,1 Стейси С. Дилзер,2 Кеннет С. Лассетер2
1 Alkermes Inc., Кембридж, США;2 SFBC International, Майами, СШАДлительно-действующий налтрексон - это лекарственная форма с длительным высвобождением активного компонента, разработанная для обеспечения непрерывного воздействия налтрексона в течение 1 месяца для лечения алкоголизма. Было изучено влияние незначительного или умеренного нарушения функций печени на фармакокинетику налтрексона после введения длительно-действующего налтрексона 190 мг. В исследование были включены пациенты со слабым или умеренным нарушением функций печени (соотв. степени А или В по Чайлду-Пью) (по б человек в группе) и 13 здоровых добровльцев с близкими демографическими характеристиками (контроль). В течение 63 дней после однократного внутримышечного введения длительно-действующего налтрексона измеряли концентрации в плазме крови налтрексона и бβ-налтрексола. У всех участников налтрексон и бβ-налтрексол обнаруживались в плазме крови в течение 28 дней. Уровень системного воздействия (AUC0-∞) налтрексона и бβ-налтрексола во всех группах пациентов и здоровых людей был одинаков. Длительный Т1/2 налтрексона и бβ-налтрексола (5-8 дней) обусловлены медленным высвобождением налтрексона из лекарственной формы (выведение длительно-действующего налтрексона ограничивается скоростью всасывания и характеризуется кинетикой типа “флип-флоп”); у больных с нарушением функций печени выведение препарата не изменено. Исходя из этих данных, для больных с незначительным или умеренным нарушением функций печени коррекции дозы длительно-действующего налтрексона не требуется.
Злоупотребление алкоголем является серьезной проблемой здравоохранения и в мировом масштабе стоит на 4-м месте среди причин инвалидности.1 Алкоголизмом страдают примерно 4% взрослого населения,2 он часто наблюдается у пациентов первичного звена здравоохранения3,4 и может вносить вклад более чем в 100 ООО предотвратимых случаев гибели людей в год.5 Опиоидный антагонист налтрексон ослабляет подкрепляющий эмоциональный и поведенческий эффект алкоголя.6,7 Хотя пероральный налтрексон эффективен для поддерживающей терапии алкоголизма и опиатной наркомании, его существенным недостатком является плохое соблюдение пациентами схемы ежедневного приема препарата.8,9
Длительно-действующий налтрексон (Нал-LA) - это лекарственная форма с длительным высвобождением активного компонента, предназначенная для поддержания терапевтической концентрации налтрексона в плазме крови в течение примерно 1 месяца после внутримышечной (в/м) инъекции, что устраняет необходимость ежедневного перорального приема препарата. Нал-LA представляет собой микросферы из биорасщепляемой полимерной матрицы полилактида-ко-гликолида (PLG), в которые помещен налтрексон. После инъекции налтрексон высвобождается из микросфер путем диффузии и в результате разрушения полимера PLG, которое происходит в течение нескольких недель.10
Поскольку печень играет важную роль в выведении веществ из организма, то заболевания или нарушение функций печени могут изменять фармакокинетику лекарств.11 У 10-35% сильно пьющих людей развивается алкогольный гепатит, а у 10-20% - цирроз печени.12 Поэтому важно понимать влияние заболеваний печени на фармакокинетику налтрексона.
У здоровых людей фармакокинетика налтрексона при его ежедневном пероральном приеме характеризуется быстрым и почти полным всасыванием, значительным захватом в печени при первом проходе и выведением через почки самого налтрексона, его основного метаболита бβ-налтрексола и других, несущественных метаболитов.13,14 Биодоступность после перорального приема колеблется в пределах 5-40%.15,16 После перорального приема 50 мг налтрексона концентрация вещества падала ниже порога измерения примерно через 8 часов. При этом клиренс вещества был высоким (-50 л/час) и примерно соответствовал кровотоку через печень.15 Налтрексон активно метаболизируется до бβ-налтрексола, концентрация которого после перорального приема налтрексона обычно в 10-30 раз выше концентрации исходного вещества.15,17 бβ-налтрексол биологически активен, но его активность в разных моделях у животных in vivo составляет от 1/12 до 1/85 от активности налтрексона.18 Роль бβ-налтрексола в терапевтическом эффекте налтрексона при лечении алкоголизма не ясна.
Bertolotti et al.19 изучали фармакокинетику налтрексона после однократного перорального приема 100 мг больными с компенсированным (степени А или В по Чайлду-Пью) или декомпенсированным (степени С) заболеванием печени. У этих больных системная биодоступность налтрексона была значительно выше, чем у здоровых людей (у больных с компенсированным заболеванием - в 4 раза, у больных с декомпенсированным заболеванием - в 8 раз). Уровень системного воздействия бβ-налтрексола у больных существенно не отличался от контроля, хотя максимальная концентрация этого метаболита достигалась позже, чем у здоровых людей. С увеличением тяжести заболевания отношение концентраций метаболита и исходного вещества снижалось, но время полувыведения метаболита и исходного вещества у больных и у здоровых людей не отличались.19
В недавно проведенном клиническом исследовании с участием сильно пьющих пациентов Нал-LA в сочетании с психосоциальной терапией значительно ослаблял потребление алкоголя в течение всех 6 месяцев лечения.20 Фармакокинетика Нал-LA после однократного и многократного введения здоровым добровольцам описана ранее.21 В данном исследовании оценивалась фармакокинетика и безопасность однократного в/м введения Нал-LA больным со слабым или умеренным нарушением функций печени и здоровым людям со сходными демографическими характеристиками.
Методы
Схема исследования
Это было открытое исследование с параллельным участием групп, спланированное для изучения фармакокинетики Нал-LA у больных со слабым или умеренным нарушением функций печени в сравнении со здоровыми людьми. В исследование включали пациентов в возрасте от 18 до 70 лет со стабильным слабым (степени А по Чайлду-Пью) или умеренным (степени В по Чайлду-Пью) нарушением функций печени, вызванным алкогольным циррозом (по данным медицинского анамнеза и биопсии печени) и здоровых людей. В исследование не включали беременных женщин, людей с индексом массы тела >35 кг/м2, клиренсом креатинина <60 мл/мин, а также страдавших наркоманией или алкоголизмом в момент скрининга или получавших терапию опиатами.Здоровые добровольцы соответствовали больным с нарушением функций печени по показателям пола (1:1), возраста (± 5 лет) и веса тела (± 15%). Вначале в исследование были отобраны 6 больных со слабым нарушением функций печени (группа 1) и соответствующие им здоровые добровольцы (группа 2). После промежуточной оценки безопасности через 2 недели после введения Нал-LA участникам групп 1 и 2 были отобраны 6 больных с умеренным нарушением функций печени (группа 3) и соответствующие им здоровые добровольцы (группа 4). До включения в исследование все участники дали письменное информированное согласие на участие в исследовании и согласились выполнять его процедуры. Длительность участия в исследовании для всех участников составляла примерно 13 недель; исследование включало посещение клиники для скрининга, 4-дневное пребывание в клинике для скрининга, введения препарата и последующего контроля состояния пациента, а также 11 амбулаторных посещений. В ходе исследования безопасность оценивали по показателям жизненных функций, результатам врачебного осмотра, анализа функций печени, клинического и биохимического анализов крови, анализа мочи и оценки состояния участка инъекции, а также путем регистрации неблагоприятных явлений. Исследование было одобрено экспертной организацией Institutional Review Board, Inc. (Майами, США) и соответствовало принципам Хельсинской декларации. Исследование проводилось в одной клинике - SFBC International (Майами, США).
Все участники исследования получали однократную в/м инъекцию Нал-LA 190 мг глубоко в ягодичную мышцу. Образцы крови (по 4 мл) для анализа фармакокинетики собирали в полипропиленовые пробирки с ЭДТА в следующие сроки: до инъекции, через 1, 2, 4, 8, 12, 24, 36, 42, 48 и 72 часа и 5, 7, 14, 21, 28, 35, 42, 49, 56 и 63 дня после инъекции. Плазму крови отделяли центрифугированием (2000 об/мин в течение 15 мин при 4°С) и хранили при -20°С до анализа.
Методы анализа
Концентрации налтрексона и бβ-налтрексола измеряли проверенным методом анализа. Кратко, к 0,5-мл аликвоте образца добавляли внутренний стандарт налтрексона (до конечной концентрации -10 нг/мл), после чего смешивали с органическим растворителем в щелочных условиях. После центрифугирования верхний органический слой собирали, упаривали и перерастворяли в подвижной фазе. Аликвоту полученного раствора вводили в систему высокоэффективной жидкостной хроматографии/масс-спектрометрии SCIEX API 3000 LC-MS-MS. Измеряли площади пиков иона налтрексона m/z 342→324 и иона бβ-налтрексола m/z 344→326, которые сопоставляли с площадью пика иона внутреннего стандарта m/z 328→310. Площадь пика рассчитывали путем взвешенного линейного регрессионного анализа по методу наименьших квадратов с использованием калибровочных стандартов плазмы крови с добавлением налтрексона, приготовленных непосредственно перед каждой серией измерений. Хроматограмму формировали с помощью программы Mass Chrom, v. 1.1; данные обрабатывали по программе Analyst, V. 1.3.1 (Applied Biosystems/MDS SCIEX, Фостер Сити, США) для SCIEX 3000.Пригодность данного метода анализа была проверена для диапазона концентраций налтрексона 0,200-100 нг/мл и концентраций бβ-налтрексола 0,500-250 нг/мл. Правильность, определяемая как абсолютное отклонение измеренной концентрации от теоретической, при 3 уровнях концентраций налтрексона и бβ-налтрексола (низкой, средней, высокой) в контрольных образцах колебалась в пределах от 0,5% до 5,5%. Точность, определяемая как коэффициент вариации (в %) измеренных концентраций в контрольных образцах, для обоих веществ была меньше 12%.
Обработка и статистический анализ данных
В каждый срок сбора образцов крови рассчитывали средние концентрации налтрексона и бβ-налтрексола в плазме. Для этого расчета концентрацию меньше порога измерения принимали равной 0. Для каждого участника рассчитывали показатели фармакокинетики налтрексона и бβ-налтрексола в стандартной бескамерной модели. Максимальную концентрацию в плазме крови (Смакc) и время достижения Смакc (Тмакс) определяли непосредственно из кривой “ время-концентрация”. Площадь под кривой (ППК0-∞) рассчитывали методом построения трапеций до последнего измеренного значения плюс экстраполируемая площадь, определяемая как отношение последней измеренной концентрации к коэффициенту к, равному константе скорости терминального выведения, оцениваемой по линейному участку кривой “время-концентрация” в полулогарифмическом масштабе. Для всех участников, включенных в анализ, экстраполируемая площадь составляла <15%. Время полувыведения (Т1/2) рассчитывали как ln(2)/k. Примечание: из-за длительного высвобождения налтрексона из депо-участка величины к и Т1/2 отражают соотв. кажущуюся скорость терминального выведения и кажущееся время полувыведения. Отношение метаболит/исходное вещество рассчитывали как отношение AUC0-∞ этих веществ. Возможность анализа неполных комплектов фармакокинетических данных оценивали в индивидуальном порядке. Фармакокинетические расчеты проводили по программе WinNonlin Professional, v.4.1 (Pharsight Corp., Маунтейн Вью, США).Показатели фармакокинетики налтрексона и бβ-налтрексола у больных с нарушением функций печени и у здоровых добровольцев сравнивали путем дисперсионного анализа ANOVA, в котором функция печени являлась фиксированным параметром, а изучаемый показатель - переменным показателем. 4 группы участников в этом анализе считались независимыми выборками. Также был проведен дополнительный анализ для сравнения каждой из групп больных (со слабым или умеренным нарушением функций печени) с объединенной группой всех здоровых добровольцев. Для анализа проводили логарифмическую трансформацию величин Сmах, AUC0-∞ и Т1/2. Рассчитывали абсолютное различие показателей между группами и доверительные интервалы 90% (ДИ90%) вероятности этого значения. Полученные значения и их ДИ90% трансформировали из логарифмической шкалы обратно в линейную шкалу, и рассчитывали отношение показателей у больных со слабым или умеренным нарушением функций печени и у здоровых добровольцев. Помимо указанных выше показателей, рассчитывали отношение AUC0-∞ для бβ-налтрексола и налтрексона, и сравнивали величину этого отношения в разных группах участников исследования. Тmах в группах больных со слабым или умеренным нарушением функций печени и в соответствующих контрольных группах сравнивали непараметрическим методом суммы рангов Уилкоксона. Статистические расчеты проводили по программе SAS v.8.2 (SAS Institute, Кери, США).
Результаты
Демографические характеристики
Из 25 включенных в исследование участников 23 полностью прошли его, а 2 прекратили досрочно. Один здоровый доброволец из группы 4, вышедший из исследования до 7-го дня, был заменен. Второй участник из этой же группы вышел из исследования после дня 14 и не был заменен. Данные о Сmах и Тmах для этого участника были включены в статистический анализ. Демографические характеристики участников исследования суммированы в таблице 1.Таблица 1.
Демографические данные
Показатель Группа 1: слабое нарушение функций печени Группа 2: здоровые добровольцыa Группа 3: умеренное нарушение функций печени Группа 4: здоровые добровольцы6 Пол, n (%) мужчины 4(67) 4(67) 3 (50) 4(57) женщины 2 (33) 2 (33) 3 (50) 3 (43) Раса, n (%) южноевропейская 5 (83) 1(17) 3 (50) 1(14) латиноамериканская 1(17) 5 (83) 3 (50) 6 (86) Возраст(лет) среднее (SD) 58,2 (9,4) 58,0 (9,0) 55,0 (8,6) 51,7 (7,4) диапазон 51-76 47-73 47-71 43-67 Индекс массы тела (кг/м2) среднее (SD) 28,6 (5,6) 29,6 (3,7) 27,8 (4,7) 26,9 (2,1) диапазон 18-35 25-34 24-34 24-31 а соответствует группе
1 6 соответствует группе 3Фармакокинетика
Кривые зависимости концентраций налтрексона и бβ-налтрексола от времени для больных со слабым и умеренным нарушением функций печени представлены соотв. на рисунках 1 и 2. У всех участников налтрексон и бβ-налтрексол обнаруживались в плазме крови в течение 28 дней после введения, и у большинства участников концентрация этих веществ падала ниже предела измерения к 49 дню. Средняя концентрация налтрексона у больных со слабым нарушением функций печени была выше или такой же, как в соответствующей контрольной группе, а у больных с умеренным нарушением функций печени - меньше или такой же, как в соответствующей контрольной группе. В целом, форма кривой “время-концентрация” для бβ-налтрексола была такой же, как для налтрексона.
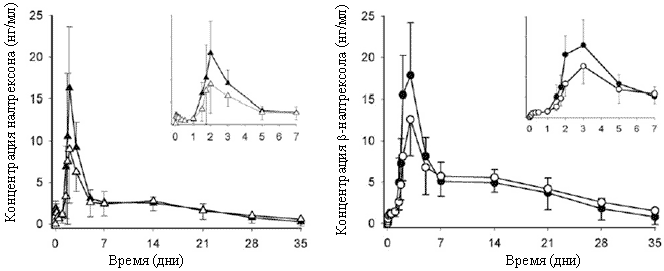
Рисунок 1. Изменение со временем концентрации налтрексона (слева) и бβ-налтрексола (справа) в плазме крови больных со слабым нарушением функций печени (черные символы) и у здоровых добровольцев (белые символы) после введения длительно-действующего налтрексона (Нал-LA) 190 мг. Врезка: ранние сроки (дни 0-7). Данные представлены как среднее и SD для n=6.

Рисунок 2. Изменение со временем концентрации налтрексона (слева) и бβ-налтрексола (справа) в плазме крови больных с умеренным нарушением функций печени (черные символы) и у здоровых добровольцев (белые символы) после введения длительно-действующего налтрексона (Нал-LA) 190 мг. Врезка: ранние сроки (дни 0-7). Данные представлены как среднее и SD для n=6.Показатели фармакокинетики налтрексона и бβ-налтрексола после введения Нал-LA в разных группах участников исследования суммированы в таблице 2. Разброс величин Сmах у здоровых добровольцев группы 2 и у больных с умеренным нарушением функций печени (группа 3) был больше, чем в группах 1 и 4. Уровень системного воздействия налтрексона (AUC0-∞) в разных группах участников исследования был одинаков. Индивидуальные значения Сmах и AUC0-∞ налтрексона в разных группах участников исследования представлены на рисунке 3. Средние значения Сmах бβ-налтрексола в разных группах различались так же, как Сmах налтрексона, a AUC0-∞ бβ-налтрексола в разных группах участников исследования была одинакова. Медиана Тmах и среднее Т1/2 для налтрексона и бβ-налтрексола в разных группах тоже были сходными. Во всех группах уровень системного воздействия бβ-налтрексола был в 2 раза (диапазон 1,86-2,34) выше уровня системного воздействия налтрексона.
Таблица 2.
Средние показатели фармакокинетики после однократного внутримышечного введения длительно-действующего налтрексона (190 мг) больным с нарушением функций печени и здоровым добровольцам
Показатель Группа 1: слабое нарушение функций печени Группа 2: здоровые добровольцыa Группа 3: умеренное нарушение функций печени Группа 4: здоровые добровольцы6 Налтрексон Сmах, нг/мл 16.3 ± 7.3 9.7 ±6.8 9.0 ±5.3
14.2 ±4.9 Тmах, дни 2.0 (2.0-3.0) 2.0 (1.8-14.0)
2.0 (1.5-2.0) 2.0 (1.8-2.0) AUC0-∞, нг х сут/мл 87 ±27 82±27 79 ±19 82 ± 20с Т1/2, дни 6.0 ±1.7 5.6 ±1.4 7.1 ±2.0 7.8 ± 1.7c б β-налтрексол Сmах, нг/мл 18.0 ±6.2 12.6 ±4.4 12.3 ±5.2
16.5 ±2.3 Тmах, дни 3.0 (2.0-3.0) 3.0 (З.0-З.0) 3.0 (2.0-14.0) 3.0 (З.0-З.0) AUC0-∞, нг х сут/мл 165 ±58 176 ±53 199 ±93
150 ± 28с Т1/2, дни 6.9 ±1.6 6.5 ±1.6 7.2 ±1.7 8.8 ± 5.4с Данные представлены как арифметическое среднее ± SD (n=6, если не указано иначе), за исключением Тmах, для которого представлена медиана. AUC0-∞ - площадь под кривой, экстраполированная в бесконечность; Сmах - максимальная концентрация в плазме крови; Тmах - время достижения Сmах; Т1/2 время полувыведения
а соответствует группе 1
6 соответствует группе 3
с n=5
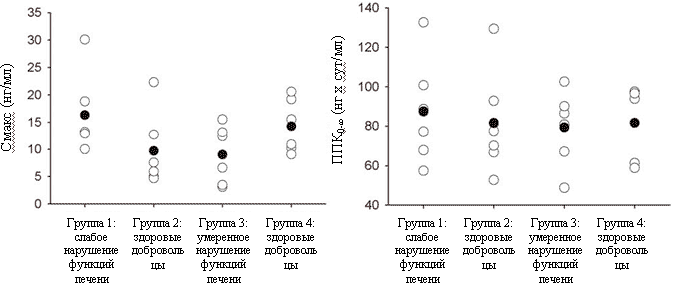
Рисунок 3.Индивидуальные (белые символы) и средние значения (черные символы) Сmах и AUC0-∞ после введения длительно-действующего налтрексона (Нал-LA) 190 мгСравнение показателей фармакокинетики налтрексона и бβ-налтрексола у больных с нарушением функций печени и у здоровых добровольцев приведено в таблице 3. По сравнению с соответствующими контрольными группами, у больных со слабым нарушением функций печени Сmах налтрексона была на 86% больше, а у больных с умеренным нарушением функций печени - на 45% меньше. Аналогичные результаты получены и для Сmах бβ-налтрексола. Нарушение функций печени, по-видимому, не влияло на AUC0-∞ налтрексона и (соотношение с контролем при слабом и умеренном нарушении функций печени соотв. 0,97 и 1,08). Хотя уровень системного воздействия бβ-налтрексола при слабом нарушении функций печени был таким же, как в контроле, у больных с умеренным нарушением функций печени этот показатель был повышен примерно на 20%. Соответственно, отношение AUC бβ-налтрексола и налтрексона при умеренном нарушении функций печени было на 26% выше, чем у здоровых добровольцев.
Таблица 3.
Сравнение показателей фармакокинетики у больных с нарушением функций печени и у здоровых добровольцев
Показатель Соотношение у больных и у здоровых людей
Слабое нарушение функций печени
Умеренное нарушение функций печени
Налтрексон Сmах, нг/мл 1.86 (1.1,3.2) 0.55 (0.3,0.9) AUC0-∞, нг х сут/мл 1.08 (0.8,1.4) 0.97 (0.7,1.3)а Тmах, дни6 -0.10 (0.92) -0.74 (0.46) Т1/2, дни 1.05 (0.8,1.4) 0.90 (0.7,1.2)а бβ-налтрексол Сmах, нг/мл 1.44 (1.0, 2.0) 0.70 (0.5, 1.0) AUC0-∞, нг х день/мл 0.93 (0.7,1.3) 1.22 (0.9,1.8)а Тmах, дни6 -1.23 (0.22) -0.69 (0.49) Т1/2, дни 1.06 (0.8,1.5) 0.91 (0.7,1.2)а бβ-налтрексол/ налтрексон соотношение AUC0-∞ 0.86 (0.6,1.1) 1.26 (0.9,1.7)а Данные представлены как отношение геометрических средних значений показателей у больных с нарушением функций печени у здоровых добровольцев с доверительными интервалами 90% вероятности (n=6 в группе, если не указано иначе)
а n = 5 для группы 4, здоровые добровольцы.
6 Для Тmах представлено значение Z в тесте Уилкоксона и величина Р для сравнения с контролемТакже был проведен дополнительный анализ для сравнения показателей фармакокинетики налтрексона и бβ-налтрексола у больных со слабым или умеренным нарушением функций печени и в объединенной группе всех здоровых добровольцев (данные не показаны). Результаты этого дополнительного анализа совпали с результатами основного анализа. Однако степень отличия величин Сmах и AUC0-∞ у больных с нарушением функций печени и в объединенной группе всех здоровых добровольцев была меньше, чем в основном анализе.
Безопасность
Длительно-действующий налтрексон в целом хорошо переносился всеми участниками исследования. У 12 из 25 участников зарегистрировано 17 неблагоприятных явлений (НЯ). Эти явления чаще развивались у больных со слабым (5 из 6) и умеренным (4 из 6) нарушением функций печени, чем у здоровых добровольцев (3 из 13). Большинство (13 из 17) НЯ были слабыми, и самым частым НЯ была головная боль (5 случаев).Ни в одной группе участников исследования не обнаружено тенденций или клинически значимых изменений средних значений или медианы лабораторных показателей (включая печеночные ферменты), показателей жизненных функций и ЭКГ по сравнению с исходными. У больных с умеренным нарушением функций печени средний уровень аланин-аминотрансферазы (AЛT) и аспартат-аминотрансферазы (ACT) через 28 дней после введения Нал-LA повысился по сравнению с исходным соотв. на 30,3 и 24 Ед/л. Это увеличение отражает в основном изменение у 2 больных, у которых уровни этих ферментов сильно колебались, что, вероятно, связано с наличием у них гепатита С и алкогольного цирроза печени.
Обсуждение
Данное исследование было спланировано для изучения фармакокинетики Нал-LA у больных со слабым и умеренным нарушением функций печени, так как у многих пациентов, страдающих алкоголизмом, наблюдается та или иная степень нарушения функций печени. Чтобы обеспечить одинаковое распределение участников разных групп по полу, возрасту и весу тела, здоровых добровольцев в это исследование включали после того, как отбирали больных с нарушением функций печени. Среди здоровых добровольцев (группы 2 и 4) по сравнению с больными с нарушением функций печени (группы 1 и 3) оказалось больше лиц латиноамериканского происхождения, но, судя по полученным результатам, расовые различия на влияют на фармакокинетику Нал-LA.После однократного введения Нал-LA 190 мг в плазме крови большинства участников исследования налтрексон обнаруживался более 30 дней. Концентрация бβ-налтрексола в плазме крови была примерно в 2 раза выше концентрации налтрексона. Величины Сmах налтрексона и бβ-налтрексола у больных со слабым нарушением функций печени были выше, а у больных с умеренным нарушением функций печени - ниже, чем в соответствующих контрольных группах. Биологическая причина такого различия неочевидна и легко не объяснима. Не исключено, что она может быть связана с высоким разбросом величин в небольшой выборке. Различие Сmах налтрексона и бβ-налтрексола в двух группах здоровых добровольцев было почти таким же, как различие этого показателя у здоровых добровольцев и у больных с нарушением функций печени (таблица 2). Это позволяет предположить, что наблюдаемое различие не обязательно обусловлено нарушением функций печени, но может быть следствием различия Сmах в разных группах людей.
На разброс величин Сmах налтрексона и на кажущееся удлинение Тmах бβ-налтрексола мог повлиять большой интервал между сроками сбора образцов крови. После перорального приема налтрексон быстро метаболизируется до бβ-налтрексола, Тmах которого близко или равно Тmах налтрексона.15,17,20 Поэтому истинное Тmах бβ-налтрексола после введения Нал-LA, вероятно, ближе к Тmах налтрексона, чем это наблюдалось в данном исследовании. Учитывая ограниченное количество образцов крови, собираемых в период 2-3 дня после введения препарата, можно предположить, что в момент истинного Тmах бβ-налтрексола образец не был собран.
Средний уровень системного воздействия налтрексона, оцениваемый по величине AUC0-∞, у больных с нарушением функций печени и у здоровых добровольцев был сопоставим. Этот результат противоречит ранее полученным данным для перорального налтрексона, согласно которым AUC налтрексона при нарушении функций печени была значительно увеличена.19 Заболевания печени могут снижать эффективность захвата в печени лекарств, в том числе налтрексона, при их первом проходе через печень; это может сопровождаться значительным повышением системной биодоступности препаратов после их перорального приема.11 В/м введение Нал-LA позволяет избежать захвата налтрексона при первом проходе через печень, поэтому, в отличие от перорального приема, после в/м введения Нал-LA системная биодоступность налтрексона не зависит от его метаболизма в печени.
Скорость захвата налтрексона в печени ограничивается только скоростью его поступления в печень,15 поэтому клиренс налтрексона чувствителен к изменению кровотока через печень.11 Однако, в отличие от перорального приема, введение препарата с длительным высвобождением налтрексона из полимерной матрицы приводит постепенному поступлению препарата в печень. В этом случае скорость захвата налтрексона в печени ограничивается скоростью его всасывания (кинетика по типу “флип-флоп”).21,22 Следовательно, снижение кровотока через печень может не приводить к изменению клиренса налтрексона. В данном исследовании снижение кровотока через печень, которое могло наблюдаться у больных с нарушением функций печени, было недостаточно для изменения клиренса и, следовательно, уровня системного воздействия налтрексона.
Влияние заболеваний печени на экспрессию и активность ферментов, участвующих в метаболизме налтрексона, не ясно. Хотя общепринято, что у больных с циррозом печени снижена активность альдегид-дегидрогеназы и некоторых ферментов системы цитохрома Р450 23 , ни один из этих ферментов не участвует в метаболизме налтрексона.24,25 Скорее, за стереоспецифичное восстановление налтрексона до бβ-налтрексола отвечают альдо-кеторедуктазы AKR1C1, AKR1C2 и AKR1C4, ранее называвшиеся дигидродиол-дегидрогеназами DD1, 2 и 4.24,26 До настоящего времени экспрессия этих ферментов у больных с нарушением функций печени не описана. Формирование глюкуронидных конъюгатов налтрексона и бβ-налтрексола вряд ли изменяется, так как у больных со слабым и умеренным нарушением функций печени глюкуронизация преимущественно сохраняется.23
Известное изменение содержания сывороточных белков у больных с нарушением функций печени11 вряд ли повлияет на клиренс налтрексона, так как этот препарат слабо связывается с белками плазмы крови (21%).27
Длительно-действующий налтрексон предназначен для лечения алкоголизма. Поскольку алкоголики часто имеют заболевания печени,28 то возможность нарушения фармакокинетики налтрексона являлась основанием для проведения данного исследования с участием больных со слабым и умеренным нарушением функций печени. Больных с тяжелым нарушением функций печени в исследование не включали в основном из-за того, что они имеют повышенный риск нарушения свертывания крови. 29
Длительно-действующий налтрексон был безопасен и хорошо переносился больными с незначительными и умеренным нарушением функций печени. Зарегистрированные неблагоприятные явления были сходны с теми, которые наблюдались после перорального приема налтрексона.16 Как указывалось выше, в/м введение Нал-LA позволяет избежать захвата налтрексона при его первом проходе через печень, который интенсивно происходит после перорального приема препарата. Поэтому накопление налтрексона в печени при в/м введении значительно меньше, чем при пероральном приеме (50 мг/сут, или 1500 мг/мес), что вносит дополнительный вклад в предотвращение гепатотоксического действия.
Таким образом, после однократного в/м введения длительно-действующего налтрексона препарат обнаруживается в плазме крови более 1 месяца; уровень системного воздействия (AUC) налтрексона и бβ-налтрексола у больных со слабым или умеренным нарушением функций печени и у здоровых добровольцев со сходными демографическими характеристиками был сопоставим. Сравнение других показателей фармакокинетики налтрексона и бβ-налтрексола у этих групп участников исследования не выявило каких-либо различий, имеющих клиническую значимость. В/м введение Нал-LA позволяет избежать метаболизма препарата при первом проходе через печень и увеличения системной биодоступности налтрексона, которое наблюдается при пероральном приеме препарата больными с нарушением функций печени. Исходя из результатов данного исследования, можно заключить, что фармакокинетика налтрексона после введения Нал-LA больным со слабым или умеренным нарушением функций печени не изменяется.
ЛИТЕРАТУРА
1. Murray CJ, Lopez AD. Global and regional descriptive epidemiology of disability: incidence, prevalence, health expectancies, and years lived with disability. In:Murray CJ, Lopez AD, eds. The Global Burden of Disease: A Comprehensive Assessment of Mortality and Disability From Diseases, Injuries, and Risk Factors in 1990 and Projected to 2020. Boston: Harvard School of Public Health on behalf of the World Health Organization and the World Bank; 1996;201-246.
2. Grant BF, Dawson DA, Stinson FS, Chou SP, DufourMC, Pickering RP. The 12-month prevalence and trends in DSM-IV alcohol abuse and dependence: United States, 1991-1992 and 2001-2002. Drug Alcohol Depend. 2004;74:223-234.
3. O’Connor PG, Schottenfeld RS. Patients with alcohol problems. N Engl JMed. 1998;338:592-602.
4. Fleming MF, Barry KL, Manwell LB, .Johnson K, London R. Brief physician advice for problem alcohol drinkers: a randomized controlled trial in community-based primary care practices. JAMA. 1997;277:1039-1045.
5. McGinnis JM, Foege WH. Mortality and morbidity attributable to use of addictive substances in theUnited States. Proc AssocAmPhysicians. 1999;111:109-118.
6. O’Malley SS, Jaffe AJ, Chang G, Schottenfeld RS, Meyer RE, Rounsaville B. Naltrexone and coping skills therapy for alcohol dependence: a controlled study. Arch Gen Psychiatry. 1992;49:881-887.
7. Volpicelli JR, Alterman AI, Hayashida M, O’Brien CP. Naltrexone in the treatment of alcohol dependence. Arch Gen Psychiatry. 1992;49:876-880.
8. Volpicelli JR, Rhines КС, Rhines JS, Volpicelli LA, Alterman AI, O’Brien CP. Naltrexone and alcohol dependence: role of subject compliance. Arch Gen Psychiatry. 1997;54:737-742.
9.Weiss RD. Adherence to pharmacotherapy in patientswith alcohol and opioid dependence. Addiction. 2004;99:1382-1392.
10. Dean RL. The preclinical development ofmedisorb naltrexone, a once a month long acting injection, for the treatment of alcohol dependence. Front Biosci. 2005;10:643-655.
11. BrouwerKLR, Dukes GE, Powell JR. Influence of liver function on drug disposition. In: Evans WE, Schentag JL, JuskoWJ, eds. Applied Pharmacokinetics: Principles of Therapeutic Drug Monitoring. 3rd ed. Vancouver, Wash: Applied Therapeutics; 1992:6-1-6-59.
12. NIAAA Alcohol Alert No. 19.
13. Wall ME, Brine DR, Perez-Reyes M. Metabolism and disposition of naltrexone inman after oral and intravenous administration. Drug Metab Dispos. 1981;9:369-375.
14. Cone EJ, Gorodetzky CW, Yeh SY. The urinary excretion profile of naltrexone and metabolites in man. Drug Metab Dispos. 1974;2:506- 512.
15. Meyer MC, Straughn AB, Lo MW, Schary WL, Whitney CC. Bioequivalence, dose-proportionality, and pharmacokinetics of naltrexone after oral administration. JClin Psychiatry. 1984;45:15-19.
16. ReVia (naltrexone hydrochloride tablets) [package insert]. Wilmington, Del: DuPont Pharma; 1998.
17. MasonBJ,GoodmanAM, DixonRM, et al.Apharmacokinetic and pharmacodynamic drug interaction study of acamprosate and naltrexone. Neuropsychopharmacology. 2002;27:596-606.
18. Porter SJ, Somogyi AA, White JM. In vivo and in vitro potency studies of 6beta-naltrexol, the major human metabolite of naltrexone. Addict Biol. 2002;7:219-225.
19. Bertolotti M, Ferrari A, Vitale G, et al. Effect of liver cirrhosis on the systemic availability of naltrexone in humans. JHepatol. 1997;27:505-511.
20. Garbutt JC, Kranzler HR, O’Malley SS, et al. Efficacy and tolerability of long-acting injectable naltrexone for alcohol dependence: a randomized controlled trial. JAMA. 2005;293:1617-1625.
21. Dunbar JD, Turncliff RZ, Dong Q, Silverman BL, Ehrich EW, Lasseter КС. Single and multiple dose pharmacokinetics of long-acting naltrexone. Alcoholism: Clinical and Experimental Research. Submitted for publication.
22. Silber BM, Bialer M, Yacobi A. Pharmacokinetic/pharmacodynamic basis of controlled drug delivery. In: Robinson JR, Lee VH. eds. Controlled Drug Delivery Fundamentals and Applications. 2nd ed. New York: Marcel Dekker; 1987:213-251.
23. Elbekai RH, KorashyHM, El-Kadi AO. The effect of liver cirrhosis on the regulation and expression of drug metabolizing enzymes. Curr Drug Metab. 2004;5:157-167.
24. Ohara H,Miyabe Y, Deyashiki Y,Matsuura К, Hara A. Reduction of drug ketones by dihydrodiol dehydrogenases, carbonyl reductase and aldehyde reductase of human liver. Biochem Pharmacol. 1995;50:221-227.
25. Porter SJ, Somogyi AA, White JM. Kinetics and inhibition of the formation of 6beta-naltrexol from naltrexone in human liver cytosol. Br J Clin Pharmacol. 2000;50:465-471.
26. Breyer-Pfaff U, Nill K. Carbonyl reduction of naltrexone and dolasetron by oxidoreductases isolated from human liver cytosol. J Pharm Pharmacol. 2004;56:1601-1606.
27. Ludden TM, Malspeis L, Baggot JD, Sokoloski TD, Frank SG, Reuning RH.Tritiated naltrexone binding in plasma from several species and tissue distribution in mice. J Pharm Sci. 1976;65:712-716.
28. Yoon YH, Yi HY, Grant BF, Dufour MC. Surveillance Report #57: LiverCirrhosis Mortality in the United States, 1970-98. Bethesda,Md: National Institute on Alcohol Abuse and Alcoholism; 2001.
29.MammenEF. Coagulation defects in liver disease. Med Clin North Am. 1994;78:545-554.
| Сентябрь 2012 г. |