Опубликовано в журнале, Пульмонология, 3, 2008Оценка влияния фенспирида на некоторые показатели мукозального иммунитета при хронической обструктивной болезни легких ранней стадии
Г.Л.Игнатова, Л.А.Степанищева, Ю.О.Печенкина
Уральская государственная медицинская академия дополнительного образования, г. ЧелябинскEffects of fenspirid on some parameters of mucosal immunity in patients with early-stage chronic obstructive pulmonary disease
G.L.Ignatova, LA.Stepanishcheva, Yu.O.Pechenkina
Резюме
Цель исследования - определить влияние фенспирида на клинико-иммунологические характеристики заболевания у пациентов ХОБЛ ранних стадий. В исследовании участвовали мужчины - рабочие крупного машиностроительного предприятия г. Челябинска со впервые выявленной ХОБЛ 1-й и 2-й степеней в стабильном состоянии, которые методом случайной выборки были разделены на 2 группы: 30 человек получали фенспирид по 80 мг 2 раза в день в течение 6 месяцев, контрольная группа (n = 30) получала плацебо (глюконат кальция) 2 раза в день в течение 6 месяцев. Ежемесячно оценивали жалобы, выраженность кашля и одышки, количество мокроты, параметры функции внешнего дыхания, в слюне измеряли концентрацию конечных стабильных метаболитов оксида азота (NO) с помощью реакции Гриса, лактоферрина, интерлейкина-8 (IL-8), муцина с помощью иммуноферментного анализа. К концу лечения в группе фенспирида существенно уменьшилась бронхиальная обструкция (объем форсированного выдоха за 1-ю с (ОФВ1) увеличился с 57,42±1,66 до 61,93±2,59%; p<0,05), у пациентов контрольной группы изменения ОФВ1 были недостоверными. Клинический эффект (уменьшение кашля, мокроты, одышки, сухих хрипов в легких) отмечался у 26 (86,6%) больных, получавших фенспирид, и у 16 (53,3 %) пациентов группы плацебо. В группе фенспирида снизилась концентрация лактоферрина с 486,01±60,59 до 96,40±10,17 мкг/мл (p<0,05), IL-8 - с 111,7±16,68 до 41,90±6,60 мкг/мл (p<0,05), увеличилась концентрация белка муцина с 110,8±13,28 до 298,4±33,14 мкг/мл (p<0,05). Показатели NOχ снизились с 11,21±0,91 до 6,15±2,06 мкмоль/л (p<0,05). В группе плацебо динамика этих показателей недостоверна. Обострения ХОБЛ за период лечения развивались у 6 (20%) пациентов группы фенспирида и у 10 (33,3%) пациентов группы плацебо. Переносимость препарата в целом была хорошей. Таким образом, фенспирид обладает выраженным противовоспалительным действием, уменьшает выраженность клинических признаков ХОБЛ, повышает ОФВ1. Полученные данные свидетельствуют о целесообразности использования препарата в лечении больных ХОБЛ на ранних стадиях.Summary
The aim of this study was to evaluate influence of fenspirid on clinical and immune parameters of early-stage COPD. Workers (all were males) from a large machine-building enterprise of Chelyabinsk having stable COPD stage I or II participated in the study. They were randomized in 2 groups: 30 patients received fenspirid 80 mg b.i.d. and 30 patients received placebo (calcium gluconate) b.i.d. during 6 months. We assessed the patients' complaints, severity of cough and dyspnea, sputum volume, lung function parameters, measured saliva concentrations of final NO metabolites using the Griess reaction, lactoferrin, IL-8, and mucins using immune enzyme analysis. To the end of the treatment period, FEV1 significantly increased in the fenspirid group (from 57.42±1.66% до 61.93±2.59%; p<0.05) whereas it did not change significantly in the placebo group. Clinical improvement (reduction in cough, sputum volume, dyspnea, wheeze) was noted in 26 patients (86.6%) and 16 patients (53.3%), respectively. Lactoferrin concentration decreased from 486.01±60.59 to 96.40±10.17 μg ml-1 (p<0.05), IL-8 decreased from 111.7±16.68 to 41.90±6.60 μg ml-1 (p<0.05), mucin protein concentration increased from 110.8±13.28 to 298.4±33.14 μg ml-1 (p<0.05), NOχ decreased from 11.21±0.91 to 6.15±2.06 μmol L-1 (p<0.05). These parameters in the placebo group changed nonsignificantly. Exacerbations of COPD occurred in 6 patients (20%) of fenspirid group and 10 patients (33.3%) of the placebo group during the study period. Tolerance of the drug was generally good. Thus, fenspirid has significant antiinflammatory effect, improves clinical signs of COPD and FEV1. The results suggest that fenspirid could be useful in early-stage COPD patients.Хроническая обструктивная болезнь легких (ХОБЛ) является одной из актуальных проблем современного здравоохранения и одной из основных причин смерти от хронических заболеваний во всем мире [1,2]. Она оказывает существенное влияние на качество и продолжительность жизни пациентов. ХОБЛ наносит значительный ущерб, связанный с утратой трудоспособности, наиболее активной части населения [3].
Главным механизмом развития и прогрессирования ХОБЛ является хроническое воспаление. Как один из основных типовых процессов, воспаление это результат реакции на повреждающий агент, формирующий основные морфологические проявления болезни [2, 4]. Известно, что бронхиальная обструкция при ХОБЛ имеет необратимый и обратимый характер. Обратимый компонент бронхиальной обструкции связан с воспалением и характерным спазмом гладкой мускулатуры бронхов, отеком слизистой и гиперсекрецией слизи, возникающей под влиянием большого спектра провоспалительных медиаторов, таких как интерлейкин-8 (IL-8), фактор некроза опухоли ɑ, нейтрофильная протеаза и свободные радикалы [5]. Необратимый компонент бронхиальной обструкции определяется эмфиземой и перибронхиальным фиброзом, который неуклонно нарастает. Персистирующие микроорганизмы в бронхиальном дереве являются важным элементом в поддержании хронического воспаления [6, 7].
Изучение различных адаптационных механизмов, так или иначе участвующих в процессе пато- и саногенеза локального бронхолегочного иммунитета, требует изучения [8, 9]. Микробоцидный барьер слизистой оболочки респираторного тракта - важный компонент врожденного иммунитета, который формирует одну из наиболее эффективных линий микробной защиты. К веществам антиадгезивного действия, снижающим уровень колонизации патогенных микроорганизмов, относят муцин [10]. Его биосинтез осуществляется специальными экзокринными бокаловидным клетками с интроэпителиальным расположением. Муцин в составе вязкого геля растекается по поверхности слизистой оболочки, хорошо адсорбируя различные частицы (пыль, микроорганизмы), предотвращая их прикрепление к поверхности и внедрение в глубокие слои покровных тканей [11].
В последние годы изучена роль NO в патологии легких [12]. Показано, что оксид азота (NO), выделяемый эндотелиальными клетками, участвует в регуляции тонуса и структуры легочных сосудов [13]. Образованный макрофагами и эндотелиальными клетками NO способствует бронходилатации - преимущественно крупных бронхов [14]. Также NO участвует в антимикробной защите бронхиального дерева и регуляции цилиарного транспорта как необходимое звено для усиления биения ресничек [15].
Лактоферрин относят к белкам острой фазы; его изучение перспективно в области легочной патологии в качестве маркера активности воспаления, а также наступающих осложнений [16, 17]. Этот железосодержащий гликопротеин обладает способностью связывать ионы железа и другие металлы, чем можно объяснить его бактерицидное и антиэндотоксиновое действие [18]. В литературе имеются сведения, характеризующие лактоферрин как регулятор клеточных и гуморальных иммунологических реакций [19]. Все вышеперечисленные провоспалительные факторы мукозального иммунитета у лиц, страдающих ХОБЛ, являются маркерами воспаления с тенденцией к хронизации процесса.
Эффективность лечебных мер по прекращению прогрессирования ХОБЛ в полной мере зависит от возможностей лечения хронического воспаления. Классическая терапия ХОБЛ в настоящее время не располагает методами, способными тормозить прогрессирование болезни. Парадокс заключается в том, что из всего арсенала средств и методов главным является назначение бронходилататоров, не обладающих прямым противовоспалительным действием [2]. В глобальной инициативе GOLD пересмотра 2003 г. эксперты отмечают, что исследование клеточных и молекулярных механизмов воспаления для поиска лекарственных средств, способных тормозить хроническое воспаление, лежащее в основе ХОБЛ, - это одно из важнейших направлений исследований. Среди современных средств воздействия на аномальный воспалительный процесс при ХОБЛ особое место занимает препарат фенспирид (Эреспал).
Цель данного исследования - определить влияние фенспирида на клинико-иммунологические характеристики заболевания у пациентов с ХОБЛ на ранних стадиях.
Материалы и методы
В ходе анкетирования, проводимого в рамках программы "Профилактика и лечение бронхолегочной патологии у работников ОАО "Уралтрак-ЧТЗ", разработанной коллективом кафедры терапии, фтизиопульмонологии и профпатологии ГОУ ДПО УГМАДО и сотрудниками городской поликлиники № 8 ОАО ЧТЗ "Уралтрак" в 2002 г., были обследованы 2 584 рабочих крупного машиностроительного предприятия г. Челябинска.В данную работу из общего числа обследованных пациентов были включены мужчины с впервые выявленной ХОБЛ 1-й и 2-й стадий в стадии ремиссии, требующие амбулаторного лечения и профилактики дальнейшего прогрессирования заболевания. Методом случайной выборки испытуемые были разбиты на 2 группы. Пациентам 1-й, основной, группы (n=30) назначали фенспирид в дозе 80 мг 2 раза в день в течение 6 месяцев. Во 2-й группе - группе сравнения (n=30) - больные получали плацебо, в качестве которого принимался глюконат кальция по 1 таблетке 2 раза в день в течение 6 месяцев.
Критерии включения больных в исследование:
ежедневный кашель, часто с мокротой; бронхиальная обструкция, обратимость - не менее 12 %; функциональные признаки ХОБЛ (по данным спирографии): снижение отношения объема форсированного выдоха за 1-ю с к форсированной жизненной емкости легких (ОФВ1/ФЖЕЛ) - <70 % в период ремиссии заболевания трижды на протяжении года; отсутствие в анамнезе типичных приступов удушья и / или атопии; отсутствие других заболеваний, сопровождающихся одышкой и кашлем (бронхоэктатическая болезнь, туберкулез); получение информированного согласия пациента на участие в исследовании. Критерии исключения:
обострение хронических заболеваний, а также тяжелые формы сопутствующих заболеваний. В обеих группах проводимая предшествующая терапия (муколитики, редкий прием бронхолитиков) была малоэффективной, и у всех пациентов к началу лечения сохранялись клинические и лабораторные признаки заболевания вне обострения. Для оценки эффективности терапии в группах ежемесячно анализировались жалобы больного, осуществлялся общий осмотр (оценивалась выраженность кашля, одышки и количество отделяемой мокроты). Выраженность клинических симптомов заболевания оценивали в баллах [20].
Инструментальные и функциональные методы исследования
Исследование ФВД
Параметры функции внешнего дыхания (ФВД) регистрировались с помощью спирографа Microspiro-GP (Япония). После записи спирограммы определялись следующие показатели: пиковая скорость выдоха (ПСВ), ОФВ1, ФЖЕЛ, ОФВ1/ФЖЕЛ. Проводился бронходилатационный тест с применением 200-800 мкг сальбутамола и оценивалось его влияние на показатели кривой "поток-объем" и на показатель ОФВ1 [21]. Для расчета бронходилатационного ответа в соответствии с рекомендациями использовался параметр ОФВ1 [22].Исследование мукозального иммунитета
Уровень продукции эндогенного NO оценивали по концентрации конечных стабильных метаболитов NO в препарате слюны посредством реакции Гриса. Количественное определение общего белка и муцина слюны определялось по методу Э.Н.Коробейниковой (2002 г.), определение лактоферрина, IL-8 проводилось с помощью иммуноферментного анализа.Статистические методы
Статистическая обработка полученных результатов выполнена с помощью пакета программ Statistica 6.0 с расчетом среднего арифметического значения (М), ошибки среднего (m), критерия Стьюдента.Результаты и обсуждение
На момент включения в исследование сформированные группы не различались по анамнестическим и клиническим параметрам. Средний возраст участников составил 57,16±2,68 года в 1-й группе и 55,80±1,90 года во 2-й группе. К моменту окончания лечения в 1-й группе отмечено существенное уменьшение явлений бронхиальной обструкции, что выражалось в достоверном повышении значения ОФВ1 (с 76,42±1,66 до 83,33±2,59%; p<0,05). У пациентов 2-й группы была зарегистрирована тенденция к повышению ОФВ1 (с 78,27 ± 1,41 до 79,64 ± 2,79 %), как показано на рис. 1.
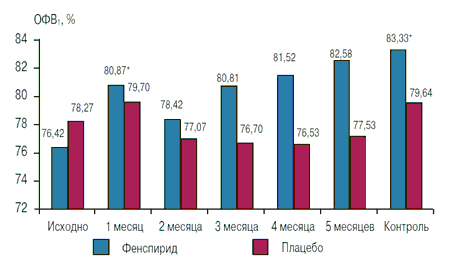
Рис. 1. Динамика ОФВ1 за время лечения в обеих группах
Примечание: * - p < 0,05 по сравнению с исходными показателями.
Следует отметить, что, в отличие от данных Е.И.Шмелева [2], в нашем исследовании отмечено повышение ОФВ1 сразу через 1 месяц от начала лечения (с 76,42±1,66 до 80,87±1,74%; p<0,05; затем, на 3-м месяце наблюдения, значение этого показателя уменьшается, но к концу 6-го месяца остается достоверно повышенным.
К моменту окончания лечения клинический эффект отмечался у 26 (86,6%) больных, получавших фенспирид, а также у 16 (53,3%) пациентов в группе плацебо, что проявлялось в уменьшении интенсивности кашля, уменьшении и/или прекращении отделения мокроты, выраженности одышки, в значительном уменьшении либо исчезновении сухих хрипов в легких. Клинический эффект лечения в группе, принимавшей плацебо, возможно, обусловлен интенсивной психологической работой с пациентами: ежемесячный осмотр, беседы о факторах, усугубляющих течение заболевания, вреде курения табака (рис. 2).
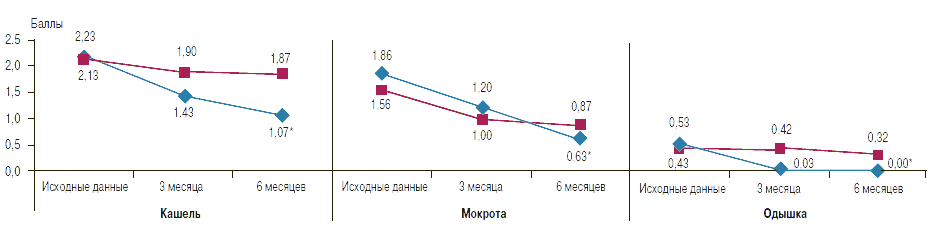
Рис. 2. Сравнительная динамика клинических показателей у больных ХОБЛ в группе фенспирида и контрольной группе: выраженность кашля, мокроты, одышки в баллах
Примечание: * - p< 0,05 в сравнении с исходными показателями.
Критериями оценки результатов мукозального иммунитета явились изменения изучаемых параметров слюны. В группе пациентов, принимавших фенспирид, снизилось количество лактоферрина с 486,01±60,59 мкг/мл в начале до 96,40±10,17 мкг/мл в конце терапии (p<0,05) и количество IL-8 с 111,7±16,68 до 41,90±6,60 мкг/мл соответственно (p<0,05). Количество белка муцина в данной группе увеличилось с 110,8±13,28 до 298,4±33,14 мкг/мл (p<0,05), как показано на рис. 3.
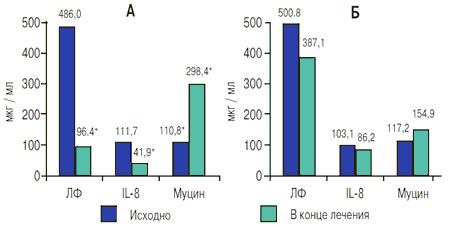
Рис. 3. Некоторые показатели мукозального иммунитета (лактоферрин, IL-8, муцин) в обеих группах (А - группа фенспирида, Б - контрольная группа) до и после лечения
Примечание: * - p <0,05 по сравнению с исходными показателями.
При измерении уровня эндогенного NO были отмечены снижение показателей NOχc 11,21±0,91 мкмоль/л в начале до 6,15±2,06 мкмоль/л в конце лечения (p<0,05) и лишь тенденция к изменению показателей конечных NO: уровень NO2 составил 7,28±0,42 и 4,07±1,76 мкмоль/л соответственно (p>0,05), количество NO3 изменилось соответственно с 9,96±0,77 до 5,02±0,42 мкмоль/л (p>0,05) - эти данные представлены на рис. 4.
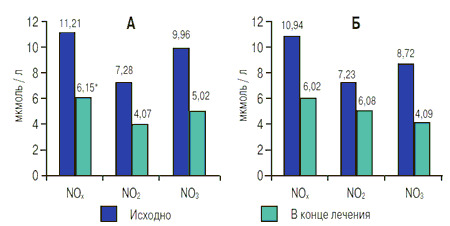
Рис. 4. Изменения показателей слюны (конечные стабильные метаболиты NO) в обеих группах (А - группа фенспирида, Б - контрольная группа) до и после лечения
Примечание: * - p <0,05 по сравнению с исходными данными.
В контрольной группе, получавшей плацебо, наблюдались тенденция к снижению лактоферрина с 500,8±60,93 до 387,1±31,87 мкг/мл (p>0,05), тенденция к увеличению муцина с 117,2±13,83 до 154,9±15,26 мкг/мл (p>0,05) и тенденция к уменьшению количества IL-8 с 103,1±17,39 до 86,2±21,5 мкг/мл (p>0,05) с начала к концу исследования соответственно (рис. 3).
Также была зарегистрирована тенденция к снижению показателей количества NO: NOχ - с 10,94±1,12 до 6,02±1,83 мкмоль/л (p>0,05), NO2 -с 7,23±0,46 до 5,08±0,42 мкмоль/л (p>0,05), NO3 - с 8,72±0,89 до 4,09±1,75 мкмоль/л (p>0,05), как показано на рис. 4.
Влияние терапии на обострения ХОБЛ
За время наблюдения в обеих группах были зарегистрированы случаи обострения ХОБЛ: в 1-й группе - у 6 (20%) пациентов, во 2-й - у 10 (33,3%) больных. Клиническими признаками обострения считались: усиление выраженности кашля, появление гнойной и слизисто-гнойной мокроты, усиление одышки, снижение показателей ОФВ1. Количество выданных листов нетрудоспособности составило в группах 2 (33,3%) и 7 (70%) соответственно. Надо отметить, что симптомы обострения заболевания в 1-й группе купировались быстрее, чем во 2-й группе, что в дальнейшем значительно сократило период нетрудоспособности.Общая переносимость терапии в группах была хорошей. В 1-й группе у 2 (6,6%) пациентов отмечались диспепсические расстройства, у 3 (10%) человек - сонливость, у 1 (3,3%) больного - чувство нехватки воздуха после приема препарата. Во 2-й группе 1 (3%) пациент жаловался на горечь во рту после приема препарата. Указанные нежелательные явления купировались симптоматическими средствами и прекратились после адаптации к препарату.
Таким образом, в результате проведенного исследования удалось установить, что при длительном лечении противовоспалительным препаратом фенспирид у больных ХОБЛ ранних стадий улучшается клиническая симптоматика, изменяются показатели секреторного иммунитета слюны: снижается уровень белков острой фазы (лактоферрина) и провоспалительных цитокинов (IL-8), повышается концентрация бактерицидных факторов слюны (белка муцина) и прослеживается тенденция к изменению уровня NO, способствующего бронходилатации в большей степени крупных бронхов. Отмечен достоверный рост значения ОФВ1.
Заключение
В связи с тем, что в период клинической ремиссии заболевания у пациентов с ХОБЛ выявляются признаки воспаления в бронхиальном дереве, противовоспалительная терапия должна быть обязательной составляющей в базовом лечении. Препарат фенспирид обладает выраженным противовоспалительным действием и, как следствие, уменьшает выраженность клинических признаков заболевания и достоверно увеличивает ОФВ1. Полученные данные свидетельствуют о целесообразности использования фенспирида в лечении больных ХОБЛ ранних стадий.Литература
1. Чучалин А.Г.(ред.). Хроническая обструктивная болезнь легких: Практ. рекомендации. М.: Атмосфера; 2003.
2. Шмелев Е.И. Хроническая обструктивная болезнь легких. М.; 2003.
3. Айсанов З.Р., Кокосов А.Н., Овчаренко С.И. и др. Хронические обструктивные болезни легких. Федеральная программа. Рус. мед. журн. 2001; 9 (1): 9-32.
4. Miravitlles M., Espinosa C., Fernandez-Laso E. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study group of bacterial infection in COPD. Chest 1999; 116 (1): 40-46.
5. Agusti A.G.N. COPD, a multicomponent disease: implications for management. Respir. Med. 2005; 99: 670-682.
6. Копьева Т.Н., Бармина Г.В., Свищев А.В, Макарова О.В. Морфология и патогенез хронического бронхита. Арх. пат. 1989; 7: 83.
7. Cole P., Wilson R. Host-microbal interrelationships in respiratory infection. Chest 1989; suppl.: 217-221.
8. Орлова Е.А. Клинико-диагностические исследования лактоферрина при неспецифических заболеваниях легких. Астрахань; 1996; т. 4: 97-100.
9. Степанищева Л.А. Клинико-иммунологические особенности хронической обструктивной болезни легких, стратификация риска и реабилитация рабочих машиностроительного предприятия: Автореф. дис. ... д-ра мед. наук. Самара; 2005.
10. Hill A.T., Bayley D., Stockley R..A. The interrelationship of sputum inflammatory markers in patients with chronic bronchitis. Am. J. Respir. Crit. Care Med. 1999; 160: 893-898.
11. Immunology. 7-th ed. / Male D., Brostoff J., Roth D.B. et.al. St. Louis: Mosby Elsevier; 2006. 163-181.
12. Andersson F., Borg S., Jansson S.A. et al. The costs of exacerbations in chronic obstructive pulmonary disease (COPD). Respir. Med. 2002; 96: 700-708.
13. Nijkamp F.P., Folkerts G. Nitric oxide and bronchial reactivity. Clin. Exp.Allergy. 1994; 24 (10): 905-914.
14. Kagan V.E., Gleiss B., Tyurina Y. et al. A role for oxidative stress in apoptosis: oxidation and externalization of phosphatidylserine is required for macrophage clearance of cells undergoing Fas - mediated apoptosis. J. Immunol. 2002; 169: 487-499.
15. Bhowmik A., Seemungal T.A.R., Sapsford R.J. et al. Relation of sputum inflammatory markers to symptoms and physiological changes at COPD exacerbations. Thorax 2000; 55: 114-200.
16. Сухарев А.Е., Николаев А.А., Васильев М.Ю. Уровень сывороточного лактоферрина в норме и при патологии. Вопр. мед. химии 1990; 3: 81-83.
17. Трубников Г.А. Иммунохимические маркеры воспаления и опухолей в клинической пульмонологии. Астрахань: изд-во АГМА; 2000.
18. Немцова Е.Р., Якубовская Р.И., Уткин М.М. Иммунохимическое сравнение лактоферрина женского молока и лактоферрина нейтрофилов. Вопр. мед. химии 1998; 3: 127-131.
19. Kolb E. Recent knowledge of the structure and function of lactoferrin. Z. Ges. Inn. Med. 1989; 44 (12): 345-350.
20. Borg G. Psychophisical bases of perceived exertion. Med. Sci. Sport Exerc. 1982; 14: 436-447.
21. Чучалин А.Г. Клинические рекомендации по хронической обструктивной болезни легких. М.: Колор Ит Студио; 2001.
22. Айсанов З.Р. Исследование респираторной функции. В кн.: Чучалин А.Г. (ред.). Клинические рекомендации. Хроническая обструктивная болезнь легких. М.: Атмосфера; 2003. 28-32.
| Ноябрь 2012 г. |