задержанных после драки в общежитии. . Самая свежая информация . . Как очень быстро похудеть . |
Опубликовано в журнале:
«ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ» 2007, № 11, с. 45-48Дофаминергическая терапия когнитивных нарушений
В.В. Захаров
Кафедра нервных болезней Московской медицинской академии им. И.М. СеченоваDophaminergic therapy of cognitive disturbances
V.V. Zakharov
Одной из наиболее хорошо зарекомендовавших себя стратегий терапии когнитивных нарушений является воздействие на церебральные нейротрасмиттерные системы. Применение ацетилхолинергических и глютаматергических препаратов является в настоящее время «золотым стандартом» лечения наиболее распространенных форм деменции [1—4, 8, 20, 22], хотя применение первых на стадии умеренных когнитивных нарушений пока дало противоречивые результаты [19—21]. Предполагают, что развитие ацетилхолинергической недостаточности является относительно поздним событием в патогенезе когнитивных расстройств и менее тяжелые нарушения в большей степени обусловлены дисфункцией со стороны других нейротрансмиттерных систем — дофаминергической, норадренергической, серотонинергической и др.
В связи с этим весьма интересны результаты исследований L. Backman и соавт., N. Volkow и соавт. [15, 30]. В цитируемых работах было показано, что в пожилом возрасте закономерно развивается легкая дофаминергическая недостаточность, о чем свидетельствует уменьшение биодоступности D2-рецепторов полосатых тел (по данным позитронно-эмиссионной томографии головного мозга). При этом прослеживается корреляция между указанными нейрохимическими изменениями и выраженностью когнитивных нарушений лобного типа, которые являются одним из основных и наиболее ранних признаков хронической сосудистой мозговой недостаточности [2, 4, 7, 12].
В основе данной корреляции вероятно лежит недостаточность дофаминергической активации лобных долей со стороны вентральной зоны покрышки среднего мозга (так называемый мезокортикальный дофаминергический путь).
К настоящему времени накоплен значительный клинический опыт применения дофаминергических препаратов при возрастной когнитивной дисфункции. Наиболее изученным препаратом является пирибедил, или проноран (фирма «Сервье»). Он совмещает свойства агониста дофаминовых D2/DЗ-рецепторов и блокатора пресинаптических а2-адренорецепторов. Применение пронорана способствует усилению не только дофаминергической, но и норадренергической медиации, что весьма выгодно с клинической точки зрения, так как активация норадренергической системы играет одну из ключевых ролей в процессе запоминания новой информации. Кроме того, по экспериментальным данным проноран обладает также положительным вазоактивным эффектом в отношении церебрального и периферического кровообращения, что также является преимуществом при использовании данного препарата у пациентов с хронической сосудистой мозговой недостаточностью [5, 6, 14, 15, 24, 27, 28].
В 70—80-х годах XX века в европейских странах проводилась серия плацебо-контролируемых клинических испытаний, в которых был показан положительный ноотропный эффект пронорана у пациентов с возрастной когнитивной дисфункцией, не достигающей выраженности деменции [14, 15, 27, 28]. При этом, по некоторым данным, эффективность пронорана превосходила эффективность монотерапии сосудистыми препаратами [28]. В 2001 г. эти результаты были воспроизведены в работе D. Nagaraia и соавт. [25], которые применяли проноран у пациентов с синдромом умеренных когнитивных нарушений. Было показано, что применение пронорана сопровождалось достоверно большим процентом улучшений когнитивных функций по Краткой шкале оценки психического статуса по сравнению с плацебо. Известно также, что на ранних стадиях болезни Паркинсона использование пронорана сопровождается не только улучшением двигательных, но и когнитивных функций [10].
Согласно требованиям доказательной медицины, проведение двойных слепых плацебо-контролируемых рандомизированных исследований является основным и абсолютно необходимым методом оценки эффективности ноотропных препаратов. Однако этот метод также имеет определенные ограничения, которые препятствуют «механическому» перенесению полученных результатов на повседневную клиническую практику. Как известно, отбор пациентов при проведении клинических исследований проводится по определенным критериям, которые, как правило, значительно ограничивают число сопутствующих заболеваний и применение прочих препаратов. Также не всегда просто интерпретировать практическое значение полученных в ходе рандомизированных исследований изменений психометрических шкал. В связи с этим целесообразен дополнительный анализ результатов применения того или иного препарата в условиях обычной клинической практики. При этом наряду с психометрическими [например «Краткой шкалой оценки психического состояния» (Mini-mental scale examination — MMSE)] используются шкалы типа шкалы «Общего клинического впечатления» (Clinical Global Impression — CGI). Последние предоставляют лечащему врачу значительную свободу в оценке практического значения проводимой терапии на основании всей совокупности изменений клинического статуса пациента. Применение таких шкал является общепринятым в мировой практике и настоятельно рекомендуется [23, 26] для применения в области когнитивной неврологии.
В 2005—2007 г. в России в рамках программы «Прометей» (координатор проекта — акад. РАМН Н.Н. Яхно) был проанализирован опыт применения пронорана в терапии возрастной когнитивной дисфункции в повседневной клинической практике. Результаты выполнения этой программы были опубликованы в целом ряде статей [6, 9, 14].
Данная публикация отражает раздел указанной программы, целью которого была оценка влияния препарата проноран на возрастные когнитивные нарушения при определении их выраженности разными методами. В этом случае сопоставляли данные психометрических шкал (MMSE) [18] и нейропсихологических тестов (тест рисования часов) [23], с одной стороны, и клинической шкалы (CGI) [27], с другой.
Материал и методы
В соответствии с указанной целью исследование было разделено на 2 части. В 1-й части для оценки эффективности терапии использовались психометрические (MMSE) и нейропсихологические тесты, а во 2-й части — шкала CGI.
В 1-й части был проведен анализ лечения 574 пациентов в возрасте от 60 до 89 лет (в среднем 69,5±5,5 года) с легкими или умеренными когнитивными нарушениями возрастного и/или сосудистого характера. Эти пациенты наблюдались в поликлиниках 33 городов из 30 регионов России. Наиболее частым клиническим диагнозом была дисциркуляторная энцефалопатия I или II стадии. В лечении и наблюдении за пациентами приняли участие 132 врача-невролога амбулаторного звена.
Проноран назначали в дозе 50 мг в сутки в 1 прием в течение 3 мес. Монотерапия данным препаратом проводилась 385 пациентам, а 189 пациентов получали проноран в сочетании с другими сосудистыми и метаболическими средствами. Оценка эффективности терапии проводилась на 6-й и на 12-й неделе лечения.
Во 2-й части был проведен анализ лечения 2058 пациентов (1447 женщин и 611 мужчин в возрасте от 50 до 94 лет, в среднем 64,9+8,3 года) с диагнозом дисциркуляторная энцефалопатия I или II стадии и легкими или умеренными когнитивными нарушениями. Данные пациенты наблюдались в поликлиниках 54 городов из 37 регионов России. В лечении и наблюдении за пациентами приняли участие 212 врачей-неврологов амбулаторного звена.
В этой группе проноран пациентам назначали в дозе 50 мг в сутки в 1 прием в течение 3 мес. Монотерапия этим препаратом проводилась 1181 пациенту, а 875 получали проноран в сочетании с другими сосудистыми и метаболическими средствами.
Оценка эффективности терапии в этих случаях также проводилась на 6-й и на 12-й неделе лечения. Различий по возрасту, полу и выраженности когнитивных расстройств между пациентами, получавшими мототерапию пронораном и политерапию в обеих группах не было.
По CGI лечащий врач до начала терапии, и далее на 6-й и 12-й дни оценивал общее состояние пациента на основании всей совокупности имеющейся симптоматики по 7-балльной шкале оценке «нет нарушений» соответствовал 1 балл, «незначительные» — 2, «легкие» — 3, «умеренные» — 4, «умеренно тяжелые» — 5, «тяжелые» — 6, «крайне тяжелые нарушения» — 7 (эти баллы далее см. на рисунке).
Кроме того, отмечалась степень влияния соответствующих нарушений на повседневную жизнь больных.
Как в 1-й, так и во 2-й частях исследования в анализ не включались пациенты в остром периоде инсульта, черепно-мозговой травмы, после оперативного вмешательства, с болезнью Паркинсона и синдромом паркинсонизма, с шизофренией, а также пациенты с тяжелыми речевыми, двигательными и чувствительными расстройствами.
Результаты и обсуждение
На фоне терапии пронораном было отмечено достоверное улучшение когнитивных функций. Так, средний результат по MMSE повысился с 26,0±1,0 до лечения до 27,9±3,5 балла на 12-й неделе лечения (p<0,05) (см. рисунок).
Распределение больных (в %) по показателям шкалы CGI до лечения, на 6-й и 12-й неделе терапии.
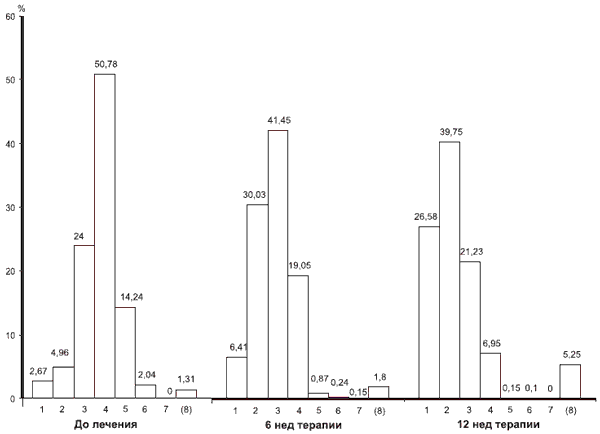
По оси ординат — процент больных, по оси абсцисс — баллы (1—7); (8) — нет данных.На фоне проводимой терапии достоверно уменьшилась также доля пациентов, допустивших существенные ошибки в тесте рисования часов. До лечения такие ошибки выявлялись у 48,6% пациентов, после лечения (на 12-й неделе) — лишь у 14,3% (p < 0,0001). При этом не было зафиксировано достоверных различий соответствующих показателей между группами, получавшими монотерапию пронораном и комбинированную терапию (более подробные данные по этим группам были опубликованы ранее [9]).
Улучшение когнитивного функционирования больных было отмечено и по шкале CGI. Если до лечения выраженность нарушений по данной шкале у большинства пациентов варьировала от легкой до умеренно тяжелой (3—5 баллов), то после лечения это были или умеренные либо незначительные (2—4 балла) расстройства. Отсутствие динамики зафиксировано у 170 пациентов, а отрицательная — только у 6. Распределение больных в соответствии с показателями шкалы CGI до лечения, на 6-й и 12-й неделе терапии приведено на рисунке.
Терапия пронораном характеризовалась удовлетворительным профилем безопасности и переносимости. Нежелательные явления отмечались у 15,4% пациентов. Наиболее распространенными из них были тошнота, головокружение, рвота, головная боль, повышенная сонливость, боли или дискомфорт в эпигастрии, диспепсия, общая слабость. Данные явления не угрожали жизни пациентов, не наносили непоправимого вреда здоровью и крайне редко (менее 1% случаев) вынуждали прекратить проводимую терапию. Несколько чаще нежелательные явления отмечались у пациентов, получавших комбинированную терапию, по сравнению с получавшими монотерапию пронораном (15 и 22% соответственно).
Таким образом, опыт практического применения пронорана в условиях повседневной амбулаторной неврологической практики согласуется с результатами опубликованных ранее плацебо-контролируемых рандомизированных клинических исследований.
Применение пронорана у пациентов с хронической сосудистой мозговой недостаточностью способствует регрессу выраженности когнитивных нарушений. При этом улучшение когнитивных функций фиксируется не только с помощью психометрических, но общих клинических шкал. Данный факт свидетельствует о практической значимости выявленного когнитивного улучшения, которое, по нашим наблюдениям, оказывает ощутимое положительное влияние на повседневную жизнь пациента, его поведение и самочувствие.
Сказанное дает основание утверждать, что терапия пронораном показана для лечения пациентов с недементными (легкими или умеренными) когнитивными нарушениями. Это имеет практическое значение, ибо на сегодняшний день отсутствует единый протокол ведения пациентов с когнитивными расстройствами, не достигающими стадии деменции [7, 9, 11, 12, 20], хотя распространенность недементных нарушений в пожилом возрасте значительно превышает частоту деменции [6, 16, 18]. При этом они, снижая качество жизни не только пациентов и их ближайших родственников, приносят социально-экономический ущерб обществу в целом. Поэтому раннее начало лечения когнитивных нарушений имеет большое значение и для профилактики деменции, так как пациенты с умеренными когнитивными нарушениями, представляют собой группу высокого риска ее развития в будущем (так, заболеваемость болезнью Альцгеймера в данной категории пациентов составляет 10-15% в год [25]).
Из изложенного видно, что дофаминергическая терапия может проводиться как самостоятельный вид лечения недементных когнитивных нарушений, так и в комплексе с традиционными сосудистыми и ноотропными препаратами. Важно, что проноран может сочетаться с другими ноотропными и сосудистыми препаратами, поскольку такое сочетание не приводит к увеличению частоты побочных эффектов. Вместе с тем следует обратить внимание на то, что в нашей работе не было получено различий по величине ноотропного эффекта между монотерапией пронораном и комбинацией данного препарата с другими сосудистыми и ноотропными лекарственными средствами. Это дает нам основание сделать вывод, что указанная комбинированная терапия не имеет в данном случае особых преимуществ в отношении коррекции когнитивных расстройств по сравнению с монотерапией пронораном.
Таким образом, проноран оказывает положительный ноотропный эффект при недементных (легких и умеренных) когнитивных нарушениях сосудистой этиологии. Данный эффект не фиксируется с помощью различных методов оценки нейропсихологических тестов и клинически ориентированных шкал, позволяющих оценить состояние больных в целом.
Эффективность в отношении когнитивных расстройств и удовлетворительный профиль переносимости и безопасности у пациентов пожилого возраста позволяет рекомендовать проноран для широкого клинического применения при дисциркуляторной энцефалопатии I и II стадии.
ЛИТЕРАТУРА
1. Гаврилова СИ. Фармакотерапия болезни Альцгеймера. М: Пульс 2003; 115.
2. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция. Под ред. Н.Н. Яхно. М 2002; 85.
3. Дамулин И.В., Преображенская И.С, Мхитарян Э.А. Влияние мемантина на когнитивные функции у пациентов с болезнью Альцгеймера, смешанной альцгеймеровско-сосудистой деменцией и деменцией с тельцами Леви. Неврол журн (приложение 1) 2005;11:37-41.
4. Захаров В.В., Яхно Н.Н. Нарушения памяти. М: ГеотарМед 2003;150.
5. Захаров В.В., Локшина А.Б. Применение препарата проноран (пирибедил) при легких когнитивных расстройствах у пожилых больных с дисциркуляторной энцефалопатией. Неврол журн 2004;2:30-35.
6. Захаров В.В. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей»). Неврол журн 2006;11:27-32.
7. Локшина А.Б. Захаров В.В. Легкие и умеренные когнитивные нарушения при дисциркуляторной энцефалопатии. Неврол журн (приложение 1) 2005;11:57-63.
8. Преображенская И.С. Экселон в терапии нейродегенеративных деменций. Неврол журн (приложение 1) 2005;11:42-46.
9. Преображенская И. С, Яхно Н.Н. Возрастная когнитивная дисфункция: диагностика и лечение. Журн неврол и психиат 2006;106:11:33-38.
10. Яхно Н.Н, Захаров В.В. Легкие когнитивные нарушения в пожилом возрасте. Неврол журн 2004;1:4-8.
11. Яхно Н.Н, Преображенская И. С. Проноран в лечении больных с ранними стадиями болезни Паркинсона. Неврол журн 2004;9:6:34-38.
12. Яхно Н.Н. Когнитивные расстройства в неврологической клинике. Неврол журн (приложение 1) 2005;11:4-12.
13. Яхно Н.Н, Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии. Клин геронтол 2005;11:38-39.
14. Яхно Н.Н, Захаров В.В., Локшина А.Б. Нарушение памяти и внимания в пожилом возрасте. Журн неврол и психиат 2006; 106:2: 58-62.
15. Backman L., Ginovart N., Dixon R. et al. Age-related cognitive deficits mediated by changes in the striatal dopamine system. Am J Psy-chiat 2000;157:635-637.
16. Bille J., Bukiwsky J.V., De Ferron A. et al. Decline cerebral et thera-peutique: une etude clinique multicenrique de Trivastal 50 retard en Neuro-Geriatrie. Psych Med 1986;18:609-626.
17. DiCarloA., Baldereschi M., Amaducci L. et al. Cognitive impairment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging. J Am Ger Soc 2000;48:775-782.
18. Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State: a practical guidefor grading the mental state of patients for the clinician. J Psych Res 1975;12:189-198.
19. Graham J.E., Rockwood K., Beattie E.L. et al Prevalence and severity of cognitive impairment with and without dementia in an elderly population. Lancet 1997;349:1793-1796.
20. Jelic V., Kivipelto M., Winblad B. Clinical trials in mild cognitive impairment: lessons for the future. J Neurol Neurosurg Psychiat 2006;77:7:892.
21. Knopman D.S. Current treatment of mild cognitive impairment and Alzheimer's disease. Curr Neurol Nerosci Rep 2006;6:5:365—371.
22. Kurshner H.S. Mild cognitive impairment: to treat or not to treat? Curr Neurol Neurosci Rep 2005;5:6:455—457.
23. Lovenstone S., Gauthier S. Management of dementia. London: Martin Dunitz 2001.
24. McLendon B.M., Doraiswang P.M. Defining meaningful changes in AD trials: the donepizil experience. J Ger Psych Neurol 1999;12:l:39-48.
25. Nagaraia D., Jayashree S. Randomised study of the dopamine receptor agonist piribedil in the treatment of mild cognitive impairment. Am J Psychiat 2001; 158:9:1517—1519.
26. PetersenR.S., Smith G.E., Waring S. С. et al. Aging, memory and mild cognitive impairment. Int J Psychogeriat 1997;9:37-43.
27. Reisberg B. Global measures: utility in defining and measuring treatment response in dementia. Int J Psychogeriat 2007; 19:3:421—456.
28. Scholing W.E. Controlled trial of trivasal retard 50 and comparision with trivasal 20 in the treatment of clinical and mental signs of neurovascular disease. Sci Med 1977;4:4-8.
29. Scholing W.E. A double-blind study using psychometric tests Trivastal versus a reference compound. Temp Med 1982; 114.
30. Volkow N., Wang G, Fowler J. et al. Parallel loss of presynaptic and postsynaptic dopamine markers in normal aging. Ann Neurol 1998;44:1:143—147.
| Октябрь 2012 г. |