Влияние снижения артериального давления на развитие гипертензивных очагов в белом веществе головного мозга у больных инсультом
Источник: C. Dufouil, J. Chalmers, O. Coskun, V. Besanon, M.-G. Bousser, P. Guillon, S. MacMahon, B. Mazoyer, B. Neal, M. Woodward, N. Tzourio-Mazoyer, C. Tzourio for the PROGRESS MRI substudy investigators. Effects of blood pressure lowering on cerebral white matter hyperintensities in patients with stroke the PROGRESS (Perindopril Protection Against Recurrent Stroke Study) magnetic resonance imaging substudy. Circulation. 2005;112:1644-1650
INSERM U708, Paris, France; The George Institute for International Health, Sydney, Australia; the UMR6194 CNRS-CEA, and Unite IRM, CHU de Caen, France; and the Service de Neurologie, Hopital Lariboisire, Paris, France.Предпосылки и цель исследования
Распространенность гиперинтенсивных очагов (ГИО) по данным МРТ головного мозга ассоциирована с наличием артериальной гипертензии, однако известно, что снижение артериального давления может остановить их прогрессирование. Ниже приводятся результаты дополнительного МРТ исследования в рамках клинического испытания PROGRESS, рандомизированного исследования гипотензивной терапии периндоприлом у больных цереброваскулярными заболеваниями.Методы и результаты
Дополнительное исследование включало 192 участника, которым проводилось МРТ головного мозга до включения и по прошествии среднего периода динамического наблюдения 36 мес. (стандартное отклонение 6 мес.). При первом МРТ ГИО были категоризованы по визуальной шкале от А (нет ГИО) да Г (выраженные ГИО). Участникам назначали комбинированную терапию периндоприлом и индапамидом (или их плацебо; 58%) или монотерапию периндоприлом (или плацебо). Ко времени проведения повторной МРТ в группе активного лечения снижение артериального давления составило 11,2 мм рт.ст. для систолического и 4,3 мм рт.ст. для диастолического артериального давления. Новые ГИО были выявлены при повторном МРТ у 24 (12,5%) участников. Риск развития новых ГИО был снижен на 43% (95% ДИ от -7% до 89%) в группе активного лечения периндоприлом по сравнению с плацебо-группой (р=0,17). Средний общий объем новых ГИО был достоверно снижен в группе активного лечения (0,4 мм3 [стандартная ошибка среднего 0,8]) по сравнению с плацебо-группой (2,0 мм3 [стандартная ошибка среднего 0,7]; р=0,012). Эти различия были наиболее значительны у больных с выраженными ГИО на момент включения, составляя 0,0 мм3 [стандартная ошибка среднего = 0] в группе активного лечения и 7,6 мм3 [стандартная ошибка среднего=1,0] в плацебо-группе (р<0,0001).Выводы
Результаты исследования свидетельствуют, что активная гипотензивная терапия, основанная на периндоприле, останавливает или замедляет прогрессирование ГИО у больных с цереброваскулярными заболеваниями.Ключевые слова: инсульт (stroke), цереброваскулярные заболевания (cerebrovascular disorders), магнитно-резонансная томография (magnetic resonance imaging), артериальная гипертензия (hypertension), клинические испытания (trials).
Гиперинтенсивные очаги в белом веществе (ГИО), к которым относятся как участки демиелинизации, так и немые инфаркты, часто выявляются при МРТ головного мозга у пожилых лиц [1-5] и у больных с инсультом [6-8]. ГИО ассоциированы с развитием когнитивных нарушений или деменции [4, 9-13], депрессии [14-16] и нарушений ходьбы [17, 18]. Помимо возраста, фактором риска развития ГИО являются сосудистые факторы, в частности повышение артериального давления [1, 2, 4]. Популяционные МРТ исследования распространенности ГИО показали наличие положительной линейной взаимосвязи между уровнем артериального давления и тяжестью ГИО [5, 19]. По данным этих исследований также очевидно, что у лиц с нелеченной артериальной гипертензией отмечается более высокая распространенность ГИО, чем у лиц без гипертензии или с леченной гипертензией.
Динамические МРТ исследования показали, что общее бремя ГИО может со временем увеличиваться, но никогда не уменьшаться [17, 20, 21]. К настоящему времени неизвестно, можно ли остановить или замедлить прогрессирование сосудистой энцефалопатии. Поскольку выявлена достоверная ассоциация между уровнем артериального давления и наличием ГИО, весьма вероятно, что снижение артериального давления снизит частоту возникновения ГИО, хотя ранее это никем не было продемонстрировано [8]. Для проверки данной гипотезы мы провели первое МРТ исследование ГИО в дополнительном исследовании в рамках рандомизированного клинического испытания гипотензивной терапии, а именно Клинического испытания периндоприла при повторном инсульте (PROGRESS) [22].
Методы
Структура исследования и участники
Структура клинического испытания PROGRESS описана ранее [22]. 6105 больных были включены в испытание в 172 центрах 10 стран с мая 1995 по ноябрь 1997 года. Участников включали, если в анамнезе у них были цереброваскулярные заболевания (инсульт или транзиторная ишемическая атака, но не субарахноидальное кровоизлияние) в течение предшествующих 5 лет. Кроме того, больных включали, если у них не было прямых показаний (например, застойной сердечной недостаточности) или противопоказаний к лечению ингибиторами АПФ. В качестве активного лечения назначали периндоприл (4 мг в сутки) с добавлением индапамида (2,5 мг в сутки), если ответственный исследователь считал, что у больного не было специфического показания либо противопоказания к назначению этого диуретика. Больные плацебо-группы получали таблетки, идентичные по внешнему виду препаратам активного лечения. Комбинированную (периндоприл и индапамид или двойное плацебо) терапию назначали для оптимизации снижения артериального давления, где это было необходимо.Дополнительное МРТ исследование в рамках клинического испытания PROGRESS было начато во Франции в 1995 году. Исследование было одобрено этическим комитетом Св. Антония, все пациенты подписали информированное согласие. Критериями исключения были наличие противопоказаний к проведению МРТ, в частности наличие искусственных клапанов сердца, клиппирования аневризм церебральных сосудов, попадание металлических инородных тел в параорбитальные пространства, наличие кохлеарных протезов, клаустрофобия. Для включение в мультицентровое испытание центр должен был иметь МР томограф и возможность передавать данные. Согласились участвовать 10 центров, которые соответствовали критериям включения. Из 332 больных (159 из плацебо-группы и 163 из группы активного лечения), рандомизированных в 10 центрах, 281 (71%) выразили добровольное желание участвовать (141 в плацебо-группе и 140 в группе активного лечения, 9 из них умерло до проведения МРТ, а 18 соответствовали одному из критериев исключения (см. рисунок 1).
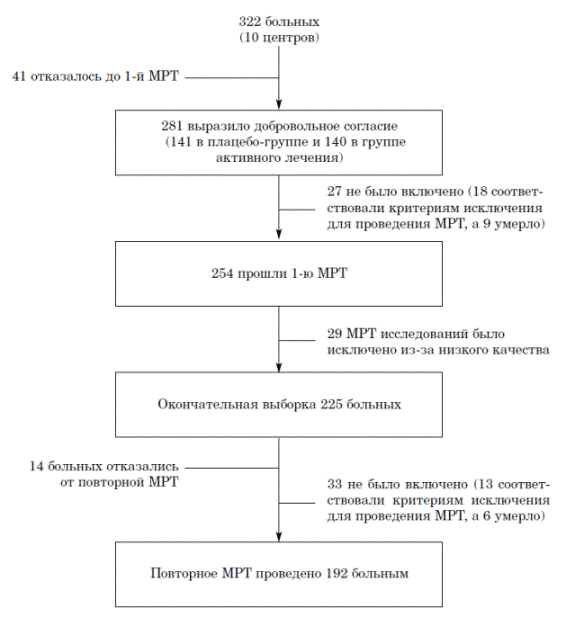
Рис. 1. Динамика по участникам дополнительного МРТ исследования в рамках клинического испытания PROGRESS
Оставшимся 254 больным (131 в плацебо-группе и 123 в группе активного лечения) было проведено первое МРТ исследование в течение первых 6 мес. после рандомизации. Среди них 29 МРТ исследований не было проанализировано из-за плохого качества, поэтому окончательная выборка больных включала 225 человек (116 в плацебо-группе и 109 в группе активного лечения). Рандомизированные больные, которым не было проведено МРТ исследования (n=97) были старше (средний возраст 64 лет [стандартное отклонение 11 лет ]) по сравнению с включенными больными (60,4 лет [стандартное отклонение 10,8 лет]), и среди них чаще встречались женщины (377,5% и 22,1%, р=0,007), чем среди тех, кто стали участниками. Эти две группы достоверно не отличались по принадлежности к исследуемым группам (44,2% из тех, кто не стал участвовать, и 51,6% из тех, кто стал, получали плацебо, р=0,23; 59,6 и 50,9% из тех, кто не стал и стал участвовать соответственно, получали гипотензивную терапию, р=0,14). Сходные различия были выявлены среди 192 больных, которые прошли оба МРТ исследования по сравнению со 130 больными, которые их не прошли.
Второе МРТ исследование проводилось до окончания периода динамического наблюдения, в среднем через 3 года после первой МРТ (от 24 до 49 мес.). Процент больных, прошедших динамическое наблюдение, составил 86% (192 больных). Среди 33 больных, которым повторная МРТ не была проведена, 14 отказались, 13 соответствовали одному критерию исключения для проведении МРТ, а 6 умерло (см. рисунок 1). Лица, не прошедшие повторного МРТ (n=33), были в среднем, старше (средний возраст 68,9 лет [стандартное отклонение 9 лет] и 59 лет [стандартное отклонение 10,4 года], р<0,001), и чаще у них отмечались выраженные ГИО на первой МРТ (48,5 и 14% соответственно, p<0,001), чем больные, которые прошли повторную МРТ (n=192). В обеих группах распределение по полу, исходным уровням артериального давления и виду принимаемого лечения было одинаковым. Процент больных, прошедших динамическое наблюдение, был несколько выше в плацебо-группе (89%), чем в группе активного лечения (82%), однако различия были недостоверными (р=0,14). На каждом этапе исследования частота отказов и выбываний достоверно не отличалась между группой активного лечения и плацебо-группой.
Магнитно-резонансное исследование
Первое МРТ исследование было проведено при силе магнитного поля 1 Тесла в 5 центрах и 1,5 Тесла в 5 других центрах. Последующие процедуры проводились после визитов группы МРТ-координаторов в каждый центр.Поскольку основной целью настоящего исследования было оценить динамическое МРТ для оценки выраженности ГИО, была необходима специальная процедура для уверенности в том, что условия интерпретации снимков одниковы при первой и повторной МРТ по каждому отдельно взятому больному. Этапы данной процедуры были следующими: 1) объем, полученный на Т2-взвешенных повторных снимках сопоставлялся с объемом, полученным при первом исследовании с помощью алгоритма автоматической регистрации снимков [23]; 2)далее к двум объемам, полученным на Т2-взвешенных снимках, применялась уравнительная гистограмма, что было необходимо для оценки сопоставимости характеристик снимка по интенсивности сигнала; 3) затем был разработан графический интерфейс, удобный для пользователя персонального компьютера, который позволял нейрорентгенологу визуализировать один за другим срезы, полученные при первичном и при повторном МРТ исследовании (см. рисунок 2).
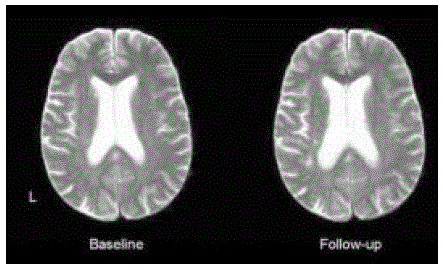
Рис. 2. Иллюстрация методики, использованной для оценки МРТ
Слева на рисунке аксиальный Т2-взвешенный снимок, полученный при первой МРТ у больного в ходе дополнительного МРТ исследования в рамках клинического испытания PROGRESS.
Справа снимок, полученный при повторной МРТ в рамках динамического наблюдения.С помощью методики регистрации и уравнительной гистограммы стало возможным провести повторное исследование при условиях, максимально сходных с таковыми при первой МРТ. Как показано на рисунке 2, это обеспечивало оптимальность сравнения результатов двух исследований одним нейрорентгенологом. Несмотря на небольшую утрату разрешающей способности на повторном снимке, было возможно визуализировать новые очаги вблизи заднего рога левого бокового желудочка.
Оценка выраженности ГИО
Оценка выраженности ГИО проводилась одним опытным нейрорентгенологом (ОС), которому не были известны ни клинические данные, ни принадлежность больных к группам. При первой МРТ магнитно-резонансные томограммы были оценены визуально на предмет наличия ГИО с помощью модифицированной версии шкалы валидации [5, 24]. Согласно этой шкале ГИО классифицировались на 4 группы от А до Г следующим образом: А - нет очагов; Б (легкие ГИО) - глубинные ГИО <3 мм в диаметре или перивернтрикулярные очаги гиперинтенсивности <5 мм в диаметре; В (умеренные ГИО) - от 1 до 10 глубинны ГИО (от 4 до 10 мм в диаметре) или перивентрикулярные очаги гиперинтенсивности (от 6 до 10 мм в диаметре); Г (выраженные ГИО) - более 10 глубинных ГИО (от 4 до 10 мм в диаметре) или сливные глубинные ГИО, или перивентрикулярные очаги гиперинтенсивности >11 мм в диаметре.Ввиду ограниченного количества больных в ходе некоторых анализов мы объединяли категории Б и В и использовали шкалу из 3 категорий. Сравнивая исходные и динамические томограммы на одном и том же экране, нейрорентгенолог также определял наличие новых ГИО, которые появились после периода динамического наблюдения, объем которых был оценен после выделения конкретных ГИО на экране. Объем новых ГИО вычисляли, суммируя поверхности ГИО на последовательных Т2-взвешенных снимках, а в качестве третьего измерения использовали толщину среза. Наличие ранее имевшихся постинсультных рубцов оценивали в соответствии с их размерами (мелкие, среднего размера и крупные). Постинсультные изменения, ограниченные белым веществом, отличали от ГИО, поскольку они на Т1-взвешенных снимках были гипоинтенсивны. Объем постинсультных рубцов не включали в вычисления объема ранее имевшихся и новых ГИО.
Статистическая обработка
В анализ были включены все рандомизированные участники, которым было проведено два МРТ исследования (n=192). Для исходных сравнений мы использовали обычный метод хи-квадрат для категориальных переменных и метод ANOVA для оценки непрерывных переменных.Для оценки соотношения между лечением и наличием новых ГИО на повторной МРТ мы использовали логистическую регрессию. Для сравнения общего объема новых ГИО в плацебо-группе и группе активного лечения использовали метод ANCOVA. Как для логистической регрессии, так и для ANCOVA, анализ включал стандартизацию по полу, возрасту и принадлежности к центру. Также стандартизация проводилась по росту, виду инсульта, исходному уровню артериального давления, применению гипотензивной терапии, интервалу (мес.) между МРТ исследованиями, а также исходной выраженности ГИО. Для проверки гипотезы о том, что исходная выраженность ГИО может изменить соотношение между лечением и общим объемом новых ГИО, мы в рамках вышеуказанной модели дополнительно использовали категорию взаимодействия ГИО и лечения и оценили ее достоверностью. Поскольку взаимодействие было достоверным, мы провели стратифицированный анализ по исходной выраженности ГИО. Мы также изучали соотношение между лечением и возрастом, полом, принадлежностью к центру и видом инсульта. Поскольку распределение объемов ГИО было непараметрическим, мы для оценки достоверности использовали логарифмически трансформированные объемы ГИО. Все анализы проводились с помощью пакета статистических программ SAS версия 8.02 (Институт SAS инкорпорэйтед).
Результаты
В таблице 1 представлены данные по принадлежности к группам всех рандомизированных участников, которым было проведено две МРТ.Таблица 1.
Показатель Плацебо-группа (n=103) Группа активного лечения (n=89) p* Средний возраст, лет (СО) 60,7 (12,2) 60,9 (12,1) 0,89 Мужчин, % 77 75 0,67 Возраст при наиболее высоком уровне образования, лет (СО) 17,6 (5,9) 17,2 (4,5) 0,56 Средний рост, см (СО) 170,3 (9,0) 168,8 (7,3) 0,22 Среднее САД, мм рт.ст. (СО) 142,2 (19,7) 144,3 (20,0) 0,41 Средне ДАД, мм рт.ст. (СО) 87,8 (12,2) 88,2 (11,6) 0,79 Гипотензивная терапия (%) 51 48 0,52 Гипертензия, %+ 50 53 0,65 Курильщики, % 19 20 0,96 Диабет в анамнезе, % 15 16 0,97 Среднее количество употребляемого алкоголя в неделю (СО)# 6,6 (9,7) 5,5 (9,0) 0,37 Вид инсульта§ 0,65 Ишемический 73 77 Геморрагический 11 8 Транзиторная ишемическая атака 16 15
САД- систолическое артериальное давление,
ДАД- диастолическое артериальное давление
* Сравнение плацебо-группы и группы активного лечения проводилось с использованием критерия хи-квадрат для качественных переменных и t теста Стьюдента для количественных переменных.
+ Систолическое артериальное давление >160 мм рт.ст. или диастолическое артериальное давление >90 мм рт.ст.
# Количество раз употребления алкоголя
§ Определяющее (самое недавнее) сосудистое осложнение на момент включенияВозраст участников колебался в пределах от 35 до 85 лет, и примерно 75% из них были мужчины. На момент включения примерно половина больных получала гипотензивную терапию и у 52% больных отмечалась артериальная гипертензия. Достоверных различий между двумя лечебными группами по полу, возрасту и сосудистым факторам риска не было (см. таблицу 1). Если говорить о принадлежности к лечебным группам, 112 больных (58%) получали комбинированную терапию периндоприлом и индапамидом (или двойное плацебо) и 80 больных получали монотерапию периндоприлом (или моноплацебо). При первой МРТ ГИО не были выявлены у 42% больных, у 26% больных были легкие ГИО, у 13% - умеренные, а у 19% - выраженные ГИО (см. таблицу 2).
Таблица 2. Исходные МРТ характеристики в зависимости от принадлежности к лечебной группе
Характеристика Плацебо-группа (n=103) Группа активного лечения (n=89) p* Выраженность ГИО , % 0,21 Нет 38 47 Легкие 24 28 Умеренные 15 10 Выраженные 23 15 Размер постинсультного рубца, % 0,86 Нет 44 46 Мелкий 21 24 Средних размеров 18 16 Крупный 18 15
* Сравнение плацебо-группы и группы активного лечения проводилось с помощью критерия хи-квадрат.Постинсультный рубец был визуализирован при первой МРТ головного мозга у 55% больных. Среди больных с визуализированным постинсультным рубцом, у 41% он был мелким (<15 мм), у 30% - средних размеров и у 29% - крупным. Достоверных различий характеристик МРТ головного мозга у больных плацебо-группы и группы активного лечения не выявлено. Факторы, ассоциированные с исходной выраженностью ГИО для всей выборки показаны в таблице 3.
Таблица 3. Факторы, ассоциированные с исходной выраженностью ГИО
Фактор Исходная выраженность ГИО Нет (n=86) Низкая (n=53) Умеренные (n=26) Выраженые(N=27) p* Средний возраст, лет (СО) 55,9 (10,4) 59,7 (9,2) 61,1 (10,5) 65,5 (9,1) 0,0001 Мужчин, % 80 76 69 85 0,49 Средний рост, см (СО) 170,6 (7,8) 168,4 (9,0) 168,2 (8,2) 170,1 (8,3) 0,37 Возраст при наиболее высоком уровне образования, лет (СО) 18 17 19 17 0,13 Среднее САД, мм рт.ст. (СО) 136,0 (15,6) 144,6 (21,8) 146,6 (19,3) 149,3 (21,7) 0,003 Средне ДАД, мм рт.ст. (СО) 85,1 (10,8) 90,0 (13,4) 90,1 (10,8) 88,9 (12,9) 0,07 Гипотензивная терапия (%) 30 51 58 67 0,006 Курильщики, % 13 21 19 15 0,50 Диабет в анамнезе, % 13 6 27 22 0,04 Среднее количество употребляемого алкоголя в неделю (СО)# 4,9 (7,3) 7,2 (9,6) 5,7 (7,4) 6,2 (9,4) 0,48 Вид инсульта§ 0,64 Ишемический 44 27 15 14 Геморрагический 50 20 5 25 Транзиторная ишемическая атака 45 32 13 10
САД - систолическое артериальное давление,
ДАД - диастолическое артериальное давление
* Величинар при сопоставлении критерием хи-квадрат для количественных переменных и методом ANOVA для качественных переменных
# Количество раз употребления алкоголя
§ Определяющее (самое недавнее) сосудистое осложнение на момент включенияОтмечалось достоверное соотношение между увеличением возраста и выраженностью ГИО. Распространенность выраженных ГИО также была ассоциирована с применяемой терапией на момент включения и уровнем артериального давления на момент рандомизации. Среднее САД было на 13 мм рт.ст. выше в группе больных, у которых были выраженные ГИО, чем у больных с отсутствием ГИО на момент включения (см. таблицу 3).
Повторная МРТ была проведена, в среднем, через 36 мес. после включения (37 мес. для плацебо-группы и 36 мес. для группы активного лечения, р=0,1). Ко времени выполнения повторной МРТ степень снижения уровня артериального давления, как систолического, так и диастолического, была значительно большей по сравнению с таковой на момент включения в группе активного лечения, чем в плацебо группе. Средняя степень снижения систолического АД составила 12,5 мм рт.ст. (СО 22) в группе активного лечения по сравнению с таковой в плацебо-группе (1,3 мм рт.ст. (СО 20) (р=0,0004), а средняя степень снижения диастолического АД составила 8,2 (СО 12,3) в группе активного лечения по сравнению с 3,9 (СО 15,5) в плацебо-группе (р=0,04). Доля больных, продолжавших принимать рандомизированную терапию на момент проведения повторного МРТ исследования, составила 79% в группе активного лечения и 88% в плацебо-группе (р=0,42).
Во время динамического наблюдения у 24 больных возникли новые ГИО, у 16 (16%) в плацебо-группе и у 8 (9%) в группе активного лечения (р=0,17, см. таблицу 4).
Таблица 4. Наличие и объем новых ГИО в зависимости от принадлежности к лечебной группе
Характеристика Всего (n=192) Плацебо-группа (n=103) Группа активного лечения (n=89) Величина р Модель 1* Величина p Модель 2+ Новые ГИО, n (%) 24 (13) 16 (16) 8 (9) 0,17 0,10 Средний объем новых ГИО, мм3 (СО) 1,8 (0,5) 2,0 (0,7) 0,4 (0,8) 0,012 0,009 Объем новых ГИО в зависимости от исходной категоризации ГИО, мм3 (СО) Нет ГИО 0,05 (0,8) 0 0,09 (0,8) 0,76 0,81 Легкие и умеренные ГИО 1,2 (1,2) 1,3 (1,0) 0,9 (1,0) 0,58 0,71 Выраженные ГИО 6,5 (2,0) 7,6 (1,0) 0 <0,0001 <0,0001
* Величина p, полученная при проведении логистической регрессии для количественных переменных, и анализа ANCOVA со стандартизацией по полу, возрасту и принадлежности к центру.
+ Величина p, полученная при проведении логистической регрессии для количественных переменных, и анализа ANCOVA со стандартизацией по полу, возрасту, принадлежности к центру, росту, виду инсульта, исходному уровню артериального давления, приему гипотензивной терапии, интервалу (в мес.) между двумя МРТ исследованиями и исходной выраженности ГИО (где возможно).Исключение больных, у которых развился инсульт (n=20) в течение периода динамического наблюдения, не отразилось на характере результатов. Мы также провели отдельный анализ в зависимости от лечебной схемы (комбинация периндоприла и индапамида и монотерапии периндоприлом), и результаты в 2 подгруппах были сходными (данные не показаны). Взаимодействие между лечением и полом (р=0,83), возрастом (р=0,47), принадлежностью к центру (р=0,96) и видом инсульта (p=0,55) было недостоверным.
Обсуждение
В этом двойном слепом плацебо-контролируемом испытании комбинации ингибитора АПФ (периндоприла) и диуретика (индапамида) у пациентов с цереброваскулярными заболеваниями в анамнезе, в группе больных, получавших активное лечение, отмечался достоверно более низкий объем новых ГИО, чем у больных, получавших плацебо, за трехлетний период динамического наблюдения. Благоприятное влияние гипотензивной терапии сохранялось после стандартизации по ряду переменных, в частности полу, возрасту, типу инсульта, исходному уровню артериального давления и исходной выраженности ГИО. Мы также показали, что снижение риска развития новых ГИО в группе активного лечения по сравнению с плацебо-группой составило 43% (95% ДИ от -7 до 89%), хотя эти различия не достигли статистической достоверности (8/89 [9%] и 16/103 [15,5%], соответственно, р=0,17).Наличие ГИО тесно связано с наличием артериальной гипертензии [5, 19, 25], и результаты некоторых обсервационных исследований с крупными когортами больных говорят, что чем лучше поддается терапии гипертензия, тем меньше прогрессирует сосудистая энцефалопатия с развитием ГИО [5, 25]. Настоящее исследование, которое впервые в мире включало оценку при помощи МРТ в рамках рандомизированного клинического испытания, подтвердило, что прогрессирование сосудистой энцефалопатии можно приостановить посредством лечения больных с цереброваскулярными заболеваниями периндоприлом. Post hoc анализ также указывает на то, что наиболее выраженное благоприятное влияние гипотензивной терапии на прогрессирование ГИО наблюдалось в группе больных, у которых на момент включения в исследование ГИО были выраженными. Эти данные согласуются с результатами предыдущих исследований, в ходе которых было показано, что у больных с исходно более выраженными ГИО отмечается наиболее выраженное увеличение общего объема ГИО [6, 17, 20, 21, 26].
Настоящие результаты следует рассматривать с учетом ограничений силы данного исследования. В течение трехлетнего периода динамического наблюдения, у 24 из 192 больных развились новые ГИО (Соотношение, сходное с данными предыдущих работ [21]), однако относительно малая величина подгрупп негативно повлияла на возможность установить эффект лечения. Малочисленность выборок больных также не позволила нам точно оценить размер влияния вида терапии периндоприлом (монотерапия периндоприлом или в комбинации с индапамидом) и вида инсульта на возникновение ГИО или же объем новых ГИО [7, 27]. Что касается объема ГИО, мы в нашем протоколе решили измерять только объем новых ГИО. Мы также могли бы оценить и рост исходных ГИО, поскольку вклад этого процесса в увеличение общего объема ГИО очевиден. И хотя вопросы, которые будут поставлены в других исследованиях, будут несколько отличаться, возможность подобного анализа следует предусмотреть при проведении последующих исследований для повышения их статистиской силы, с помощью которой может быть установлен размер влияния лечения. В данной работе в ходе анализа объема новых ГИО, мы намеренно исключали больных, у которых постинсультные рубцы развились в течение периода динамического наблюдения, поскольку влияние лечения на инсульт могло маскировать влияние на развитие ГИО. Более того, из 20 больных, у которых инсульт развился в течение периода проведения исследования, новые ГИО развились лишь у 2-х человек, и исключение этих участников из анализа не повлияло на статистическую достоверность результатов. Отбор пациентов является наиболее важным ограничением в проведении настоящего исследования, поскольку больные, согласившиеся на участие в МРТ исследовании, были более здоровыми, чем больные, отказавшиеся участвовать. Эта погрешность отбора, которая характерна для МРТ исследований, не повлияла на равномерность распределения переменных в группе плацебо и группе активного лечения. Боле того, поскольку наиболее выраженный эффект лечения наблюдался у больных с наибольшей исходной выраженностью ГИО, то есть у больных, которые скорее бы отказались, чем согласились на участие, данная погрешность отбора возможно достаточно статична. Поэтому мы полагаем, что методика отбора больных не повлияла на валидность настоящих результатов, хотя могла повлиять на статистическую силу исследования.
Несмотря на ограничение по статистической силе, наше исследование имеет ряд преимуществ. Среди больных, включенных в центрах, 87% (281/332) согласилось участвовать в исследовании, а среди больных, которым была проведена первая МРТ, 93% (192/206) согласились на проведение повторного МРТ. В целом, несмотря на наличие умерших больных и больных, выбывших на основании критериев исключения, процент участия в исследовании составил 85% (192/225) в среднем по всем центрам. Исследование также имеет преимущества по методам, использованным для оценки объема ГИО. Ограничения визуального шкалирования выраженности ГИО, как и изменения ГИО со временем, активно обсуждались [28-30]. Мы использовали полуавтоматический метод выявления новых ГИО с измерением их объема. С особой тщательностью мы стандартизировали качество и условия интерпретации Т2-взвешенных снимков одних и тех же пациентов, полученных с интервалом в 3 года. Наконец, это дополнительное исследование обладает всеми преимуществами клинического испытания PROGRESS в плане высокого уровня сотрудничества больных и поддержания различий уровня артериального давления во времени.
Отбор больных, обсужденный выше, не дал возможности экстраполировать результаты этого дополнительного исследования на всех участников PROGRESS. Настоящее исследование показало, что у особой группы больных сдержать прогрессирование сосудистой энцефалопатии можно. Эти результаты требуют подтверждения в последующих клинических испытаниях, как например у больных, страдающих артериальной гипертензией, но не страдающих цереброваскулярными заболеваниями. Наши результаты помогут организовать подобные исследования в будущем, определить необходимое количество участников, длительность периода динамического наблюдения, особенности стратификации больных на основании выраженности ГИО и методы для оценки объема ГИО.
Благодарность
Клиническое испытание PROGRESS было профинансировано грантами Сервье, Национального совета по здравоохранению Новой Зеландии и Национальной ассоциации здравоохранения Австралии. Дополнительное МРТ исследование в рамках PROGRESS было проведено по соглашению INSERM (Institute National de la Santе et de la Recherche Mеdicale) и Сервье. Основное и дополнительное исследования были организованы не зависимыми от спонсоров исследователями. База данных МРТ велась UMR 6194 CNRS-CEA (Caen, Франция) под руководством профессора Б. Мазойе. Авторы входят в комиссию по публикациям дополнительного МРТ исследования в рамках клинического испытания PROGRESS, состав которой приводится ниже.Центры и руководители дополнительного МРТ исследования в рамках клинического испытания PROGRESS
Hopital d'Angers: Drs H. Brugeilles, P. Lejeune, C. Moreau (Neurology); Dr A. Pasco (Radiology). Hopital de Caen: Dr S. Iglesias, Professor F. Viader (Neurology); Dr JM. Constans, Professor P. Courtheoux (Radiology). Hopital de Grenoble: Dr A. Jaillard, Dr G. Besson, Professor M. Hommel (Neurology); Dr S. Grand, Professor J.F. Lebas (Radiology). Hopital de Lille: Dr C. Lucas, Professor D. Leys (Neurology); Dr X. Leclerc, Professor J.P. Pruvost (Radiology). Hopital de Maubeuge: Drs V. Neuville, T. Rosolacci (Neurology). Hopital de Meaux: Drs A. Ameri, F. Chedru (Neurology); Dr P. Borou (Radiology). H_pital de Nantes: Drs B. Guillon, G. Hinzelin, Professor Feve (Neurology); Drs E. Auffray, H. Desal, Professor De Kersaint-Gilly (Radiology). Hopital Saint Antoine and Lariboisi_re, Paris: Drs V. Biousse, K. Berthet, K. Vahedi, Professor M.G. Bousser (Neurology). H_pital Saint Antoine: Drs V. Bousson, C. Levy, L Brunereau, Professor J. Tubiana (Radiology). Hopital Tenon, Paris: Dr S. Alamovitch, Professor E. Roullet (Neurology). Hopital de Saint-Denis: Dr T. De Broucker (Neurology); Dr N. Gauthier, Stroh-Marcy (Radiology). H_pital de Valenciennes: Dr P. Dobbelaere (Radiology). Hopital des 15-20, Paris: Dr M.T. Iba-Zizen, Professor S. Cabanis (radiology).Литература
1. Bots M.L., van Swieten J.C., Breteler M., de Jong P.T.V.M., van Gijn J., Hofman A., Grobbee D.E. Cerebral white matter lesions and atherosclerosis in the Rotterdam Study. Lancet. 1993;341:1232-1237.
2. Breteler M., van Swieten J.C., Bots M.L., Grobbee D.E., Claus J.J., van den Hout J.H.W., van Harskamp F., Tanghe H.L.J., de Jong P.T.V.M., van Gijn J., Hofman A. Cerebral white matter lesions, vascular risk factors and cognitive function in a population-based study: the Rotterdam study. Neurology. 1994;44:1246-1252.
3. Lindgren A., Roijer A., Rudling O., Norrving B., Larsson E.M., Eskilsson J., Wallin L., Olsson B., Johansson B.B. Cerebral lesions on magnetic resonance imaging, heart disease, and vascular risk factors in subjects without stroke: a population-based study. Stroke. 1994;25:929-934.
4. Longstreth W.T., Manolio T.A., Arnold A., Burke G..L., Bryan N., Jungreis C.A., Enright P.L., O'Leary D., Fried L. Clinical correlates of white matter findings on cranial magnetic resonance imaging of 3301 elderly people: the Cardiovascular Health Study. Stroke. 1996;27:1274-1282.
5. Dufouil C., de Kersaint Gilly A., Besancon V., Levy C., Auffray E., Brunnereau L., Alperovitch A., Tzourio C. Longitudinal study of blood pressure and white matter hyper-intensities: the EVA MRI cohort. Neurology. 2001;56:921-926.
6. van Zagten M., Boiten J., Kessels F., Lodder J. Significant progression of white matter lesions and small deep (lacunar) infarcts in patients with stroke. Arch Neurol. 1996;53:650-655.
7. Miyao S., Takano A., Teramoto J., Takahashi A. Leukoaraiosis in relation to prognosis for patients with lacunar infarction. Stroke. 1992;23:1434-1438.
8. Inzitari D. Leukoaraiosis: an independent risk factor for stroke? Stroke. 2003;34:2067-2071.
9. Breteler M., van Amerongen N.M., van Swieten J.C., Claus J.J., Grobbee D.E., van Gijn J., Hofman A., van Harskamp F. Cognitive correlates of ventricular enlargement and cerebral white matter lesions on MRI: the Rotterdam Study. Stroke. 1994;25:1109-1115.
10. Bronge L., Wahlund L.O. White matter lesions in dementia: an MRI study on blood-brain barrier dysfunction. Dement Geriatr Cogn Disord. 2000;11:263-267.
11. Garde E., Mortensen E.L., Krabbe K., Rostrup E., Larsson H.B. Relation between age-related decline in intelligence and cerebral white-matter hyperintensities in healthy octogenarians: a longitudinal study. Lancet. 2000;356:628-634.
12. Koga H., Yuzuriha T., Yao H., Endo K., Hiejima S., Takashima Y., Sadanaga F., Matsumoto T., Uchino A., Ogomori K., Ichimiya A., Uchimura H., Tashiro N. Quantitative MRI findings and cognitive impairment among community dwelling elderly subjects. J Neurol Neurosurg Psychiatry. 2002;72:737-741.
13. Vermeer S.E., Prins N.D., den Heijer T., Hofman A., Koudstaal P.J., Breteler M.M.B. Silent brain infarcts and the risk of dementia and cognitive decline. N Engl J Med. 2003;348:1215-1222.
14. Videbech P. MRI findings in patients with affective disorder: a metaanalysis. Acta Psychiatr Scand. 1997;96:157-168.
15. Hickie I., Scott E., Wilhelm K., Brodaty H. Subcortical hyperintensities on magnetic resonance imaging in patients with severe depression: a longitudinal evaluation. Biol Psychiatry. 1997;42:367-374.
16. O'Brien J., Ames D., Chiu E., Schweitzer I., Desmond P., Tress B. Severe deep white matter lesions and outcome in elderly patients with major depressive disorder: follow up study. Br Med J. 1998;317:982-984.
17. Whitman G.T., Tang T., Lin A., Baloh R.W. A prospective study of cerebral white matter abnormalities in older people with gait dysfunction. Neurology. 2001;57:990-994.
18. Starr J.M., Leaper S.A., Murray A.D., Lemmon H.A., Staff R.T., Deary I.J., Whalley L.J. Brain white matter lesions detected by magnetic resonance imaging are associated with balance and gait speed. J Neurol Neurosurg Psychiatry. 2003;74:94-98.
19. Liao D.P., Cooper L., Cai J.W., Toole J.F., Bryan N.R., Hutchinson R.G., Tyroler H.A. Presence and severity of cerebral white matter lesions and hypertension, its treatment, and its control: the ARIC study. Stroke 1996;27:2262-2270.
20. Schmidt R., Enzinger C., Ropele S., Schmidt H., Fazekas F. Progression of cerebral white matter lesions: 6-year results of the Austrian Stroke Prevention Study. Lancet. 2003;361:2046-2048.
21. Schmidt R., Fazekas F., Kapeller P., Schmidt H., Hartung H.P. MRI white matter hyperintensities: three-year follow-up of the Austrian stroke prevention study. Neurology. 1999;53:132-139.
22. PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack. Lancet. 2001;358:1033-1041.
23. Woods R.P., Grafton S.T., Holmes C.J., Cherry S.R., Mazziotta J.C. Automated image registration, I: general methods and intrasubject, intramodality validation. J Comput Assist Tomogr. 1998;22:139-152.
24. Scheltens P., Barkhof F., Leys D., Pruvo J.P., Nauta J.J., Vermersch P., Steinling M., Valk J. A semiquantitative rating scale for the assessment of signal hyperintensities on magnetic resonance imaging. J Neurol Sci. 1993;114:7-12.
25. de Leeuw F.E., de Groot J.C., Oudkerk M., Witteman J.C.M., Hofman A., van Gijn J., Breteler M. Hypertension and cerebral white matter lesions in a prospective cohort study. Brain. 2002;125:765-772.
26. Taylor W.D., MacFall J.R., Provenzale J.M., Payne M.E., McQuoid D.R., Steffens D.C., Krishnan K.R.R. Serial MR imaging of volumes of hyperintense white matter lesions in elderly patients: correlation with vascular risk factors. Am J Roentgenol. 2003;181:571-576.
27. van Swieten J.C., Kappelle L.J., Algra A., Van Latum J.C., Koudstaal P.J., van Gijn J. Hypodensity of the cerebral white matter in patients with transient ischemic attack or minor stroke: influence on the rate of subsequent stroke: Dutch TIA Trial Study Group. Ann Neurol. 1992;32:177-183.
28. Scheltens P., Erkinjuntti T., Leys D., Wahlund L.O., Inzitari D., del Ser T., Pasquier F., Barkhof F., Mantyla R., Bowler J., Wallin A., Ghika J., Fazekas F., Pantoni L. White matter changes on CT and MRI: an overview of visual rating scales. Eur Neurol. 1998;39:80-89.
29. Kapeller P., Barber R., Vermeulen R.J., Ader H., Scheltens P., Freidl W., Almkvist O., Moretti M., del Ser T., Vaghfeldt P., Enzinger C., Barkhof F., Inzitari D., Erkinjunti T., Schmidt R., Fazekas F. Visual rating of agerelated white matter changes on magnetic resonance imaging: scale comparison, interrater agreement, and correlations with quantitative measurements. Stroke. 2003;34:441-445.
30. Pantoni L., Simoni M., Pracucci G., Schmidt R., Barkhof F., Inzitari D. Visual rating scales for age-related white matter changes (leukoaraiosis): can the heterogeneity be reduced? Stroke. 2002;33:2827-2833.
Август 2013 г.