Опубликовано в:
«Эффективная Фармокотерапия. Пульмонология и оториноларингология.» »» 2012 № 3
Ингибиторы фосфодиэстеразы-4 в терапии хронической обструктивной болезни легких
К.м.н. Н.П. Княжеская
ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава России, кафедра пульмонологии ФУВ
В статье изложен современный подход к лечению ХОБЛ, обосновывается необходимость патогенетической терапии заболевания. Представлены данные, свидетельствующие об особой роли ингибиторов фосфодиэстеразы-4 в воздействии на течение воспаления при ХОБЛ.
На примере первого препарата нового класса рофлумиласта (препарат Даксас®) показано, что рофлумиласт улучшает функцию легких и снижает риск обострений у больных со среднетяжелой, тяжелой и очень тяжелой формами ХОБЛ. Наибольшую эффективность препарат демонстрирует у пациентов с тяжелым течением ХОБЛ с частыми обострениями.
Введение
В последние годы проблеме хронической обструктивной болезни легких (ХОБЛ) уделяется все больше внимания. Это связано с ростом не только заболеваемости, но и смертности среди больных с данным недугом [1, 2]. Наиболее важным фактором в формировании болезни является развитие выраженных морфофункциональных изменений легких, вызванных воздействием экзогенных факторов и, в первую очередь, курением табака [3]. По данным Всемирной организации здравоохранения (ВОЗ), ХОБЛ средней или тяжелой степени тяжести страдают порядка 80 млн человек. В 2005 г. более 3 млн человек умерли от ХОБЛ, что составляет 5% случаев всех летальных исходов. Если не будут предприняты меры по снижению факторов риска, прежде всего курения, то, согласно прогнозам ВОЗ, в течение ближайших 10 лет общая смертность от ХОБЛ может вырасти на 30%, а к 2020 г. станет третьей среди причин смертности [1, 4, 5]. В странах Евросоюза, например, среди болезней органов дыхания ХОБЛ занимает первое место по количеству потерянных рабочих дней из-за временной нетрудоспособности. Потери производительности труда, обусловленные обострениями ХОБЛ, оцениваются в 28,5 млрд евро в год. Экономическое бремя ХОБЛ ложится на государство и общество, больного и его семью [6, 7, 8].
Особенности патогенеза, клинической картины, диагностики и классификации ХОБЛ
Патологический процесс при ХОБЛ заключается в воспалении в стенке бронхиального дерева, паренхиме легких и легочных сосудах. Основными клетками, участвующими в развитии воспаления, являются нейтрофилы, Т-лимфоциты (CD8+) и макрофаги. Эти клетки накапливаются в легких и запускают каскад воспалительных реакций, которые приводят к ограничению бронхиальной проводимости и воздушного потока, а также к системному воспалению вне легких. Высвобождаются воспалительные медиаторы, такие как фактор некроза опухоли альфа (ФНО-альфа), матриксные металлопротеиназы и интерлейкины 1, 6, 8 [9]. Воспаление приводит к морфологическим изменениям в легких (бронхоконстрикции, отеку слизистой оболочки бронхов, гиперсекреции слизи, эмфиземе). Необратимые обструктивные изменения, которые возникают в процессе болезни со стороны всех составляющих респираторной системы, обусловливают снижение эффективности лечения [7]. Для ХОБЛ характерны системные эффекты, подход к лечению которых отличается от такового при других заболеваниях легких [10, 11].
ХОБЛ, как правило, диагностируется на поздних стадиях, поэтому пациенты с ХОБЛ долгое время считают себя здоровыми людьми, а симптомы болезни (кашель, отделение мокроты, появление одышки при физической нагрузке) объясняют какими-то другими причинами. ХОБЛ является не только серьезной медицинской проблемой, которую довольно трудно решать из-за выраженных морфологических изменений, но и крайне сложной социальной проблемой по причине высокой степени социальной дезадаптации таких пациентов (преимущественно людей пожилого возраста) вследствие возникновения тяжелой одышки и резкого ограничения физической активности [1, 2, 4, 5].
Современная диагностика ХОБЛ и классификация заболевания по степени тяжести построены на регистрации бронхиальной обструкции и степени ее выраженности; воспаление дыхательных путей присутствует уже на ранних стадиях болезни, а его активность увеличивается по мере прогрессирования ХОБЛ [1, 2]. Но такой подход не отражает всей сложности и разнообразия данной патологии. На практике врачи нередко рассматривают ХОБЛ как стабильное хроническое состояние с постоянным присутствием симптомов, незначительной вариацией проходимости дыхательных путей и неуклонным прогрессированием бронхиальной обструкции. Однако уже длительное время (более 50 лет) существует разделение пациентов на два подтипа: больные с эмфиземой, одышкой, без цианоза, со сниженной массой тела («розовые пыхтельщики») и больные с хроническим бронхитом, цианозом и отеками, признаками правожелудочковой сердечной недостаточности («синие отечники»). В 1966 г. B. Burrows и соавт. описали различия в клинической, функциональной, рентгенологической и морфологической картине этих двух подтипов больных ХОБЛ и ввели термины эмфизематозного и бронхитического типа хронической обструкции дыхательных путей, что соответствовало эмфизематозному и бронхитическому фенотипам хронической бронхиальной обструкции [12, 13]. Идентификация и последующее объединение ключевых элементов синдрома ХОБЛ в клинически значимые и полезные подгруппы (фенотипы) позволят проводить более эффективную терапию у больных ХОБЛ [14].
В 2010 г. группа экспертов предложила следующее определение фенотипа ХОБЛ - это характерная черта или комбинация таких черт, которые описывают различия между пациентами с ХОБЛ, связанные с клинически значимыми исходами (симптомы, обострения, ответ на терапию, скорость прогрессирования заболевания или смерть) [14, 15]. Пациенты, соответствующие одному фенотипу, имеют подобные клинические исходы и должны иметь сходный ответ на проводимое лечение. Таким образом, фенотипы ХОБЛ отражают определенные особенности пациентов, которые важны, прежде всего, для лечения и прогноза заболевания. Выделение отдельных фенотипов ХОБЛ позволяет улучшить качество жизни и прогноз больных ХОБЛ. К сожалению, в связи с тем, что концепция фенотипирования ХОБЛ находится в начале своего развития, исследований, посвященных эффективности современных препаратов у больных с разными фенотипами ХОБЛ, пока немного. В настоящее время обсуждается вопрос выделения таких фенотипов больных ХОБЛ, как ХОБЛ в сочетании с бронхиальной астмой, ХОБЛ с быстрым прогрессированием бронхиальной обструкции, раннее начало ХОБЛ, фенотип больного с частыми обострениями, ХОБЛ у женщин, «молодые больные» с ХОБЛ и др. [16].
Определению клинически значимых фенотипов больных ХОБЛ с II-IV стадией по GOLD (Global Strategy of Chronic Obstructive Lung Disease - Глобальная стратегия по диагностике, лечению и профилактике ХОБЛ) и параметров, на основании которых можно прогнозировать прогрессирование заболевания, было посвящено исследование ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-point) [14, 15]. В ходе исследования было показано, что пациенты с ХОБЛ действительно имеют различные фенотипы, среди которых наиболее неблагоприятным в отношении прогноза является фенотип, проявляющийся частыми обострениями. Обострения ХОБЛ увеличивают скорость падения функции легких, снижают физическую активность и качество жизни, повышают риск летального исхода, приводят к значительным расходам на медицинскую помощь. В основе обострений ХОБЛ лежит дальнейшее усиление процесса воспаления, присутствующего и в стабильном состоянии [1, 18, 19]. Влияние на частоту обострений ХОБЛ является одним из путей лечения, направленного на улучшение прогноза заболевания.
Таким образом, сама природа воспалительного процесса при ХОБЛ и логика научного поиска подсказывают: необходимо разрабатывать препараты, которые могут воздействовать на специфический характер воспаления при этом заболевании и его ключевые звенья.
Роль фосфодиэстеразы-4 в воспалении при ХОБЛ
Несмотря на сложность и многогранность воспаления при ХОБЛ, в нем можно выделить ключевые звенья. Одним из этих звеньев является фосфодиэстераза 4-го типа (ФДЭ-4) - энзим, регулирующий метаболизм циклического аденозинмонофосфата (цАМФ) в провоспалительных и иммунных клетках, а также катализирующий переход цАМФ в его неактивную форму - АМФ. Высокое содержание ФДЭ-4 в провоспалительных и структурных клетках сделало этот фермент одним из наиболее значимых для терапевтического воздействия на хроническое воспаление при ХОБЛ. Фосфодиэстераза состоит из 11 изоформ, однако именно ФДЭ-4 является цАМФ-специфической и преобладающей изоформой, которая экспрессируется иммунными и провоспалительными клетками и является основным регулятором метаболизма цАМФ практически во всех провоспалительных и структурных клетках, вовлеченных в хроническое воспаление при ХОБЛ [20]. Ингибирование ФДЭ-4 приводит к повышению внутриклеточного уровня цАМФ и ослаблению связанной с ХОБЛ дисфункции лейкоцитов, клеток дыхательных путей и легочных васкулярных гладких мышц, эндотелиальных клеток и эпителиальных клеток дыхательных путей, а также фибробластов.
Способностью ингибировать фосфодиэстеразу обладает используемый с 1930-х годов теофиллин. Применение неселективных ингибиторов, подобных теофиллину, было ограничено большим числом лекарственных взаимодействий и узким диапазоном терапевтических доз, что приводило к частым нежелательным явлениям со стороны сердечно-сосудистой системы и желудочно-кишечного тракта (ЖКТ). Кроме того, теофиллин, являющийся слабым и неселективным ингибитором фосфодиэстеразы, не способен оказывать влияние на ФДЭ-4 в терапевтических концентрациях. Интенсивный поиск новых молекул, которые могли бы в терапевтических концентрациях подавлять ФДЭ-4, привел к созданию селективных ингибиторов ФДЭ-4, таких как циломиласт и рофлумиласт, которые изначально разрабатывались как противовоспалительные препараты для лечения ХОБЛ и бронхиальной астмы. В отличие от рофлумиласта, циломиласт демонстрировал некоторую селективность в отношении 4D-подтипа фосфодиэстеразы, что стало причиной высокой частоты нежелательных явлений со стороны ЖКТ (тошнота, рвота) и в итоге привело к отказу от применения препарата. Рофлумиласт обладает намного большей активностью, чем циломиласт, и при этом воздействует на 4A-D подтипы фосфодиэстеразы, чем обусловлено меньшее число и частота нежелательных явлений [21, 22]. Рофлумиласт активно метаболизируется в организме человека с образованием основного фармакодинамически активного метаболита N-оксида рофлумиласта. Поскольку рофлумиласт и N-оксид рофлумиласта участвуют в ингибировании активности фосфодиэстеразы (in vivo), фармакокинетика рофлумиласта и его метаболита N-оксида рофлумиласта носит линейный характер в диапазоне доз от 250 мкг до 1000 мкг. Стимуляция человеческих нейтрофилов, моноцитов, макрофагов или лимфоцитов (in vitro) показала, что рофлумиласт и N-оксид рофлумиласта ослабляют высвобождение медиаторов воспаления, таких как лейкотриен В4, активные формы кислорода, ФНО-альфа, интерферон-гамма и гранзим В. У пациентов с ХОБЛ рофлумиласт понижает уровень нейтрофилов в мокроте, а также уменьшает миграцию нейтрофилов и эозинофилов в дыхательные пути.
У пациентов с III стадией (тяжелая форма) или IV стадией (крайне тяжелая форма) ХОБЛ, обострениями в анамнезе и симптомами хронического бронхита применение ингибитора ФДЭ-4 рофлумиласта снижает частоту обострений при лечении глюкокортикостероидами. Сходные эффекты наблюдаются и при добавлении рофлумиласта к терапии бронхорасширяющими препаратами длительного действия [21, 22]. В рекомендациях GOLD пересмотра 2010 г. ингибиторы ФДЭ-4 добавлены как новый класс препаратов для терапии ХОБЛ. В документе подчеркивается, что принцип действия ингибиторов ФДЭ-4 основан на уменьшении специфического воспаления при ХОБЛ и его клинических проявлений. Включение рофлумиласта в рекомендации GOLD свидетельствует о значимости вклада препарата в лечение этого заболевания. В странах Европейского Союза, Канаде и России рофлумиласт зарегистрирован под торговым наименованием Даксас®. Препарат направлен на подавление специфического воспаления при ХОБЛ. Четыре крупных рандомизированных плацебоконтролируемых исследования показали, что рофлумиласт значительно сокращает частоту обострений и улучшает легочную функцию при добавлении к терапии первой линии.
Влияние рофлумиласта на воспалительные маркеры
В исследованиях, проведенных на моделях у животных, рофлумиласт показал способность подавлять основные патогенетические механизмы ХОБЛ: воспаление, связанное с воздействием табачного дыма, дисфункцию мукоцилиарного аппарата, фиброзные и эмфизематозные изменения легочной ткани, оксидативный стресс и ремоделирование легочных сосудов.
Для изучения характера и степени выраженности воспаления дыхательных путей при обострении ХОБЛ были проведены иммуногистохимические анализы биопсий слизистой оболочки долевого бронха и цитологические анализы мокроты у 11 пациентов во время обострения и у 12 пациентов перед обострением. Было выявлено, что во время обострения число нейтрофилов достоверно повышается (p<0,01). В исследовании, проведенном у 46 курильщиков и бывших курильщиков (средний возраст 64 года), было показано, что у пациентов с обструкцией дыхательных путей в индуцированной мокроте содержалось больше нейтрофилов (77%), чем у пациентов без обструкции (60%). Содержание нейтрофилов также было выше (77%) у пациентов с хроническим выделением мокроты, чем без такового (57%) [23, 24].
Повышенные уровни нейтрофилов коррелировали с более быстрым снижением объема форсированного выдоха за первую секунду (ОФВ1) за 15-летний период наблюдения. У пациентов с наибольшим процентом нейтрофилов в индуцированной мокроте отмечалась максимальная скорость снижения параметров функции внешнего дыхания (ФВД). Эти результаты представляются очень важными для объяснения того, как противовоспалительный препарат, не являющийся бронходилататором, может влиять на показатели ФВД.
Возможности клинического применения рофлумиласта
Влияние на обострения ХОБЛ и ФВД
Снижение частоты и тяжести обострений является одной из основных целей лечения ХОБЛ, определенных экспертами GOLD. Обострения ХОБЛ связаны с повышением активности воспаления, которое происходит после каждого острого периода и удлиняет срок восстановления после обострения. В ранее упомянутом исследовании [24] у пациентов с ХОБЛ были получены четкие доказательства того, что обострения связаны с повышением активности воспаления в виде роста содержания нейтрофилов в мокроте и биоптатах бронхов. В дополнение к этому у пациентов с частыми обострениями даже в стабильном состоянии отмечается более высокая активность воспаления в дыхательных путях [19]. Наилучшим предиктором обострений на всех стадиях ХОБЛ являлось наличие обострений в предшествующем году. Кроме того, была показана необходимость выделять подгруппу пациентов с частыми обострениями (это может обеспечить сбор анамнеза) и проводить специальные мероприятия по профилактике обострений у таких пациентов.
С целью изучения влияния рофлумиласта на обострения ХОБЛ были проведены два сходных по дизайну 12-месячных рандомизированных плацебоконтролируемых двойных слепых исследования в параллельных группах - M2-111 и M2-112 [25]. В общей сложности в них участвовали 2686 пациентов. Различия в дизайне исследований заключались в том, что в исследование M2-111 включали пациентов с ХОБЛ в соответствии с критериями Американского торакального общества (АТО), а в M2-112 - с критериями GOLD. При проведении ретроспективного анализа с целью выявить подгруппы пациентов, у которых наблюдался наибольший эффект от лечения рофлумиластом, было показано, что наличие кашля с отделением мокроты коррелирует с более выраженным снижением частоты обострений. У этой категории больных частота обострений при терапии рофлумиластом снизилась на 26,2%, тогда как у пациентов с эмфиземой -на 1,1%. В результате пациенты с клиническими симптомами хронического бронхита были выделены в качестве целевой популяции для дальнейших исследований. Эта категория больных ХОБЛ также характеризовалась функциональными признаками выраженного ограничения бронхиальной проходимости и наличием обострений в анамнезе.
Объединенный анализ двух других 52-недельных рандомизированных плацебоконтролируемых исследований [26] с применением рофлумиласта (500 мкг 1 раз в сутки, число пациентов в группе терапии рофлумиластом составило 1537 человек) или плацебо (количество пациентов - 1554 человека) показал, что терапия рофлумиластом сопровождалась улучшением ОФВ1 до приема бронходилататора в среднем на 48 мл по сравнению с плацебо (p<0,0001). Рофлумиласт достоверно улучшил также постбронходилатационный ОФВ1 - на 55 мл по сравнению с плацебо (p<0,0001). Улучшение ФВД после применения бронходилататора было достоверным уже через 4 недели применения рофлумиласта и сохранялось на всем протяжении 52-недельного лечебного периода. Полученные данные свидетельствуют, что прием рофлумиласта вызывает дополнительные положительные эффекты при добавлении к терапии бронходилататором. Кроме того, использование рофлумиласта достоверно снизило частоту среднетяжелых и тяжелых обострений ХОБЛ - на 17% по сравнению с плацебо (p = 0,0003). Это сопровождалось увеличением периода времени до возникновения обострения в группе рофлумиласта по сравнению с группой плацебо (относительный риск 0,89, p = 0,02) [26, 27].
Эффективность рофлумиласта в комбинации с другими препаратами
Рофлумиласт и длительно действующие бета-2-агонисты. В ранее упоминавшихся 52-недельных исследованиях [26] около половины пациентов продолжали принимать бета-2-агонисты длительного действия во время лечения. В группе лечения рофлумиластом частота обострений снижалась независимо от того, принимали ли пациенты сопутствующую поддерживающую терапию ХОБЛ или нет. Анализ эффектов рофлумиласта в подгруппе пациентов, принимавших бета-2-агонисты длительного действия, выявил, что частота обострений снижалась на 21% по сравнению с пациентами, получавшими плацебо (p = 0,0011) (рис. 1) [28]. Помимо этого лечение рофлумиластом достоверно улучшило показатели ОФВ1 до и после применения бронходилататора по сравнению с плацебо у всех пациентов независимо от того, получали ли они одновременно бета-2-агонисты длительного действия или нет.
Рис. 1. Снижение частоты обострений у больных ХОБЛ при добавлении рофлумиласта (Даксас®) к терапии длительно действующими бета-2-агонистами (ДДБА)
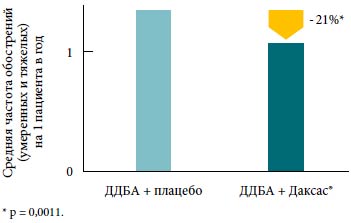
Данные двух повторных 12-месячных исследований (n=1542) [28].Рис. 2. Улучшение функции легких у больных ХОБЛ при добавлении рофлумиласта (Даксас®) к терапии тиотропием
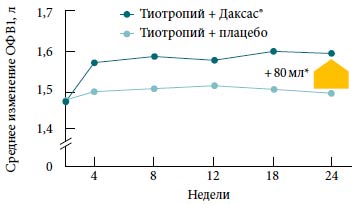
* p<0,0001.
Изменение ОФВ1 до приема бронходилататора.
Данные 24-недельного исследования (n=743) [29].Рофлумиласт и длительно действующие М-холинолитики. Эффекты рофлумиласта изучали в 24-недельном исследовании у пациентов с ХОБЛ, принимавших антихолинергический бронходилататор длительного действия тиотропий [29]. Рофлумиласт при добавлении к терапии тиотропием достоверно улучшал ОФВ1 до и после применения бронходилататора по сравнению с плацебо (p<0,0001) (рис. 2) [29]. Улучшение показателей ФВД становилось очевидным уже через 4-8 недель лечения рофлумиластом и сохранялось на всем протяжении исследования.
Положительные эффекты рофлумиласта и бронходилататоров длительного действия являются аддитивными, поскольку эти препараты обладают разными механизмами действия. Иными словами, добавление к терапии рофлумиласта позволяет получить дополнительные благоприятные эффекты помимо тех, что уже были достигнуты с помощью препаратов первого ряда для поддерживающей терапии ХОБЛ.
Рофлумиласт и ингаляционные глюкокортикостероиды (ИГКС). В исследованиях М2-111 и М2-112 пациентам разрешалось продолжать лечение ИГКС в дозе, не превышающей эквивалент 2000 мкг беклометазона дипропионата, если они использовали ИГКС в постоянной дозе на протяжении не менее 3 месяцев до включения в исследование. Таким образом, около 60% всех больных (1622 пациента) одновременно с исследуемыми препаратами принимали ИГКС [25]. При объединенном анализе данных этих исследований выяснилось, что рофлумиласт снизил частоту средне-тяжелых и тяжелых обострений ХОБЛ у пациентов, получавших ИГКС, на 18,8%. Эти данные свидетельствуют о различии механизмов противовоспалительного действия рофлумиласта и ИГКС. Большая способность рофлумиласта снижать количество обострений у пациентов, получающих ИГКС, может частично объясняться тем, что ИГКС принимали пациенты с более тяжелым течением ХОБЛ. Такие больные подвергаются более высокому риску обострения, о чем свидетельствует более высокая частота обострений в группе плацебо у пациентов, получавших ИГКС (0,89 случая в год), чем у не получавших ИГКС (0,46 случая в год). Таким образом, у этой категории больных влияние противовоспалительной терапии на частоту обострений может проявляться в большей степени [22]. Кроме того, у больных ХОБЛ (фенотип с частыми обострениями), которые получали ИГКС, прием рофлумиласта снизил частоту среднетяжелых и тяжелых обострений на 30,2% по сравнению с плацебо [30, 31]. Добавление рофлумиласта повышает эффективность комбинированной терапии у пациентов с ХОБЛ [32].
Заключение
Имеющиеся на сегодняшний день данные, полученные в ходе крупных клинических исследований, свидетельствуют о большом потенциале рофлумиласта как первого представителя принципиально нового класса препаратов, нацеленных на лечение специфичного для ХОБЛ воспаления. Анализ совокупных результатов показал, что наибольшая эффективность рофлумиласта отмечается у пациентов с тяжелым течением ХОБЛ с частыми обострениями. Рофлумиласт (Даксас®) улучшает функцию легких и снижает риск обострений у больных со среднетяжелой, тяжелой и очень тяжелой формой ХОБЛ. Сокращение осложнений не зависит от сопутствующего лечения бета-2-агонистами, холинолитиками (стандартной бронхолитической терапии).
Эта эффективность подтверждается улучшением легочной функции, а также уменьшением частоты обострений при добавлении рофлумиласта к поддерживающей терапии бронходилататорами длительного действия и ИГКС. Рофлумиласт продемонстрировал статистически значимые улучшения ОФВ1 в диапазоне от 48 до 80 мл. Рофлумиласт, в отличие от бронхолитиков, оказывает влияние на причину, а не на ежедневные симптомы заболевания. Действие препарата проявляется в течение нескольких недель. Он обладает длительным эффектом. У пациентов пожилого возраста, женщин и лиц не европеоидной расы общая ингибирующая активность ФДЭ-4 увеличивалась. Ни одно из этих изменений нельзя рассматривать как клинически значимое. Именно поэтому коррекцию доз в отношении этих групп пациентов проводить не рекомендуется.
Особенности применения препарата Даксас® Препарат назначают внутрь. Рекомендуемая доза – 500 мкг 1 раз в сутки. Даксас® применяется длительно. Для достижения терапевтического эффекта может потребоваться лечение в течение нескольких недель. Даксас® не предназначен для лечения острого приступа одышки (острого бронхоспазма).
Тошнота, расстройство желудка и потеря в весе – наиболее частые побочные эффекты, отмеченные у пациентов в ходе четырех крупных рандомизированных плацебоконтролируемых исследований, – были, как правило, умеренными или средней степени тяжести и обычно возникали в течение первых недель применения препарата. Пациентам с недостаточной массой тела следует ее контролировать. В случае необъяснимого уменьшения массы тела (не связанного с диетой или физическими упражнениями) пациенту требуется консультация врача.
Список использованной литературы
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (COPD). 2009 // www.goldcopd.org.
- Респираторная медицина. Руководство / Под ред. А.Г. Чучалина. М.: ГЭОТАР-Медиа, 2007. Т. 1. 626 с.
- Anthonisen N.R., Connett J.E., Murray R.P. Smoking and lung function of Lung Health Study participants after 11 years // Am. J. Respir. Crit. Care Med. 2002. Vol. 166. № 5. P. 675-679.
- European Lung Foundation. COPD Burden in Europe, 2009 // www. european-lung-foundation.org.
- Лещенко И.В. Ключевые вопросы ранней терапии хронической обструктивной болезни легких // Consilium medicum. 2008. Т. 10. № 10. С. 46-50.
- Pauwels R.A., Rabe K.F. Burden and clinical features of chronic obstructive pulmonary disease (COPD) // Lancet. 2004. Vol. 364. № 9434. P. 613-620.
- Chapman K.R., Mannino D.M., Soriano J.B. et al. Epidemiology and costs of chronic obstructive pulmonary disease // Eur. Respir. J. 2006. Vol. 27. № 1. P. 188-207.
- Halbert R.J., Natoli J.L., Gano A. et al. Global burden of COPD: systematic review and meta-analysis // Eur. Respir. J. 2006. Vol. 28. № 3. P. 523-532.
- Domagala-Kulawik J., Hoser G., Dabrowska M. et al. Increased proportion of Fas positive CD8+ cells in peripheral blood of patients with COPD // Respir. Med. 2007. Vol. 101. № 6. P. 1338-1343.
- Andreassen H., Vestbo J. Chronic obstructive pulmonary disease as a systemic disease: an epidemiological perspective // Eur. Respir. J. Suppl. 2003. Vol. 46. P. 2s-4s.
- Gan WQ., Man S.F., Senthilselvan A., Sin D.D. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis // Thorax. 2004. Vol. 59. № 7. P. 574-580.
- Авдеев С.Н. Фенотипы хронической обструктивной болезни легких: особенности терапии // Consilium medicum. Пульмонология. 2010. Т. 12. № 1. С. 23-28.
- Burrows B., Fletcher C.M., Heard B.E. et al. The emphysematous and bronchial types of chronic airways obstruction. A clinicopathological study of patients in London and Chicago // Lancet. 1966. Vol. 1. № 7442. P. 830-835.
- Vestbo J., Anderson W., Coxson H.O. et al. Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-points (ECLIPSE) // Eur. Respir. J. 2008. Vol. 31. № 4. P. 869-873.
- Agusti A., Calverley P.M., Celli B. et al. Characterization of COPD heterogeneity in the ECLIPSE cohort // Respir. Res. 2010. Vol. 11. P. 122.
- Овчаренко С.И., Капустина В.А. Хроническая обструктивная болезнь легких - проблема женского здоровья // Consilium medicum. 2011. Т. 13. № 6. С. 55-58.
- Spencer S., Calverley P.M., Burge P.S. et al. Impact of preventing exacerbations on deterioration of health status in COPD // Eur. Respir. J. 2004. Vol. 23. № 5. P. 698-702.
- Soler-Cataluna J.J., Martinez-Garcia M.A., Roman S.P. et al. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease // Thorax. 2005. Vol. 60. № 11. P. 925-931.
- Seemungal T.A., Donaldson G.C., Paul E.A. et al. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease // Am. J. Respir. Crit. Care Med. 1998. Vol. 157. № 5. Pt. 1. P. 1418-1422.
- Hatzelmann A., Morcillo E.J., Lungarella G. et al. The preclinical pharmacology of roflumilast - a selective, oral phosphodiesterase 4 inhibitor in development for chronic obstructive pulmonary disease // Pulm. Pharmacol. Ther. 2010. Vol. 23. № 4. P. 235-256.
- Soto F.J., Hanania N.A. Selective phosphodiesterase-4 inhibitors in chronic obstructive lung disease // Curr. Opin. Pulm. Med. 2005. Vol. 11. № 2. P. 129-134.
- Calverley P.M., Sanchez-Toril F., McIvor A. et al. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am. J. Respir. Crit. Care Med. 2007. Vol. 176. № 2. P. 154-161.
- Grootendorst D.C., Gauw S.A., Verhoosel R.M. et al. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD // Thorax. 2007. Vol. 62. № 12. P. 10811087.
- Wang D., Cui X. Evaluation of PDE4 inhibition for COPD // Int. J. Chron. Obstruct. Pulmon. Dis. 2006. Vol. 1. № 4. P. 373-379.
- Rennard S.I., Calverley P.M., Goehring U.M. et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast - the importance of defining different subsets of patients with COPD // Respir. Res. 2011. Vol. 12. P. 18.
- Calverley P.M., Rabe K.F., Goehring U.M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials // Lancet. 2009. Vol. 374. № 6991. P. 685-694.
- Rabe K.F., Bateman E.D., O.Donnell D. et al. Roflumilast - an oral antiinflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. 2005. Vol. 366. № 9485. P. 563571.
- Hanania N.A., Brose M., Larsson T. et al. Efficacy of roflumilast in patients receiving concomitant treatments for chronic obstructive pulmonary disease over 12 months // Am. J. Respir. Crit. Care Med. 2010. Vol. 181. Abstract A4435.
- Fabbri L.M., Calverley P.M., Izquierdo-Alonso J.L. et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with long acting bronchodilators: two randomised clinical trials // Lancet. 2009. Vol. 374. № 9691. P. 695-703.
- Calverley P.M., Martinez F.J., Goehring U.M. et al. Defining patient populations in COPD: experience with roflumilast. 7th International Multidisciplinary Conference on Chronic Obstructive Pulmonary Disease (COPD7). Birmingham, UK: 30 June - 2 July, Poster 48. 2010. www.copdconferences.org.
- Ito K., Ito M., Elliott W.M. et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease // N. Engl. J. Med. 2005. Vol. 352. № 19. P. 1967-1976.
- Calverley P.M., Martinez F.J., Fabbri L.M. et al. Does roflumilast decrease exacerbations in severe COPD patients not controlled by inhaled combination therapy? The REACT study protocol // Int. J. Chron. Obstruct. Pulmon. Dis. 2012. Vol. 7. P. 375-382.
| Июнь 2013 г. |