Опубликовано в журнале:
«Фарматека» 2012, № 17, с. 10-14ЖЕЛЕЗОДЕФИЦИТ В КАРДИОЛОГИИ – НОВЫЙ ПОДХОД К СТАРОЙ ПРОБЛЕМЕ?
Ф.Ю. Копылов
Кафедра профилактической и неотложной кардиологии ФППОВ, Первый МГМУ им. И.М. Сеченова, МоскваВ последние годы появляется все больше научных работ, посвященных диагностике и лечению железодефицита вне зависимости от наличия анемии у пациентов с сердечно-сосудистыми заболеваниями. В кардиологическую практику этот подход пришел из области нефрологии, т. к. многие диагностические и лечебные подходы к анемии и/или железодефициту изучались у больных хронической почечной недостаточностью и зачастую сопутствующей хронической сердечной недостаточностью. Результатом последних исследований, освещенных в данном обзоре, стала постановка вопроса о признании железодефицита независимым фактором риска ухудшения прогноза больных сердечно-сосудистыми заболеваниями и, соответственно, не зависимой от анемии терапевтической мишенью. Ключевые слова: анемия, железодефицит, железо, хроническая сердечная недостаточность, ишемическая болезнь сердца
In recent years, the number of scientific papers on the diagnosis and treatment of iron deficiency regardless of the presence of anemia in patients with cardiovascular diseases is increased. In cardiology practice this approach came from the field of nephrology, since many diagnostic and therapeutic approaches to the treatment of anemia and/or iron deficiency were evaluated in patients with chronic renal failure and often concomitant chronic heart failure. Results of recent studies highlighted in this review led to the question of the recognition of iron deficiency as independent risk factor for worsening prognosis of patients with cardiovascular diseases, and, therefore, as therapeutic target not related to anemia. Key words: anemia, iron deficiency, iron, chronic heart failure, coronary artery disease
Дефицит железа (ДЖ) достаточно часто встречается среди пациентов с сердечнососудистыми заболеваниями (ССЗ). Так, например, недавно показана распространенность ДЖ у 10 % больных ишемической болезнью сердца (ИБС) [1] и у 37 % больных хронической сердечной недостаточностью (ХСН) [2].
Современный подход оценки взаимосвязи изменения биохимического показателя с каким-либо заболеванием предполагает в первую очередь изучение следующих факторов:
- изменения прогноза заболевания в зависимости от изменения показателя;
- возможных патогенетических механизмов действия;
- точных критериев пороговых значений показателя;
- эффекта лечебных мероприятий по изменению уровня показателя.
Ухудшает ли прогноз пациента с ССЗ наличие ЖД вне зависимости от наличия анемии?
Факты ухудшения течения различных ССЗ на фоне анемии широко известны. Так, например, показано, что анемия является фактором риска высокой смертности при остром коронарном синдроме [3] и ХСН [4, 5] (рис. 1).
Рис 1. Влияние анемии на исходы ХСН: результаты исследования CHARM [5]
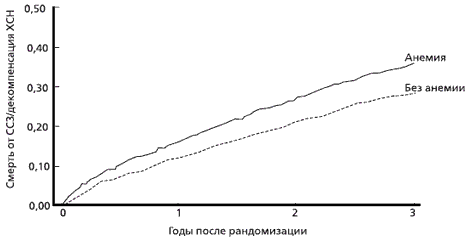
В связи с этим необходимо отметить, что для хронической ИБС в нескольких крупных исследованиях не выявлено влияния анемии на смертность и другие исходы при длительном наблюдении [6], однако в подгруппах пациентов с хронической болезнью почек и/или сахарным диабетом негативный эффект наличия анемии четко прослеживается [7].
Если мы обратимся к вопросу прогностического влияния ДЖ, то можем проследить эволюцию взглядов от ранних исследований [8], в которых обсуждалась защитная роль недостатка железа относительно ИБС, до современных хорошо спланированных исследований, демонстрирующих отрицательное влияние снижения уровня железа на прогноз как при ХСН [2], так и у пациентов с ИБС и предстоящим аортокоронарным шунтированием [9]. В исследованиях 1980–1990-х гг. постулировалась связь высокой частоты ИБС и ее осложнений с наличием запасов железа в организме, которые у мужчин увеличиваются сразу после пубертатного возраста [10], а у женщин – только после менопаузы [11], а также наличие железо-индуцированного оксидативного стресса, приводящего к эндотелиальной дисфункции [12].
Следует отметить, что большинство исследований данного периода выполнено на недостаточном методологическом уровне с позиций современной доказательной медицины. Это послужило поводом к проведению новых, хорошо спланированных поисковых работ, показавших отрицательное влияние ДЖ на прогноз ССЗ вне зависимости от наличия или отсутствия анемии.
Одним из самых интересных исследований, проведенных на данную тему, является проспективное наблюдение 546 пациентов с ХСН в течение 3 лет (рис. 2) [2]. Группа пациентов с ДЖ показала значительно меньшую выживаемость по сравнению с пациентами с нормальным уровнем железа вне зависимости от наличия анемии, причем особую ценность этому исследованию придает тот факт, что у пациентов без анемии в 32 % случаев регистрировался ДЖ.
Рис. 2. Прогноз пациентов с ХСН в зависимости от наличия железодефицита [2].
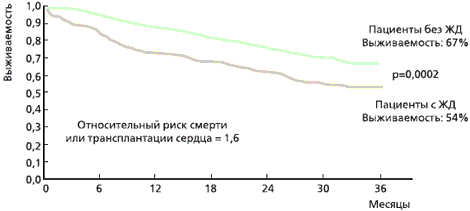
ЖД - железодефицит. (проспективное исследование: 546 пациентов с ХСН, критерии ЖД: ферритин сыворотки < 100 нг/мл или < 300 мг/мл при сатурации трансферрина < 20%.Какова роль железа в патогенезе ССЗ?
Железо играет основную роль в транспортировке кислорода (гемоглобин), накопления кислорода (миоглобин), окислительного метаболизма (в составе окислительных ферментов дыхательной цепи), а также участвует в синтезе и деградации липидов, углеводов, ДНК, РНК, коллагена, тирозина и катехоламинов [13–15].
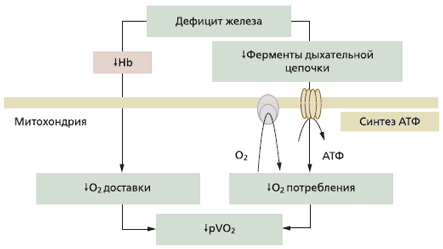
С учетом данных фактов можно констатировать, что наличие железа абсолютно необходимо для поддержания процессов выработки энергии в организме, особенно в клетках с высокими энергетическими потребностями – кардиомиоцитах и скелетных миоцитах. Соответственно, недостаток железа может приводить к серьезным нарушениям окислительного метаболизма и клеточных энергетических механизмов [16, 17] (рис. 3). Это отражается на уровне потребления кислорода и переносимости физических нагрузок – факторах, особенно важных для пациентов с ССЗ [18].
Рис. 3. Влияние дефицита железа на окислительный метаболизм [18]
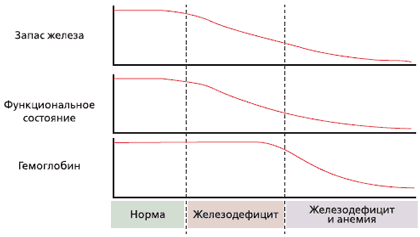
Временные взаимосвязи истощения запасов железа, возникновения анемии и функциональных расстройств (снижение иммунитета, переносимости физических нагрузок и неврологические нарушения) представлены на рис. 4 [19].
Рис 4. Функциональные расстройства возникают при железодефиците до наступления анемии (с изменениями по ]19])
При обсуждении вопросов патогенеза необходимо упомянуть понятия абсолютного и функционального ДЖ. Абсолютный ДЖ – это общее снижение запасов железа в организме, определяемое при снижении ферритина сыворотки ниже 100 мкг/л, который в свою очередь может быть латентным или манифестированным в зависимости от отсутствия или наличия анемии. Функциональный ДЖ (ферритин > 100 мг/л, при этом насыщение трансферрина < 20 %) проявляется неспособностью обеспечить необходимым количеством железа пролиферирующие эритробласты, несмотря на достаточные запасы железа в организме.
Функциональный ДЖ является одним из звеньев патогенеза анемии хронических заболеваний, в основе которой лежит иммуноопосредованный механизм: цитокины и клетки ретикулоэндотелиальной системы вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [20, 21].
Открытие железорегулирующего острофазового белка – гепцидина – позволило во многом прояснить связь между иммунным механизмом нарушения гомеостаза железа и развитием анемии хронических заболеваний. Через усиление синтеза в печени гепсидина под влиянием воспалительных стимулов (главным образом интерлейкина-6 и фактора некроза опухоли а происходят снижение абсорбции железа в кишечнике и блокирование высвобождения железа из макрофагов и гепатоцитов. Дизрегуляция гомеостаза железа ведет к последующей недостаточности доступного железа для эритроидных предшественников, ослаблению пролиферации этих клеток вследствие негативного влияния на них нарушения биосинтеза гема.
Анемия хронических заболеваний достаточно часто встречается среди больных ХСН и хронической почечной недостаточностью. Частое сочетание данных патологических состояний является в последние годы предметом многих исследований и даже привело к формулировке в 2003 г. группой исследователей под руководством Д. Сильверберга понятия о ”кардиоренальном анемическом синдроме” (CRAS – cardio renal anemia syndrome) при ХСН, что способствовало некоторым изменениям в тактике лечения данных пациентов [22]. Этот синдром основывается на том факте, что каждое из трех составляющих – ХСН, хроническая почечная недостаточность и анемия – ухудшает течение остальных двух.
В 2011 г., обобщив последние данные по этому вопросу, упомянутые ученые предложили расширить понятие и переименовать его в “синдром кардиоренальной анемии и железодефицита” (CRAID syndrome – the Cardio Renal Anemia Iron Deficiency Syndrome) [23].
Какие показатели используются для оценки железодефицита?
Согласно докладу Всемирной организации здравоохранения 2011 г. “Концентрации ферритина в сыворотке крови для оценки статуса железа и степени дефицита железа у населения” [24], для оценки абсолютного железодефицита устанавливается значение сывороточного ферритина < 15 мкг/л (для взрослых женщин и мужчин в странах с невысоким распространением воспалительных и инфекционных заболеваний).
В большинстве недавних исследований по данной проблематике для оценки наличия железодефицита к пациентам с ХСН и хронической почечной недостаточностью применялись следующие критерии: снижение ферритина сыворотки < 100 мкг/л для абсолютного дефицита и ферритина > 100 мг/л, при этом насыщение трансферрина < 20 % для функционального дефицита. На основании этих критериев доказана достоверно более высокая смертность пациентов с железодефицитом вне зависимости от наличия анемии [2]; кроме того, эти критерии служили точкой начала терапии во многих исследованиях, о которых речь пойдет ниже.
Какие терапевтические подходы к коррекции железодефицита у больных ССЗ изучены?
В конце 2011 г. был опубликован интересный систематический обзор “Лечение анемии у пациентов с ССЗ” [25], в котором проанализировано подавляющее большинство статей по указанной тематике. Строгий отбор клинических исследований для данного обзора прошли только три исследования пациентов с ХСН и ДЖ вне зависимости от наличия анемии – в одном применялся карбоксимальтозат железа (Феринжект 200 мг в неделю, фаза коррекции – до 8–12 недель, затем 200 мг в месяц, фаза поддержки – до 24–26 недель) [26], в двух других – гидроксид сахарозный комплекс железа (Венофер 200 мг в неделю – 5 недель) [27, 28]. Результатом этого анализа стали признание роли внутривенного железа в снижении функционального класса ХСН, улучшение переносимости физических нагрузок, функции почек и качества жизни, достоверное увеличение уровня гемоглобина, фракции выброса левого желудочка, снижение уровней натрий-уретических пептидов, С-реактивного белка, а также уменьшение частоты госпитализаций в связи с декомпенсацией ХСН. При этом (несмотря на имеющиеся тенденции к улучшению прогноза) отсутствуют полноценные данные о влиянии монотерапии внутривенными препаратами железа на смертность и другие неблагоприятные исходы ХСН при долговременном наблюдении.
Стоит отметить, что в первом из представленных исследований применялся препарат железа для внутривенного введения нового поколения в виде карбоксимальтозатного комплекса (Феринжект), который обладает помимо уже упомянутого выше положительного действия на ХСН (переход в более низкий функциональный класс) и хроническую болезнь почек (увеличение скорости клубочковой фильтрации) очень удобен в применении (200 мг железа можно вводить в одной внутривенной инъекции). Эта особенность существенно облегчает ведение данной категории больных на амбулаторном этапе – нет необходимости в капельном введении препарата и зачастую связанных с этим госпитализациях.
Более того, в подтверждение возможных “негемоглобиновых” механизмов действия препаратов железа у больных ХСН с ДЖ без анемии показано повышение функционального класса ХСН, потребления кислорода и общего состояния даже в отсутствие повышения уровня гемоглобина при применении внутривенных препаратов железа [27].
В иных клинических ситуациях (ИБС и другие ССЗ), не вошедших в данных обзор, нам приходится опираться на отдельные медицинские публикации или экстраполировать подходы из них. Так, относительно применения препаратов перорального железа в кардиологической практике на сегодняшний день нет единого мнения. Однако при сравнении эффективности пероральных и внутривенных препаратов железа в нефрологической практике показан лучший ответ при меньшем количестве побочных эффектов в последнем случае [29, 30]. Более того, в одном исследовании пациентов с ХСН и анемией применение препаратов перорального железа не привело к улучшению показателей гемоглобина и сердечной недостаточности [31]. Можно предположить, что эффективность препаратов перорального железа зависит от степени выраженности гепцидин-регулируемого угнетения всасывания железа в кишечнике (один из механизмов анемии хронических заболеваний), а также от сопутствующей патологии желудочно-кишечного тракта.
В настоящий момент нет рекомендаций по коррекции железодефицита у пациентов с другой сердечно-сосудистой патологией, в частности ИБС. В силу этого возможны подходы, аналогичные лечению железодефицитных анемий, т. е. применение пероральных форм железа, а в случае отсутствия эффекта (отсутствует или недостаточный прирост гемоглобина, отсутствие ретикулоцитоза) – переход на внутривенную терапию; при выявлении признаков анемии хронических заболеваний (функциональный дефицит железа) сразу назначение внутривенной терапии. Оптимальная тактика ведения в данной ситуации предполагает насыщающую и поддерживающую терапию препаратами железа.
Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 3–4 недели, при этом минимальная суточная доза свободного железа должна соответствовать 100–300 мг (оптимальная – 150–200 мг). Поддерживающая терапия (до 6 месяцев) показана в тех ситуациях, когда сохраняется или трудно устранима причина ДЖ (меноррагии, беременность, патология кишечника и др.).
Заключение
Накопленные за последние годы данные позволяют сделать заключение о появлении новой терапевтической мишени – железодефицита вне зависимости от наличия анемии. Важность выявления и коррекции железодефицита у пациентов с ССЗ показана в различных хорошо спланированных исследованиях. Данные факты потребуют в ближайшее время внесения изменений в Национальные рекомендации по диагностике и лечению ХСН (в первую очередь) и других ССЗ – рутинного определения показателей железодефицита и назначения препаратов железа.
Наши австралийские коллеги уже прошли этот путь и в 2011 г. внесли дополнения в рекомендации по ХСН: “Дефицит железа необходимо выявлять и лечить у пациентов с ХСН для улучшения клинической симптоматики, повышения переносимости физических нагрузок и улучшения качества жизни. (уровень рекомендаций В)” [32].
Следом за этим и в недавних Европейских рекомендациях по диагностике и лечению острой и хронической сердечной недостаточности 2012 г. дано указание на выявление и лечение железодефицитных состояний у больных ХСН [33].
ЛИТЕРАТУРА
1. Boyd CM, Le ff B, Wolff JL, et al. Informing clinical practice guideline development and implementation: prevalence of coexisting conditions among adults with coronary heart disease. J Am Geriatr Soc 2011;59(5): 797–805.
2. Jankowska EA, Rozentryt P, Witkowska A, et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J 2010;31(15):1872–80.
3. Sabatine MS, Morrow DA, Giugliano R P, et al. Association of hemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation 2005;111(16):2042–49.
4. Anand I, McMurray JJ, Whitmore J, et al. Anemia and its relationship to clinical outcome in heart failure. Circulation 2004;110(2):149–54.
5. O'Meara E, Clayton T, McEntegart MB, et al. CHARM Committees and Investigators. Clinical correlates and consequences of anemia in a broad spectrum of patients with heart failure: results of the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) Program. Circulation 2006;113(7):986–94.
6. Pereira AA, Sarnak MJ. Anemia as a risk factor for cardiovascular disease Kidney Int 2003;64(Suppl. 87):32–9.
7. Vlagopoulos PT, Tighiouart H, Weiner DE, et al. Anemia as a risk factor for cardiovascular disease and all-cause mortality in diabetes: the impact of chronic kidney disease. J Am Soc Nephrol 2005;16(11):3403–10.
8. Sullivan JL: Iron and the sex difference in heart disease risk. Lancet 1981;1:1293–94.
a. Weissert S, Flint J, Aggarwal S, et al. Iron Deficiency as the Most Ominous Substrate for Anemia in Patients Undergoing Coronary Artery Bypass Surgery Circulation 2011;124: Abstract17396.
9. Cook JD, Lipschitz DA, Miles LE, et al: Serum ferritin as a measure of iron stores in normal subjects. Am J Clin Nutr 1974;27:681–7.
10. Burt MJ, Halliday J W, Powell LW: Iron and coronary heart disease. BMJ 1993; 307:575–76.
11. Cooper CE: Nitric oxide and iron proteins. Biochim Biophys Acta 1999;1411:290–309.
12. Ponka P. Cellular iron metabolism. Kidney Int 1999; 55(69):S2–S11.
13. Cairo G, Bernuzzi F, Recalcati S. Apreciousmetal: iron, an essential nutrient for all cells. Genes and Nutrition 2006;1:25–40.
14. Anderson GJ, Vulpe CD. Mammalian iron transport. Cell and Mol Life Sciences 2009;66(20):3241–61.
15. Dallman PR. Iron deficiency: does it matter? J Intern Med 1989;226:367–72.
16. Haas JD, Brownlie T. Iron deficiency and reduced work capacity: a critical review of the research to determine a causal relationship. J Nutr 2001;131:S676–S88.
17. Anker SD, Colet JC, Filippatos G, et al. FAIR-HF committees and investigators. Rationale and design of Ferinject Assessment in patients with IRon deficiency and chronic Heart Failure (FAIR-HF) study: a randomized, placebo-controlled study of intravenous iron supplementation in patients with and without anaemia. Eur J Heart Fail 2009;11:1084–91.
18. Beard JL. Iron biology in immune function, muscle metabolism and neuronal functioning. J Nutr 2001;131(2 Suppl. 2):S568–S79.
19. Weiss G, Goodnough LT. Anemia of Chronic Disease. New Eng J Med 2005;352(10): 1011–23.
20. Mastromarino V, Volpe M, Musumeci MB, et al. Erythropoietin and the heart: facts and perspectives. Clin Sci (Lond) 2011; 120(2):51–63.
21. Silverberg DS, Wexler D, Blum M, Iaina A. The cardio renal anemia syndrome: correcting anemia in patients with resistant congestive heart failure can improve both cardiac and renal function and reduce hospitalizations. Clinical Nephrology 2003;60(1):93–102.
22. Silverberg DS, Wexler D, Iaina A, Schwartz D. Correction of iron deficiency in the cardiorenal syndrome. Int J Nephrol 2011;2011:365301.
23. http://www.who.int/vmnis/indicators/serum_ ferritin_ru.pdf.
24. Kansagara D, Dyer E, Englander H, Freeman M, Kagen D. Treatment of Anemia in Patients with Heart Disease: A Systematic Review [Internet]. Washington (DC): Department of Veterans Affairs (US);2011 Oct.
25. http://www.ncbi.nlm.nih.gov/books/NBK83423/pdf/TOC.pdf.
26. Anker SD, Comin Colet J, Filippatos G, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. New England Journal of Medicine 2009;361(25):2436–48.
27. Toblli JE, Lombrana A, Duarte P, Di Gennaro F. Intravenous iron reduces NTpro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. Journal of the American College of Cardiology 2007;50(17):1657–65.
28. Okonko DO, Grzeslo A, Witkowski T, et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. Journal of the American College of Cardiology 2008;51(2):103–12.
29. Van Wyck DB, Roppolo M, Martinez CO, et al, for the United States Iron Sucrose (Venofer) Clinical Trials Group: A randomized, controlled trial comparing IV iron sucrose to oral iron in anemic patients with nondialysis-dependent CKD. Kidney Int 2005;68:2846–56.
30. Rozen-Zvi B, Gafter-Gvili A, Paul M, et al. Intravenous versus oral iron supplementation for the treatment of anemia in CKD: systematic review and meta-analysis. Am J Kidney Dis 2008;52:897–906.
31. Palazzuoli A., Silverberg D. S., Iovine F. et al. Effects of β-erythropoietin treatment on left ventricular remodeling, systolic function, and B-type natriuretic peptide levels in patients with the cardiorenal anemia syndrome. American Heart Journal 2007;154(4): 645e9–5e15.
32. Krum H, Jelinek MV, Stewart S, Sindone A, Atherton JJ. National Heart Foundation of Australia; Cardiac Society of Australia and New Zealand. 2011 update to National Heart Foundation of Australia and Cardiac Society of Australia and New Zealand Guidelines for the prevention, detection and management of chronic heart failure in Australia, 2006. Med J Aust 2011;194(8):405–9.
33. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J 2012;33(14):1787–847.
| Май 2013 г. |