|
Опубликовано в журнале:
«Новые подходы в онкологии»; № 1(21); Февраль, 2013; стр. 5-16.РАСПРОСТРАНЕННОСТЬ И ЛЕЧЕНИЕ АНЕМИЙ ПРИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ, ЖЕЛЕЗОДЕФИЦИТ И СПЕЦИФИЧЕСКАЯ РОЛЬ ВНУТРИВЕННЫХ ПРЕПАРАТОВ ЖЕЛЕЗА
M. Aapro1*, A. Osterborg2, P. Gascon3, H. Ludwig4 и Y. Beguin5
1 IMO Clinique de Genolier, Женолье, Швейцария; 2Department of Hematology, Karolinska Institutet and Karolinska Hospital, Стокгольм, Швеция; 3Department of Haematology-Oncology, Hospital Clinic de Barcelona, University of Barcelona, Барселона, Испания; 4Department of Medicine I, Center for Oncology and Haematology, Wilhelminenspital, Вена, Австрия; 5Department of Medicine, Division of Hematology, University Hospital Liege, Льеж, БельгияВведение. Хронические заболевания снижают биодоступность железа, необходимого для эритропоэза. В данном обзоре обобщаются клинические последствия дефицита железа (железодефицит, ЖД) и анемий у пациентов со злокачественными новообразованиями, а также механизмы влияния нарушений обмена железа на диагностику и выбор метода лечения ЖД. Также в обзоре рассматриваются данные клинических исследований, оценивавших эффективность использования внутривенных препаратов железа как в качестве монотерапии, так и совместно со стимуляторами эритропоэза (СЭ).
Дизайн исследования. Соответствующие клинические исследования отбирались в ходе поиска в национальной медицинской библиотеке США PubMed и в сборниках тезисов основных конгрессов по данной тематике.
Результаты. Распространенность ЖД у онкологических пациентов варьирует от 32% до 60%, при этом у большинства больных с дефицитом железа также выявляется анемия. Рандомизированные клинические исследования продемонстрировали преимущество препаратов железа для внутривенного введения по сравнению с использованием его пероральных форм, или без его использования в отношении снижения частоты переливаний крови, повышения уровня гемоглобина и улучшения качества жизни онкологических пациентов, получающих лечение СЭ. Более того, применение в/в препаратов железа без дополнительного использования СЭ следует рассматривать в качестве потенциального метода лечения больных с анемией, индуцированной проведением химиотерапии. При использовании в рекомендованных дозах в/в препараты железа хорошо переносятся, в особенности по сравнению с пероральными препаратами железа. В ходе клинических исследований при длительном применении у больных с нарушением функции почек не было выявлено серьезных нежелательных явлений, связанных с применением парентеральных препаратов железа. У онкологических пациентов с анемией препараты не оказывали влияния на рост опухоли.
Выводы. Надежные методы диагностики и лечения ЖД являются ключевыми компонентами современной терапии злокачественных опухолей, направленными на минимизацию их влияния на качество жизни и общее состояние онкологических больных.
Ключевые слова: анемия; обусловленная химиотерапией анемия; диагностика; внутривенные препараты железа; железодефицит; гепсидин.Введение
Дефицит железа (железодефицит, ЖД) и анемия являются часто встречающимися осложнениями у больных онкологическими заболеваниями, особенно в результате проведения химиотерапии [1-3]. Даже при отсутствии анемии ЖД может привести к ухудшению функционального состояния пациента, появлению слабости и утомляемости. Однако эти осложнения могут быть скорректированы за счет применения препаратов железа [4]. ЖД при отсутствии лечения приводят к развитию анемии. Таким образом, нельзя недооценивать потенциальное влияние ЖД на такие уязвимые группы, как пациенты с онкологическими заболеваниями.Современные клинические руководства по лечению анемии злокачественных новообразований рекомендуют ограниченно использовать стимуляторы эритропоэза (СЭ) и уменьшить частоту гемотрансфузий, либо воздерживаться от их применения [5-8]. Результаты нескольких контролируемых клинических исследований продемонстрировали, что внутривенное введение препаратов железа улучшает ответ на введение стимуляторов эритропоэза и может снизить их назначаемые дозы у пациентов с онкологическими заболеваниями [9-14]. Первые результаты исследований по применению внутривенных препаратов железа без сопутствующей терапии СЭ показали, что их использование должно рассматриваться в качестве одного из методов лечения анемии у онкологических больных [15, 16].
Данный обзор сфокусирован на клинических последствиях дефицита железа и анемии у онкологических больных, а также на результатах клинических исследований, посвященных изучению роли в/в препаратов железа при лечении больных злокачественными опухолями. Также в обзоре обсуждаются механизмы развития анемии при онкологических заболеваниях, от понимания которых зависит правильная диагностика и выбор метода лечения ЖД или поддержания доступности запасов железа.
Стратегия поиска и критерии отбора
Данные подходящих для обзора клинических исследований отбирались в ходе поиска в базе данных национальной медицинской библиотеки США PubMed по таким ключевым словам, как «рак», «внутривенные препараты железа» или «парентеральное железо» и «анемия». Поиск был ограничен публикациями на английском языке. Данные, представленные только в виде резюме, отбирались в ходе рутинного поиска в сборниках тезисов основных конгрессов по данной тематике.Распространенность и тяжесть ЖД и анемии у пациентов со злокачественными новообразованиями
Высокая распространенность анемии у пациентов с различными онкологическими заболеваниями уже была продемонстрирована в исследовании European Cancer Anemia Survey (ECAS): у 39% пациентов анемия обнаружена при первичном обследовании; у 68% пациентов анемия была зафиксирована хотя бы однократно в течение 6 месяцев наблюдения [1]. В то же время опубликованные данные о распространенности ЖД у онкологических больных в целом довольно скудны (табл. 1) [2, 3, 17-19]. Наибольшая распространенность ЖД наблюдается у больных колоректальным раком (60% всех больных, при этом у 69% из них выявлена анемия) [2]. Хроническая кровопотеря у больных колоректальным раком и злокачественными заболеваниями желудочно-кишечного тракта, вероятно, делает их более подверженными развитию ЖД и анемии. Несмотря на это, распространенность ЖД и анемии в других популяциях также была очень высокой (29%-46% и 7%-42% соответственно) [3, 17-19].Таблица 1
Опубликованные данные о распространенности дефицита железа в различных популяциях пациентов со злокачественными новообразованиями
Новообразования/Пациенты (N) % пациентов с ЖД Показатели, по которым определялся ЖД % пациентов с ЖДА Kuvibidila, 2004 [3] Рак предстательной железы (34) 35 ФС < 12 пг/мла н.д. 32 НТЖ < 16% Beale, 2005 [2] Колоректальный рак (130) 60 ФС < 15 нг/мл и/или НТЖ < 14% 42b Steinmetz, 2010 [17] АИХ (286)
29 ИФ > 3,2e или CHr ≤ 28 пг 7d Beguin, 2009 [18] АИХ (481) 43 ФС < 100 нг/мл и/или НТЖ < 20% н.д. Ludwig, 2011 [19] Солидные опухоли (1053) 46 ФС < 30 нг/мл или НТЖ < 20% 33 a Или < 100 нг/мл у пациентов с воспалением.
b Hb < 12,5 г/дл у мужчин и Hb < 11,5 г/дл у женщин.
c Более, чем 2,0 у пациентов с уровнем С-реактивного белка > 5 мг/л.
d ИФ ≤ 3,2 (или 2,0) и CHr ≤ 28 пг.
АХЗ, анемия хронических заболеваний; CHr, содержание гемоглобина в ретикулоцитах; АИХ, анемия, индуцированная химиотерапией; ИФ, индекс отношения растворимых рецепторов ферритина к догарифму ферритина; ФЖД, функциональный дефицит железа; ЖД, железодефицит; ЖДА, железодефицитная анемия; ФС, ферритин сыворотки; НТЖ, насыщение трансферрина железом.Данные о влиянии ЖД на пациентов с онкологическими заболеваниями, доступные в настоящее время только в форме тезисов, предполагают наличие значимой корреляционной связи между низким уровнем железа и плохим общим состоянием по шкалам Всемирной организации здравоохранения (ВОЗ) [19]. Коррекция ЖД в популяции пациентов без онкологических заболеваний (пациенты с хронической сердечной недостаточностью) привела к значительному улучшению переносимости физической нагрузки, качества жизни и течения заболевания независимо от наличия анемии у данного больного [20].
Несколько больше данных имеется относительно значения анемии. Согласно этим данным, наличие анемии увеличивает риск смерти больных на 65% [21], при этом средние годовые затраты на лечение больного возрастают почти в четыре раза [22]. Прежде чем делать выводы относительно улучшения прогноза больных в результате лечения анемии, следует подтвердить причинно-следственные связи между анемией и риском смерти. Два крупных анализа продемонстрировали связь между уровнем гемоглобина и физическим состоянием, а также качеством жизни онкологических больных [1, 23]. В исследовании ECAS у больных с наихудшим общим состоянием (2-4) по шкале ВОЗ с большей вероятностью диагностировался низкий уровень гемоглобина (р < 0,001). Прямая корреляция между качеством жизни и уровнем гемоглобина у пациентов с онкологическими заболеваниями, получающих химиотерапию, была продемонстрирована при клинически значимом уровне гемоглобина в 8-14 г/дл. Соответственно, повышение уровня гемоглобина, достигнутое дополнительным внутривенным введением препаратов железа при терапии СЭ у больных с железодефицитной анемией (ЖДА), индуцированной химиотерапией, способствовало значительному увеличению выносливости, активности и улучшению качества жизни пациентов в целом (р < 0,0002) [9].
Методы диагностики и причины дефицита железа и анемии
Нарушение обмена железа при хронических заболеваниях
Анемия хронических заболеваний (АХЗ) и анемия, возникающая на фоне химиотерапии, являются основными причинами анемий у онкологических больных. Они могут усугубляться за счет хронической кровопотери и недостаточности питания (например, вследствие анорексии при раке или при удалении новообразований ЖКТ). У больных с АХЗ усвоение железа блокируется гепсидином, который является ключевым регулятором гомеостаза железа (рис. 1) [24, 25]. Повышение уровня гепсидина блокирует обусловленное ферропортином высвобождение железа из энтероцитов и макрофагов [25]. В отдаленном периоде это может привести к абсолютному ЖД (АЖД, недостаточные запасы железа) вследствие нарушения его усваиваемости из пищи или применяемых внутрь препаратов. Если гепсидиновый блок существует недолго, то это может привести к функциональному железодефициту (ФЖД) - состоянию, при котором железо не может быть эффективно мобилизовано из запасов в ретикулоэндотелиальной системе (РЭС) [24]. При наличии воспалительного процесса высвобождение железа снижено до 44% по сравнению со здоровыми людьми (рис. 2) [26]. Таким образом, даже у пациентов с достаточными запасами железа могут возникнуть ситуации с уменьшением количества доступного железа, особенно в случае быстрого роста числа эритроцитов крови при применении СЭ [28].
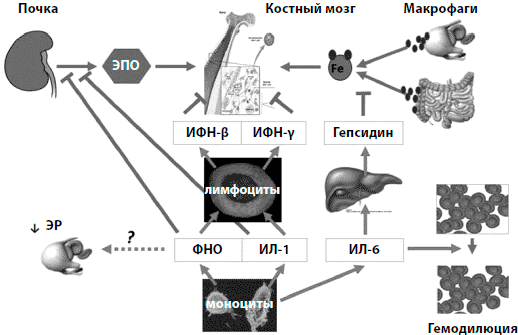
Рисунок 1. Гепсидин-опосредованное торможение гомеостаза железа, возникающее вследствие воспалительного процесса при анемии хронических заболеваний. В процессе воспаления моноциты осуществляют выброс цитокинов, таких как фактор некроза опухолей (ФНО; TNF), интерлейкин (ИЛ; IL)-1 и ИЛ (IL)-6. Продолжительность жизни эритроцитов (ЭР; RBC) снижается, вероятно, посредством ФНО-зависимого механизма. ФНО и ИЛ-1 уменьшают выработку эритропоэтина (ЭПО) почками и стимулируют лимфоциты к выбросу интерферонов, которые в свою очередь ингибируют пролиферацию и дифференцировку клеток-предшественниц эритроцитов. С другой стороны, ИЛ-6 усугубляет тяжесть анемии посредством увеличения объема плазмы. Также ИЛ-6 увеличивает секрецию гепсидина печенью, таким образом ингибируя процессы всасывания железа и его высвобождения из макрофагов [24].
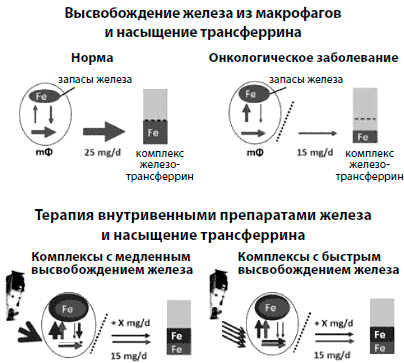
Рисунок 2. Механизм преодоления блокады метаболизма железа путем использования внутривенных препаратов железа у пациентов с хроническими заболеваниями. Внутривенные препараты железа могут помочь преодолеть блокаду метаболизма железа и снизить уровень гепсидина у пациентов с хроническими заболеваниями. Железо, проникающее в макрофаги в составе стареющего эритроцита (в сером) или в/в железа (в черном), может либо немедленно высвобождаться (и насытить до определенной степени трансферрин плазмы), либо откладываться в виде ферритина. По сравнению с ежедневным количеством высвобождаемого из макрофагов 25 мг железа у здоровых людей, у пациентов с воспалением эта цифра снижается до -15 мг в день [26]. У таких пациентов стабильные карбогидратные комплексы в/в препаратов железа осуществляют высвобождение железа в течение длительного периода времени, так что большие дозы железа могут быть введены однократно, в то время как менее стабильные комплексы быстро разрушаются макрофагами и, таким образом, требуют многократного введения в низких дозах [27].Воспалительные цитокины также подавляют пролиферацию и дифференцировку клеток-предшественников эритроцитов и снижают эндогенный синтез эритропоэтина в почках [29]. Также нарушению нормальных процессов гемопоэза могут способствовать: снижение чувствительности к эритропоэтину, снижение продолжительности жизни эритроцитов, солидные опухоли и метастазы с инфильтрацией костного мозга, а также миелосупрессивный эффект химиотерапии [25, 30-32].
Диагностические маркеры дефицита железа у пациентов с хроническими заболеваниями
Ферритин сыворотки крови является наиболее часто используемым диагностическим маркером, который в основном отражает состояние запасов железа, в то время как уровень насыщения трансферрина железом (НТЖ), процентное содержание гипохромных эритроцитов (% HYPO) и содержание гемоглобина в ретикулоцитах (CHr) лучше отражает степень биодоступности железа [33]. Поскольку уровень сывороточного ферритина - белка острой фазы - может повышаться в связи с воспалением или деструкцией гепатоцитов, нормальный или высокий уровень ферритина не обязательно отражает наличие достаточных запасов железа, особенно у онкологических больных [34]. Таким образом, рутинный анализ крови должен также включать исследование уровня С-реактивного белка (СРБ) и аланинаминотрансферазы (АЛАТ) для выявления воспаления или нарушения функции печени. Определение уровня растворимых рецепторов трансферрина, недавно предложенное для выбора тактики лечения онкологических больных (СЭ, только препараты железа или их комбинация [17, 35]), скорее отражает активность эритропоэза, чем содержание железа, и поэтому не может быть использовано для оценки уровня железа при стимуляции эритропоэза, например, при использовании СЭ. Таким образом, в рутинной клинической практике уровень сывороточного ферритина < 100 нг/мл, возможно, демонстрирует недостаточный запас железа для проведения успешной терапии СЭ у онкологических больных, а одновременное снижение НТЖ (< 20%) и нормальный или высокий уровень ферритина может означать наличие ФЖД (рис. 3) [34].
Рисунок 3. Критерии диагностики дефицита железа в рутинной практике. Минимальные (черным) и оптимальные (серым) параметры клинического обследования, необходимые для постановки диагноза дефицита железа и разграничения абсолютного и функционального дефицита железа в рутинной практике.АХЗ, анемия хронических заболеваний; CHr, содержание гемоглобина в ретикулоцитах; HYPO, гипохромные эритроциты; ЖДА, железодефицитная анемия; НТЖ, насыщение трансферрина железом.Возможность использования НТЖ в качестве маркера функционального дефицита железа была продемонстрирована у пациентов с лимфопролиферативными заболеваниями, при которых у 39% больных, несмотря на наличие достаточных запасов железа в костном мозге, уровень НТЖ составлял < 20% [12]. В последующих клинических исследованиях средний уровень НТЖ снижался у пациентов, получавших монотерапию СЭ, и возрастал у пациентов при одновременном назначении СЭ и в/в препаратов железа. Расхождение значений уровня сывороточного ферритина и НТЖ также обнаруживалось у пациентов с гематологическими и другими онкологическими заболеваниями. У 22% больных с уровнем сывороточного ферритина 100-800 нг/мл и даже у 24% больных с уровнем сывороточного ферритина ≥ 800 нг/мл была выявлена ЖДА (НТЖ < 20% и Hb < 12 г/дл) [36].
Другие маркеры эритропоэза в условиях ограниченного запаса железа (% HYPO > 5%, CHr < 26 пг), особенно быстроизменяющийся показатель содержания гемоглобина в ретикулоцитах, отражают исход эритропоэза [33]. Однако для изучения данных параметров требуется высокотехнологичное оборудование и быстрая обработка образцов с целью предупреждения деструкции эритроцитов.
Лечение дефицита железа и анемии
Рекомендации и нормативные требования
Методы лечения анемии у онкологических больных включают переливание крови, использование СЭ и в/в введение препаратов железа. Целью лечения анемии является улучшение качества жизни больных и снижение потребности в гемотрансфузиях [5-8], которые ассоциированы с потенциальным риском передачи инфекционных заболеваний, развитием трансфузионных реакций, повреждением легких и аллоиммунизацией [38-41]. Более того, переливание крови само по себе может повышать риск летального исхода и тяжелых осложнений, таких как инсульт, инфаркт миокарда, острая почечная недостаточность и рецидив злокачественной опухоли [38-41].Потребность в гемотрансфузиях у пациентов с онкологическими заболеваниями может быть снижена путем применения СЭ [42], однако гематологический ответ на СЭ довольно ограничен (30-75% пациентов) [43-45]. Более того, данные клинических исследований, систематических обзоров и мета-анализов вызывают беспокойство в связи с увеличением риска возникновения тромбоэмболий и повышением риска смерти у больных, не получающих химиотерапию, при использовании СЭ, особенно при применении без четких показаний [8]. В связи с этим, Европейское агентство лекарственных средств (ЕМА) пересмотрело целевые показатели уровня гемоглобина и особо отметило, что СЭ должны применяться только для лечения пациентов с симптомами анемии [46]. Управление по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA) ограничило показания к применению СЭ только популяцией больных с анемией, подлежащих проведению миелосупрессивной химиотерапии, с целью улучшения исхода лечения [47, 48]. FDA также внедрило в практику программу по минимизации риска, включающую обучение медицинских работников, назначающих СЭ, и информирование пациента о рисках, связанных с терапией СЭ [49]. Другие ограничения предполагают начало терапии СЭ у больных с уровнем гемоглобина < 10 г/дл, снижение дозировки при повышении уровня гемоглобина на ≥ 1 г/дл в течение двух недель, избегание назначения СЭ онкологическим больным, которые не проходят одновременно лечение миелосупрессивными химиотерапевтическими препаратами [8].
В свою очередь, согласно действующим клиническим рекомендациям по лечению анемии у онкологических больных, применение внутривенных препаратов железа улучшает эффективность терапии СЭ у пациентов с абсолютным или функциональным железодефицитом [5-8]. Национальная всеобщая онкологическая сеть (The National Comprehensive Cancer Network - NCCN) предлагает рассматривать возможность применения в/в препаратов железа у пациентов с ФЖД, уровнем сывороточного ферритина до 800 нг/мл при уровне НТЖ менее 20%; наличие активного инфекционного процесса является единственным противопоказанием для их использования [7]. Поскольку у пациентов с анемией и достаточными запасами железа эффект от использования в/в препаратов железа может появиться только после начала терапии СЭ [8], у них рекомендуется проводить оценку обмена железа исходно, перед началом каждого цикла химиотерапии и в процессе лечения анемии, для того чтобы своевременно начать применение препаратов железа.
Прием пероральных препаратов железа рекомендован только в случае абсолютного ЖД [7]. Хотя препараты железа для приема внутрь используются чаще, чем в/в препараты железа, они менее эффективны (особенно у онкологических больных, получающих лечение СЭ) и ассоциированы с возникновением нежелательных реакций со стороны ЖКТ и плохой приверженностью к лечению [7, 50].
Дополнение терапии СЭ препаратами в/в железа
В период с 2004 по 2011 г. были опубликованы результаты семи рандомизированных контролируемых клинических исследований по оценке эффективности в/в применения препаратов железа при терапии СЭ у онкологических больных с анемией [9-14, 51]. Шесть исследований касались анемии, обусловленной проведением химиотерапии, и одно - анемии, не связанной с ее проведением [12]. Во всех исследованиях, за исключением одного с нестандартным режимом дозирования [51], была продемонстрирована значительная эффективность применения в/в препаратов железа. В исследованиях, в которые не вошли больные с функциональным дефицитом железа, частота ответа на лечение увеличилась на 13-19% [10, 11, 13, 14]. При включении в исследования больных с ФЖД абсолютное увеличение частоты ответа на лечение у пациентов, получавших в/в препараты железа, составляло почти 34%-43% по сравнению с пациентами, не получавшими железо [9, 12]. В двух исследованиях был продемонстрирован гораздо более быстрый ответ, связанный с в/в применением препаратов железа [12, 14]. Это подтверждает концепцию о том, что высокие дозы в/в препаратов железа могут помочь преодолеть гепсидин-опосредованное снижение высвобождения железа из клеток ретикулоэндотелиальной системы (рис. 2).В исследованиях, включающих группы пациентов, получавших пероральные препараты железа, применение в/в препаратов по сравнению с ними значительно улучшило гематологический ответ. В то же время, значимых различий в эффективности между группами перорального препарата железа и группами, не получавшими железо вообще, выявлено не было [9, 13]. Несмотря на то что в исследования включались различные популяции пациентов, использовались различные лекарственные формы в/в железа, проводилась различная сопутствующая химиотерапия, возможность обобщения результатов остается под вопросом [8]. В частности, широкий разброс отклонений частоты ответа уровня гемоглобина на лечение между исследуемой и контрольной группами (13%-43%), а также исследования, которые, казалось бы, не демонстрируют выгоды применения парентеральных препаратов железа, могут вызвать опасения насчет гетерогенности исследований. Однако обобщенные результаты исследований, включавших пациентов с ФЖД [9,12] и фокусировавшихся на пациентах с достаточными запасами железа [10, 11, 13, 14], продемонстрировали значительное увеличение частоты ответа на лечение в каждой из двух популяций.
Мета-анализ восьми публикаций и тезисов исследований, сравнивающих применение в/в препаратов железа на фоне терапии СЭ с применением препаратов железа для приема внутрь или без использования препаратов железа (N = 1555; включая семь исследований, упомянутых выше), продемонстрировал увеличение на 31% количества пациентов, ответивших на терапию [95% доверительный интервал (ДИ) 1,15-1,49] [52]. Схожим образом другой мета-анализ семи исследований, сравнивавших применение в/в препаратов железа и отсутствие препаратов железа при терапии СЭ, продемонстрировал значительное увеличение вероятности гематологического ответа (на 29%) и снижение необходимости проведения гемотрансфузий на 23% (95% ДИ 0,62-0,97) в группе пациентов, получавших в/в препараты железа. При сравнении эффективности применения препаратов железа для приема внутрь и отсутствия терапии препаратами железа в трех исследованиях, разницы в гематологическом ответе не было; обнаружено только незначительное снижение трансфузионного риска [53].
Дозировка в/в препаратов железа
В первом опубликованном исследовании, посвященном дополнительному применению в/в препаратов железа при терапии СЭ, в которое включались пациенты с ЖД, суммарная дозировка железа доходила до 3000 мг [9]. В пяти последующих исследованиях запланированная суммарная дозировка железа составила около 1000 мг (табл. 2). В одном из исследований планируемая суммарная дозировка составила 2000 мг, однако назначенная суммарная дозировка препарата в среднем составила только 1169 мг [10]. Максимальная разовая доза и минимальное время инфузии имеющихся на рынке парентеральных лекарственных форм железа (табл. 3) зависит от их профиля переносимости, в основном определяющегося биохимическими свойствами и процессами производства. Стабильные комплексы железа могут применяться в высоких дозах по 20 мг/кг массы тела с продолжительностью инфузии от 15 минут (карбоксимальтоза железа) до 6 часов (декстран железа). Комплексы, более быстро высвобождающие железо, должны назначаться с меньшей скоростью инфузии и в меньшей дозировке (рис. 2).Таблица 2
Запланированная общая и еженедельная доза в/в препаратов железа в опубликованных рандомизированных контролируемых исследованиях дополнительного применения в/в препаратов железа при терапии СЭ у онкологических пациентов a
Железо в мг Auerbach, 2004 [9] Hedenus, 2007 [12] Henry, 2007 [13] Bastit, 2008 [11] Pedrazzoli, 2008 [14] Auerbach, 2010 [10] Steensma, 2011 [51,54] Еженедельная доза 100 100 и 50b 125 67 125 133 62.5 Общая доза 1000-3000 1100 1000 1000 750 2000 937,5 aБолее детальная информация о популяции пациентов, лечении и исходах доступна в электронном приложении (дополнительная таблица S1 доступна в электронной версии журнала Annals of Oncology).
b100 мг железа раз в неделю с 0 по 6 недели и каждую вторую неделю с 8 по 14 недели.Влияние режима дозирования препарата, не соответствующего клиническим рекомендациям, или даже его использование не по зарегистрированным показаниям было показано лишь в одном исследовании, в котором не было продемонстрировано значимой выгоды от применения в/в препаратов железа [55, 56]. В этом исследовании пациенты получали железа-натрия глюконат однократно в дозе 187,5 мг, что на 50% больше рекомендованной однократной дозы и ассоциировано с более высокой частотой возникновения и/или степенью выраженности нежелательных явлений (НЯ). В противоположность этому, 3-недельный интервал между введениями в этом исследовании привел к введению наименьшей расчетной недельной дозы препарата среди всех опубликованных исследований (табл. 2) [51, 52]. На основании ретроспективных анализов сделано предположение о том, что ответ на лечение железа-натрия глюконатом зависит как от дозы в/в препарата железа, так и от уровня гепсидина [54, 56]. Пациенты, которые получали ≥ 750 мг препаратов железа, достигли 80% частоты ответа на лечение по сравнению с 67% и 65% в группе пациентов, получавших препараты железа для приема внутрь или плацебо соответственно. Пациенты с низким или средним уровнем гепсидина (≤ 64,3 нг/мл) продемонстрировали лучшую частоту ответа на лечение, чем больные с высоким уровнем гепсидина.
Уменьшение частоты переливаний крови и дозировок СЭ
Наряду с уменьшением выраженности симптомов анемии, одним из важнейших аспектов в оценке таких методов лечения анемии, как применение в/в препаратов железа, является их потенциальная возможность снижения потребности в переливаниях крови и/или снижения дозировок СЭ. В одном достаточно крупном для оценки потенциальных различий в частоте переливаний крови (N = 396 пациентов) исследовании было продемонстрировано значительное снижение потребности в гемотрансфузиях при использовании в/в препаратов железа, по сравнению с применением препаратов железа для приема внутрь или без их использования [11]. В то время как в предшествующих менее масштабных исследованиях было отмечено снижение количества трансфузий при использовании в/в препаратов железа по сравнению с применением препаратов железа для приема внутрь или без их использования только начиная с 4 недели [13], данное крупное исследование продемонстрировало значительное снижение количества необходимых гемотрансфузий в группе пациентов, получавших в/в препараты железа, независимо от того, за весь период исследования производилась оценка (P = 0,038) или только с 5 недели и до конца исследования (P = 0,005). Единственное другое исследование того же масштаба было завершено досрочно, как обсуждалось ранее [51, 55].Только в одном из исследований, подтвердивших эффективность дополнительного применения в/в препаратов железа, были опубликованы данные по дозировкам СЭ [12, 57]. Было продемонстрировано, что через 5 недель применения в/в препаратов железа необходимость в СЭ снижается, достигая статистической значимости на 13 неделе лечения (P = 0,029). В целом, дополнительное применение в/в препаратов железа наряду с применением эритропоэтина β снизило среднюю суммарную дозу СЭ на 18% и среднюю дозу СЭ в конце исследования (15 неделя) на 25%. Проведенный фармакоэкономический анализ выявил, что экономия, полученная от снижения дозировок СЭ, превысила все дополнительные затраты, обусловленные назначением в/в препаратов железа. При назначении вместе с СЭ в/в препаратов железа можно достичь финансовой выгоды в 11% [57]. Еще одно исследование продемонстрировало, что комбинация дарбэпоэтина-альфа и 400 мг в/в препарата железа дает приблизительно такое же улучшение гематологического ответа и общего состояния, как и увеличение дозы СЭ с 300 до 500 мг дарбэпоэтина-альфа (при применении каждые 3 недели) [10].
Какова потенциальная роль в/в препаратов железа в качестве терапии первой линии у больных с анемией, обусловленной проведением химиотерапии?
Согласно клиническим руководствам, лечение непосредственной причины анемии, такой как железодефицит, следует проводить до назначения СЭ. Однако результаты исследований, в которых изучается роль в/в препаратов железа в качестве единственного способа лечения анемии у онкологических больных, только начинают публиковаться. Уже опубликовано два небольших (N = 44 и 75 пациентов) релевантных контролируемых рандомизированных клинических исследования. Оба исследования включали пациентов со злокачественными новообразованиями женской репродуктивной системы, получавших химиотерапию или химиолучевую терапию, и в обоих исследованиях применение в/в препаратов железа значительно снизило число необходимых гемотрансфузий [15, 16]. В одном из исследований значительно более высокие уровни гемоглобина к завершению наблюдения наблюдались у пациентов, получавших в/в препараты железа, по сравнению с больными, принимавшими препараты железа внутрь, независимо от того, проводилась гемотрансфузия или нет [15]. В другом исследовании, сравнивавшем применение в/в препаратов железа и отсутствие лечения анемии вовсе, была достигнута низкая частота трансфузий, несмотря на исходно большее число включенных в исследование пациентов с анемией [16]. Оба исследования не давали оценку параметрам, характеризующим статус железа, таким как уровень НТЖ и уровень сывороточного ферритина; таким образом, доля больных с функциональным или абсолютным дефицитом железа не могла быть определена.В отсутствие других рандомизированных контролируемых исследований, исследование, проведенное Steinmetz et al. [17], является более информативным. Это проспективное мультицентровое исследование в параллельных группах было спланировано для изучения обоснований распределения пациентов в группу лечения или только СЭ, или СЭ и в/в препаратами железа, или только в/в препаратами железа. Распределение проводилось на основании диагностической диаграммы, построенной согласно анализу показателей содержания гемоглобина в ретикулоцитах (анемия определена как CHr ≤ 28 пг) и индекса ферритина (АЖД определяется как индекс ферритина > 2,0 или > 3,2 в зависимости от того, превышал ли уровень СРБ > 5 мг/мл, либо нет). Пациенты с анемией, но без дефицита железа, получали лечение только СЭ, пациенты с ФЖД и анемией получали и СЭ, и в\в препараты железа, пациенты с железодефицитной анемией получали только препараты железа. Частота ответа на лечение (увеличение Hb > 1 г/дл от исходного значения) была сходной у пациентов, получавших в качестве монотерапии в/в препараты железа или СЭ. Однако у 49% пациентов, ответивших на лечение СЭ повышением уровня Hb, затем развивался ЖД (определено по индексу ферритина) в течение 12 недель исследования. Этот результат, по сравнению только с 19% таких больных в группе, получавшей СЭ и в/в препараты железа, дает основание предполагать, что назначение в/в препаратов железа пациентам, имеюшим исходно достаточные запасы железа, также может быть эффективным [17].
Таблица 3
Максимально разрешенные для применения разовые дозы в/в форм карбогидратов железа
Железа-натрия глюконат Сахароза железа Ферумокситол Железа декстран Изомальтоза железа Карбоксимальтоза железа Необходимость в пробной дозе Нет В некоторых странах Нет Да Нет Нет Максимальная доза в одной инфузии 125 мг железа 200-500 мг железа 510 мг железа 20 мг железа на кг массы тела 1000 мг железа (20 мг железа на кг массы тела) 1000 мг железа (20 мг железа на кг массы тела) Минимальное время инфузии 60 мин 30-210 мин 17 сек 240-360 мин 60 мин 15 мин аНа основании результатов недавно проведенных клинических исследований, NCCN сменила рекомендованную дозу с 200 до 125 мг железа за 60 минут [7].
b Доступно только в США;
Для уточнения дозировки смотрите инструкции по применению препарата.Примечательно, что мультицентровое обсервационное исследование, посвященное применению карбоксимальтозы железа в клинической практике, продемонстрировало среднее увеличение уровня гемоглобина на 1,4 г/дл в течение 12 недель исследования (медиана общей дозы железа составила 1000 мг) несмотря на то, что большинство больных (83%) получали карбоксмальтозу железа без СЭ [58].
Профили безопасности и эффективности в/в препаратов железа, используемых в качестве монотерапии для лечения ЖД и анемии были подробно изучены у пациентов с различными хроническими заболеваниями. Несколько рандомизированных контролируемых исследований продемонстрировали, что в/в препараты железа хорошо переносятся и эффективны при лечении ЖДА, а также улучшают качество жизни у пациентов с воспалительными заболеваниями кишечника [59, 60]. У больных с хронической сердечной недостаточностью применение в/в препаратов железа значительно уменьшило функциональный класс сердечной недостаточности по NYHA (New York Heart Association, Нью-Йоркская ассоциация сердца), улучшило переносимость физических нагрузок и качество жизни как у пациентов с анемией, так и без нее [20].
Переносимость в/в препаратов железа в ежедневной клинической практике
В шести из семи рандомизированных контролируемых клинических исследований, оценивавших дополнительное применение в/в препаратов железа при терапии СЭ у онкологических больных, не было выявлено различий в частоте возникновения нежелательных явлений между группами пациентов, получавших в/в препараты железа, и контрольными группами [9-14]. Индивидуальные высокие дозы железа-натрия глюконата, которые превышают рекомендованные, могут быть причиной, по которой в одном из исследований была получена большая частота возникновения нежелательных явлений в группе пациентов, получавших в/в препараты железа [51, 55].Распространенным предубеждением в отношении применения в/в препаратов железа являются реакции гиперчувствительности. Однако 3 анализа, оценивавшие НЯ с 1997 по 2009 г., показали, что аллергические и анафилактические реакции, даже если изредка и встречались, в основном были связаны с использованием декстран-содержащих препаратов (рис. 4) [61-63]. Даже при использовании низкомолекулярных декстранов (европейские данные), частота анафилактических реакций значительно выше по сравнению с сахарозой железа или железо-натрия глюконатом (15,6, 0,9, и 0,4 на миллион при дозировке, эквивалентной 100 мг железа, соответственно).
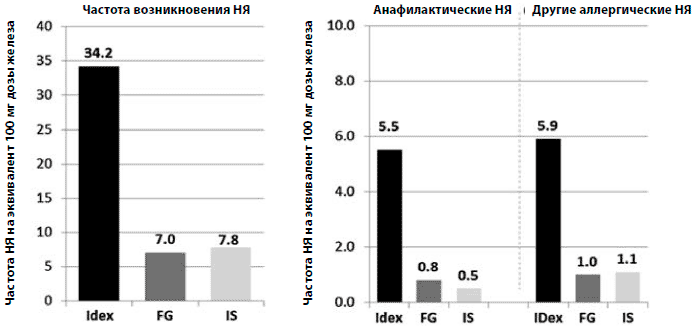
Рисунок 4. Частота возникновения нежелательных явлений при использовании парентеральных препаратов железа в Европе и Северной Америке (2003-2009). Частота всех нежелательных явлений (НЯ), а также частота анафилактических и серьезных аллергических НЯ на эквивалент 100 мг дозы железа в Европе и Северной Америке в период с 2003 по 2009 годы [61]. За период наблюдения при применении железо-декстрановых препаратов (IDex) общее число анафилактических или других серьезных аллергических НЯ было в 6-10 раз выше, чем при применении других в/в препаратов железа (сахароза железа, IS; железа-натрия глюконат, FG). (Рисунок адаптирован из Bailie et al. Drug Research 2011 [61]).Общая частота НЯ на миллион доз в эквиваленте 100 мг железа в Европе составляет 68,9 при применении декстран-содержащих препаратов с низким молекулярным весом, 12,8 - сахарозы железа и 3,5 - железо-натрия глюконата [61]. В Северной Америке частота НЯ при применении препаратов сахарозы железа ниже (4,4), что может быть связано с появлением аналогов сахарозы железа в Европе, но не в США. Терапевтическая и токсикологическая равноценность этих аналогов в настоящее время обсуждается, поэтому должно быть проведено прямое клиническое сравнение аналогов и оригинальных препаратов [64-66]. Примечательно, что в Северной Америке частота НЯ при использовании препаратов железо-натрия глюконата выше по сравнению с Европой (12,6 против 3,5), что может быть связано с более высокой максимальной разрешенной дозой железа (125 против 62,5 мг в большинстве Европейских стран).
Другой часто задаваемый вопрос - увеличивает ли применение в/в препаратов железа риск возникновения инфекций? Согласно имеющимся данным, повышения риска инфекций у онкологических пациентов, получавших в/в препараты железа по поводу анемии, не отмечено. В исследовании, проведенном в группе пациентов, находящихся на гемодиализе, среди больных, получавших в/в препараты железа, было показано даже снижение частоты госпитализаций, связанных с инфекциями (относительный риск 0,54, P < 0,001), и смертности (относительный риск = 0,61, P = 0,08) по сравнению с общей популяцией [67]. Несмотря на это, результаты исследований, проведенных на животных моделях, позволяют заключить, что назначения в/в препаратов железа следует избегать у больных с активным инфекционным процессом [68].
Ограничения в применении в/в препаратов железа в клинической практике
Потенциальным ограничением для применения в/в препаратов железа у онкологических больных может быть взаимодействие железа и определенных химиотерапевтических препаратов, в частности антрациклинов и препаратов платины [69, 70]. В случае с антрациклинами, данные доклинических исследований демонстрируют, что перенос электронов супероксидными радикалами приводит к высвобождению двухвалентного железа (Fe2+) из многоядерного оксигидроксида железа (Fe3+). Высвобожденное железо может быть обратно окислено до двухвалентного железа посредством реакции Фентона и создаст таким путем высокореактивный гидроксидный радикал [71]. Таким образом, окислительно-восстановительный цикл железа, в частности лабильного железа, не связанного с трансферрином, может привести к окислительному стрессу и повреждению тканей. Кардиотоксичность других химиотерапевтических препаратов, вероятнее всего, обусловлена другими факторами, такими как ингибирование ряда киназ или снижение продукции оксида азота, а не взаимодействием с железом [72, 73]. Доступные в настоящее время результаты клинических исследований, посвященных применению в/в препаратов железа у онкологических больных, говорят об отсутствии у пациентов признаков токсичности, связанной непосредственно с препаратами железа. В настоящее время имеются только неклинические данные относительно токсических свойств препаратов железа. До тех пор пока не будет получена информация об этой токсичности для людей, следует раздельно вводить кардиотоксичные химиотерапевтические препараты и препараты железа, а лечение анемии начинать при первом визите после курса потенциально кардиотоксичной химиотерапии.Вопрос о потенциальном влиянии железа на рост новообразования в основном проистекает из эпидемиологических исследований, демонстрирующих связь между состояниями, ассоциированными с длительной перегрузкой железом (например, гемохроматоз), и высоким риском возникновения опухолей [71]. Однако эти состояния не отражают ситуацию у онкологических пациентов с анемией и железодефицитом, получающих в/в препараты железа в относительно более короткие промежутки времени, для пополнения запасов железа. Потенциальная роль железа в росте уже существующих новообразований была изучена на неклинических моделях. Однако на этих моделях, часто у животных с достаточными запасами железа, использовались избыточные для них дозы препаратов, или же препараты железа вводились интраперитонеально [74, 75]. До настоящего времени нет опубликованных данных о применении в/в препаратов железа на животной модели онкологического заболевания. Таким образом, практическая значимость доступных неклинических исследований должна быть тщательно сопоставлена с рисками для больного, которые присущи другим методам лечения анемии, или отсутствием лечения. К сожалению, большинство исследований по применению в/в препаратов железа у онкологических больных не ставят задачи получения отдаленных результатов. В ходе одного проспективного рандомизированного контролируемого исследования, которое было опубликовано только в виде тезисов, наблюдались только пациенты с лимфоидными опухолями, получавшие дарбэпоэтин-альфа и в/в препараты железа стразу после аутологичной трансплантации стволовых клеток. В этом предварительном исследовании трехлетняя выживаемость без прогрессирования заболевания не зависела от проводимого лечения в/в препаратами железа [76, 77].
Заключение
Ввиду высокой распространенности у пациентов с онкологическими заболеваниями железодефицит и анемия требуют к себе пристального внимания в клинической практике. Согласно современным клиническим руководствам по лечению онкологических больных с анемией, ЖД следует рассматривать как причину анемии до назначения лечения СЭ, а в/в применение препаратов железа гораздо эффективнее препаратов для приема внутрь. Тщательная и регулярная оценка состояния обмена железа у онкологических больных (перед каждым циклом химиотерапии) может помочь удостовериться, что пациенты получают оптимальную для них терапию. Среди различных маркеров статуса железа уровень НТЖ рассматривается как наиболее надежный маркер, который позволяет обнаружить как абсолютный, так и относительный ЖД без необходимости проведения других тестов для оценки функции печени или для выявления воспаления.Опубликованные рандомизированные контролируемые исследования показали, что применение в/в препаратов железа повышает частоту ответа терапию СЭ, а также может способствовать снижению дозировки СЭ и снижению потребности в гемотрансфузиях, несмотря на то что необходимо дальнейшее изучение долгосрочной безопасности препаратов. В имеющихся ранних сообщениях по применению в/в препаратов железа в качестве первой линии терапии анемии, предполагается, что у некоторых пациентов применение в/в препаратов железа может быть эффективным даже без сопутствующей терапии СЭ. Однако для подтверждения отдаленной эффективности и безопасности этих препаратов необходимы более крупные рандомизированные контролируемые исследования с длительным наблюдением.
Благодарность
Все авторы внесли равный вклад в поиск литературы, интерпретацию информации и критический обзор публикации. YB подготовил рисунки 1, 2 и 3. Медицинская поддержка при подготовке публикации осуществлялась Walter Furst (SFL Regulatory Affairs & Scientific Communication, Швейцария).Финансирование
Данное исследование поддерживалось неограниченным грантом от фирмы Vifor Pharma Ltd. (Швейцария), финансирующей помощь при медицинских публикациях.Конфликт интересов
Все авторы независимо принимали участие в интерпретации данных, написании обзора и принятии решения о подаче работы для публикации. MA сообщил о работе в качестве лектора и/или в консультативном совете и/или в получении исследовательского гранта от Vifor Pharma, Sandoz, Amgen, Roche, Hexal и Hospira. AO сообщил о получении гонораров за участие в консультативном совете и проведение клинических исследований компании Vifor Pharma. PG заявил об отсутствии конфликта интересов. HL сообщил о работе в качестве лектора в компании Vifor Pharma. YB сообщил о работе в качестве лектора в компании Vifor Pharma.ЛИТЕРАТУРА
1. Ludwig H, Van BS, Barrett-Lee P et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 2004; 40: 2293-2306.
2. Beale AL, Penney MD, Allison MC. The prevalence of iron deficiency among patients presenting with colorectal cancer. Colorectal Dis 2005; 7: 398-402.
3. Kuvibidila SR, Gauthier T, Rayford W. Serum ferritin levels and transferrin saturation in men with prostate cancer. J Natl Med Assoc 2004; 96: 641-649.
4. Krayenbuehl PA, Battegay E, Breymann C et al. Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood 2011; 118: 3222-3227.
5. Aapro MS, Link H. September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents. Oncologist 2008; 13 (Suppl 3): 33-36.
6. Bokemeyer C, Aapro MS, Courdi A et al. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer: 2006 update. Eur J Cancer 2007; 43: 258-270.
7. National Comprehensive Cancer Network Inc. NCCN Practice Guidelines in Oncology; Cancer and Chemotherapy-Induced Anemia—v.2. 2012.
8. Rizzo JD, Brouwers M, Hurley P et al. American Society of Hematology/ American Society of Clinical Oncology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer. Blood 2010; 116: 4045-4059.
9. Auerbach M, Ballard H, Trout JR et al. Intravenous iron optimizes the response to recombinant human erythropoietin in cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial. J Clin Oncol 2004; 22: 1301-1307.
10. Auerbach M, Silberstein PT, Webb RT et al. Darbepoetin alfa 300 or 500 ug once every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. Am J Hematol 2010; 85: 655-663.
11. Bastit L, Vandebroek A, Altintas S et al. Randomized, multicenter, controlled trial comparing the efficacy and safety of darbepoetin alpha administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. J Clin Oncol 2008; 26: 1611-1618.
12. Hedenus M, Birgegard G, Nasman P et al. Addition of intravenous iron to epoetin beta increases hemoglobin response and decreases epoetin dose requirement in anemic patients with lymphoproliferative malignancies: a randomized multicenter study. Leukemia 2007; 21: 627-632.
13. Henry DH, Dahl NV, Auerbach M et al. Intravenous ferric gluconate significantly improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy. Oncologist 2007; 12: 231-242.
14. Pedrazzoli P, Farris A, Del PS et al. Randomized trial of intravenous iron supplementation in patients with chemotherapy-related anemia without iron deficiency treated with darbepoetin alpha. J Clin Oncol 2008; 26: 1619-1625.
15. Dangsuwan P, Manchana T. Blood transfusion reduction with intravenous iron in gynecologic cancer patients receiving chemotherapy. Gynecol Oncol 2010; 1 16: 522-525.
16. Kim YT, Kim SW, Yoon BS et al. Effect of intravenously administered iron sucrose on the prevention of anemia in the cervical cancer patients treated with concurrent chemoradiotherapy. Gynecol Oncol 2007; 105: 199-204.
17. Steinmetz HT, Tsamaloukas A, Schmitz S et al. A new concept for the differential diagnosis and therapy of anaemia in cancer patients. Support Care Cancer 2010; 19: 261-269.
18. Beguin Y, Lybaert W, Bosly A. A prospective observational study exploring the impact of iron status on response to darbepoetin alfa in patients with chemotherapy induced anemia. Blood 2009; 114 (Abstr 2007).
19. Ludwig H, Muldur E, Endler G et al. High prevalence of iron deficiency across different tumors correlates with anemia, increases during cancer treatment and is associated with poor performance status. Haematologica 2011; 96 (Abstr 982).
20. Anker SD, Comin CJ, Filippatos G et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361: 24362448.
21. Caro JJ, Salas M, Ward A et al. Anemia as an independent prognostic factor for survival in patients with cancer: a systemic, quantitative review. Cancer 2001; 91: 2214-2221.
22. Nissenson AR, Wade S, Goodnough T et al. Economic burden of anemia in an insured population. J Manag Care Pharm 2005; 11: 565-574.
23. Crawford J, Cella D, Cleeland CS et al. Relationship between changes in hemoglobin level and quality of life during chemotherapy in anemic cancer patients receiving epoetin alfa therapy. Cancer 2002; 95: 888-895.
24. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005; 352: 1011-1023.
25. Grotto HZ. Anaemia of cancer: an overview of mechanisms involved in its pathogenesis. Med Oncol 2008; 25: 12-21.
26. Fillet G, BeguinY, Baldelli L. Model of reticuloendothelial iron metabolism in humans: abnormal behavior in idiopathic hemochromatosis and in inflammation. Blood 1989; 74: 844-851.
27. Van Wyck D, Anderson J, Johnson K. Labile iron in parenteral iron formulations: a quantitative and comparative study. Nephrol Dial Transplant 2004; 19: 561-565.
28. Brugnara C, Chambers LA, Malynn E et al. Red blood cell regeneration induced by subcutaneous recombinant erythropoietin: iron-deficient erythropoiesis in ironreplete subjects. Blood 1993; 81: 956-964.
29. Weiss G. Iron metabolism in the anemia of chronic disease. Biochim Biophys Acta 2009; 1790: 682-693.
30. Groopman JE, Itri LM. Chemotherapy-induced anemia in adults: incidence and treatment. J Natl Cancer Inst 1999; 91: 1616-1634.
31. Tas F, Eralp Y, Basaran M et al. Anemia in oncology practice: relation to diseases and their therapies. Am J Clin Oncol 2002; 25: 371-379.
32. Untch M, Mobus V, Kuhn W et al. Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for high-risk primary breast cancer. J Clin Oncol 2009; 27: 2938-2945.
33. Wish JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol 2006; 1Suppl 1S4-S8.
34. Beguin Y. Prediction of response and other improvements on the limitations of recombinant human erythropoietin therapy in anemic cancer patients. Haematologica 2002; 87: 1209-1221.
35. Thomas C, Kirschbaum A, Boehm D et al. The diagnostic plot: a concept for identifying different states of iron deficiency and monitoring the response to epoetin therapy. Med Oncol 2006; 23: 23-36.
36. Ludwig H, Endler G, Hubl W et al. High prevalence of iron deficiency in patients with various hematological and malignant diseases: a single center study in 1989 sequential patients. Haematologica 2010; 95 (Abstr 1819).
37. Vamvakas EC, Blajchman MA. Transfusion-related mortality: the ongoing risks of allogeneic blood transfusion and the available strategies for their prevention. Blood 2009; 113: 3406-3417.
38. Marik PE, Corwin HL. Efficacy of red blood cell transfusion in the critically ill: a systematic review of the literature. Crit Care Med 2008; 36: 2667-2674.
39. Thomson A, Farmer S, Hofmann A et al. Patient blood management—a new paradigm for transfusion medicine?. ISBT Science Series 2009; 4: 423-435.
40. Rawn J. The silent risks of blood transfusion. Curr Opin Anaesthesiol 2008; 21: 664-668.
41. Amato AC, Pescatori M. Effect of perioperative blood transfusions on recurrence of colorectal cancer: meta-analysis stratified on risk factors. Dis Colon Rectum 1998; 41: 570-585. Annals of Oncology reviews Volume 23 | No. 8 | August 2012 doi:10.1093/annonc/mds112 | 1961
42. Bohlius J, Schmidlin K, Brillant C et al. Erythropoietin or darbepoetin for patients with cancer—meta-analysis based on individual patient data. Cochrane Database Syst Rev 2009; CD007303.
43. Gabrilove JL, Cleeland CS, Livingston RB et al. Clinical evaluation of once-weekly dosing of epoetin alfa in chemotherapy patients: improvements in hemoglobin and quality of life are similar to three-times-weekly dosing. J Clin Oncol 2001; 19: 2875-2882.
44. Littlewood TJ, Bajetta E, Nortier JW et al. Effects of epoetin alfa on hematologic parameters and quality of life in cancer patients receiving nonplatinum chemotherapy: results of a randomized, double-blind, placebo-controlled trial. J Clin Oncol 2001; 19: 2865-2874.
45. Ludwig H, Aapro M, Bokemeyer C et al. Treatment patterns and outcomes in the management of anaemia in cancer patients in Europe: findings from the Anaemia Cancer Treatment (ACT) study. Eur J Cancer 2009; 45: 1603-1615.
46. European Medicines Agency. Summary of scientific discussion.
47. US Food and Drug Administration. Epoetin Alfa (Marketed as Epoetin, Procrit) Label.
48. US Food and Drug Administration. Darbepoetin Alfa (Marketed as Aransep) Label.
49. US Food and Drug Administration. FDA Announces New Safety Plan for Agents Used to Treat Chemotherapy-Related Anemia. Newsroom/PressAnnouncements/2010/ ucm200471.htm (5 September 2011, date last accessed).
50. Macdougall IC. Strategies for iron supplementation: oral versus intravenous. Kidney Int Suppl 1999; 69: S61-S66.
51. Steensma DP, Sloan JA, Dakhil SR et al. Phase III, randomized study of the effects of parenteral iron, oral iron, or no iron supplementation on the erythropoietic response to darbepoetin alfa for patients with chemotherapyassociated anemia. J Clin Oncol 2011; 29: 97-105.
52. Gafter-Gvili A, Rozen-Zvi B, Vidal L et al. Intravenous iron supplementation for the treatment of cancer-related anemia—systematic review and meta-analysis. Blood 2010; 116 (Abstr 4249).
53. Petrelli F, Borgonovo K, Cabiddu M et al. Addition of iron to erythropoiesisstimulating agents in cancer patients: a meta-analysis of randomized trials. J Cancer Res Clin Oncol 2012; 138: 179-187.
54. Steensma DP, Sloan JA, Loprinzi CL. Reply to M. Aapro et al. J Clin Oncol 2011;29: e527-e528.
55. Aapro M, Beguin Y, Birgegard G et al. Too-low iron doses and too many dropouts in negative iron trial?. J Clin Oncol 2011; 29: e525-e526.
56. Steensma DP, Sasu BJ, Sloan JA et al. The relationship between serum hepcidin levels and clinical outcomes in patients with chemotherapy-associated anemia treated in a controlled trial. J Clin Oncol 2011; 29 (Abstr 9031).
57. Hedenus M, Nasman P, Liwing J. Economic evaluation in Sweden of epoetin beta with intravenous iron supplementation in anaemic patients with lymphoproliferative malignancies not receiving chemotherapy. J Clin Pharm Ther 2008; 33: 365-374.
58. Steinmetz T, Tschechne B, Virgin G et al. Ferric carboxymaltose for the correction of cancer- and chemotherapy-associated anemia in clinical practice. Haematologica 2011; 96 (Abstr 983).
59. Evstatiev R, Marteau P, Iqbal T et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology 2011; 141: 846-853.
60. Kulnigg S, Stoinov S, Simanenkov V et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol 2008; 103: 1182-1192.
61. Bailie GR, Horl WH, Verhof JJ. Differences in spontaneously reported hypersensitivity and serious adverse events for intravenous iron preparations: comparison of Europe and North America. Drug Res 2011; 61: 267-275.
62. Bailie GR, Clark JA, Lane CE et al. Hypersensitivity reactions and deaths associated with intravenous iron preparations. Nephrol Dial Transplant 2005; 20: 1443-1449.
63. Chertow GM, Mason PD, Vaage-Nilsen O et al. Update on adverse drug events associated with parenteral iron. Nephrol Dial Transplant 2006; 21: 378-382.
64. European Medicines Agency. Reflection Paper on Non-Clinical Studies for Generic Nanoparticle Iron Medicinal Product Applications.
65. Rottembourg J, Kadri A, Leonard E et al. Do two intravenous iron sucrose preparations have the same efficacy?. Nephrol Dial Transplant 2011; 26: 3262-3267.
66. Schellekens H, Klinger E, Muhlebach S et al. The therapeutic equivalence of complex drugs. Regul Toxicol Pharmacol 2011; 59: 176-183.
67. Aronoff GR, Bennett WM, Blumenthal S et al. Iron sucrose in hemodialysis patients: safety of replacement and maintenance regimens. Kidney Int 2004; 66: 1193-1198.
68. Zhang F, Wang W, Tsuji Y et al. Post-transcriptional modulation of iron homeostasis during p53-dependent growth arrest. J Biol Chem 2008; 283: 33911-33918.
69. Baliga R, Zhang Z, Baliga M et al. In vitro and in vivo evidence suggesting a role for iron in cisplatin-induced nephrotoxicity. Kidney Int 1998; 53: 394-401.
70. Minotti G, Menna P, Salvatorelli E et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacol Rev 2004; 56: 185-229.
71. Toyokuni S. Role of iron in carcinogenesis: cancer as a ferrotoxic disease. Cancer Sci 2009; 100: 9-16.
72. Hasinoff BB, Patel D, O'Hara KA. Mechanisms of myocyte cytotoxicity induced by the multiple receptor tyrosine kinase inhibitor sunitinib. Mol Pharmacol 2008; 74: 1722-1728.
73. Kamba T, McDonald DM. Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br J Cancer 2007; 96: 1788-1795.
74. Bergeron RJ, Streiff RR, Elliott GT. Influence of iron on in vivo proliferation and lethality of L1210 cells. J Nutr 1985; 115: 369-374.
75. Carthew P, Nolan BM, Smith AG et al. Iron promotes DEN initiated GST-P foci in rat liver. Carcinogenesis 1997; 18: 599-603.
76. Auerbach M, Glaspy J. What is the right balance between iron and erythropoiesis stimulating agents in chemotherapy induced anemia?. Eur J Clin Med Oncol 2009; 1: 7-12.
77. Beguin Y, Maertens J, De Prijck B et al. Darbepoetin-alfa and i.v. iron administration after autologous hematopoietic stem cell transplantation: a prospective randomized multicenter trial. Blood 2008; 112: (Abstr 54).
| Май 2013 г. |