Опубликовано в журнале:
«CONSILIUM MEDICUM», ТОМ №10, № 9, с. 67-72Современный алгоритм лечения сахарного диабета типа 2. Кому и как назначать комбинированные сахораснижающие препараты
Т.В.Никонова
Эндокринологический научный центр Росмедтехнологий, МоскваСахарный диабет (СД) – одно из наиболее распространенных в мире заболеваний. В силу эпидемического характера распространения, большой частоты развития сосудистых осложнений и высокого уровня смертности в 2006 г. принята резолюция ООН о борьбе с СД. В настоящее время число больных СД в мире превышает 246 млн человек. Около 85–90% составляют больные СД типа 2. СД типа 2 увеличивает риск развития ишемической болезни сердца (ИБС) и инсульта, а также сердечно-сосудистую смертность, которая, по данным ряда исследований, у больных СД типа 2 в 3 раза выше, чем в общей популяции. Удовлетворительное самочувствие пациентов в начале заболевания оттягивает диагностику и начало медикаментозной терапии у многих больных СД типа 2, в связи с чем почти у 1/3 пациентов микро- и макрососудистые осложнения выявляют одновременно с установлением диагноза СД.
К основным патофизиологическим механизмам развития СД типа 2 относят инсулинорезистентность (ИР) и дисфункцию β-клеток поджелудочной железы. На начальных стадиях заболевания ИР вызывает компенсаторное повышение инкреции инсулина. Однако по мере прогрессирования ИР и развития гипергликемии концентрация инсулина в плазме снижается. При манифестации СД типа 2 инкреция инсулина снижается на 50%, чувствительность к инсулину – на 70% [4]. Развитие ИР тканей предшествует СД и зависит как от генетических факторов, так и от факторов внешней среды. Идентифицировано большое количество мутаций, обусловливающих развитие ИР, однако частота их встречаемости в популяции невелика. Вероятнее всего, чувствительность к инсулину определяется эффектом многих генов [3]. К приобретенным факторам, влияющим на чувствительность к инсулину, относятся возраст, качество питания, физическая активность, ожирение и тип распределения жира. ИР диагностируют практически у 90% пациентов с СД типа 2 [9].
Нарушение секреции инсулина может быть связано с ИР самих β-клеток [28].
При СД типа 2 резистентность к действию инсулина развивается в мышечной, жировой ткани и ткани печени:
- ИР мышечной ткани выражается в снижении поступления глюкозы в миоциты;
- ИР жировой ткани – в отсутствие антилиполитического действия инсулина, накоплении свободных жирных кислот (СЖК) [21];
- ИР ткани печени – в снижении синтеза гликогена и активации гликогенолиза [11].
Таким образом, основным стратегическим направлением лечения СД типа 2 должно быть воздействие на ИР как на основополагающий патофизиологический механизм развития заболевания. При увеличении чувствительности к инсулину снижается нагрузка на инкреторный аппарат поджелудочной железы, нивелируется отрицательное влияние гиперинсулинемии на состояние сердечно-сосудистой системы, а также приводящее к повышению аппетита и увеличению массы тела.
Для медикаментозного лечения ИР при СД типа 2 используют пероральные сахароснижающие препараты группы бигуанидов и тиазолидиндионов (глитазонов).
История применения бигуанидов берет начало со Средних веков, когда для лечения СД применяли содержащий гуанидины экстракт [1]. Химический синтез бигуанидов впервые осуществлен в 1920-х годах, а в практику лечения они вошли в конце 1950-х годов.
Метформин – препарат группы бигуанидов, находящийся на международном фармацевтическом рынке уже более 40 лет. Конец XX столетия можно охарактеризовать как "второе рождение" этого препарата. "Ренессанс" метформина связан с ростом интереса к синдрому ИР, а также с публикацией результатов британского проспективного исследования UKPDS (United Kindom Prospective Diabetes Study) [33]. В этом масштабном и долгосрочном исследовании была показана высокая эффективность применения Глюкофажа (оригинального препарата метформина) при СД. На фоне приема метформина обусловленная СД летальность снизилась на 42%, общая смертность – на 36%, частота развития осложнений – на 32% по сравнению с группой пациентов, находившихся только на диетотерапии. В группах больных, не получавших метформин, эти показатели были значительно хуже [14]. Проведенные в последнее десятилетие многочисленные испытания метформина позволили не только оценить терапевтическую значимость и подтвердить положительное влияние на предотвращение развития сердечно-сосудистых осложнений СД, но и расширили круг показаний к назначению препарата.
Так, обсервационное исследование, проведенное J.Evans и соавт. (2005 г.), позволило предположить, что метформин оказывает протективное действие в отношении некоторых видов рака [15].
В консенсусе АDA/EASD, принятом в 2006 г., метформин рекомендован как препарат первого выбора, который назначается сразу после постановки диагноза СД, параллельно с изменением образа жизни, не ожидая нескольких месяцев, пока изменение образа жизни приведет к улучшению гликемического профиля (рис. 1).
Рис. 1. ADA/EASD-консенсус для СД типа 2 [30].
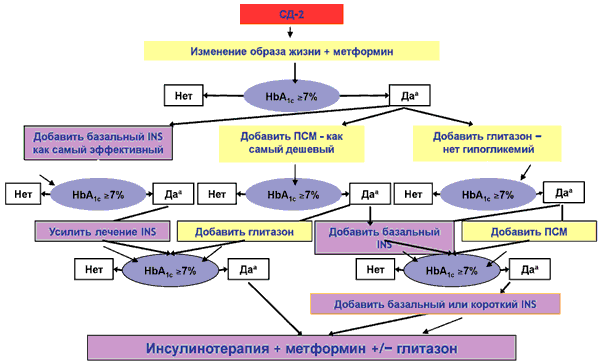
Метформин показан больным СД типа 2 не только с избыточной, но и с нормальной массой тела. Антигипергликемическое действие метформина обусловлено несколькими механизмами:
- снижением продукции глюкозы печенью (у больных СД типа 2 печень продуцирует глюкозу, по крайней мере в 2 раза больше, чем в норме) за счет подавления глюконеогенеза и гликогенолиза [23, 31];
- повышением синтеза гликогена;
- увеличением чувствительности гепатоцитов к инсулину.
Метформин улучшает утилизацию глюкозы периферическими тканями благодаря повышению активности трансмембранных транспортеров глюкозы GLUT-1, GLUT-3 и GLUT-4. Кроме того, метформин задерживает абсорбцию глюкозы в кишечнике, что способствует снижению пиков постпрандиальной гликемии. Немаловажен анорексигенный эффект препарата, обусловленный его прямым контактом со слизистой оболочкой желудочно-кишечного тракта. К дополнительным благоприятным эффектам этого препарата относят снижение массы тела (преимущественно за счет уменьшения жировой ткани), улучшение липидного профиля и фибринолитической активности крови, что обусловливает кариопротективное действие метформина. Снижая концентрацию свободных жирных кислот (на 10–17%), метформин не только улучшает чувствительность к инсулину, но и способствует восстановлению нарушенной секреции инсулина [1, 10, 24, 33].
Вазопротективные эффекты метформина обусловлены нормализацией цикла сокращение–расслабление артериол, уменьшением проницаемости сосудистой стенки и торможением неоангиогенеза. Механизм активации фибринолиза обусловлен снижением концентрации и активности ингибитора активатора тканевого плазминогена-1 (PAI-1) (рис. 2).
Рис. 2. Динамика изменения фибринолиза на фоне терапии метформином [19].
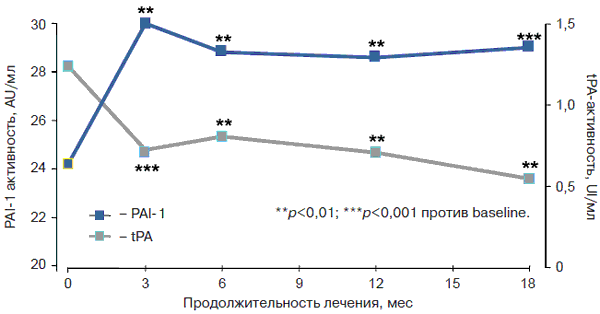
Метформин обладает и ангиоксидантной активностью, обусловленной торможением клеточных окислительных реакций, в том числе и окислительного гликозилирования белков [27, 30]. Лечение препаратом начинают с дозы 500–850 мг, принимаемых во время ужина. В дальнейшем дозу препарата увеличивают на 500–850 мг каждые 1–2 нед. Оптимальной суточной дозой, при которой наблюдают наиболее близкие к целевым показатели контроля гликемии, считают 2000 мг. Метформин не стимулирует продукцию инсулина β-клетками, поэтому риск развития гипогликемии на фоне его приема практически отсутствует (рис. 3).
Рис. 3. Данные рандомизированного многоцентрового исследования, в кото- ром принял участие 451 больной СД типа 2 – UKPDS: оптимальная дозировка метформина – 2000 мг/сут [17].
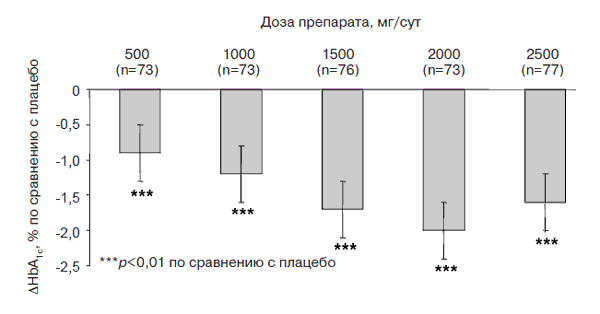
При назначении метформина у части пациентов развиваются нежелательные лекарственные реакции (диарея, метеоризм, металлический вкус во рту). Во избежание появления таких симптомов следует постепенно увеличивать дозу препарата, а в некоторых случаях – временно снижать ее. К противопоказаниям к назначению метформина относятся нарушения функции почек (снижение клиренса креатинина ниже 50 мл/мин или повышение концентрации креатинина в крови выше 130–150 мкмоль/л), беременность, лактация, злоупотребление алкоголем, гипоксические состояния любой природы (из-за возможности развития лактатацидоза). Соблюдение правил назначения метформина исключает риск развития лактатацидоза [20].
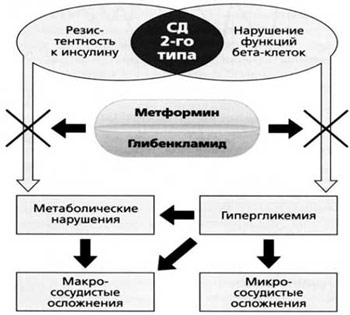
Недостижение целевых показателей постпрандиальной гликемии на фоне лечения метформином свидетельствует о значительном инкреторном дефекте β-клеток и необходимости назначения комбинированной терапии, в основе которой лежат дополняющие друг друга механизмы действия препаратов. Эффективно применение метформина в комбинации с препаратами сульфонилмочевины (рис. 4).
Рис. 4. Совместные эффекты метформина и глибенкламида.
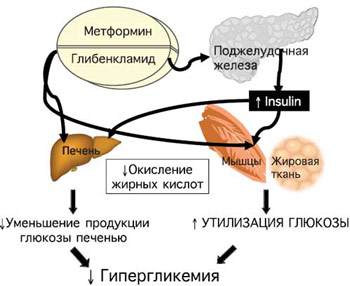
При этом важной целью считают упрощение схемы сахароснижающей терапии. Глюкованс – современный комбинированный препарат, обеспечивающий патогенетический подход к лечению СД типа 2 (рис. 5).
Рис. 5. Влияние Глюкованса на патогенетические механизмы развития СД типа 2.
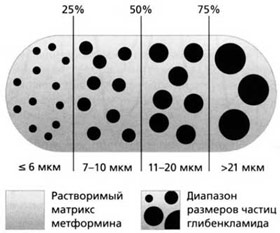
Глюкованс – сбалансированная комбинация метформина 500 мг и глибенкламида в дозе 2,5 мг или 5 мг в одной таблетке. Это единственный комбинированный препарат, в котором глибенкламид представлен в виде микронизированной формы. Технология производства Глюкованса уникальна: глибенкламид в виде частиц строго определенного размера равномерно распределен в растворимом матриксе метформина [12] (рис. 6).
Рис. 6. Структура Глюкованса.
Микронизированные формы глибенкламида характеризуются значительно лучшей биодоступностью, при их использовании пик концентрации активного препарата в плазме крови наступает раньше, чем у немикронизированных форм. При приеме Глюкованса эти особенности позволяют добиться более эффективного контроля концентрации глюкозы в плазме крови после еды и снижения HbA1c по сравнению с монотерапией его компонентами. Микронизированная форма глибенкламида в составе Глюкованса обеспечивает безопасность препарата при высокой эффективности [22]. Препарат оказывает меньшее воздействие на β-клетки, не повышает концентрацию инсулина в плазме крови натощак, и снижает риск гипогликемий (рис. 7).
Рис. 7. Концентрация глибенкламида в плазме крови [12].
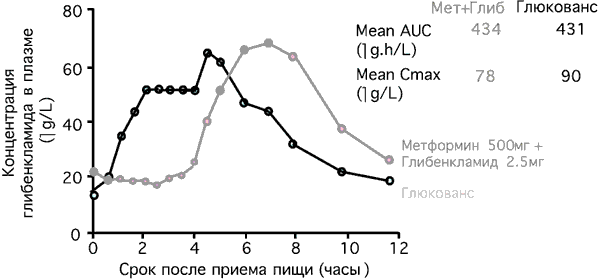
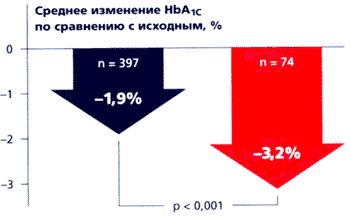
Быстрое всасывание глибенкламида согласуется во времени с изменениями постпрандиальной гликемии, поэтому Глюкованс следует принимать во время еды. Эффективность глюкованса сравнивали с таковой современных средств монотерапии в многоцентровых рандомизированных клинических исследованиях с двойным слепым контролем и параллельным участием групп больных. В четырех двойных слепых рандомизированных плацебо-контролируемых многоцентровых исследованиях сравнивали Глюкованс с монотерапией метформином и глибенкламидом [5, 16, 18, 26]. В исследования включали пациентов, страдающих СД типа 2 и не достигающих целевых показателей контроля гликемии, несмотря на диету, физические упражнения, применение метформина или по крайней мере 50% максимальной дозы сульфонилмочевины (в этом исследовании 65% больных ранее получали глибенкламид). В совокупности в этих четырех исследованиях участвовали 2342 больных. Во всех четырех исследованиях наилучшие результаты были достигнуты в группах больных, принимавших Глюкованс. Глюкованс обеспечивал более значительное снижение концентрации HbA1c и глюкозы в плазме крови натощак (рис. 8).
Рис. 8. Эффекты Глюкованса по сравнению с приемом отдельных препаратов [6, 8].
Средние конечные дозы
Глюкованс®:
метформин 764 мг
глибенкламид 5 мг
Метформин+глибенкламид:
метформин 1384 мг
глибенкламид 10 мгЭто преимущество достигалось при меньших средних суточных дозах метформина и глибенкламида, чем при применении этих препаратов по отдельности. В 52-недельном дополнительном исследовании с участием больных, ранее получавших препараты производных сульфонилмочевины, средняя концентрация HbA1c уменьшилась с 9,4 до 7,4% [7]. Кроме того, в этом исследовании получены данные, позволяющие назначать Глюкованс 500/5 мг больным, нуждающимся в высоких дозах препарата, для достижения оптимальных показателей гликемии. В этом исследовании дозу Глюкованса сначала повышали до 4 таблеток в день (суточная доза метформина/глибенкламида – 2000/10 мг или 2000/20 мг). Через 26 нед лечения больным с концентрацией HbA1c более 7% дозу Глюкованса увеличивали до 2000/20 мг (по 500/5 мг 4 раза в день) либо до 2500/20 мг (500/5 мг 3 раза в день плюс 500/2,5 мг 2 раза в день).
Из 188 человек, исходно получавших таблетки 500/2,5 мг, 85 больным потребовался переход на прием таблеток 500/5 мг/сут. В фазе лечения с двойным слепым контролем концентрация HbA1c у этих больных снизилась с 8,4 до 8,2%, а при применении таблеток Глюкованса 500/2,5 мг (до 4 раз в день) средняя концентрация HbA1c уменьшилась еще на 0,3%. Дальнейшее повышение дозы Глюкованса с использованием дозы 500/5 мг сопровождалось дополнительным снижением концентрации HbA1c на 0,5%. Таким образом, при неэффективности дозировки препарата 500/2,5 мг прием Глюкованса в дозе 500/5 мг может помочь достичь оптимальных показателей контроля гликемии.
В нескольких ретроспективных исследованиях оценивали эффекты перевода больных с комбинированного применения метформина и глибенкламида на Глюкованс. В одном из них проанализированы данные о 72 больных, получавших комбинацию метформина и глибенкламида, по крайней мере 6 мес до взятия анализа, а затем получавших Глюкованс в суточных дозах до 2000/20 мг в среднем в течение 196 дней [13].
В результате приема Глюкованса концентрация HbA1c снизилась среди всех больных в среднем на 0,6%, а среди больных, исходно имевших HbA1c>8% – на 1,3%. После перевода больных на Глюкованс средняя суточная доза меформина у них достоверно увеличилась (р=0,02), а доза глибенкламида уменьшилась (р=0,007).
Более высокая эффективность Глюкованса по сравнению с комбинацией метформина и глибенкламида может быть обусловлена лучшей комплаентностью и более быстрым всасыванием глибенкламида в уникальной структуре Глюкованса. Больные СД типа 2 часто принимают одновременно несколько лекарственных препаратов. Комбинация препаратов в одной таблетке упрощает схему пероральной сахароснижающей терапии и обеспечивает хорошее соблюдение больными назначенного лечения.
Основным показанием к назначению Глюкованса остается СД типа 2 у взрослых, при неэффективности предшествующей терапии метформином и (или) глибенкламидом. Противопоказания к назначению Глюкованса складываются из известных противопоказаний к назначению метформина и глибенкламида.
Глюкованс следует принимать во время еды. При неэффективности монотерапии оптимальной дозой метформина (как правило, 2000 мг/сут) больных переводят на Глюкованс (по 1 таблетке 500/2,5 мг/сут), затем дозу препарата повышают. При переводе с комбинированного приема метформина и препарата сульфонилмочевины на Глюкованс начальная суточная доза Глюкованса составляет 1–2 таблетки по 500/2,5 мг с последующей титрацией. При этом начальная доза глибенкламида в Глюковансе не должна превышать ранее применявшейся дозы сульфонилмочевины. Максимальная суточная доза составляет 4 таблетки Глюкованса по 500/5 мг. При переходе с Глюкованса 500/2,5 мг на Глюкованс 500/5 мг последний применяют с дозы, не превышавшей ранее применявшейся дозы глибенкламида, а затем дозу постепенно увеличивают по мере необходимости. Максимальная доза составляет 4 таблетки Глюкованса по 500/5 мг/сут (2000/20 мг).
Таким образом, Глюкованс – современный уникальный препарат, влияющий на два основных патофизиологических звена патогенеза СД типа 2. Это единственный комбинированный препарат, в состав которого входит микронизированная форма глибенкламида. Выбор дозировок позволяет титровать дозы. Глюкованс высокоэффективен в малых дозах, а удобный прием препарата обеспечивает хорошую комплаентность.
ЛИТЕРАТУРА
1. Старостина Е.Г., Древаль А.В. Бигуаниди в лечении сахарного диабета 2 типа. М.: Медпрактика, 2000.
2. Bailey CJ, Turner RC. Metformin. N Engl J Med 1996; 334: 574–9.
3. Barroso I, Gurnell M, Crowley VE et al. Dominant negative mutations in human PPARgamma associated with severe insulin resistance, diabetes mellitus and hypertension. Nature 1999; 402 (6764): 880–3.
4. Beck-Nielsen H, Groop LC. Metabolic and genetic characterization of prediabetic states. Sequence of events leading to non-insulin-dependent diabetes mellitus. J Clin Invest 1994; 94: 1714–21.
5. Blonde L, Rosenstock J, Mooradian AD et al. Gly-buride/metformin combination product is safe and efficacious in patients with type 2 diabetes failing sulphonylurea therapy. Diab Obes Met 2002; 4 (6): 368–75.
6. Blonde L, Wogen J, Kreilick C, Seymour AA. Greater reductions in A1C in type 2 diabetic patients new to therapy with glyburide/metformin tablets as compared to glyburide co-administered with metformin. Diab Obes Met 2003; 5 (6): 424–31.
7. Blonde L, Rosenstock L, Piper BA, Henry D. Durable Antidiabetic Effect Of Glyburide/Metformin Tabletes As Second-Line Therapy For Tipe 2 Diabetes. Diabetes 50 (Suppl. 2): A106.
8. Blonde L, Wolgen J, Kreilik C, Seymour A. Switching to glyburide/metformin tabletes from co-administrated of glyburide plus metformin is associated with A1c reduction. Diabetes 2003; 52 (Suppl. 1): A442.
9. Bonora E, Kiechl S, Willeit J et al. Prevalence of insulin resistance in metabolic disorders: the Bru-neck Study. Diabetes 1998; 47 (10): 1643–9.
10. Davidson MB, Peters AL. An overview of met-formin in the treatment of type 2 diabetes mellitus. Am J Med 1997; 102 (1): 99–110.
11. DeFronzo RA. Lilly lecture 1987. The triumvirate: beta-cell, muscle, liver. A collusion responsible for NIDDM. Diabetes 1988; 37 (6): 667–87.
12. Donahue SR, Turner KC, Patel S. Pharmacokinet-ics and pharmacodynamics of glyburide/metformin tablets (Glucovance) versus equivalent doses of gly-buride and metformin in patients with type 2 diabetes. Clin Pharmacokinet 2002; 41: 1301–9.
13. Duckworth W, Marcelli M, Padden M et al. Improvements in glycemic control in type 2 diabetes patients switched from sulfonylurea coadministered with metformin to glyburide-metformin tablets. J Manag Care Pharm 2003; 9 (3): 256–62.
14. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352 (9131): 854–65.
15. Evans JM, Donnelly LA, Emslie-Smith AM et al. Metformin and reduced risk of cancer in diabetic patients. BMJ 2005; 330 (7503): 1304–5.
16. Garber AJ, Donovan DSJr, Dandona P et al. Efficacy of glyburide/metformin tablets compared with initial monotherapy in type 2 diabetes. J Clin Endocrinol Met 2003; 88 (8): 3598–604.
17. Garber AJ, Duncan TG, Goodman AM et al. Efficacy of metformin in type II diabetes: results of a double-blind, placebo-controlled, dose-response trial. Am J Med 1997; 103: 491–7.
18. Garber AJ, Larsen J, Schneider SH et al. Simultaneous glyburide/metformin therapy is superior to component monotherapy as an initial pharmacological treatment for type 2 diabetes. Diabetes Obes Met 2002; 4 (3): 201–8.
19. Gregorio F, Ambrosi F, Manfrini S et al. Poorly controlled elderly Type 2 diabetic patients: the effects of increasing sulphonylurea dosages or adding met-formin. Diabet Med 1999; 16: 1016–24.
20. Harris MI. Epidemiologic studies on the patho-genesis of non-insulin-dependent diabetes mellitus (NIDDM). Clin Invest Med 1995; 18 (4): 231–9.
21. Hennes MM, Shrago E, Kissebah AH. Receptor and postreceptor effects of free fatty acids (FFA) on hepa-tocyte insulin dynamics. Int J Obes 1990; 14 (10): 831–41.
22. Howlett H, Porte F, Allavoine T et al. The development of an oral antidiabetic combination tablet: design, evaluation and clinical benefits for patients with type 2 diabetes. Curr Med Res Opin 2003; 19 (3): 218–25.
23. Jeng CY, Sheu WH, Fuh MM et al. Relationship between hepatic glucose production and fasting plasma glucose concentration in patients with NIDDM. Diabetes 1994; 43: 1440–4.
24. Kimmel B, Inzucchi EM. Oral Agents For Type 2 Diabetes: An Update. Clin Diabetes 2005; 23 (2): 64–76.
25. Management of Hyperglycemia in tipe 2 Diabetes: A Consensus algorithm for the Initiation and Agjustment of therapy. Diab Care 2006; 29 (8): 1963–72.
26. Marre M, Howlett H, Lehert P, Allavoine T. Improved glycaemic control with metformin-gliben-clamide combined tablet therapy (Glucovance) in Type 2 diabetic patients inadequately controlled on metformin. Diab Med 2002; 19 (8): 673–80.
27. Nagi DK, Yudkin JS. Effects of metformin on insulin resistance, risk factors for cardiovascular disease, and plasminogen activator inhibitor in NIDDM subjects. A study of two ethnic groups. Diabetes Care 1993; 16 (4): 621–9.
28. Nandi A, Kitamura Y, Kahn CR, Accili D. Mouse models of insulin resistance. Physiol Rev 2004; 84 (2): 623–47.
29. Nathan DM, Buse JB, Davidson MB et al. Management of hyperglycaemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2006; 49 (8): 1711–21.
30. PatanП G, Piro S, Rabuazzo AM et al. Metformin restores insulin secretion altered by chronic exposure to free fatty acids or high glucose: a direct met-formin effect on pancreatic beta-cells. Diabetes 2000; 49 (5): 735–40.
31. Perriello G, Misericordia P, Volpi E et al. Acute antihyperglycemic mechanisms of metformin in NIDDM. Evidence for suppression of lipid oxidation and hepatic glucose production. Diabetes 1994; 43: 920–8.
32. Stratton IM, Adler AI, Neil HA et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321 (7258): 405–12.
33. Wiernsperger NF, Bailey CJ. The antihypergly-caemic effect of metformin: therapeutic and cellular mechanisms. Drugs 1999; 58 (Suppl. 1): 31–9.
| Август 2011 г. |