Предупреждение! Препарат рецептурного отпуска! Использовать только после назначения врача! Анализ переносимости Xefocam® в клинических исследованиях
В недавнем обзоре и мета-анализе всех клинических экспериментов, проводимых на Xefocam®, были собраны более чем 100 клинических исследований разной продолжительности и включающих более 11 000 пациентов ((Grarup, Olsen et al. 2001) Clinical Safety Report, Nycomed 2001). 6 000 пациентов принимали Xefocam® (данные первой фазы не были включены) безотносительно к возрасту, полу и состоянию органов.
В таблице 1 предоставлены суммарное количество пациентов, подвергшихся воздействию Xefocam® и других лекарств. Эти данные репрезентируют свыше 1 100 пациентов в год, принимающих Xefocam®, и охватывают более чем 6 538 пациентов, пролечиваемых Xefocam®.
Таблица 7. Количество пациентов по времени экспозиции, дозам Xefocam® и способу лечения ((Таблица 9 из (Grarup and others 2001)
Пациенты первой фазы не включены
Время экспозиции (месяцы) Всего Лечение Xefocam®
суточная доза≤1 1-2 2-3 3-6 6-9 9-12 12-18 >18 Кол-во пациентов Пациентов в год Xefocam® < 8 мг 874 5 3 1 2 4 889 28.0 8 мг 1,716 77 23 36 40 174 16 22 2,104 351.2 12 мг 880 25 10 24 28 123 15 56 1,161 339.2 16 мг 1,403 22 18 26 45 208 14 14 1,750 339.8 > 16 мг 578 8 6 6 2 33 1 634 54.7 Xefocam® всего 5,451 137 60 93 117 538 50 92 6,538 1,112.9 Диклофенак 334 125 14 473 53.0 Напроксен 278 126 34 438 54.3 Индометацин 78 23 2 103 9.2 Пироксикам 10 40 20 70 15.1 Аспирин 148 148 0.4 Ибупрофен 168 168 1.0 Кеторолак 56 56 0.2 Теноксикам 8 8 0.3 НПВП всего 1,080 314 70 1,464 133.5 Стандартные
анальгетики1,910 1,910 14.7 Морфин 133 133 0.5 Трамадол 66 66 0.5 Петидин 20 20 0.1 Пиритрамид 3 3 0.0 Опиоиды всего 222 222 1.1 Плацебо 1,189 3 1,192 40.4 Всего 9,852 454 130 93 117 538 50 92 11,326 1,302.7 Общая доля пациентов в клинических исследованиях, испытывавшая как минимум один ПЭП составляла 21%. Другими словами приблизительно 4 из 5 пациентов не имели ПЭП вообще (Grarup and others 2001).
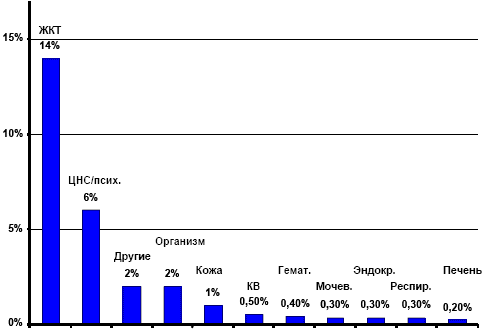
На рисунке ниже предоставлен обзор описанных ПЭП, разделенных по системам органов. Как ожидалось, большинство общих ПЭП относятся к гастроинтестинальной системе, но также сравнительно часто наблюдались симптомы ЦНС.
Рисунок 41. Преобладание ПЭП в разных группах органов (WHO-Art) (На основании таблицы 19 из (Grarup and others 2001))
Наиболее частые ПЭП представлены на рисунке внизу (Рисунок 42).
Рисунок 42. Наиболее частые ПЭП, описанные для Xefocam® (Рисунок 3 из (Grarup and others 2001))
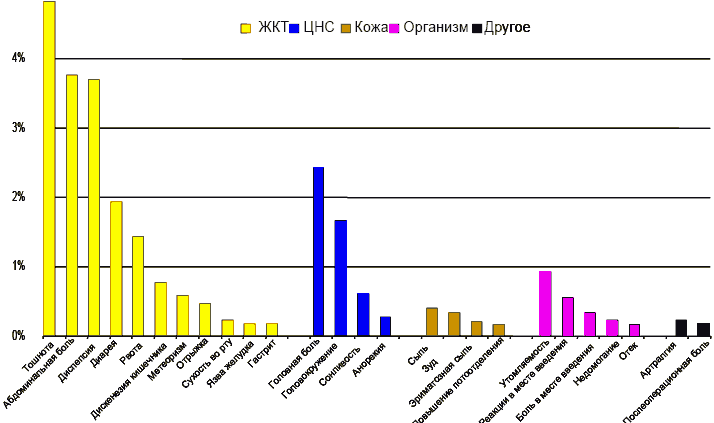
Как и ожидалось, тошнота, абдоминальная боль и диспепсия доминировали между гастроинтестинальными синдромами, тогда как головная боль и головокружение были наиболее распространенными симптомами со стороны ЦНС.
Несколько пациентов жаловались на ПЭП со стороны мочевой системы (0,3%) или печени (0,2% в целом). Изменения тестируемых ферментов печени и почек оставались на уровне плацебо (Grarup and others 2001). Данные анализа подтверждают, что в отличии от других НПВП, таких как диклофенак, Xefocam® не имеет или имеет минимальное воздействие на эти две системы органов.
Таблица 8. Обобщение наиболее частых ПЭП, индуцированных применением Xefocam® (из (Grarup and others 2001))
Побочный эффект % пациентов Часто встречающиеся осложнения Гастроинтестинальная система 14 Тошнота, абдоминальная боль, диспепсия, диарея и рвота Центральная нервная система 6 Головная боль, головокружение Реакции на коже 1 Эритема и везикулярный зуд Общие эффекты 2 Астения, утомление, недомогание, отек Таблица 8. обобщает наиболее часто встречающиеся ПЭП при применении Xefocam®. Эти ПЭП являются общеизвестными реакциями на НПВП.
Новые исследования
Xefocam® Rapid сравнивался с диклофенаком калия среди пациентов с наиболее острой болью в спине в рандомизированном двойном, слепом исследовании 220 пациентов из России. Начальная доза Xefocam® Rapid составляла 16 мг, а диклофенака – 100 мг, увеличиваясь до 8 мг и 50 мг соответственно; прием осуществлялся дважды в сутки в течении одной недели.
Всего 123 ПЭП было зарегистрировано на протяжении 7-ми дневного периода: 56 случаев среди 27 пациентов, принимавших Xefocam® Rapid, и 67 случаев среди 28 пациентов, принимавших диклофенак калия. Все зарегистрированные случаи не представляли какой-либо значительной угрозы и имели степень тяжести от легкой до средней. Велось наблюдение за: равномерностью распределение всех ПЭП между сравниваемыми группами, наиболее частыми ПЭП, степенями повреждения, причинностью и исключением из тестирования (Møller 2005).
Зависимость побочных эффектов препарата от способа применения
Основываясь на первой стадии исследования, была показана биологическая доступность Xefocam® в виде 8 мг таблеток, покрытых пленочной оболочкой, и 8 мг Xefocam® в виде инъекций. Следовательно, считается справедливым, что соматическая переносимость Xefocam® стандартных таблеток и Xefocam® инъекций (парентеральной формы для внутримышечного и внутривенного использования) можно экстраполировать на другие формы, такие как Xefocam® Rapid и Xefocam® суппозитории.
С клинической фармакологической точки зрения Xefocam® Rapid является модификацией стандартных Xefocam® таблеток, так как способ применения и абсорбции обоих препаратов одинаков. Единственным преимуществом Xefocam® Rapid является его более быстрая абсорбция и, соответственно, достижение более высокого пика концентрации. Смах приблизительно на 25% выше, чем при использовании стандартных Xefocam® таблеток.
Еще один интересный результат фармакокинетического исследования показал, что кривая зависимости концентрации Xefocam® Rapid от времени фактически совпадает с таковой для внутримышечного Xefocam®. Это означает, что пик максимальной концентрации после применения Xefocam® Rapid также наблюдается после использования внутримышечного Xefocam®, и соответственно, эти данные могут использоваться для определения возможного эффекта в верхнем пике концентрации.
Исходным данным противопоставлена забота о безопасности, в связи с тем, что ранние, зависящие от концентрации, побочные явления вероятно относятся к реакции со стороны ЦНС. Такие симптомы, как головокружение и головная боль хорошо известны для всех НПВП, в том числе и для Xefocam®.
Таблица 9 предоставляет обзор заболеваемости с доверительными интервалами 90% среди пациентов, жалующихся на ПЭП после применения Xefocam®. В таблице сопоставляется парентеральное применения Xefocam® (Xefocam® инъекции – в/м), стандартные Xefocam® таблетки и Xefocam® Rapid.
Таблица 9. Заболеваемость с 90% доверительных интервалами среди пациентов, жалующихся на ПЭП после применения разных форм Xefocam®
К кратковременной относится менее 3 недель
Форма Xefocam®-вм Стандартные Xefocam® таблетки Таблетки Xefocam® Rapid Популяция Общая Общая Кратко-временная Всего Кол-во пациентов n=505 n=3287 n=926 n=208 Общая заболеваемость 20.4%
(17.4-23.4)25%
(23.8–26.3)20.1%
(17.9-22.3)15.4%
(10.5-20.3)Гастро-интестинальная система 6.1%
(4.5–8.2)16.4%
(15.3-17.5)9.3%
(7.8-11.0)9.1%
(5.2-13.1)Кожа 0.8%
(0.3–1.8)2.1%
(1.7-2.6)0.5%
(0.2-1.1)1.4%
(0-3.1)Общие расстройства 2.8%
(1.7–4.3)2.1%
(1.7-2.6)2.8%
(2.0-3.9)1.4%
(0-3.1)ЦНС 4.5%
(3.1–6.4)5.1%
(4.5-5.8)8.3%
(6.9-10.0)4.8%
(1.9-7.7)Психиатрические расстройства 1.4%
(0.7-2.6)2.0%
(1.6-2.5)3.7%
(2.7-4.9)0% Локальная переносимость (специфика формулировки)
Парентеральные: вызванные применением лекарства локальные расстройства были описаны у 7,43% пациентов (1,21% для морфина, 9,77% для трамадола)
Сопоставление побочных эффектов препарата и дозы
Общая доля ПЭП (включая гастроинтестинальные и другие ПЭП) растет в соответствии с ожиданием при повышении дозы (Рисунок 43). Это заключение основано на долгосрочных и краткосрочных исследованиях боли и других симптомов среди 6 260 пациентов (Grarup and others 2001).
Рисунок 422. Частота ПЭП в разных системах органов и доза Xefocam® (Рисунок 4 из (Grarup and others 2001))
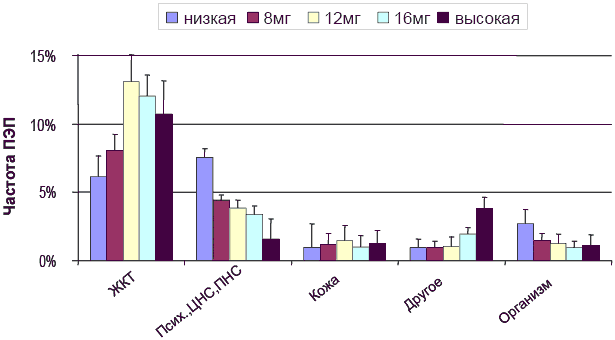
Заболеваемость с 95% доверительным интервалом (основано на обследовании 6 260 пациентов)
Зависимость побочных эффектов препарата от возраста
В отчете по безопасности препарата были использованы результаты нескольких мета-анализов (Grarup and others 2001). Результаты представлены в виде коэффициентов относительного риска (ОР)4), включая все исследования, в которых использовался двойной слепой метод. Во внимание принимались только ПЭП (т.е. побочные эффекты, вызванные применением препарата).
4)Относительный риск (коэффициент вероятности события)Мета-анализ частоты ПЭП среди пациентов в возрасте 65 лет включал 23 исследования. В общем 3 341 пациент в возрасте до 65 лет и 854 пациента старше этого возраста были обследованы.
По сравнению с картиной, наблюдаемой при применении других НПВП (Phillips and others 1997; Henry and others 1997; Rodriguez 1997; Hernandez-Diaz and Rodriguez 2000), зависимости частоты выявления нежелательных воздействий от возраста не было обнаружено; у пациентов старше 65 лет частота встречаемости побочных реакций была такой же как и в более младшем возрасте.
ОР составлял 0,95 (0,80-1,13). Следовательно, признаки повышения риска Xefocam®-индуцированных ПЭП у лиц в возрасте 65 лет и старше отсутствуют. ОР для желудочно-кишечных ПЭП, вызванных применением Xefocam® у пациентов в возрасте 65 лет и старше составлял 1,01 (0,83 – 1,23) и не являлся статистически значимым.
Риск возникновения побочных эффектов, вызванных применением Xefocam® с возрастом отсутствуетЗависимость побочных эффектов препарата от пола
Подобный мета-анализ был проведен по отношению к полу. Сравнение ОР для мужчин и женщин проводилось в 40 исследованиях, которые содержали значительное количество лиц обоих полов. ОР равнялся 0,78 (0,69 – 0,88), т.е. риск ПЭП был значительно ниже для мужчин (P<0,0001). Это обстоятельство в большой мере обусловлено данными клинического исследования КИ102 среди 1841 пациентов, принимающих Xefocam®, в котором у мужчин значительно реже чем женщин проявлялись ПЭП (ОР=0,65, Р<0,0001).
Эти данные подтверждают, что риск возникновения побочных эффектов незначительно выше для женщин, как и при использовании других НПВПДалее:
| Март 2008 г. |