Опубликовано в журнале:
«Вопросы практической педиатрии» 2013, т. 8, №6Преимущества комбинации железо + медь + марганец в лечении железодефицитных состояний у детей
Е.Н.Семенова
Российский университет дружбы народов, Москва, Российская ФедерацияБыстрый рост – главная причина отрицательного баланса железа, поэтому дети особенно подвержены развитию железодефицитной анемии. В метаболизме железа в организме человека принимает участие 22 марганцевых белка и 9 купроэнзимов. Монотерапия железом не учитывает взаимодействия между микроэлементами и поэтому может сопровождаться повышенным количеством побочных эффектов, а в случае дефицита меди (недоношенность, период активного роста, целиакия, амилоидоз кишечника, применение препаратов цинка, синдром Менкеса) может вызвать либо перегрузку организма железом, либо рефрактерность к данному лечению. Применение комбинации Fe + Cu + Mn позволяет избежать подобных результатов. Анализ 38 исследований показал, что комбинация глюконат Fe II + Cu + Mn (Тотема) обладает в 2–3 раза лучшей переносимостью в сравнении с сульфатом железа II и также хорошо переносится, как препараты трехвалентного железа (уровень доказательности 1А). Побочные эффекты при приеме Тотема, как правило, носили преходящий характер, в группе детей и подростков (n = 690) составили 9,3%, отказы – всего 0,4%. Синергидное действие трех элементов в препарате Тотема и жидкая форма выпуска способствуют быстрому увеличению гемоглобина: на 31% за 7–8 дней у детей и подростков с легкой железодефицитной анемией и на 63% за 14–15 дней при анемии средней степени тяжести.
Ключевые слова: глюконат марганца, глюконат меди, дефицит железа, дефицит меди, железа глюконат, железа сульфат, лечение анемии, полимальтозный комплекс гидроксида железа, Тотема
Advantages of iron + copper + manganese combination in treatment of iron deficiency conditions in children
E.N.Semenova
People’s Friendship University of Russia, Moscow, Russian FederationRapid growth is the main cause of a negative iron balance that is why children are especially subject to development of iron deficiency anaemia. In a human body, 22 manganese proteins and 9 copper enzymes take part in iron metabolism. Iron monotherapy does not take into account interactions between trace elements and therefore might be accompanied by an increased number of side effects, and in case of copper deficiency (prematurity, active growth period, celiac disease, intestinal amyloidosis, intake of zinc preparations, Menkes syndrome) might result in either body overload with iron, or refractory to such treatment. The use of Fe + Cu + Mn combination permits to avoid such results. Analysis of 38 studies has shown that a combination of Fe II + Cu + Mn gluconates (Tot’hema) has a 2–3-fold better tolerance as compared with iron II sulfate and the same good tolerance as iron III preparations (level of evidence 1А). Side effects of Tot’hema intake, as a rule, were of transient character, in the group of children and adolescents (n = 690) they were 9.3%, refusals – only 0.4%. The synergistic action of three elements in the drug Tot’hema and its liquid form promote a rapid increase of haemoglobin: by 31% within 7–8 days in children and adolescents with mild iron deficiency anaemia and by 63% within 14–15 days in moderate anaemia.
Key words: manganese gluconate, copper gluconate, iron deficiency, copper deficiency, ferrous gluconate, ferrous sulfate, anaemia treatment, iron hydroxide polymaltose complex, Tot’hema
Как известно, железо в организме выполняет ряд очень важных функций, таких как захват, транспорт кислорода (гемоглобин), хранение кислорода (миоглобин), выработка энергии в клетках (цитохром с-оксидаза), железо участвует в механизмах иммунитета (ионы Fe2+, лактоферрин), антиоксидантной защите (пероксидаза, каталаза), синтезе ДНК (коэнзим редуктазы рибонуклеотидов), формировании соединительной ткани (лизилгидроксилазы и пролилгидроксилаза 1 отвечают за стабилизацию коллагена и синтез хондроитин сульфат протеогликанов), а также влияет на когнитивные функции и память. На сегодняшний день насчитывается около 100 железосодержащих белков [1, 2, 3, 5].
Среди основных причин дефицита железа у детей выделяют недоношенность, повышенную потребность организма в железе в связи быстрыми темпами роста, недостаточное поступление микроэлемента с пищей, сниженную абсорбцию, а также потери железа (носовые, маточные, желудочно-кишечные, почечные). Значимость каждой из перечисленных причин железодефицитной анемии меняется в зависимости от возрастного периода [1, 6]. Известно, что первоначальные запасы железа у ребенка создаются благодаря его антенальному поступлению через плаценту от матери. Наиболее интенсивно этот процесс протекает, начиная с 28–32-й нед гестации [1]. Почти у всех недоношенных детей, которые не получали дополнительно железо с пищей, в 6-месячном возрасте развивается дефицит железа [6]. У доношенных детей также к моменту удвоения массы тела ребенка (5–6 мес) антенальные запасы истощаются, и организм ребенка становится зависимым от количества элемента, поступающего с пищей [1]. В 5–12 лет увеличивается значимость потерь железа (в случае глистной инвазии, гастро-интестинальной формы пищевой аллергии, носовых кровотечениях, обильных менструациях). Дефицит железа приводит к задержке роста, нарушается интеллектуальное развитие, наблюдаются изменения поведения у детей, появляются неврологические симптомы. Нарушения психического развития и познавательной функции описаны даже у детей при умеренном дефиците железа [6].
Количество железа в норме чрезвычайно стабильно и определяется равновесием между поступлением и потерями этого металла. Причем до 70% его инкорпорированы в гемоглобин, приблизительно 10% находится в миоглобине и железосодержащих энзимах, остальное сохраняется в «медленно обменивающемся пуле» в составе ферритина, который также называют «пул накопления» [4, 5]. Плазматический транспорт включает трансферриновое железо и составляет приблизительно 0,1%. Ежедневные потери железа чрезвычайно малы, порядка 1 мг в день, и являются результатом слущивания эпителия, потерь с желчью и в меньшей степени с мочой. У девочек-подростков к этому добавляются ежемесячные расходы железа в связи с менструальными кровотечениями. Компенсация этих потерь, а также обеспечение повышенных потребностей в период интенсивного роста имеет важнейшее значение и тщательно регулируется, поскольку человеческий организм не имеет возможности увеличить экскрецию железа в случае его избыточного поступления [4–6].
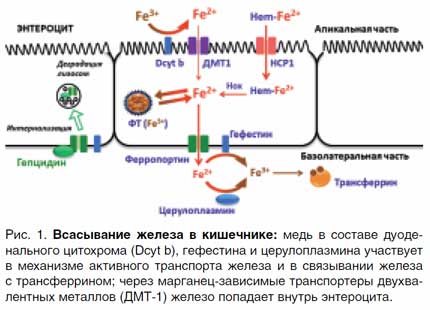
Роль меди и марганца в абсорбции железа в кишечнике и утилизации в тканях В гомеостазе железа принимают участие 9 медьсодержащих ферментов и 22 марганец-зависимых белка. Важная роль в метаболизме железа отводится таким купро-энзимам, как дуоденальный цитохром b, гефестин, эндосомальные ферриредуктазы STEAP и церулоплазмин, которые осуществляют взаимопревращения Fe2+ и Fe3+, необходимые при входе железа в клетки, выходе железа в кровоток и дальнейшего связывания с трансферрином [3, 5]. Всасывание железа происходит преимущественно в верхних отделах тонкого кишечника. Наибольшей биодоступностью (до 30%) обладает железо, входящее в состав гема (мясные продукты), которое усваивается в неизмененном виде с помощью пиноцитоза, предварительно связавшись с мембранным белком-переносчиком гема (НСР-1). В образовавшейся эндосоме под действием гемоксигеназы (Hox) железо высвобождается в цитоплазму в так называемый «транзитный пул» либо связывается с ферритином (ФТ) [4, 5]. Этот путь является основным для поступления железа из пищи, поэтому важно вовремя вводить мясной прикорм детям, и в любом возрасте мясо рекомендуется употреблять не реже 2–3 раз в неделю. Негемовое железо представлено нерастворимыми гидроокисями и потому требует активного транспорта, через неспецифические марганец-зависимые транспортеры двухвалентных металлов (ДМТ-1) c участием медь-зависимого дуоденального цитохрома b (Dcyt b), который восстанавливает окисное железо (Fe3+) до растворимой закисной формы (Fe2+). Биодоступность негемового железа составляет всего 1–3%. Далее через базальную мембрану энтероцита, также в двухвалентном состоянии железо попадает в кровоток через мембранный белок ферропортин. Ферропортин связан с купроэнзимом гефестином, который является мембранной феррооксидазой и окисляет железо для связывания с переносчиком трансферрином, как показано на рис. 1 [2–6].
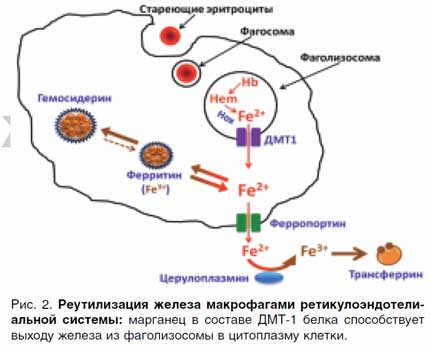
В сутки требуется где-то 20–25 мг железа на нужды эритропоэза. Таким образом, железо, поступающее из энтероцитов, составляет всего около 5%, остальные 95% поступают из системы мононуклеарных макрофагов, осуществляющих реутилизацию старых эритроцитов [4, 5].
Продолжительность жизни эритроцита в среднем составляет 125 суток. Стареющие клетки фагоцитируются макрофагами и в образовавшейся фаголизосоме под действием гемоксигеназы высвобождаются ионы Fe2+, которые через Mn-зависимые ДМТ-1 белки выходят в цитоплазму и далее через ферропортин в кровоток или накапливаются в ферритине. Железо из макрофагов, вышедшее в кровоток, окисляется церулоплазмином для связывания с трансферрином (рис. 2).
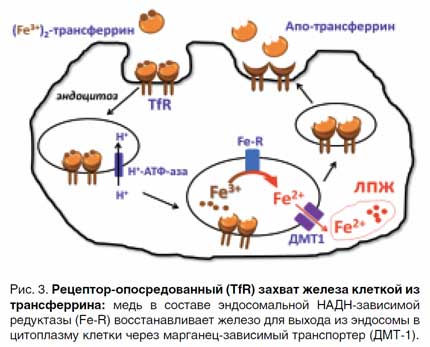
Фракция железа, не предназначенная для костного мозга, делится между различными местами накопления представленными макрофагами и, в основном, гепатоцитами, особенно чувствительными к перегрузке железом, а также доставляется в клетки различных органов. Комплекс железо–трансферрин захватывается рецептором 1 трансферрина (TfR1), затем пиноцитируется (рис. 3). В результате он оказывается внутри эндосом, куда с помощью АТФ-насоса нагнетаются ионы Н+ и происходит закисление среды. В кислой среде комплекс трансферрин-Fe3+ диссоциирует, далее Fe3+ восстанавливается эндосомальной Cu-НАДН-зависимой феррооксидазой (Fe-R) до растворимого Fe2+ и через ДМТ-1 белки попадает в цитоплазму в «лабильный» (транзитный) пул (ЛПЖ), откуда транспортируется в места синтеза железосодержащих белков, либо попадает в пул накопления. В транзитном пуле железо находится в виде Fe2+, поскольку несвязанные ионы Fe 3+неустойчивы при физиологических рН и быстро образуют нерастворимые в воде оксиды и гидроокиси [3–6].
Помимо упомянутого марганец-зависимого ДМТ-1 белка, играющего ключевую роль в транспорте железа внутрь клеток, всего на биологические функции железа влияют 22 марганцевых энзима (серин-треонин фосфатазы, гуанилатциклазы, ионтранспортеры, малат-дегидрогеназа, митохондриальная пептидаза). Наиболее изученным из них является митохондриальная пептидаза, при участии которой происходит созревание различных белковых молекул, в том числе транспортеров железа, а также регуляция уровня железа в митохондриях, где происходит последняя стадия синтеза гема [3].
Роль меди в регуляции гомеостаза железа
Регуляция абсорбции железа осуществляется на уровне базальной мембраны энтероцита с помощью гепцидина. Этот небольшой противомикробный белок (25 аминокислот) вырабатывается в основном в печени. Его синтез активируется при высоких уровнях запасов железа, при высокой концентрации железа в сыворотке, а также при инфекции и воспалении под действием воспалительных цитокинов, таких как ИЛ-6. В результате связывания гепцидина с ферропортином индуцируется его интернализация в клетку с последующей деградацией в лизосомах (рис. 1). Таким образом, железо оказывается запертым внутри клетки и утрачивается в процессе естественной десквамации кишечного эпителия. Аналогичным образом гепцидин регулирует выход железа в кровоток из макрофагов и других клеток. В случае высокой активности эритропоэза (независимо от состояния запасов железа), при дефиците железа или гипоксии, выработка гепцидина подавляется, и железо через ферропортин попадает в кровоток, где после окисления гефестином или церулоплазмином связывается с трансферрином и переносится в костный мозг [5–7]. Интересные данные получены Martin F. с соавторами о роли меди в активации эритропоэза путем стабилизации выработки гипоксией индуцированного фактора (HIF-1), который контролирует экспрессию гена эритропоэтина [8].
Регуляция выработки HIF регулируется семейством пролилгидроксилазных доменов (PHD) ферментов, которые выполняют функции датчиков кислорода и Fe2+ в клетках. В условиях нормоксии PHD гидроксилируют альфа субъединицу HIF, что приводит к его деградации. При снижении парциального давления кислорода в клетках (гипоксии) активность PHD ферментов снижается, что приводит к накоплению ядерной HIF и индукции генов мишеней. У млекопитающих известно три HIF-пролилгидроксилазы, кодируемые независимыми генами, PHD1, PHD2, PHD3. При этом если PHD2 и PHD3 прекращают индуцированную гипоксией HIF транскрипцию при реоксигенации, то PHD1 является кислород-независимой [8]. В экспериментах F.Martin et al. было показано, что медь при нормальном парциальном давлении кислорода стабилизирует ядерную HIF-1 и ингибирует пролил-4-гидроксилирование.
Основываясь на спектрометрических и структурных исследованиях 2-оксоглуторатзависимых диоксигеназ, показывающих, что Cu2+ может заменить Fe2+ в активном центре в этом классе энзимов, можно предположить, что ионы Cu2+ связываются с активным центром PHD со значительно более высоким сродством, чем ионы Fe2+, однако в эксперименте F.Martin ионы меди тормозили гидроксилирование HIF даже в присутствии избытка ионов железа. Таким образом, механизм, ответственный за регуляцию выработки HIF-1 при участии ионов меди, еще неизвестен. Основными мишенями для HIF являются гены эритропоэтина (синтезируется преимущественно в почках), а также трансферрина, трансферриновых рецепторов и церулоплазмина (синтезируются в печени) [8, 9]. Увеличение уровня эритропоэтина приводит к активации эритропоэза, что ведет к снижению содержания гепцидина, увеличению всасывания железа в кишечнике и мобилизации Fe из макрофагов ретикулоэндотелиальной системы. Увеличение синтеза церулоплазмина и трансферрина способствуют быстрому усвоению железа в тканях, нормализации синтеза гемоглобина и других железосодержащих белков.
Различия в механизме всасывания железа из антианемических препаратов
Если для пищевого железа основным путем поступления этого микроэлемента является путь гема, то для всасывания железа из препаратов основными каналами будут ДМТ-1 белки. При этом препараты трехвалентного железа будут адсорбироваться путем активного транспорта, так же как негемовое железо пищи, а двухвалентные препараты железа будут свободно диффундировать через каналы транспортеров двухвалентных металлов. Именно поэтому биодоступность таких препаратов, как Ферлатум, Мальтофер, Феррум Лек, Биофер, в состав которых входит трехвалентное железо, не превышает 10%, а биодоступность препаратов на основе двухвалентного железа (Тотема, Ферретаб, Сорбифер, Тардиферон, Ферро-фольгамма, Фенюльс, Актиферрин, Гемофер, Ферроградумет, Ферроплекс) составляет от 10 до 40% [15, 18–20].
Влияние дефицита меди на адсорбцию из двухвалентных и трехвалентных препаратов
Отдельно необходимо затронуть проблемы в лечении железодефицитной анемии (ЖДА) в случае сочетанного дефицита меди. Дефицит меди может возникать у недоношенных детей, в период интенсивного роста, а также при избыточном поступлении цинка в организм при лечении препаратами цинка диареи, акне, серповидноклеточной анемии или при нарушении всасывания меди (целиакия, амилоидоз кишечника) [11]. Поскольку до 80% всей меди находится в плазме в составе церулоплазмина, то ЖДА, развившиеся в результате хронической или острой кровопотери, также будут с большой вероятностью сопровождаться дефицитом меди.
По данным разных авторов дефицит меди у детей дошкольного возраста составляет 58%, у детей школьного возраста – 39 и 89% [12, 13]. Исследование микроэлементного состава крови юношей 17–19 лет г. Владивостока выявило дефицит меди в 63% случаев [14].
При лечении ЖДА в сочетании с дефицитом меди препараты трехвалентного железа будут неэффективны, поскольку в отсутствие этого микроэлемента нарушается активный транспорт железа (рис. 4).
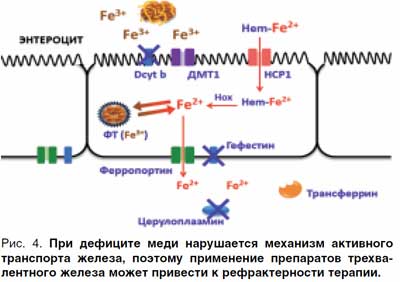
В литературе имеются данные о неэффективности применения полимальтозного комплекса гидроксида железа III (ПКГЖ) даже при длительном лечении (от 4 до 14 мес) у значительного количества пациентов (75 (31%) из 241). Последующий перевод этих пациентов на препараты двухвалентного железа приводил к быстрой нормализации гемоглобина [16, 17].
В случае лечения препаратами на основе двухвалентных солей железа ионы Fe2+ будут свободно проходить через каналы ДМТ-1 белков, но из-за снижения активности гефестина и церулоплазмина будет нарушена утилизация железа и может возникнуть состояние «перегрузки железом» с активацией свободно-радикального окисления. Соответственно, чем больше дефицит меди, тем вероятнее возникновение такого состояния (рис. 5).
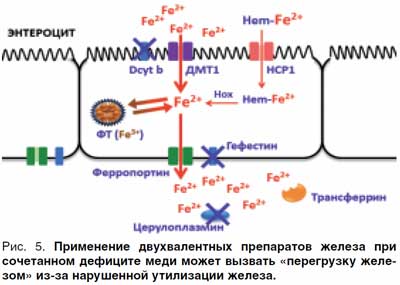
Применение комбинации железо + медь позволяет избежать подобных проблем. Однако следует помнить, что в случае наследственных заболеваний, таких как болезнь Вильсона–Коновалова, встречается обратная ситуация – избыток свободных ионов меди. В этих случаях применение медьсодержащих препаратов противопоказано.
Роль меди и марганца в антиоксидантной защите
Известно, что железо способно активировать процессы образования свободных радикалов, поэтому поддержание баланса антиоксидантных молекул в клетках и плазме является необходимым условием нормального функционирования организма. Наиболее важными антиоксидантами в клетках являются супероксиддисмутаза (СОД) и глютатион, в мембранах – токоферол и бета-каротин, а в плазме – церулоплазмин. В активном центре цитозольной СОД находится медь, а в СОД митохондрий – марганец. Содержащий до 8 ионов меди церулоплазмин инактивирует железо, связывая его с трансферрином, и кроме того, обладает слабой супероксиддисмутазной активностью. Важно, что применение препаратов железа может снижать синтез Mn-СОД, так как железо конкурирует с марганцем за участок связывания на уровне транскрипции этого фермента, тогда как комбинация железо + марганец лучше удовлетворяет потребности в этом антиоксидантном ферменте [4, 10, 19].
Принимая во внимание роль меди и марганца в механизмах всасывания и утилизации железа, а также механизмы антиоксидантной защиты, применение препарата Тотема (производитель «Лаборатория Иннотек Интернасиональ»), содержащего в составе железо II, медь и марганец в форме глюконата, более физиологично и учитывает взаимоотношения трех элементов. Важно, что Тотема разрешен к применению с 3-месячного возраста и выпускается в жидкой форме, что обеспечивает лучшую биодоступность по сравнению с таблетированными формами. В литературе есть данные, что жидкий глюконат железа в более низких дозах также эффективен, как таблетированные формы сульфата и глюко-ната железа [18]. В исследовании С.Я.Анмут с соавт. применение Тотема в дозе 5–7 мг на кг веса у детей и 150 мг в сутки у подростков (98 пациентов) приводило к нормализации гемоглобина через 7–8 дней (повышение гемоглобина на 31%) при легкой степени анемии и через 14–15 дней (повышение гемоглобина на 63%) при анемии средней степени тяжести. При этом побочные реакции были редки и выражались в виде аллергической необильной сыпи на коже (1% детей) и кишечной диспепсии (2%), связанной с нарушением режима приема препарата [21].
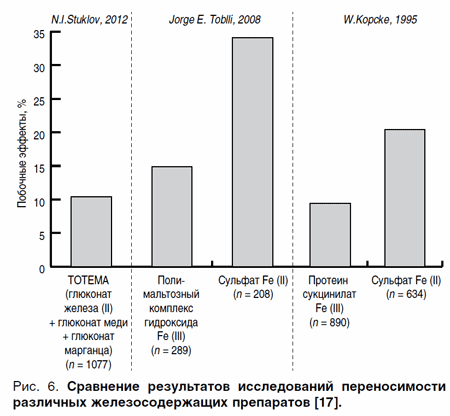
Результаты сравнения переносимости жидкой формы глюконата железа II, меди и марганца (Тотема) с двухвалентными и трехвалентными препаратами железа [19]
Проведенный мета-анализ 30 исследований (1077 пациентов) показал хорошую переносимость Тотема [19]. Полученная средняя частота нежелательных явлений составила 10,4% (112 пациентов). Побочные явления, в основном, были представлены легкими, непродолжительными диспепсическими реакциями (8,5%), не требующими отмены препарата. Реже встречались аллергические реакции в виде необильной сыпи – 0,7% и потемнение эмали зубов – 1,0%. Только 1,1% пациентов были вынуждены отказаться от дальнейшего приема Тотема. В группе детей (n = 690) побочные явления составили 9,28%. При этом выраженные побочные эффекты, которые не позволили завершить лечение, наблюдались только у 3 из 690 детей и подростков (0,43%).
Сопоставление данных этих 30 исследований применения препарата Тотема с величинами, полученными в мета-анализе 5 сравнительных исследований полимальтозного комплекса гидроксида железа III (ПКГЖ, 289 пациентов) и сульфата железа II (208 пациентов) и в мета-анализе 3 сравнительных исследований (протеинсукцинилата железа III (890 пациентов) и сульфата железа II (634 пациента), показало, что Тотема обладает лучшей переносимостью, чем сульфат железа II (34,1 и 20,4%; р < 0,005) и сравнимой переносимостью по отношению к препаратам трехвалентного железа (полимальтозный комплекс гидроксида железа III (14,9%; 0,1 < р < 0,25), протеин сукцинилат железа III (9,4%; 0,75 < р < 0,9) (рис. 6) [19].
Отдельно сравнивали частоту запоров, поскольку данный побочный эффект может значительно снизить приверженность к лечению. Частота запоров при применении Тотема (24 исследования, 841 пациент) достоверно отличалась и составила всего 0,83% (р < 0,005), что в 10 раз меньше, чем при применении ПКГЖ (8,7%) и в 19 раз меньше, чем при применении сульфата железа (15,9%) [19].
Заключение
1. В метаболизме железа важные функции выполняют купроэнзимы и марганец-содержащие белки. Так, медь участвует в активном транспорте железа в кишечнике, утилизации железа в тканях, способствуя связыванию железа с транспортными белками. Марганец отвечает за транспорт железа внутрь клеток, участвует в синтезе гема.
2. Ионы меди, вероятно, участвуют в регуляции эритропоэза, поскольку способны подавлять деградацию HIF, что приводит к накоплению его в ядре клеток, увеличению экспрессии генов эритропоэтина, трансферрина, трансферриновых рецепторов и церулоплазмина, в результате чего активируется эритропоэз.
3. Важной функцией меди и марганца является участие их в антиоксидантной защите в составе супероксиддисмутаз и в составе церулоплазмина.
4. Сопутствующий дефицит меди (встречается у детей от 39 до 89%) может приводить к рефрактерности лечения трехвалентными препаратами железа из-за нарушения механизма активного транспорта или может вызвать перегрузку железом при использовании двухвалентных препаратов, поскольку снижается связывание железа с трансферрином и антиоксидантная защита.
5. Совместное применение железа, меди и марганца позволяет избежать рефрактерности или перегрузки железом при лечении железодефицитных анемий с сопутствующим дефицитом меди.
6. Применение препарата Тотема, содержащего все три элемента (1 ампула содержит питьевой раствор глюконата железа, меди и марганца в количестве, соответствующем 50 мг элементного железа, 0,7 мг меди и 1,33 мг марганца), позволяет быстро, за 7–14 дней, нормализовать показатели гемоглобина у детей и подростков (в зависимости от степени тяжести анемии).
7. Тотема в 2–3 раза лучше переносится, чем сульфат железа и в 19 раз реже вызывает запоры у пациентов. Более того, переносимость Тотема сравнима с переносимостью трехвалентного железа и при этом в 10 раз реже вызывает запоры, чем полимальтозный комплекс железа (уровень доказательности 1А).
8. Из-за различия в механизме всасывания существуют различия в дозировании препаратов из разных групп. Так, у детей до 3 лет из-за возможной перегрузки железом для солевых препаратов двухвалентного железа (Актиферрин, Гемофер) для лечения предусмотрена доза 3 мг/кг в сутки, а для трехвалентных (Мальтофер, Ферум лек, Ферлатум) – 5 мг/кг в сутки. Благодаря хорошей переносимости, комбинация железо + медь + марганец, согласно инструкции и исследованиям, может назначаться в такой же дозе, как и трехвалентные формы, позволяя нормализовать гемоглобин значительно быстрее [21–25].
Рекомендации производителя по применению препарата Тотема
Для минимизации вероятности появления нежелательных явлений и увеличения приверженности необходимо:
Таблица.
- принимать препарат за 30 мин до начала приема пищи или спустя 2 ч после еды;
- рекомендуется разбавлять содержимое 1 ампулы минимум в 100–200 мл воды;
- начинать прием препарата (первые 1–3 дня) с минимальных суточных доз из расчета 2–3 мг/кг для детей и 50 мг в сутки (1 ампула) для подростков, затем постепенно увеличивать дозу до необходимой лечебной 5–7 мг/кг для детей и 100–150 мг для подростков (зависит от тяжести дефицитного состояния) и принимать в лечебной дозе до нормализации уровня гемоглобина (2–6 нед) (таблица).
Далее перейти на 1/2 лечебной суточной дозы (что соответствует профилактической дозе Тотема или рекомендованной РМАПО лечебной дозе для других солевых препаратов железа) до нормализации показателей депо железа (еще 2–3 мес или до достижения уровня ферритина >30–50 мкг/л). Полный курс лечения, как правило, составляет 2–4 мес в зависимости от первоначальной тяжести сидеропении;- желательно принимать препарат через трубочку или споласкивать ротовую полость сразу после приема препарата, чтобы снизить вероятность окрашивания эмали зубов.
Пример расчета дозы препарата Тотема в зависимости от веса ребенка
Лечебная доза
5–7 мг/кг в суткиПрофилактическая доза
2–3 мг/кг в суткиВес ребенка Количество Тотема в день Вес ребенка Количество Тотема в день <6 кг 7-10 кг
11-15 кг
16-20 кг
21-30 кг
>30
1/2 ампулы (5 мл) 1 ампула (10 мл)
1,5 ампулы (15 мл)
2 ампулы (20 мл)
2–3 ампулы
2–4 ампулы
<7 кг 8–15 кг
>16 кг
1/4 ампулы (2,5 мл) 1/2 ампулы (5 мл)
1 ампула (10 мл)
Перед употреблением препарат необходимо разбавить водой. Для корреспонденции:
Семенова Елена Николаевна, учебный мастер кафедры госпитальной терапии с курсом клинической лабораторной диагностики Российского университета дружбы народов
Адрес: 115432, Москва, ул Трофимова, 26 , ГКБ 53.Литература
1.Захарова ИН, Дмитриева ЮА. Синдром анемии в практике врача педиатра: дифференциальная диагностика и терапия. Эффективная фармакотерапия. Педиатрия. 2011;3:40-7.
2.Керимкулова НВ, Торшин ИЮ, Громова ОА, Серов ВН, Никифорова НВ. Систематический анализ молекулярно-физиологических эффектов синер-гидного воздействия железа, марганца и меди на соединительную ткань. Гинекология. 2012;6:51-60.
3.Громова ОА, Торшин ИЮ, Хаджидис АК. Анализ молекулярных механизмов воздействия железа (II), меди, марганца в патогенезе железодефицитной анемии. Клиническая фармакология и фармаэкономика. 2010;1:1-9.
4.Владимиров ЮА, Азизова ОА, Деев АИ, Козлов АВ, Осипов АН, Рощупкин ДИ. Свободные радикалы в живых системах. В кн.: Итоги науки и техники. Серия Биофизика. Том 29. М.: ВИНИТИ; 1991.
5.Cadet Е, Gadenne М, Capront D, Rochett J. Donnes recentes sur metabolisme du fer: un etat de transition. La revue de medecine interne. 2005;26:315-24.
6.Павлов АД, Морщакова ЕФ, Румянцев АГ. Эритропоэз, эритропоэтин, железо. Молекулярные и клинические аспекты. М.: ГЭОТАР-Медиа; 2011.
7.Левина АА, Казюкова ТВ, Цветаева НВ, Сергеева АИ, Мамукова ЮИ, Романова ЕА и др. Гепсидин как регулятор гомеостаза железа. Педиатрия. 2008;87(1):67-74.
8.Martin F, Liden Т, Katschinski DM, Oehme F, Flamme I, Mukhopadhyay CK, et al. Copper-dependent activation of hypoxia-inducible factor (HIF)-1: implications for ceruloplasmin regulation. Blood. 2005;105(12):4613-9.
9.Fong GH, Takeda K. Role and regulation of prolyl hydroxylase domain proteins. Cell Death Differ. 2008 Apr;15(4):635-41.
10.Davis C, Greger JL. Longitudinal changes of manganese-dependant superoxide dismutase and other indexes of manganese and iron in women. Am J Clin Nutr. 1992;55:747-52.
11.Филатов ЛБ. Дефицит меди как гематологическая проблема. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2010;3(1):68-72.
12.Иванова НА. Возможности коррекции микроэлементозов у детей школьного возраста. Практика педиатра. Февраль 2011;16-20.
13.Вильмс ЕА, Турчанинов ДВ, Турчанинова МС. Микроэлементозы у детского населения мегаполиса: эпидемиологическая характеристика и возможности профилактики. Педиатрия. 2011;90(1):96-101.
14.Антонюк MB, Симонова ИН, Андрюков БГ, Ковековдова ЛТ, Симконь МТ. Микроэлементный статус юношей Владивостока. Здоровье. Медицинская экология. Наука. 2009;1(36):12-6.
15.Nielsen Р, Gabbe ЕЕ, Ficher R, Heinrich НС. Bioavailability of iron from oral ferric polymaltose in humans. Arzneimittel-Forschung/Drug Research. 1994; 44(6):743-8.
16 iz-Argьelles GJ, Dfaz-Hernбndez A, Manzano C, Ruiz-Delgado GJ. Ineffectiveness of oral iron hydroxide polymaltose in iron-deficiency anemia. Hematology. 2007 Jun;12(3):255-6.
17.Mehta ВС. Iron (III) hydroxide polymaltose is ineffective in treatment of iron deficiency anemia. Medical Image. 2001;25:36-7.
18.Casparis D, Del Carlo P, Braconi F, Grossi A, Merante D, Gafforio L. Effectiveness and tolerability of oral liquid ferrous gluconate in iron-deficiency anemia in pregnancy and in the immediate poste-partum period: comparison with other liquid or solid formulations containing bivalent or trivalent iron. Minerva Ginecol. 1996 Nov;48(11):511-8.
19.Стуклов НИ. Мета-анализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железодефицитной анемии у детей и взрослых. Земский врач. 2012;4(15):11-20.
20.Стуклов НИ, Семенова ЕН. Лечение железодефицитной анемии. Что важнее эффективность или переносимость? Существует ли оптимальное решение? Журнал международной медицины. Гинекология. 2013;1(2):47-55.
21.Анмут СЯ, Санеева ОБ, Чупрова АВ. Новое в лечении железодефицитной анемии у детей. Сборник «Болезни новорожденных». 2001;44-5.
22.Квезерели-Копадзе АН, Мтварелидзе ЗГ. Применение препарата Тотема при лечении железодефицитной анемии у детей раннего возраста. Современная педиатрия. 2010;3(31):1-
23.Тарасова ИС, Чернов ВМ. Новые направления в диагностике, лечении и профилактике железодефицитных состояний. Consilium medicum. Приложение. Педиатрия. 2006;1:51-6.
24.Мтварелидзе ЗГ, Квезерели-Копадзе АН, Квезерели–Копадзе МН, Пагава КИ. Эффективность препарата Тотема при лечении железодефицитной анемии у детей раннего возраста с сопутствующим дефицитом меди. Медицинские новости Грузии. 2005;121:68-71.
25.Бугланов АА, Тураев АТ, Абдурахманова МС, Утегенова ДТ, Отамурадов АН. Эффективность комбинированного препарата Тотема в лечении железодефицитной анемии у детей. Вестник врача общей практики. 2001;3(19):30-2.
| Февраль 2014 г. |