Последующая информация предназначена только для медицинских работников!
Выбрав ссылку "Продолжить", Вы подтверждаете, что являетесь специалистом в области здравоохранения.
Опубликовано в журнале:
«Экcпеpиментальная и клиничеcкая фаpмакология» 2011, ТОМ 74, № 3, с. 26-31ОЦЕНКА ДЕТОКСИЦИРУЮЩЕГО ДЕЙСТВИЯ ПРЕПАРАТА “РЕМАКСОЛ” НА МОДЕЛИ ТОКСИКОЗА, ИНДУЦИРОВАННОГО ЦИСПЛАТИНОМ
О. А. Безбородова1, Е. Р. Немцова1, Л. Н. Александрова2, Д. С. Суханов2, А. Л. Коваленко2, Р. И. Якубовская1
1Отделение модификаторов и протекторов противоопухолевой терапии (руководитель — проф. Р. И. Якубовская) ФГУ “Московский научно-исследовательский онкологический институт им. П. А. Герцена Минздравсоцразвития России”, Москва.
2ООО “НТФФ “ПОЛИСАН”, 191119, Санкт-Петербург, Лиговский пр., 112.Цель исследования — оценка детоксицирующего действия препарата ремаксол на экспериментальной модели токсикоза, индуцированного цисплатином, и возможности применения его в онкологической клинике. На модели токсикоза, индуцированного введением токсической дозы (LD50) ДДП, изучено детоксицирующее действие препарата ремаксол. Показано, что препарат оказывает выраженное дозозависимое детоксицирующее действие в отношении токсичности цисплатина, снижая гибель животных в 3 раза при применении в курсовой дозе 130 мл/кг и отменяя летальность при применении в курсовой дозе 500 мл/кг, а также нормализуя биохимические показатели крови, характеризующие функциональное состояние печени и почек. Ремаксол не оказывает стимулирующего влияния на рост изученных опухолей (карцинома, саркома, меланома, лимфолейкоз), а при сочетанном применении с цисплатином в схемах лечения животных с различными по гистогенезу опухолями не отменяет и не снижает противоопухолевого действия цитостатика. Ремаксол может быть рекомендован к изучению в онкологической клинике в качестве детоксицирующего средства у больных со злокачественными новообразованиями.
Ключевые слова: цитостатики, цисплатин, ремаксол, экспериментальные опухоли, детоксицирующее действиеSTUDY OF DETOXIFYING EFFICACY OF REMAXOL IN EXPERIMENTAL MODEL OF CISPLATIN-INDUCED TOXICOSIS
O. A. Bezborodova1, E. R. Nemtsova1, L. N. Aleksandrova2, D. S. Sukhanov2, A. L. Kovalenko2, and R. I. Yakubovskaya1
1P. A. Herzen Oncology Research Institute, Moscow, Russia;
2POLISAN Company, Ligovskii prosp. 112, St. Petersburg, 191119, RussiaThe detoxifying efficacy of remaxol in the experimental model of cisplatin-induced toxicosis has been studied and the possibility of using this drug in cancer patients therapy is evaluated. Remaxol exhibited pronounced dose-dependent detoxifying effect in the model of toxicosis induced by cisplatin in a toxic dose (LD50). It reduced the death rate in test animals about three times when used at a 130 ml/kg dose, and prevented lethal outcome at a 500 ml/kg dose. Remaxol also normalized biochemical blood indices that characterized liver and kidney functions in survived animals. Remaxol did not stimulate growth of experimental carcinoma, sarcoma, melanoma, and lympholeukosis. The drug did not interfere with the anti-tumor efficacy of cisplatin in the schemes with combined treatment of animals bearing tumors of various histogenesis. Remaxol can be recommended for clinical study as a detoxifying preparation for cancer patients with various malignancies.
Key words: cytostatics, cisplatin, remaxol, experimental cancer, detoxifying effect
ВВЕДЕНИЕ
В последние годы неуклонно возрастает число людей, страдающих заболеваниями печени. Поражение печени приводит к снижению всех ее функций: синтеза жизненно необходимых для организма веществ, детоксикации, депонирования физиологически активных соединений и др. Индукторами заболеваний печени могут выступать микроорганизмы — вирусы и простейшие, токсические соединения различной природы — химикаты, компоненты пищи, лекарственные средства и их метаболиты и др. [5].
В частности, лечение больных злокачественными опухолями различной локализации оказывает большую нагрузку на функции печени. Все цитостатические препараты в большей или меньшей степени токсичны для гепатоцитов [1]. Лучевая терапия, индуцируя возникновение повышенного количества свободных радикалов, способствует образованию эндогенных ксенобиотиков. Хирургическое лечение, даже не затрагивающее непосредственно ткань печени, а также послеоперационный период сопровождаются развитием интоксикации вследствие многих факторов: применения анестезиологического пособия и антибактериальной терапии, кровопотери, кровезамещения и др. Поэтому для онкологической клиники особенно важное значение приобретает поиск гепатопротекторов, способных защитить печень больных от токсических воздействий и усилить детоксикацию организма [3, 4].
В течение многих лет ведется поиск средств, повышающих устойчивость печени к патологическим воздействиям, усиливающих ее детоксицирующие свойства путем повышения активности ферментных систем, а также способствующих восстановлению ее функций при различных повреждениях.
Одним из перспективных оригинальных лекарственных средств с соответствующими фармакологическими свойствами является препарат “Ремаксол, раствор для инфузий” (ООО “НТФФ “ПОЛИСАН”, Санкт-Петербург). Ремаксол является сбалансированным комплексом физиологически активных компонентов — янтарной кислоты, метионина, рибоксина и никотинамида. Сочетанное действие компонентов ремаксола не только улучшает энергетическое обеспечение печени, но и оказывает антиоксидантный эффект, что доказано в ряде доклинических и клинических исследований [2, 7].
Цель настоящего исследования — оценить детоксицирующее действие ремаксола на экспериментальной модели токсикоза, индуцированного цисплатином, и возможность применения его в онкологической клинике.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали раствор для инфузий “Ремаксол” (ООО “НТФФ “ПОЛИСАН”, Санкт-Петербург) состава: янтарная кислота — 5,28 г, N-метилглюкамин (меглумин) — 8,725 г, рибоксин (инозин) — 2 г, метионин — 0,75 г, никотинамид — 0,25 г, а также противоопухолевый препарат цисплатин (ДДП) (“Эбе-ве”, Австрия).
Изучение детоксицирующего действия
Детоксицирующее действие ремаксола изучали на модели токсикоза, индуцированного введением токсической дозы (LD50) ДДП. Цитостатик вводили однократно в вену в дозе 16 мг/кг, вызывающей 50 % гибель животных. Ремаксол вводили в вену в дозах 13 мл/кг (соответствует терапевтической дозе для человека) и 50 мл/кг (максимальная доза препарата, которую можно ввести животному) на протяжении 10 дней после введения ДДП (курсовые дозы 130 и 500 мл/кг соответственно). Регистрировали гибель животных. Оценивали гематологические и биохимические показатели. Забор материала у выживших животных проводили на 3, 7 и 12-е сутки после введения ДДП.
Биохимическое и гематологическое исследования. Гематологическое исследование включало определение концентрации гемоглобина, подсчет общего количества лейкоцитов, эритроцитов в периферической крови мышей. Кровь брали из купированного хвоста животных. Подготовку крови вели общепринятыми методами. Биохимическое исследование сыворотки крови животных включало: определение активности аспартатаминотрансаминазы (АСТ) и аланинаминотрансаминазы (АЛТ), концентрации мочевины, креатинина, содержания общего билирубина. Биохимические показатели определяли с помощью стандартных биохимических наборов фирмы “Диакон” (Россия) на биохимическом анализаторе “Screen Master Plus” (Италия).
Группы животных: 1 (контрольная, n= 18) — животным вводили однократно ДДП (16 мг/кг); 2 (n = 18) — животным вводили однократно ДДП и ремаксол в разовой дозе 13 мл/кг в течение 10 дней (курсовая доза — 130 мл/кг); 3 (n = 18) — животным вводили однократно ДДП и ремаксол в разовой дозе 50 мл/кг в течение 10 дней (курсовая доза — 500 мл/кг); 4 (n = 9) — животным вводили ремаксол в разовой дозе 13 мл/кг в течение 10 дней (курсовая доза — 130 мл/кг); 5 (n = 9) — животным вводили ремаксол в разовой дозе 50 мл/кг в течение 10 дней (курсовая доза — 500 мл/кг); 6 (контрольная, n = 9) — животным вводили 0,9 % раствор натрия хлорида (“Дальхимфарм”, Россия).
Изучение влияния на терапевтический эффект цисплатина
Перевиваемые опухоли мышей: карцинома легкого Льюис (LLC), карцинома Эрлиха (ОЭ), саркома S-37, лимфоцитарная лейкемия (Р-388). Штаммы были получены из лаборатории опухолевых штаммов РОНЦ им. Н. Н. Блохина РАМН и поддерживались in vivo по общепринятым методам в лаборатории модификаторов и протекторов противоопухолевой терапии МНИОИ им. П. А. Герцена на линейных животных [6]. В опытах использованы 2-ой — 8-ой пассажи in vivo.
Группы животных: 1, 5, 9 и 15-я (контрольные, n = 6) — животным с опухолью вводили 0,9 % раствор натрия хлорида; 2, 6, 10, 14-я (n = 6) — животным с опухолью вводили однократно внутривенно ДДП в разовой дозе 8 мг/кг; 3, 7, 11, 15-я (n = 6) — животным вводили внутривенно ДДП (однократно) в дозе 8 мг/кг и ремаксол ежедневно в течение 5-и дней в разовой дозе 50 мл/кг (курсовая доза — 250 мл/кг); 4, 8, 12, 16-я (n = 6) — животным вводили внутривенно ДДП (однократно) в дозе 8 мг/кг и ремаксол ежедневно внутрибрюшинно в течение 15-ти дней в разовой дозе 50 мл/кг (курсовая доза — 750 мл/кг). Лечение начинали через 24 или 48 ч после перевивки опухоли.
Влияние ремаксола и цисплатина на рост опухолей оценивали по торможению роста опухоли (ТРО) по средней продолжительности жизни животных (СПЖ), увеличению продолжительности жизни животных (УПЖ) [7]. Биологически значимыми считали ТРО > 50 %, УПЖ > 25 %.
Статистическую обработку результатов проводили с использованием метода Стьюдента — Фишера. Различия считали достоверными приp < 0,05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕИЕ
Детоксицирующее действие ремаксола оценивали in vivo на модели токсикоза, индуцированного противоопухолевым препаратом ДДП, используемым в схемах полихимиотерапии. Противоопухолевое действие ДДП реализуется за счет образования свободнорадикальных продуктов, которые индуцируют перекисное окисление клеточных мембран почек, печени, легких и пр., что, в конечном итоге, нарушает структуру и функцию этих органов. ДДП вызывает комплекс токсических реакций даже при применении в терапевтической дозе. При введении этого препарата в высоких дозах, вызывающих гибель животных от острой токсичности, спектр токсических реакций цитостатика расширяется с увеличением их интенсивности.
Однократное введение ДДП в дозе 16 мг/кг приводило к 50 % гибели животных от острых токсических реакций (рисунок). Гибель животных начиналась с 5-х суток после воздействия и продолжалась в течение 3-х дней. У выживших животных введение ДДП в дозе 16 мг/кг вызывало на 3-и сутки лейкопению (3,1 ± 0,3 • 109/л ) с последующим лейкоцитозом на 7-е сутки (22 ± 2,4 • 109/л ; норма — 9,8 ± 1,6 • 109/л ), который обусловлен компенсаторной реакцией организма (табл. 1).
Влияние ремаксола на токсическое действие ДДП.
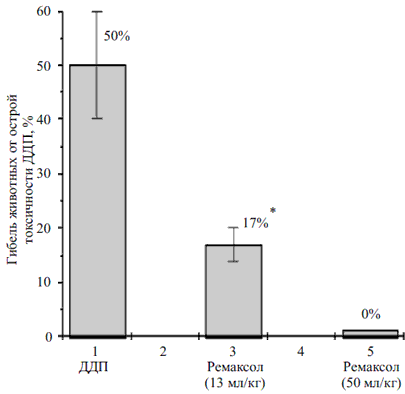
ДДП вводили однократно внутривенно в дозе 16 мг/кг. Ремаксол вводили внутривенно в течение 10 дней после воздействия ДДП в разовых дозах 13 и 50 мл/кг (курсовые — 130 и 500 мл/кг соответственно). * — статистически значимое отличие относительно животных контрольной группы ДДП (p < 0,05).Таблица 1. Гематологические показатели крови мышей (BDF1, самки) получавших ДДП и ремаксол
№ группы Применяемые препараты День после введения цитостатика 3 7 12 Лейкоциты, 109/л
1 ДДП 3,1 ± 0,3* 22,0 ± 2,4* 11,0± 1,0 2 ДДП + ремаксол (13 мл/кг) 5,0 ± 0,9* 16,1 ± 1,1 9,0 ± 1,0 3 ДДП + ремаксол (50 мл/кг) 5,5 ± 0,8 13,8 ± 0,9** 8,3 ± 1,6 4 Ремаксол (13 мл/кг) 10,1 ± 1,5 9,5 ± 0,5 8,7 ± 1,5 5 Ремаксол (50 мл/кг) 8,9 ± 1,4 10,1 ± 1,0 8,5 ± 1,0 6 Без воздействия 9,8 ± 1,6 Гемоглобин, г/л
1 ДДП 121 ± 19 134 ± 19 145 ± 15 2 ДДП + ремаксол (13 мл/кг) 147 ± 15 166 ± 19 146 ± 21 3 ДДП + ремаксол (50 мл/кг) 135 ± 10 139 ± 12 149 ± 12 4 Ремаксол (13 мл/кг) 160 ± 17 146 ± 15 140 ± 13 5 Ремаксол (50 мл/кг) 145 ± 13 159 ± 17 155 ± 17 6 Без воздействия 141 ± 29 Эритроциты, 1012/л
1 ДДП 4,9 ± 1,8 5,1 ± 1,1 5,1 ± 1,1 2 ДДП + ремаксол (13 мл/кг) 4,5 ± 0,7 5,1 ± 0,8 4,8 ± 0,6 3 ДДП + ремаксол (50 мл/кг) 6,7 ± 1,1 5,2 + 0,3 6,1 ± 0,9 4 Ремаксол (13 мл/кг) 6,1 ± 0,5 5,9 ± 0,9 6,7 ± 1,1 5 Ремаксол (50 мл/кг) 5,9 ± 0,4 6,1 ± 0,6 5,9 ± 1,0 6 Без воздействия 6,4 ± 1,2 Примечание. Здесь и в табл. 2 отличия статистически значимы: * — от группы животных без воздействия (p < 0,05), **— от группы животных получавших только цитостатик (p < 0,05) В биохимических анализах крови (табл. 2) у животных контрольной (1) группы на 7-е сутки наблюдали 2-кратное повышение (относительно среднестатистически нормальных значений) активности цитоплазматических ферментов: АСТ — до 293 + 21МЕ/л и АЛТ — до 98 + 6 МЕ/л (норма — АСТ 145 + 12 МЕ/л, АЛТ 44 + 12 МЕ/л), концентрации общего билирубина (5,4 + 0,9 мкмоль/л; норма 2,2 + 0,5), что обусловлено гепатотоксичностью ДДП. Нефротоксичность цитостатика, которая является лимитирующей для ДДП, выражалась в статистически достоверном увеличении концентрации конечных продуктов азотистого обмена — креатинина до 107+ 10 мкмоль/л и мочевины до 11,5 ± 0,9 ммоль/л на 3-е сутки наблюдения за животными (норма — 49 ± 6 и 4,7 ± 0,5 ммоль/л соответственно). Отмеченное увеличение (в 2 раза относительно показателя нормы) концентрации мочевины и креатина, сопровождающееся выраженным синдромом интоксикации, отражало развившуюся у животных почечную недостаточность.
Таблица 2. Биохимические показатели крови мышей (BDF1, самки)
Применяемые препараты Биохимические показатели после введения, день 3 7 12 АСТ, МЕ/л
ДДП 182 ± 11 293 ± 21* 212 ± 18 Ремаксол (13 мл/кг) + ДДП 154 ± 10 187 ± 14 159 ± 9 Ремаксол (50 мл/кг) + ДДП 161 ± 7 167 ± 23** 138 ± 15 Ремаксол (13 мл/кг) 135 ± 9 156 ± 9 142 ± 14 Ремаксол (50 мл/кг) 151 ± 8 150 ± 11 149 ± 9 Без воздействия 145 ± 12 АЛТ, МЕ/л
ДДП 82 ± 5 98 ± 6* 61±6 Ремаксол (13 мл/кг) + ДДП 70 ± 5 78 ± 8 68 ± 4 Ремаксол (50 мл/кг) + ДДП 54 ± 7 53 ± 5** 58 ± 7 Ремаксол (13 мл/кг) 56 ± 8 48 ± 6 51±7 Ремаксол (50 мл/кг) 46 ± 8 55 ± 15 51±7 Без воздействия 44 ± 12 Креатинин, мкмоль/л
ДДП 107 ±10* 97 ± 16* 65 ± 12 Ремаксол (13 мл/кг) + ДДП 59 ±16** 51 ± 14** 59 ± 8 Ремаксол (50 мл/кг) + ДДП 46 ± 5** 47 ± 6** 46 ± 11 Ремаксол (13 мл/кг) 48 ± 9 49 ± 3 41±5 Ремаксол (50 мл/кг) 46 ± 5 50 ± 9 47 ± 8 Без воздействия 49 ± 6 Мочевина, ммоль/л
ДДП 11,5 ± 0,9* 10,0 ± 1,1* 4,1 ± 0,9 Ремаксол (13 мл/кг) + ДДП 6,4 ± 1,0 5,9 ± 1,2** 4,8 ± 0,5 Ремаксол (50 мл/кг) + ДДП 5,0 ± 0,8** 5,4 ± 0,9** 6,2 ± 1,5 Ремаксол (13 мл/кг) 4,2 ± 0,9 4,0 ± 0,6 4,0 ± 0,3 Ремаксол (50 мл/кг) 4,4 ± 0,4 3,8 ± 0,4 4.9 ± 0,4 Без воздействия 4,7 ± 0,5 Общий билирубин, мкмоль/л
ДДП 5,6 ± 0,6* 4,4 ± 0,9* 3,4 ± 1,0 Ремаксол (13 мл/кг) + ДДП 2,9 ± 0,7** 3,0 ± 1,0 2,6 ± 0,7 Ремаксол (50 мл/кг) + ДДП 2,5 ± 0,6** 2,4 ± 0,3 2,2 ± 0,4 Ремаксол (13 мл/кг) 2,2 ± 0,4 1,8 ± 0,6 1,9 ± 0,3 Ремаксол (50 мл/кг) 1,8 ± 0,6 2 ± 0,6 2,3 ± 0,8 Без воздействия 2,2 ± 0,5 Таким образом, ДДП в разовой дозе 16 мг/кг вызывал у животных комплекс токсических реакций, характеризующих различные проявления токсичности: ге-мато-, гепато-, нефротоксичность.
В качестве детоксицирующего агента животным опытных групп вводили ремаксол. Введение гепатопротектора в разовой дозе 13 мл/кг в течение десяти дней (курсовая доза 130 мл/кг) способствовало снижению токсичности ДДП. Гибель животных в этой группе составляла 17 %, то есть уменьшилась в 3 раза относительно контроля. Увеличение разовой дозы ремаксола до 50 мл/кг и, соответственно, курсовой дозы — до 500 мл/кг приводило к “отмене” гибели животных от острой токсичности, вызванной цитостатиком.
Для выявления эффекторного звена детоксицирующего действия ремаксола оценили гематологические и биохимические показатели крови у выживших животных. В табл. 1 представлены данные общего анализа крови животных, получавших ДДП и ремаксол.
Сочетанное применение ДДП и ремаксола меняло картину гематотоксичности используемого в экспериментах цитостатика: у животных опытных групп (группы 2 и 3) наблюдалось менее выраженное повышение общего количества лейкоцитов, которое на 7-е сутки наблюдения составляло 16,1 ± 1,1 • 109/л и 13,8 ± 0,9 • 109/л (норма — 9,8 ± 1,6 • 109/л ) при введении ремаксола в разовых дозах 13 и 50 мл/кг (курсовые — 130 и 500 мл/кг), соответственно. На показатели красного ростка кроветворения ДДП не оказывает выраженного влияния: общее количество эритроцитов и концентрация гемоглобина в крови у животных опытных и контрольных групп существенно не отличались от показателей в группе животных без воздействия.
Исследования показали, что ремаксол обладает выраженными гепато- и нефропротекторными свойствами. В период реализации токсичности ДДП в группах животных, которым вводили ремаксол, практически все биохимические показатели крови животных соответствовали среднестатистически нормальным значениям во все сроки наблюдения (табл. 2).
В группе животных (3), получавших ДДП и ремаксол в разовой дозе 50 мл/кг (курсовая доза — 500 мл/кг), на 7-е сутки наблюдения активность цитоплазматических ферментов АСТ и АЛТ — показателей функционального состояния печени — составляла 167 + 23 и 53 + 5 МЕ/л соответственно, в то время как в контрольной группе (1) — 293 + 21 и 98 + 6 МЕ/л соответственно, т.е. наблюдались статистически достоверные различия между показателями в контрольной и опытной группах. При использовании ремаксола в меньшей разовой дозе — 13 мл/кг (курсовая доза — 130 мл/кг) эффект был менее выражен, однако гепатопротекторное действие ремаксола прослеживалось. Применение ремаксола в исследованных дозах в сочетании с ДДП приводило также к поддержанию концентрации общего билирубина на нормальном уровне (2,9 ± 0,7 и 2,5 ± 0,6 мкмоль/л соответственно, норма — 2,2 ± 0,5 мкмоль/л) при значительном повышении значений (до 5,6 ± 0,6 мкмоль/л) в контрольной группе. По результатам биохимического анализа крови ремаксол практически полностью купировал проявления нефротоксичности, вызванной однократным введением токсической дозы ДДП (табл. 2). Как видно из табл. 2, курсовое введение ремаксола в разовых дозах 13 и 50 мл/кг на фоне ДДП приводило к достоверному снижению концентрации креатинина по сравнению с контрольной группой (1): на 3-и сутки наблюдения в опытных группах животных (группы 2 и 3) концентрация креатинина составляла 59 ± 16 и 46 ± 5 мкмоль/л (норма — 49 ± 6 мкмоль/л), соответственно, в то время как в контрольной — 107 ± 10 мкмоль/л. При этом концентрация мочевины в крови у животных этих групп была на уровне нормальных значений и составляла 6,4 ±1 и 5 ± 0,8 ммоль/л (норма — 4,7 ± 0,5 ммоль/л), соответственно, а в группе сравнения — 11,5 ± 0,9 ммоль/л.
Таким образом, результаты исследований на модели токсикоза, индуцированного цисплатином (ДДП), подтвердили полученные ранее данные о гепатопротекторных свойствах ремаксола и показали его нефро- и гематопротекторные эффекты, то есть доказали комплексную детоксицирующую активность препарата.
Применение ремаксола может быть перспективным при химиотерапии у больных с различными формами злокачественных новообразований. Эти больные, особенно при распространенных процессах, находятся в состоянии интоксикации, которая обусловлена как онкологическим заболеванием, так и агрессивными методами противоопухолевой терапии, что определяет целесообразность проведение поддерживающей терапии. Однако известно, что биологически активные соединения, оказывающие детоксицирующее действие или стимулирующие эндогенную систему детоксикации, могут параллельно со снижением токсичности антибластомных средств уменьшить их терапевтический эффект.
Для обоснований использования ремаксола в онкологической клинике оценили влияние препарата на лечебный эффект цитостатика на экспериментальных моделях роста опухолей различного гистогенеза: карциномы легких Льюис (LLC), меланомы В-16, лимфолейкоза Р-388 и саркомы S37 (табл. 3).
Таблица 3. Влияние ремаксола на терапевтическое действие цисплатина (ДДП) у мышей с различными экспериментальными опухолями
№ группы Применяемые препараты Объем опухоли (мм )/торможение роста опухоли (%) Сроки наблюдения, сут 10 14 17 21 LLC 1 Контроль LLC 2040 ± 423 4176 ± 864 5198 ± 1922 8293 ± 1720 2 ДДП 324 ± 140
84*1057 ± 538
75*1717 ± 778
67*2825 ± 1429
66*3 ДДП + ремаксол (250 мл/кг) 198 ± 45
90*874 ± 419
79*1741 ± 594
67*2802 ± 612
66*4 ДДП + ремаксол (750 мл/кг) 189 ± 76
91*854 ± 290
80*1726 ± 348
67*2532 ± 612
69*S-37 5 Контроль S-37 1078 ± 131 1367 ± 384 2017 ± 441 2598 ± 857 6 ДДП 111 ± 25
90*150 ± 119
89*460 ± 134
77*906 ± 382
65*7 ДДП + ремаксол (250 мл/кг) 117 ± 85
89*191 ± 106
86*383 ± 117
81*956 ± 350
63*8 ДДП + ремаксол (750 мл/кг) 64 ± 31
94*139 ± 56
90*478 ± 101
76*1007 ± 235
61В16 9 Контроль В16 328 ± 177 1562 ± 600 2359 ± 862 3986 ± 1295 10 ДДП 62 ± 24
81*397 ± 64
75*812 ± 108
66*1547 ± 325
6111 ДДП + ремаксол (250 мл/кг) 6 ± 2
98*221 ± 42
86*460 ± 122
81*877 ± 128
78*12 ДДП + ремаксол (750 мл/кг) 13 ± 3
96*298 ± 87
81*649 ± 171
73*1092 ± 287
73*Р388 13 Контроль Р388 532 ± 71 857 ± 278 857 ± 181 1417 ± 399 14 ДДП 119 ± 37
78*240 ± 64
72*455 ± 74
47803 ± 194
4315 ДДП + ремаксол (250 мл/кг) 101 ± 43
81*200 ± 75
77*491 ± 43
43955 ± 259
3316 ДДП + ремаксол (750 мл/кг) 141 ± 41
73*323 ± 89
62474 ± 123
45790 ± 156
44Мыши: BDF1 самцы и самцы; F1 самки.
* — статистически значимое отличие от группы животных, получавших физраствор (контроль) ( p < 0,05).
ДДП применяли внутривенно однократно в терапевтической дозе 8 мг/кг. Ремаксол вводили внутривенно ежедневно в течение 5 дней в разовой дозе 50 мл/кг (курсовая доза — 250 мл/кг) или внутрибрюшинно в течение 15 дней в разовой дозе 50 мл/кг (курсовая доза — 750 мл/кг).
Исследования, проведенные на животных с карциномой легких Льюис (LLC), саркомой S37 (S37) и лимфолейкозом Р388 (P388), показали, что применение ремаксола в схеме лечения с цисплатином не уменьшает его противоопухолевое действие.
Добавление ремаксола в схему лечения цисплатином экспериментальной меланомы В16 не только не уменьшало, но способствовало усилению противоопухолевого действия цитостатика, что выражалось в увеличении ТРО во все сроки наблюдения. На 21-й день наблюдения в опытных группах животных ТРО составляло 78 % при внутривенном введении ремаксола на фоне цисплатина и 73 % — при внутрибрюшинном введении, в то время как в контрольной группе (ДДП) величина ТРО составляла всего 61 %.
Ремаксол не оказывал влияния на рост и метастазирование изученных экспериментальных опухолей, что свидетельствует о безопасности применения препарата у больных со злокачественными опухолями.
ВЫВОДЫ
- Ремаксол в схемах лечения с цисплатином мышей с различными по гистогенезу опухолями не уменьшает противоопухолевый эффект цитостатика.
- Ремаксол не оказывает стимулирующего влияния на рост изученных опухолей (карцинома, саркома, меланома, лимфолейкоз) у мышей.
- Ремаксол оказывает выраженное дозозависимое детоксицирующее действие в отношении цисплатина, снижая гибель интактных мышей в 3 раза при применении в курсовой дозе 130 мл/кг и предупреждая летальность при курсовой дозе 500 мл/кг, а также нормализуя биохимические показатели крови, характеризующие функциональное состояние печени и почек.
ЛИТЕРАТУРА
1. Клиническая фармакология: национальное руководство, Ю. Б. Белоусов и др. (ред.), ГЭОТАР-Медиа, Москва (2009).
2. А. Л. Коваленко, Д. С. Суханов, М. Г. Романцов, Фармацевтическая промышленность, ¹ 4, 58 - 61 (2010).
3. Н. К. Мазина, В. П. Сухоруков, Н. В. Гоголев и др., Вятский мед. вестник, ¹ 1, 34 - 42 (2010).
4. С. В. Оковитый, Н. Н. Безбородкина, С. Г. Улейчик, С. Н. Шуленин, Гепатопротекторы, ГЭОТАР-Медиа, Москва (2010).
5. В. Г. Радченко, А. В. Шабров, Е. Н. Зиновьева, Основы клинической гепатологии, СПб (2005).
6. Руководство по экспериментальному изучению новых фармакологических веществ, Р. У. Хабриев (ред.), 2-е изд., Медицина, Москва (2005), сс. 647 - 648.
7. Т. В. Сологуб, Л. Г. Горячева, Д. С. Суханов и др., Клин. мед., ¹ 1, 62 - 66 (2010).
| Июнь 2011 г. |