Последующая информация предназначена только для медицинских работников!
Выбрав ссылку "Продолжить", Вы подтверждаете, что являетесь специалистом в области здравоохранения.
Опубликовано в журнале:
«АНТИБИОТИКИ И ХИМИОТЕРАПИЯ»; 2011; 56; 1-2; стр. 12-16.Сравнительное изучение гепатопротективного действия ремаксола, реамберина и адеметионина при повреждении печени противотуберкулёзными препаратами (экспериментальное исследование)
Д. С. СУХАНОВ1, Т. И. ВИНОГРАДОВА2, Н. В. ЗАБОЛОТНЫХ2, А. Л. КОВАЛЕНКО3, С. Н. ВАСИЛЬЕВА2, М. Г. РОМАНЦОВ1
1 Санкт-Петербургская государственная медицинская академия им. И. И. Мечникова Росздрава, Санкт-Петербург
2 Санкт-Петербургский НИИ фтизиопульмонологии Росмедтехнологий, Санкт-Петербург
3 Научно-технологическая фармацевтическая фирма «ПОЛИСАН», Санкт-ПетербургВ опытах на 30 белых беспородных крысах-самцах изучена гепатозащитная активность ремаксола, реамберина и адеметионина при моделировании повреждения печени противотуберкулёзными препаратами (ПТП): изониазид (H) — 50 мг/кг, подкожно + рифампицин (R) — 250 мг/кг, внутрижелудочно + пиразинамид (Z) — 45 мг/кг, внутрижелудочно) по методике, разработанной Ю. И. Сливкой (1989). Исследуемые препараты вводили за 1,5 часа до применения ПТП, продолжительность курса — 14 дней. Установлена способность исследуемых препаратов (ремаксола, реамберина и адеметионина) корригировать структурно-функциональные нарушения печени, возникающие под действием ПТП. По влиянию на величину биохимических показателей, отражающих функциональное состояние печени, максимальный эффект достигнут при использовании ремаксола, несколько уступал ему реамберин, менее значительные результаты получены на фоне введения адеметионина. Кроме того, ремаксол оказал четко выраженный эффект снижения структурных нарушений печени, что проявлялось в восстановлении гистоархитектоники органа, сокращении распространённости углеводной, белковой и жировой дистрофии, активации процессов внутриклеточной регенерации. Отмечено, что адеметионин слабо влиял на процессы некробиоза, более того, в одном случае обнаружен крупный очаг некроза, что свидетельствует о возможной стимуляции альтерации печеночной ткани этим препаратом.
Ключевые слова: экспериментальное повреждение печени, противотуберкулёзные препараты, ремаксол, реамберин, адеметионин.Comparative study of Hepatoprotective Action of Remaxole, Reamberin and Ademethionine in Liver Injury by Antituberculosis Drugs (Experimental Study)
D. S. SUKHANOV, T. I. VINOGRADOVA, N. V. ZABOLOTNYKH, A. L. KOVALENKO, S. N. VASILYEVA, M. G. ROMANTSOV
I. I. Melnikov St.Petersburg State Medical Academy, St.Petersburg St.Petersburg Research Institute of Phthisiopulmonology, St.Petersburg Scientific and Technological Pharmaceutical Co. POLYSAN, St.PetersburgThe hepatoprotective activity of remaxole, reamberin and ademethionine was studied on a model of the liver Injury by antituberculosis drugs. The study included 30 male uninbred albino rats. The following antituberculosis drugs were used: isoniazid (50 mg/kg) subcutaneously + rifampicin (250 mg/kg) intragastrically + pyrazinamide (45 mg/kg) intragastically (by the procedure of Yu. I. Slivka, 1989). Remoxole, reamberin and ademethionine were administered 1—5 hour prior to the antituberculosis drugs. The treatment course was 14 days. It was shown that remaxole, reamberin and ademethionin were able to correct the structural to the use of the antituberculosis drugs. By the impact on the biochemical indices, evident of the liver function condition, remaxole showed the maximum effect. The effect of reamberin was somewhat lower and the results of the ademethionine use were less significant. Remaxole had also a distinct effect as for lowering the level of the structural injuries in the liver, evident from recovery of the organ histoarchitectonics, less extended carbohydrate, albuminous and fatty degeneration, more active intracellular regeneration. It was noted that ademethionine had an insignificant effect on necrobiosis. Moreover, there was once detected a large necrosis focus, evident of possible stimulation of the liver tissue alteration by the drug.
Key words: liver experimental injury, antituberculosis drugs, remaxole, reamberin, ademethionine.Введение
Патология печени, являющейся центральным органом химического гомеостаза, у больных туберкулезом характеризуется разнообразием этиологических и патогенетических факторов, среди которых выделяют специфические и неспецифические изменения. Первое место в ряду неспецифических изменений занимают лекарственные поражения печени [1—3]. Установлено, что практически все используемые во фтизиатрии препараты оказывает гепатотоксическое действие различной степени выраженности [4, 5]. Отмечается, что среди всех антибактериальных средств по выраженности гепатотоксического эффекта противотуберкулезные препараты занимают лидирующую позицию [6, 7].
В комплексном лечении лекарственных поражений печени целесообразно использование метаболической и коферментной терапии, положительно влияющей на повышение устойчивости гепатоцитов к токсическому воздействию, оказывающей детоксикационный эффект с восстановлением функции пораженного органа [6].
По мнению В. А. Хазанова [8, 9] в основе большинства внутриклеточных патологических процессов лежит митохондриальная дисфункция, оптимальная коррекция которой возможна путём активации сукцинатоксидазного окисления, обладающего мощной энергопродукцией. Введение экзогенного сукцината способствует нормализации аэробного окисления в митохондриях, устраняет разобщение окислительного фосфорилирования и угнетение микросомальных процессов [10].
В клинической практике положительно зарекомендовали себя препараты антигипоксического действия на основе янтарной кислоты. Одним из сукцинатсодержащих препаратов является реамберин (раствор Na,N-метилглюкамина сукцината), позиционируемый как дезинтоксикационное средство антигипоксического действия при ряде патологических состояний [11]. Созданный на его основе оригинальный гепатопротекторный препарат ремаксол, содержащий янтарную кислоту (в виде N-метилглюкаминовой соли), метионин, рибоксин и никотинамид в комплексе с электролитами, доказал свою эффективность в ряде доклинических и клинических исследований [12, 13]. Входящий в его состав метионин, способный к превращению в организме в адеметионин под действием метионинаденозилтрансферазы, является эндогенным донором метильной группы. Адеметионин участвует в биологических реакциях трансметилирования, обеспечивающих текучесть и поляризацию мембран за счет увеличения содержания фосфолипидов, и транссульфатирования, восстанавливающих пул эндогенного глутатиона [14, 15].
Цель настоящего исследование явилось сравнительное доклиническое изучение активности ремаксола, реамберина (Na,N-метилглюкамина сукцината) и экзогенного адеметионина при экспериментальном поражении печени противотуберкулезными препаратами.
Материал и методы
Эксперимент выполнен в лаборатории патоморфологии и экспериментального туберкулеза Санкт-Петербургского НИИ фтизиопульмонологии на 30 белых беспородных: крысах-самцах. Поставщик животныгх — питомник «Рапполово» РАМН, Санкт-Петербург.
Перед исследованием животныгх подвергали 10-дневному карантину, в течение которого проводили осмотр крыс, регистрировали массу тела, поведение и общее состояние животныгх. Основные критерии включения животных в исследование: масса тела — не менее 180—200 г; шерстяной покров — гладкий, блестящий; поведение и общее состояние — активная динамика движения и потребления кормов. Перед началом исследования крыс, отвечающих критериям включения, распределяли на группы с помощью метода рандомизации.
Повреждение печени моделировали по методике Ю.И. Сливки [16] путем введения противотуберкулезных препаратов (ПТП) в следующих дозах: изониазид (H) — 50 мг/кг, подкожно + рифампицин (R) — 250 мг/кг, внутрижелудочно + пиразинамид (Z) — 45 мг/кг, внутрижелудочно. Длительность применения ПТП составляла 14 дней.
В эксперименте было сформировано 5 групп животных:
1-я группа — интактные крысы (n=6);
2-я группа — контрольная группа (n=6), животные которой получали противотуберкулезные препараты HRZ;
3-я группа — крысы, получавшие реамберин в дозе 25 мл/кг внутрибрюшинно на фоне противотуберкулезных препаратов (n=6);
4-я группа — крысы, получавшие ремаксол в дозе 25 мл/кг внутрибрюшинно на фоне противотуберкулезных препаратов (n=6);
5-я группа — крысы, получавшие адеметионин в дозе 0,09 мл/ 100 г массы тела внутрибрюшинно на фоне противотуберкулезных препаратов (n=6).Изучаемые препараты применяли за 1,5 часа до введения противотуберкулезных препаратов. Интактные животные получали физиологический раствор в эквиобъемных количествах. Все исследуемые вещества вводили один раз в сутки, ежедневно на протяжении 14 дней.
Животных выводили из опыта путем декапитации, осуществляли забор крови для биохимического исследования, при вскрытии извлекали печень для последующего патоморфологического исследования.
В комплекс биохимических исследований входило определение уровня общего билирубина (в мкмоль/л), общего белка (в г/л), холестерина (в ммоль/л), триглицеридов (в ммоль/л), маркеры цитолиза (по активности ферментов аланинаминотрансферазы (АлАТ, в МЕ/л) и аспартатаминотрансаминазы (АсАТ, в МЕ/л)) и маркеров холестаза ( по уровню щелочной фосфатазы (в МЕ/л)).
Биохимическое исследование сыворотки крови выполняли на аппарате «Синхрон» (Бэкман, США).
Для патоморфологических исследований кусочки печени фиксировали в 10% растворе нейтрального формалина, осуществляли стандартную проводку, заливали в целлоидин парафин, масло, срезы (4—6 мкм) окрашивали гематоксилином и эозином, PAS и PAS+амилаза.
Оценка гепатозащитного эффекта исследуемых препаратов. Определяли индекс эффективности гепатозащитного действия исследуемых препаратов — ИЭ (в %) — долевую разницу показателей тяжести поражения печени в контрольной группе и в группах животных, получавших исследуемые препараты. ИЭ гепатопротекторного действия определяли по формуле:
ИЭ = (nK- n0) / nK X 100,
где пк и no — средние значения показателей соответственно в контрольной и опытной группах.Положительное значение ИЭ (плюс-эффект) указывает на снижение показателя поражённости. Отрицательное значение ИЭ (минус-эффект) свидетельствует об увеличении показателя поражённости.
При оценке полученных результатов использовали параметрический тест Стьюдента-Фишера [17] и непараметрический тест Манна-Уитни — критерий U [18].
Результаты и обсуждение
Анализ результатов биохимического тестирования показал, что у крыс, получавших в течение 14 дней только ПТП, по сравнению с интактными отмечалось следующее: увеличение активности в 1,5 раза (р<0,002) щелочной фосфатазы; гиперхолестеринемия; возрастание в 1,6 раза (р<0,001) уровня триглицеридов; нарушение пигментного обмена по содержанию общего билирубина (12,8±0,78 мкмоль/л против 8,08±0,62 мкмоль/л, р<0,001), нарастание в 1,5—1,6 раза (р<0,001) активности ферментов АлАТ и АсАТ (табл. 1 и 2). Всё вышеизложенное свидетельствует о развитии у животных под воздействием ПТП поражения печени по типу цитолиза и холестаза, что соответствует данным литературы [16, 19—21].
Таблица 1.
Влияние реамберина, ремаксола и адеметионина на функциональные показатели повреждения печени крыс противотуберкулёзными препаратами
Группы животных Билирубин общий,
мкмоль/лОбщий белок, г/л Холестерин, ммоль/л Триглицериды, ммоль/л ИЭ, % Интактные (n=6) 8,08±0,62 71,4±1,91 1,53±0,09 1,14±0,15 HRZ (n=6) 12,8±0,78 74,3±0,85 1,95±0,12 1,91±0,11 Реамберин + HRZ (n=6) Р1-2<0,001 Р1-2<0,02 Р1-2<0,01 7,63±0,28 70,9±1,17 1,55±0,17 1,11±0,14 Р2-3<0,001 Р2-3<0,002 ИЭ2-3 +40,4 +4,6 +20,5 +41,9 +26,8 Ремаксол + HRZ (n=6) 8,28±0,6 73,1±2,23 1,45±0,08 0,83±0,13 Р2-4<0,001 Р2-4<0,01 Р2-4<0,001 ИЭ2-4 +35,3 +1,6 +25,6 +56,5 +29,8 Адеметионин + HRZ (n=5) 7,34±1,48 68,5±1,09 1,99±0,11 1,35±0,08 Р2-5<0,01 Р2-5<0,01 Р1-5<0,01 Р2-5<0,01 ИЭ2-5 +42,7 +7,8 - 2,1 +29,3 +19,4 Таблица 2.
Влияние реамберина, ремаксола и адеметионина на показатели ферментных маркеров повреждения печени крыс противотуберкулёзными препаратами
Группа животных АлАТ, МЕ/л АсАТ, МЕ/л Щелочная фосфатаза, МЕ/л ИЭ, % Интактные (n=6) 46,3±3,23 189,1±3,97 154,2±11,1 HRZ (n=6) 70,3±3,39 300,0±25,8 228,5±12,2 Реамберин + HRZ (n=6) Р1-2<0,001 Р1-2<0,001 Р1-2<0,002 56,0±6,44 195,1±15,2 135,8±16,0 Р2-3<0,01 Р2-3<0,001 ИЭ2-3 +20,3 +35,0 +40,6 +32,0 Ремаксол + HRZ (n=6) 49,8±4,17 177,9±11,0 161,4±18,5 Р2-4<0,01 Р2-4<0,02 Р2-4<0,02 ИЭ2-4 +29,2 +40,7 +29,4 +33,1 Адеметионин + HRZ (n=5) 44,2±3,28 211,4±10,78 217,7±29,7 Р2-5<0,002 Р2-5<0,02 ИЭ2-5 +37,1 +29,5 + 4,7 +23,7 В условиях применения реамберина, ремаксола и адеметионина наблюдалось купирование гепатотоксических проявлений действия ПТП, при этом значения биохимических показателей восстанавливались до «интактного» уровня. Как видно из данных, представленных в табл. 1 и 2, исследуемые препараты отличались по выраженности гепатопротекторной активности. Так, по влиянию на величину показателей, отражающих функциональное состояние печени, максимальный эффект был достигнут при использовании ремаксола, когда индекс эффективности (ИЭ) составил + 29, 8%, несколько уступал ему реамберин (+26,8%); менее значительные результаты получены на фоне адеметионина — +19,4%, что в 1,4—1,5 раза ниже реамберина и ремаксола (см. табл. 1).
Важно отметить, что под влиянием реамберина и ремаксола происходила нормализация активности аланинамино- и аспартатаминотрансфераз — наиболее чувствительных индикаторов повреждения клеток печени, а также щелочной фосфатазы — маркёра холестаза. По средней суммарной величине ИЭ на первом месте оказалось действие ремаксола (+33,1%), далее в порядке снижения — реамберина (+32,0%) и адеметионина (+23,7%).
Гистологическое исследование срезов ткани печени выявило у контрольных крыс, получавших только ПТП, значительные нарушения структуры органа. Гепатоциты, расположенные в центральных отделах печеночных долек, были резко увеличены в размерах, округлились, суживая просвет соответствующих синусоидов, что привело к нарушению балочной композиции печени и к увеличению междольковых пространств (рис. 1). При этом в гепатоцитах при окраске PAS и PAS+амилаза обнаружены отчётливые признаки углеводной, белковой и диффузной, а также резко выраженной жировой дистрофии. В цитоплазме гепатоцитов обнаружены крупные липидные вакуоли (рис. 2). Отмечались отчётливые признаки некробиоза гепатоцитов: кариопикноз и мелкие фокусы некротизированных гепатоцитов (в 5 из 6 случаев). При окраске PAS единичные дольки, содержащие гликоген, сохранились только в 1 из 6 случаев.
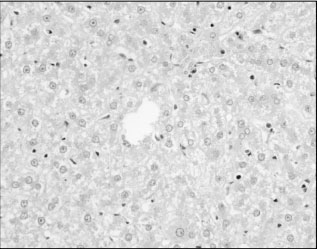
Рис. 1. Печень крысы, получавшей комплекс ПТП. Нарушение балочного строения долек.
Признаки белковой и жировой дистрофии. Окраска PAS+амилаза. Ув. Х400
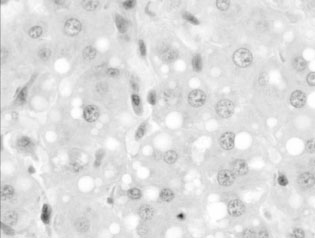
Рис. 2. Печень крысы, получавшей комплекс ПТП.
В цитоплазме гепатоцитов видны крупные и мелкие липидные вакуоли. Синусоиды резко сужены. Окраска PAS+амилаза. Ув. Х1500Под действием реамберина уменьшились процессы некробиоза гепатоцитов (мелкие фокусы некротизированных гепатоцитов не регистрировались, гепатоциты с кариопикнозом — только в 2 из 6 случаев) и несколько сократилась распространённость жировой дистрофии: в 2 из 6 случаев она была выражена слабо и зарегистрирована только на периферии долек и в междольковом пространстве.
Ремаксол способствовал значительному снижению признаков токсического поражения ткани печени ПТП. Отчетливо улучшилась архитектоника печени: восстановилась балочная структура долек, их правильное радиальное направление и уменьшилось междольковое пространство (рис. 3). Не отмечалось признаков некробиоза. Уменьшалась степень выраженности углеводной дистрофии: во всех случаях сохранялись группы долек, содержащих гликоген при окраске PAS. Жировая дистрофия была выражена слабо и только в отдельных группах гепатоцитов в междольковых пространствах. Сохранялись признаки белковой дистрофии гепатоцитов, но и они были значительно слабее, чем в контроле.
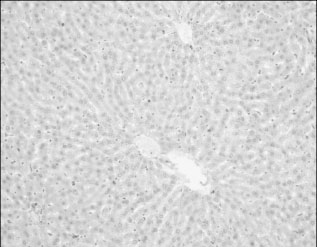
Рис. 3. Печень крысы, получавшей комплекс ПТП и ремаксол.
Дольковое строение печени и балочная структура сохранена. Окраска PAS+амилаза. Ув. Х200Важно подчеркнуть, что в 3 из 6 случаев в междольковых пространствах обнаружены группы гепатоцитов с более интенсивной, чем у остальных окраской цитоплазмы и ядер, а также менее отчетливым строением последних, что расценивается в качестве признака внутриклеточной регенерации (по Д. С. Саркисову).
У крыс, получавших адеметионин совместно с ПТП, также отмечена нормализация структуры печени и снижение степени выраженности углеводной, белковой и жировой дистрофии, как и при применении ремаксола. Однако препарат слабо влиял на процессы некробиоза (мелкие фокусы некроза гепатоцитов зарегистрированы в 4 из 5 случаев); более того, в одном случае обнаружен крупный очаг некроза, что свидетельствовало о возможной стимуляции альтерации печеночной ткани адеметионином, выявленной и в других наших исследованиях (рис. 4).
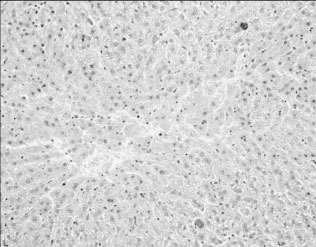
Рис. 4. Печень крысы, получавшей комплекс ПТП и адеметионин.
Крупный очаг некроза. Окраска PAS+ амилаза. Ув. Х200Таким образом, по данным морфологического анализа срезов ткани печени, только один из изученных препаратов, а именно ремаксол, оказал чётко выраженный эффект снижения структурных нарушений печени, вызванных ПТП, что проявлялось в восстановлении архитектоники органа, сокращении распространённости углеводной, белковой и жировой дистрофии, активации процессов внутриклеточной регенерации.
Выводы
1. В результате введения ПТП у крыс развивается повреждение печени, сопровождающееся повышением активности индикаторных ферментов и дистрофическими изменениями печеночной ткани с признаками некробиоза гепатоцитов.
2. Максимальный гепатопротекторный эффект отмечен при использовании ремаксола, оказывающего четко выраженный эффект снижения структурных нарушений печени, что проявлялось в восстановлении гистоархитектоники органа, сокращении распространённости углеводной, белковой и жировой дистрофии с активацикй процессов внутриклеточной регенерации.
3. Наименее значимые результаты гепато-протекторного действия получены на фоне введения экзогенного адеметионина, слабо влияющего на процессы некробиоза, при этом в одном случае обнаружен крупный очаг некроза, что свидетельствовало о возможной стимуляции альтерации печеночной ткани этим препаратом.ЛИТЕРАТУРА
1. Борзакова С. Н., Аксенова Б. А., Рейзис А. Р. Лекарственные поражения печени у детей, больных туберкулезом. Туберкулез и бол лёгких 2010; 8: 3-12.
2. Больф С. Б., Суханов Д. С., Романцов М. Г. Медикаментозные поражения печени при полихимиотерапии туберкулёза. Вест СПб гос мед акад И. И. Мечникова 2009; 1: 172—176.
3. Гурылева М. Э. Туберкулёз и заболевания печени. Фтизиатрия (национальное руководство). М.: 2007; 349—351.
4. Senaratne W. V., Pinidiyapathirage M. J., Perera G. A. et al. Anti-tuberculosis drug Induced Gepatitis — a Sri Lankan experience. Ceylon Med J 2006; 51: 2: 9—14.
5. Клиническая фармакология: национальное руководство / Под. ред. Ю. Б. Белоусова и др. М.: 2009; 450—459.
6. Зборовский А. Б., Тюренков И. Н, Белоусов Ю. Б. Неблагоприятные побочные эффекты лекарственных средств. М.: 2008; 385—405.
7. Яковлев С. Б. Клиническая химиотерапия бактериальных инфекций. М.: 1996; 120.
8. Хазанов Б. А. Фармакологическая регуляция энергетического обмена. Экспер клин фармакол 2009; 34: 61—64.
9. Кожока Т. Г.Лекарственные средства в фармакотерапии патологии клетки, М.: 2007; 136.
10. Малюк Б. И. Новые данные о биохимических механизмах туберкулёзного процесса и коррекция их нарушений этиопатогенетическими препаратами. Проблем туберкул 1984; 11: 61—64.
11. Реамберин (пострегистрационные клинические исследования 1999—2005). Рефераты опубликованных в печати научных статей. СПб.: 2005; 144.
12. Коваленко А. Л., Суханов Д. С., Романцов М. Г. Эффективность оригинального препарата «Ремаксол, раствор для инфузий» при поражениях печени различного генеза. Фарм промышл 2010; 4: 58—61.
13. Суханов Д. С., Коваленко А. Л., Романцов М. Г., Петров А. Ю, Саватеева Т. Н. Цитопротекторная активность сукцинатсодержащих препаратов на функциональную активность печени в эксперименте. Экспер клин фармакол 2010; 8: 35—39.
14. Santini D., Vincenzi B., Massaceisi C. et al. S-Adenosylmethionine supplementation for treatment of chemotherapy-induced liver injury. Anticancer Res. 2003; 23: 6D: 5173—5179.
15. Никитин И. Г. Гепатопротекторы: мифы и реальные возможности. Фарматека 2007; 13: 14—18.
16. Сливка Ю. И. Сравнительная характеристика гепатотоксичности изониазида, рифампицина и пиразинамида. Фармакол и токсикол 1989; 4: 82—85.
17. Урбах Б. Ю. Статистический анализ в биологических медицинских исследованиях. М.: 1975.
18. Гублер Е. Б. Вычислительные методы анализа и распознавания патологических процессов. Л.: 1978.
19. Литвинов А. Б. Лекарственная коррекция гепатотоксичности изониазида и сочетания изониазида с рифампицином. Автореф. дис. ... канд. мед. наук. М.: 1984.
20. Скакун Н. П., Табачук О. Е. Сравнительная гепатотоксичность изониазида, рифампицина и этамбутола. Пробл туберкул 1991; 10: 77—79.
21. Саратиков А. С., Бенгеровский А. И. Влияние гепатопротекторов, содержащих фосфолипиды, на зависимую от цитохрома Р-450 антитоксическую функцию печени при экспериментальном токсическом гепатите. Бюл экспер биол 1999; 4: 293—394.
| Июнь 2011 г. |