Опубликовано в журнале:
«Педиатрия. Приложение Consilium Medicum», 2007, № 2, с. 36-41Формирование микроэкологии кишечника и способы коррекции нарушений микробиоценоза кишечника у детей раннего возраста
Л.А. Харитонова
Кафедра педиатрии с инфекционными болезнями ФУВ ГОУ ВПО РГМУ Росздрава РоссииСтатья посвящена патогенетическому обоснованию необходимости применения различных групп лекарственных средств для корреции микробиоценоза кишечника у детей раннего возраста. Особое внимание уделено личному опыту применения про- и пребиотиков в педиатрической практике с учетом их механизма действия. Показаны преимущества и безопасность применения пребиотиков в терапии дисбиозов у детей раннего возраста. Представлены результаты собственных клинических исследований в этой области.
Введение
Микробная экология - наука, изучающая взаимоотношения микроорганизмов между собой и с окружающей средой. Медицинская микробная экология является одним из ее разделов и исследует взаимодействие медицински значимых микроорганизмов. Микрофлора человека представляет собой совокупность множества микробиоценозов, включает в себя сотни разнообразных видов и по количеству почти на порядок превышает число клеток всех органов и тканей человеческого организма.
Микроорганизмы, составляющие микробиоту человека, находятся между собой в разнообразных взаимоотношениях (синергизм, нейтрализм, паразитизм и др.). Недостаток или избыток самих микроорганизмов и/или их метаболитов служат сигналом для активации адаптивных механизмов в той или иной экосистеме. Благодаря «кооперации» между организмами, населяющими макроорганизм, микроэкологическая система человека выступает как единое целое, согласованно работающее на ту систему, в которой она локализована. Механизмы поддержания стабильности качественных и количественных параметров микрофлоры человека до конца не изучены. Очевидно, именно этим обусловлен постоянный интерес к проблеме микробиоценозов. Микроэкология пищеварительного тракта в этом плане представляет особый интерес. Понимание структурно-функционального значения изменений микрофлоры кишечника позволит подойти к терапии основных заболеваний и коррекции микробиоценозов с патогенетических позиций.
Роль микрофлоры пищеварительного тракта в организме человека
Желудочно-кишечный тракт (ЖКТ) представляет собой одну из наиболее сложных экосистем организма человека, в которой очень тонко сбалансировано взаимодействие между клетками пищеварительной системы и микробной флорой. С одной стороны, нарушение функции органа сопровождается изменениями состава микрофлоры, с другой - качественный и количественный состав последней определяет характер течения биохимических процессов, прохождения химуса по пищеварительному тракту и др. Роль микрофлоры кишечника в организме человека многообразна и сложна, она участвует в регуляции:
- темпов роста молодого и взрослого организма;
- потребности в питании;
- резистентности к инфекциям (колонизационная резистентность);
- выработки антибиотических веществ (лактолин, лактоцидин, ацидофилин);
- формирования кислой среды (путем продукции уксусной, муравьиной, янтарной и молочной кислоты) в различных отделах кишечника.
Детоксикационная функция микрофлоры кишечника в организме человека по значимости не уступает таковой функции печени (табл. 1).
Таблица 1. Детоксицирующая функция индигенной микробной флоры ЖКТ
Функция Кишечник Печень Доминируют Реакции гидролиза и восстановления Окисление и синтез Ксенобиотики битрансформируются С образованием нетоксичных продуктов и изоформ с ускоренной элиминацией из организма С образованием водорастворимыхпродуктов Таким образом, облигатная микрофлора ЖКТ участвует во многих жизненно важных физиологических процессах и оказывает в организме человека не только местное, но системное влияние. В связи с этим в настоящее время микробиоценоз кишечника рассматривают не как составную часть макроорганизма, а как экстракорпоральный орган.
Клинико-патофизиологические аспекты формирования микрофлоры кишечника
Кожа и пищеварительный тракт плода стерильны. Первично-микробная контаминация их происходит в процессе родов микроорганизмами влагалища, кожи и фекалий матери. Инфицирование новорожденных из окружающей среды в период формирования микрофлоры носит вторичный характер. В процессе колонизации ЖКТ, которая осуществляется оральным путем, на поверхности ворсинок слизистой оболочки (СО) пищеварительного тракта формируется мощная складчатая «биопленка» из разных по морфологии и типам бактерий. При этом одна группа бактерий представлена свободноживущими, другая - фиксированными к эпителиальным клеткам кишечника микроорганизмами аутохтонной (постоянная, индигенная, резидентная) микрофлоры. Прикрепление микробных клеток к поверхности СО происходит за счет их адгезии. Последняя осуществляется путем формирования водородных и ионных связей и способностью микроорганизмов к внеклеточной продукции полисахаридов. Экзополисахариды покрывают микробную клетку и защищают ее от воздействия простейших, бактериофагов и других неблагоприятных факторов. Внутри экзополисахаридного матрикса осуществляется деление микробных клеток с формированием микроколоний морфологически идентичных клеток.
Представители аутохтонной микрофлоры способны фиксироваться лишь к определенным рецепторам СО пищеварительного тракта. Фиксация бактерий осуществляется с помощью лектинов. Последние представляют собой соединения белковой или гликопротеиновой природы, обладающие специфической углеводсвязывающей активностью и комплементарные соответствующим рецепторам эпителиальных клеток. Количество рецепторов на эпителиальных клетках СО ограничено. Своеобразие рецепторов детерминируется генетически.
Видовая и анатомическая специфичность адгезии аутохтонной микрофлоры столь выражена, что, например, бактероиды, выделенные со СО полости рта, не могут длительно колонизировать кишечник даже у одного и того же индивидуума.
Биопленка, покрывающая СО пищеварительного тракта, состоит, помимо экзополисахаридов микробного происхождения и микроколоний морфологически идентичных клеток, из муцина, продуцируемого бокаловидными клетками. Бактериальномукозные взаимодействия, определяющие ассоциацию бактерий с поверхностью СО, могут происходить без морфологических изменений эпителиальных клеток и/или с формированием специализированных мембранно-адгезивных комплексов. Обращает на себя внимание тот факт, что микроорганизмы аутохтонной микрофлоры в составе биопленки в десятки и сотни раз устойчивее к воздействию неблагоприятных факторов, чем свободно плавающем состоянии.
Устойчивость индигенной микрофлоры кишечника к неблагоприятным воздействиям определяется также феноменом иммунологической толерантности к нормальной микрофлоре. Процесс формирования толерантности начинается с внутриутробного развития и продолжается после рождения ребенка. В вилочковой железе плода в ответ на трансплацентарное проникновение микробных антигенов (АГ) матери, образуются предшественники Т-супрессорных клеток. После рождения ребенка эти лимфоциты мигрируют из тимуса в ассоциированную с пищеварительным трактом лимфоидную ткань (пейеровы бляшки). Взаимодействуя с АГ, попавшими в организм новорожденного микроорганизмами, предшественники Т-супрессорных клеток дифференцируются в зрелые Т-супрессорные клетки. Последние обеспечивают толерантность иммунной системы новорожденного к микроорганизмам, которые индуцировали у плода формирование предшественников. Поскольку анаэробные индиген-ные микроорганизмы составляют основу микробной экологии матери, именно к ним и формируется иммунологическая толерантность. Аллохтонные же микроорганизмы, к которым не выработались внутриутробно Т-предшественники, элиминируются из организма иммуноглобулином A (IgA). Память иммунной системы на микробные антигены, проникающие в плод от матери через плаценту, сохраняется и во взрослом организме.
Сохранением с внутриутробного периода иммунологической памяти о микробиоценозе матери частично можно объяснить снижение колонизационной резистентности и увеличение частоты внутригоспитальных инфекций. В случаях, когда микробиоценоз матери представлен в большей степени аллохтонными, а не индигенными микроорганизмами, антигены аллохтонных бактерий, поступая через плаценту к плоду, становятся индигенными для ребенка. Поэтому механизмы элиминации аллохтонных бактерий у матери не работают у их новорожденных детей. Врожденное снижение колонизационной резистентности у детей чаще всего формируется после антибиотикотерапии и/или антибиотикопрофилактики у взрослых, включая беременных.
Нарушение микроэкологии кишечника (МЭК) в сторону увеличения факультативной и транзиторнои микрофлоры, помимо изменения физиологических функций, может сопровождаться:
- транслокацией бактерий с развитием эндогенных инфекционных процессов (вплоть до гнойно-септических);
- снижением общей иммунологической резистентности;
- развитием аллергических и иммунокомплексных реакций;
- формированием патогенных клонов бактерий и др.
Факторы, определяющие особенности микробиоциноза кишечника у детей раннего возраста
В процессах формирования микробиоценоза кишечника, кроме иммунной системы, участвуют и другие механизмы:
- антимикробный эффект секретов желудка, двенадцатиперстной кишки, желчи, кишечного сока;
- состав и количество муцина;
- напряженность кислорода по толщине биопленки;
- рН кишечного содержимого;
- уровень пищеварительных ферментов, адсорбированных из полости тонкой кишки и синтезируемых в энтероцитах;
- скорость обновления, созревания и метаболизма мукозного эпителия, определяющих синтез витаминов и пищеварительных ферментов, расщепляющих экзогенно поступающие биологически активные вещества (белки, жиры, углеводы).
У плода, новорожденных и детей до одного года основным энергетическим субстратом роста и развития являются углеводы пищи. Выделяют 3 группы углеводов:
- полисахариды (крахмал, декстрины);
- дисахариды (сахароза, лактоза, мальтоза);
- моносахариды (глюкоза, фруктоза, галактоза).
Углеводы расщепляются в пищеварительном тракте ферментами, синтезируемыми в щеточной кайме энте-роцитов кишечника, преимущественно толстой кишки (табл. 2).
Таблица 2. Ферменты, расщепляющие углеводы
Фермент Углевод Лактаза Лактозу (на глюкозу и галактозу) Сахараза Пищевую сахарозу (на глюкозу и фруктозу) Изомальтаза α1-6 связи α-декстринов и мальтозу Мальтаза α1-4 связи последних Глюкоамилаза (терминальная декстриназа) Завершает процесс расщепления крахмала и декстринов, отщепляя конечные молекулы глюкозы Расщепление углеводов
Основным углеводом, поступающим с пищей, как у плода, так и новорожденных является лактоза. При попадании в пищеварительный тракт под влиянием лактаз (β-галактозидазы) эпителиальных клеток тонкой кишки лактоза гидролизуется с образованием глюкозы и галактозы. Метаболизм лактозы в этих случаях зависит от количества выработки энтероцитами тонкой кишки расщепляющего ее фермента - лактазы. У плода и детей до 2 мес жизни уровень лактазы в 2-4 раза превышает таковой у детей от 3 до 11 мес. Таким образом, в 2 мес наступает физиологический дефицит выработки лактазы энтероцитами тонкой кишки. Избыток лактозы, поступающей с грудным молоком и/или молочными смесями, в этом возрасте приводит к изменению рН кишечного содержимого в сторону защелачивания. При рН ниже 3,4-4,0 создаются условия для активации роста в тонкой кишке факультативной и транзиторнои микрофлоры (энтерококки, лактозонегативная кишечная палочка, клебсиелла, протей и др.). Клинически эти состояния сопровождаются метеоризмом, кишечными коликами и водянистой диареей.
К другим механизмам утилизации экзогенной лактозы относится способность самих микроорганизмов индигенной микрофлоры толстой кишки (бифидобактерии, кишечные палочки, лактобациллы, клостридии, вейоллонеллы и др.) продуцировать высокоактивную лактазу Микробная биотрансформация лактозы представителями индигеннои микрофлоры ЖКТ имеет место не только в толстой кишке, но и верхних отделах пищеварительного тракта. Доказано, что наиболее высокая активность β-галактозидазы выявлена у молочно-кислых бактерий штамма L. Acidophilus LA-1. Однако следует отметить, что лактаза микробного происхождения, накапливающаяся в йогуртах и других кисло-молочных продуктах в процессе их изготовления, лишь в незначительной степени помогает утилизировать повышенные концентрации поступающей с пищей лактозы. Последнее, очевидно, обусловливает неэффективность замены молочных смесей на кисломолочные при лактазной недостаточности у детей. Таким образом, колонизационная резистентность к штаммам аутохтонной микрофлоры, обусловленная особенностями микробиоценоза матери, усугубляет нарушения микроэкологии кишечника (МЭК) у детей раннего возраста и способствует развитию хронической диареи.
В современной литературе приводятся сведения о влиянии на микробиоценоз кишечника у детей ксенобиотиков, химиопрепаратов, в частности, антибиотиков (АБ). Комплекс патологических изменений в составе микрофлоры кишечника сопровождается клинической картиной, именуемой как «антибиотико-ассоциированная диарея» (ААД). Наиболее опасными для развития последней являются антибиотики:
- широкого спектра - защищенные пенициллины (амоксициллин/клавуланат; ампициллин/сульбактам и др.;
- линкозамиды;
- цефалоспорины 3-й генерации (цефатоксим, цефаперазон, цефтриаксон и др.);
- тетрациклины с высокой концентрацией в собственной пластинке тонкой кишки (доксициклин);
- сульфаниламиды, действующие в просвете кишечника (фталазол, сульгин, фтазин);
- макролиды (сумамед, эритромицин и др.);
- фторхинолоны (ципрофлоксацин, норфлоксацин и др.).
Однако в последние годы в литературе появились сведения о том, что макролидные АБ в целом мало влияют на индигенную микрофлору кишечника, а возникновение ААД после их применения обусловлено мотилиум-подобным эффектом. Применение фторхинолоновых АБ (ципрофлоксацин, норфлоксацин и др.) имеет очень низкий риск развития ААД [3-5]. В связи с этим синдром диареи, возникающий после лечения АБ кишечной и других инфекций, в зарубежной литературе чаще называют постинфекционным синдромом раздраженного кишечника (СРК). Существование постинфекционного СРК подтверждено проведенными в Великобритании рандомизированными исследованиями, где СРК с диареей выявлялся у 16,7% больных через 6 мес после перенесенного острого энтерита, леченного АБ.
Таким образом, формирование МЭК у детей обусловлено генетически детерминированной толерантностью к индигеннои микрофлоре и сформированной внутриутробно колонизационной резистентностью к ауто- и аллохтонным микроорганизмам матери. Важная роль при формировании МЭК принадлежит также уровню лактазы, вырабатываемой эпителиоцитами тонкой кишки, и способности индигеннои микрофлоры к метаболизму экзогенной лактозы. Инфицирование новорожденных из окружающей среды и нарушения МЭК на фоне приема АБ носят вторичный характер. Все это необходимо учитывать при коррекции МЭК у детей.
Принципы коррекции дисбиотических нарушений у детей раннего возраста
В настоящее время накоплен обширный опыт коррекции микробиоценоза кишечника у детей. С этой целью используются лекарственные средства (ЛС), влияющие на разные звенья этиопатогенеза дисбиозов. Обычно лечебные мероприятия начинают с применения ЛС, содержащих живые штаммы индигенной микрофлоры кишечника, пробиотиков. Среди них предпочтение отдается препаратам, содержащим различные виды лакто- и бифидобактерий (линекс, бификол, ацилакт, аципол и др.). Капсульные формы пробиотиков позволяют сохранить активность этих Л С при прохождении кислотного барьера желудка и достигнуть толстой кишки. Однако штаммы микроорганизмов в этих пробиотических препаратах, отобранные из микрофлоры человека, не обладают способностью к длительной колонизации. Оказывая быстрый терапевтический эффект, обусловленный заселением СО ЖКТ экзогенными штаммами, они элиминируются из кишечника в течение 3-7 нед. В связи с этим, длительность терапии, составляющая не менее 1-2 мес, не предотвращает возможность развития ААД даже через 6 мес после перенесенной инфекции. Кроме того, прием пробиотиков одновременно с АБ нецелесообразен, поскольку АБ значительно снижают колонизационную резистентность последних и ускоряют их элиминацию.
Среди педиатров укрепилось мнение о безопасности приема пробиотиков. Однако следует помнить, что к настоящему времени описаны:
- возможность возникновения инфекционных процессов, обусловленных штаммами, входящими в состав пробиотиков;
- чрезмерная иммуностимуляция (сенсибилизация) лимфатического аппарата кишечника;
- формирование новых клонов бактериальных штаммов за счет передачи генов, ответственных за экспрессию факторов патогенности.
Риск развития инфекционных процессов, вызванных штаммами индигенной микрофлоры, возрастает в случаях врожденной колонизационной резистентности к ним, являющейся, как описано выше, далеко не редкой особенностью формирования микробиоценоза кишечника у детей раннего возраста. Кроме того, постоянной составляющей всех пробиотических ЛС является лактоза. От количества последней в пробиотике зависит возможность развития нежелательных эффектов (усиление диареи) у детей с непереносимостью латозы и др.
В последние годы широкое применение в качестве пробиотика получил препарат Энтерол, в состав которого входят дрожжи Saccharomyces doulardii, не относящиеся к индигенной микрофлоре, однако обладающие выраженной антагонистической активностью в отношении широкого спектра как условно-патогенных, так и патогенных микроорганизмов. В отличие от пробиотиков, содержащих бифидо-, лактобактерии, энтерококки и др., дрожжи сохраняют жизнеспособность при транзите на всем протяжении ЖКТ, абсолютно резистентны к воздействию АБ и чувствительны только к противогрибковым препаратам. Элиминация Saccharomyces doulardii из пищеварительного тракта происходит в течение 3—4 дней после прекращения лечения. Способность дрожжевых пробиотиков увеличивать проницаемость сосудов может приводить к фунгемии. В связи с вышеизложенным приоритетное использование пробиотиков для коррекции МЭК у детей оправдано только в случаях значительного или полного подавления бифидо- и лактофлоры.
Все больше внимания при коррекции МЭКудетей привлекает другой класс лекарственных средств - пребиотики, основной функцией которых является селективность действия на индигенную микрофлору без усиления роста и размножения токсигенпродуцирующих клостридий, токсигенных штаммов кишечной палочки и бактероидов. Одним из таких ЛС является пребиотик «Хилак форте», который содержит субстраты продуктов обмена индигенной микрофлоры кишечника, способствующих регенерации эпителиальных клеток СО кишечника и быстрому восстановлению аухтонной микрофлоры. У нас имеется собственный опыт эффективного применения Хилак форте для коррекции МЭК у детей раннего возраста.
Роль Хилак форте в коррекции дисбиотических нарушений у детей раннего возраста
Под наблюдением находились 180 детей в возрасте от 1 мес до 3 лет (90 детей -1-я группа - с непереносимостью лактозы и 90 детей - 2-я группа - с ААБ).
У всех детей наряду с тщательным и целенаправленным сбором анамнеза проводилось общеклиническое комплексное лабораторно-инструментальное исследование, включавшее ультрасонографию брюшной полости, исследования кала (на углеводы, копрограмму дисбактериоз до и через 2 нед после окончания лечения). В зависимости от проводимой терапии дети были разделены на подгруппы (табл. 3).
Таблица 3. Схемы коррекции микробиоценоза кишечника у наблюдаемых детей
Подгруппа/ЛС 1а; 2а 16; 2б 1в;2в Пробиотик 4 нед + - - СБФ 7 дней, затем ПР 4 нед - + - СБФ 7 дней, затем ПР+ПБ 4 нед - - +
Примечание. СБФ - специфический бактериофаг, ПР - пребиотик, ПБ - пробиотик.В качестве пробиотика использовали: Линекс (30), Би-фистим (30) и Ацилакт (30); пребиотика - Хилак форте (30); Лизоцим (30) и Дюфалак (30). Для селективной деконтаминации использовали специфические бактериофаги.
В подгруппах детей, где коррекция микробиоценоза проводилась только пробиотиками (1а; 2а) был получен быстрый клинический эффект независимо от используемого пробиотика. Так, у детей с ААД стул и явления метеоризма нормализовались на 1 -й неделе лечения практически в 50% случаев, а к концу 2-й недели - у 100% детей. Показатели индигенной микрофлоры восстанавливались только через 4 нед у 5 5% больных детей, исчезновение условно-патогенной флоры отмечалось на 3-й неделе. В остальных случаях возникала необходимость в продолжении лечения пробиотиком (рис. 1). У большинства (84%) детей с лактазнои недостаточностью наблюдался тот же клинический эффект, однако у части (16%) детей этой группы на фоне приема Линекса усиливался метеоризм и диарея. У детей, принимавших бифистим и ацилакт, побочный эффектов не выявлено (рис. 2). Возможно, снижение терапевтического эффекта Линекса было обусловлено тем, что при приеме препарата дети до 2 лет получали содержимое капсулы без ее оболочки. Прохождение ЛС по пищеварительному тракту, очевидно, снижало активность входящих в его состав штаммов пробиотических бактерий. В связи с этим фармацевтическая активность Линекса значительно снижалась. Усиление диареи могло быть также обусловлено нарушением утилизации экзогенной лактозы, входящей в состав Линекса. Следует отметить, что у 27% детей, получающих в качестве монотерапии пробиотик, через 2 нед после окончания лечения показатели кала на дисбактериоз не отличались от исходных и вновь регистрировалась склонность кдиарее. Более эффективной для коррекции дисбиотических нарушений оказалась схема лечения, при которой терапию нарушений МЭК начинали с селективной деконтаминации специфическими бактериофагами (СБФ) и далее подключали пребиотики. Наиболее эффективной была схема, в которой использовали Хилак форте и Лизоцим, менее эффективна с Дюфалаком (рис. 3, 4). Так, исчезновение метеоризма, кишечных колик и нормализация стула наблюдались на 1-й неделе при приеме Хилак форте и лизоцима, и на 2-3-й неделях - Дюфалака. Микрофлора кишечника, соответственно, восстанавливалась у большинства (87%) детей к концу 4-й неделе на фоне Хилак форте и Лизоцима и только на 57% - у детей, получавших Дюфалак. Достигнутые результаты сохранялись при контрольном исследовании кала на дисбиоз. Однако у части (18%) детей на фоне приема Лизоцима усиливались атопические реакции: нарастала или появлялась мелкоточечная сыпь, отмечался зуд кожи и др. Наконец, проведение специфической деконтаминации СБФ с последующим одновременным назначением пребиотиков и пробиотиков позволило добиться клинического эффекта и нормализации микрофлоры в течение 4 нед у 92% детей при любых сочетаниях пробиотика и пребиотика (рис. 5, 6): Хилак форте и Линекс, Лизоцим и Линекс (Бифистим, Ацилакт), Дюфалак и Линекс (Бифистим, Ацилакт). Эффективность лечения сохранялась и при последующих контрольных исследованиях. Однако у 5 (8,3%) детей первого года жизни на фоне приема Лизоцима появилась аллергическая сыпь, а у 7 (11,7%) детей с лактазной недостаточностью на фоне Дюфалака усилилась диарея. Побочных эффектов на фоне приема Хилак форте не выявлено.
Рис. 1. Нормализация клинических проявлений (метеоризм, кишечная колика, диарея) и нарушений МЭКудетей с лактазной недостаточностью.
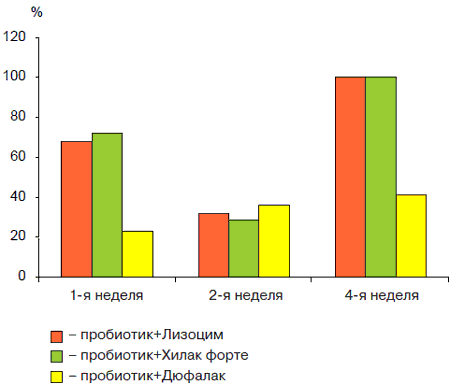
Рис. 2. Нормализация клинических проявлений (метеоризм, кишечная колика, диарея) и нарушений МЭК у детей с ААД.
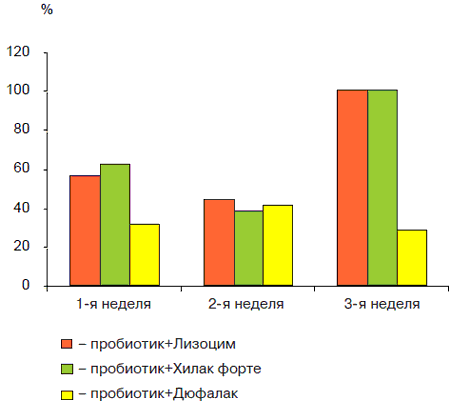
Рис. 3. Результаты лечения пробиотиками детей с ААД.
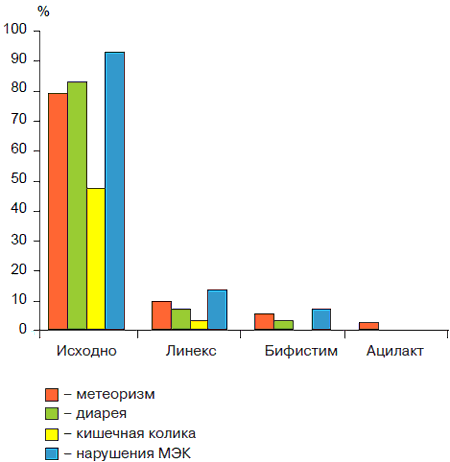
Рис. 4. Результаты лечения пробиотиками группы детей с лактазнои недостаточностью.
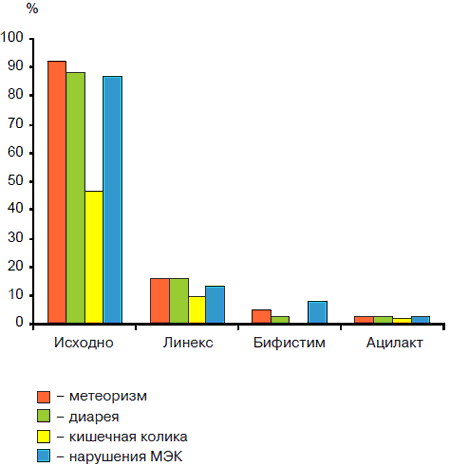
Рис. 5. Результаты лечения пребиотиками группы детей с лактазнои недостаточностью.
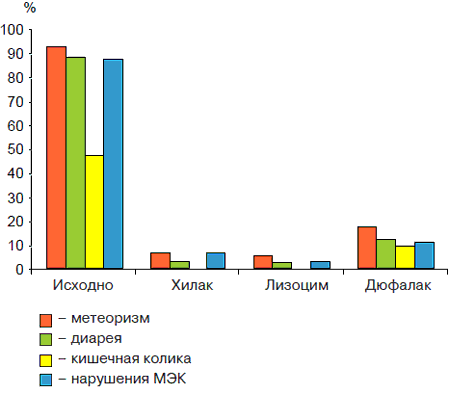
Рис. 6. Результаты лечения пребиотиками детей с ААД
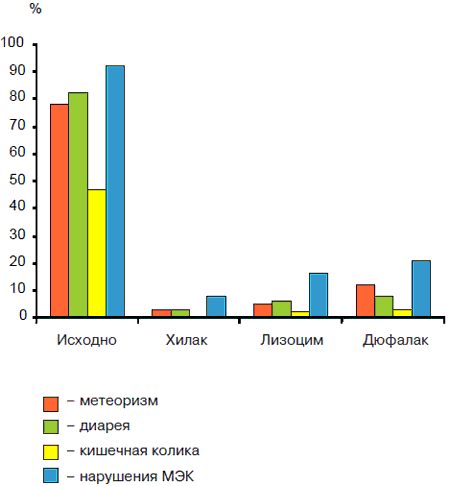
Полученные данные позволяют предположить, что наиболее эффективной для коррекции микробиоценоза кишечника у детей раннего возраста является следующая последовательность назначения ЛС: специфическая деконтаминация, затем одновременное назначение пре- и пробиотиков не менее чем на 4 нед. Отсутствие побочных эффектов и более значительная эффективность Хилак форте во всех используемых схемах коррекции микробиоценоза кишечника, очевидно, обусловлены свойствами этого препарата нормализовывать рН кишечного содержимого, как при исходном его защелачивании, так и при закислении. Немаловажную роль в определении эффективности последнего играет официальная форма препарата, позволяющая использовать Хилак форте у детей первого года жизни без потери его терапевтической активности под влиянием пищеварительных ферментов.
Заключение
Таким образом, причины нарушения МЭКу детей многогранны и до конца не изучены, в связи с чем требуется глубокое теоретическое и клиническое осмысление и дальнейшие исследования. Назначение пробиотиков в качестве монотерапии дает быстрый клинический эффект, однако отражается не только на состоянии пищеварительного тракта, но и организма в целом, а у части детей может приводит к нежелательным эффектам. Пребиотики, напротив, могут являться препаратами первого ряда при коррекции микробиоценозов у детей раннего возраста. Хилак форте может применяться на фоне АБ и энтеросорбентов без потери эффективности, даже у детей младенческого возраста. Во всех случаях нарушений МЭК у детей терапия должна быть индивидуализированной, проводиться на фоне коррекции питания и лечения основного заболевания, а также с обязательным учетом взаимодействия ЛС.
| Февраль 2012 г. |