Москва 2002 г.ПЕРВИЧНАЯ И ВТОРИЧНАЯ ПРОФИЛАКТИКА ИШЕМИЧЕСКИХ ИНСУЛЬТОВ.
Учебно-научный центр Медицинского центра Управления делами Президента РФН.В. Миронов, В.И. Шмырев, И.И. Горяйнова, И.Н. Миронов
Частота ишемического инсульта в группах лиц с факторами высокого риска
Риск Частота ( % / год) Все население от 70 лет и выше 0,6 ИМ в прошлом 1,5 Асимптомный шум 1,5 Асимптомный стеноз сонной артерии 2,0 МА (после ТИА или малого инсульта) 5,0 ТИА 6,0 + стеноз сонной артерии > 70% 13,0 ИИ в прошлом 9,0 ИМ - инфаркт миокарда;
ИИ - ишемический инсульт;
МА - мерцательная аритмия неревматического генеза;
ТИА - транзиторная ишемическая атака
( W. Feinberg. Neurology, 1998, v.51, N3, Suppl. 3, 820-822)ПЕРВИЧНАЯ И ВТОРИЧНАЯ ПРОФИЛАКТИКА ИШЕМИЧЕСКИХ ИНСУЛЬТОВ
Одной из главных проблем здравоохранения представляет церебральный инсульт, который является второй по значимости причиной смерти в развитых странах мира и ведущей причиной инвалидизации взрослого населения наиболее трудоспособного возраста. Социальные затраты, связанные с расходами на лечение больных инсультом в стационарных и амбулаторных условиях, являются главной статьей расходов здравоохранения многих стран.
В 1997 году заболеваемость цереброваскулярными заболеваниями (ЦВЗ) в России составила 393,4 на 100 тыс. населения, что превышает этот показатель за 1995 год почти на 11%. Инвалидизация после перенесенного инсульта занимает первое место среди всех причин стойкой утраты трудоспособности. (Гусев Е.И., 1997г.)
В Российской Федерации, к сожалению, происходит неуклонное прогрессирование этих заболеваний, в то время как, в экономически развитых странах происходит снижение.
В США с 80-годов имеется четкая тенденция к снижению смертности от инсультов на 45-50%. Это объясняется высокими достижениями в профилактике и лечении инсультов.
Первичная профилактика ЦВЗ основана на борьбе с известными факторами риска.
Вторичная профилактика повторного развития мозгового инсульта, является жизненно необходимой так как, к сожалению, смерть остается одним из самых частых исходов инсульта. Около 40% больных умирает в течение первого года, а 25% в течение первого месяца.
Последствия инсульта продолжают оставаться большой социальной проблемой.
Наиболее неблагоприятный прогноз встречается при тромбо-эмболических инфарктах мозга.
Наиболее частыми последствиями являются ухудшение неврологического дефицита у больных. У 1/3 пациентов ухудшение происходит непосредственно после инсульта.
Возникновение повторного инсульта также представляет серьезную проблему. Второй инсульт развивается примерно у 5% пациентов - в течение первого месяца, и у 6% - в течение каждого последующего года. Таким образом, в течение первых пяти лет повторный инсульт развивается у каждого четвертого больного (таблица 1).
Таблица 1
Смерть В течение первого месяца 5% в течение первого года 40% Ухудшение неврологического дефицита 30% Повторный мозговой инсульт в течение первого месяца 6% в течение первого года 12- 12,9% Физическая недееспособность 50% Длительное стационарное лечение 25% Деменция 30% Инвалидность До 80% Депрессия 36% Физическая и умственная недееспособность являются ключевым фактором в дальнейшей жизни больного и его семьи. Для оценки недееспособности используется шкала Barthel (таблица 2).
Таблица 2. Показатели шкалы BARTHEL
Функция кишечника Недержание кала или редкие случаи Пользование туалетом: Зависимость или необходимость небольшой помощи Функция мочевого пузыря: Недержание мочи, редкие случаи или невозможность пользования катетером Ходьба: Невозможна или необходима помощь Уход за собой: Необходима помощь при умывании /причесывании/ чистке зубов /бритье/ Переход из кровати в кресло: Невозможен или необходима помощь Прием пищи: Полная зависимость или необходима помощь Одевание: Необходима помощь Ходьба по лестнице: Невозможна или необходима помощь Купание: Зависимость Результаты Международного координационного центра Progress по предупреждению вторичного инсульта, согласно индексу Barthel
13% пациентов были практически или абсолютно недееспособны (0-9 баллов); 16% были умеренно недееспособны (10-14 баллов); 37% недееспособны в легкой степени (15-19 баллов) ; 34% обладали функциональной независимостью (20 баллов). Таким образом, 66% пациентов после мозгового инсульта становятся недееспособными.
Проблема патогенетического лечения ишемии мозга, по-прежнему, остается одной из актуальных в клинике неврологии, в частности, проблема коррекции нарушений липидного обмена. На сегодняшний день, научными исследованиями отечественных и зарубежных авторов отмечено огромное значение гиперлипидемии и нарушений агрегационных свойств крови в патогенезе ЦВЗ. Интерес к изучению обмена липидов и липопротеидов объясняется открытием связей нарушений этого обмена с возникновением атеросклероза и развитием на его основе инсульта.
Главную роль в патогенезе играет нарастание в крови содержание липопротеидов низкой и очень низкой плотности (ЛПНП и ЛПОНП), почему они и получили название "атерогенных". Как фактор риска выступает холестерин ЛПНП (в-ХС). Новым этапом явилось установление защитной роли липопротеидов высокой плотности (ЛПВП). Холестерин ЛПВН (а-ХС) является достоверным антифактором риска атеросклероза.
В состав липопротеидов входят полиненасыщенные жирные кислоты, метаболизм которых служит источником ряда биологически активных веществ: простагландинов (ПГ), тромбоксанов (Тх), лейкотриенов. Так, продуктами метаболизма арахидоновой кислоты (АК) являются Тх2, который отличается выраженной агрегирующей и вазоконстрикторной активностью, и ПГ1 2, является потенциальным вазодилататором и ингибирует агрегацию эритроцитов и тромбоцитов.
У больных с ЦВЗ имеет место увеличение агрегации тромбоцитов и эритроцитов. Увеличение агрегационных свойств эритроцитов, приводит к нарушению транспорта кислорода, что в свою очередь ведет к гипоксии.
В настоящее время, установлено, что одной из важных регуляторных систем, участвующих в поддержании постоянства внутренней среды организма, адаптации к неблагоприятным воздействиям, следует считать систему перекисного окисления липидов (ПОЛ). Наиболее интенсивное и продолжительное усиление ПОЛ, или реакций свободнорадикального окисления в липидном слое биологических мембран, наблюдается при гипоксии в центральной нервной системе. ПОЛ происходит более интенсивно при гиперлипидемиях, сопутствующих атеросклерозу, а также в процессе старения. Снижение уровня антиоксидантов в ответ на активацию ПОЛ при истощении резервных возможностей ведет к накоплению продуктов ПОЛ, повреждению клеток, увеличению агрегирующих и свертывающих свойств крови.
Продукты ПОЛ, (например, 15- гидропероксидарахидоновая кислота), обладает способностью тормозить образование ПГ1 2, в микросомальной фракции сосудистой стенки и являются индуктором агрегации. Изменение в содержании продукта ПОЛ - малонового диальдегида - в тромбоцитах, липопротеидах разных классов свидетельствует об изменении метаболизма АК, сдвиге его в сторону интенсивного образования ТхА2 в тромбоцитах. Кроме того, накопление этого продукта в ЛПНП и ЛПОНП может привести к уменьшению образования ПГ1 2 в сосудистой стенке.
Таким образом, учитывая вышесказанное, можно считать, что гиперлипидемия, система ПОЛ, агрегационная система - звенья одной цепи в патогенезе ЦВЗ. Гиперлипидемия способствует развитию атеросклероза, с одной стороны, и нарушениям агрегационной системы крови с другой, что, в свою очередь, приводит к мозговому инсульту.
Гипоксия (вследствие ишемии мозговой ткани, а также за счет изменения физико-химических свойств крови), гиперлипидемия, снижение антиоксидантной защиты при ишемии, возраст пациентов ведут к усилению процессов ПОЛ, что в свою очередь, опять ведет к нарушениям агрегационной системы.
Для осуществления патогенетического подхода к лечению ЦВЗ возникает проблема разработки методов одновременной коррекции гиперлипидемии, нарушений агрегационной системы и системы ПОЛ у сосудистых больных. Поэтому целью нашей работы явилось изучение влияния сочетания антигиперлипидемических и антиоксидантных (мексидол) препаратов, действующих также на агрегационную систему крови, на клинико-неврологическую картину, липидный обмен, ПОЛ у больных с сосудистыми поражениями мозга.
Нами проведено лечение 2-м группам больных.
В 1 -ю группу вошли 31 больной после ишемического инсульта и с гиперлипидемией (гиперхолестеринемией, гипертриглицеридемией или их сочетаний) одновременно, а также, не имевшие выраженных бульбарных нарушений.
2-ю группу составили 22 пациента, в возрасте от 58-64 лет с гиперлипидемией (гиперхолестеринемией, гипертриглицеридемией), нарушениями в системе гемостаза и начальными проявлениями недостаточности мозгового кровообращения (НПНМК), выявленных в результате скрининга при диспансеризации.
Обеим группам пациентов наряду с традиционной вазоактивной и ноотропной терапией, применялся мексидол (5% раствор в ампулах по 2 мл.), в дозе 200 мг. два раза в сутки - внутримышечно. Длительность курса составила 15 -20 дней. Количество курсов колебалось от 2-х до 3-х, в течение года. Дважды (до начала и после лечения) проводили исследование липидного спектра крови, системы гемостаза, агрегации эритроцитов, системы ПОЛ, оценивали в динамике неврологический статус. С целью изучения влияния мексидола на клиническую картину заболевания была введена балльная система оценки неврологического статуса: каждый общемозговой и очаговый симптом оценивался в I балл. В конечном итоге, у пациентов определялась сумма баллов до и после лечения, что позволило количественно оценить динамику неврологической симптоматики. В план обследования входили также электрокардиография, эхоэнцефалография, электроэнцефалография, ультразвуковая допплерография магистральных артерий головы, шеи и нижних конечностей, транскраниальная допплерография, компьютерная или магнитно-резонансная томография головного мозга, консультации окулиста и терапевта.
Помимо гиперлипидемии у I-ой группы, обследованных нами пациентов, были выявлены значительные нарушения в системе гемостаза, затрагивающие как тромбоцитарное звено (высокий процент агрегации тромбоцитов имел место в 85,7% случаев), так и свертывающие факторы, и фибринолитическую систему. О значительном повышении коагуляционного потенциала свидетельствовали гиперкоагуляция, по данным тромбоэластограммы (ТЭГ), в 92,9% случаев, увеличение количества плазменных факторов свертывания (уменьшение активированного частичного тромбопластинового времени), активированное частичное тромбопластиновое время -АЧТВ (имело место в 42,9% случаев), гиперфибриногенемия (52,4%), увеличение оптической плотности протаминсульфатного теста - ПСТ (59,5%), положительный этаноловый тест - ЭТ (47,6%). Нарушение гемостаза у больных инсультом проявлялись угнетением фибриногена - уменьшение фибринолитической активности крови (ФАК) имело место в 57,9% случаев. У 47,6% обследованных, наряду с отклонениями других показателей в сторону гиперкоагуляции, в плазме крови были обнаружены не свертывающиеся тромбином комплексы фибрин мономеров с продуктами деградации фибриногена и фибрина. Повышение агрегации эритроцитов наблюдалось в 92,9% случаев. По полученным данным, накопление продуктов пероксидации липидов в остром периоде инсульта было избыточным в 83,3% случаев, а снижение активности антиоксидантной системы (АОС) отмечалось в 95,2% случаев.
На фоне проведенного лечения положительная динамика отмечена у 80,1% пациентов, состояние 19,9% больных осталось без изменения. Количество симптомов, выявленных у одного больного, колебалось в диапазоне от 10 до 25 баллов. До начала лечения неврологический статус оценивался 12,6±0,5 балла и в 4,8±0,5 балла после его окончания (р<0,05). Степень регресса неврологической симптоматики составила 61,9% от исходного уровня.
Анализируя динамику изменения показателей липидного спектра крови больных с инсультом, получавших мексидол, можно сделать следующее заключение. В липидном спектре крови произошли изменения, которые можно характеризовать как антиатерогенное. Уровень общего холестерина на фоне лечения снизился на 8,9% (р<0,05), индекс атерогенности - на 10,95 (р<0,05), В -ХС- на 6,8%, уровень а-ХС возрос на 15,7% -(р<0,05), отношение апопротеин А 1 / апопротеину В- на 2,3%.
Позитивные сдвиги в системе гемостаза отмечались как в сосудисто-тромбоцитарном звене, так и в коагуляционном. (таблица 3).
Таблица 3. Изменения гемостаза у пациентов в восстановительном периоде ишемического инсульта до и после лечения мексидолом (вторичная профилактика)
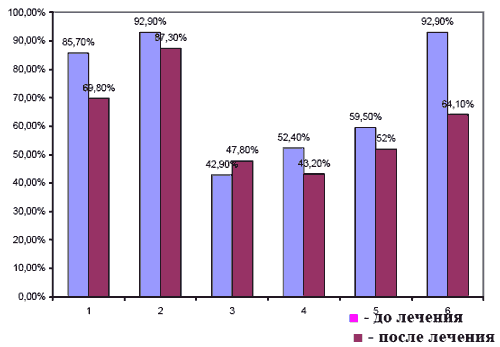
1 - Агрегация тромбоцитов (р < 0,05)
2 - Коагуляционный потенциал по данным ТЭГ
3 - Активированное частичное тромбопластиновое время (АЧТВ) (р < 0,05)
4 - Фибриногенемия
5 - Протаминсульфатный тест (р < 0,05)
6- Агрегация эритроцитов (р < 0,05)Процент агрегации тромбоцитов снизился на 15,9% (р<0,05), а процент дезагрегации тромбоцитов возрос на 14,2%. Положительное изменение показателей плазменного звена гемостаза было выражено в меньшей степени. Отмечалось замедление I и II фаз свертывания крови по данным ТЭГ: R увеличивалось на 7,5% , R+ К - на 3,8%, отмечалось снижение Ма на 5,2%. Об уменьшении количества плазменных факторов свертывания свидетельствовало увеличение ВЧТВ на 4,9% (< 0,05). Позитивные сдвиги произошли и в отношении фибринолитической системы крови, ФАК возросла на 8,7% (р<0,05), а уровень фибриногена снизился на 9,2%, положительная динамика была зафиксирована и в отношении паракоагуляционных процессов: оптическая плотность ПСТ снизилась на 7,5% (р<0,05), а положительный ЭТ имел место только в 11,9% случаев. На фоне лечения достоверно снизился процент агрегации эритроцитов на 28,8% (р<0,05).
В системе ПОЛ произошли позитивные изменения: снизился уровень первичных продуктов ПОЛ - диеновых конъюгатов - на 21,6% (р<0,05), вторичных продуктов- малонового диальдегида - на 30,1%. Отмечалось увеличение активности супероксиддисмутазы (основного фермента АСС) на 18,9% (р< 0,05).
Таким образом, за год наблюдения и лечения в 1 -ой группе больных не произошло ни одного повторного инсульта и снижения качества жизни. Во II-ой группе больных, за тот же период наблюдения, не произошло нарушения мозгового кровообращения, а отмечались положительные изменения в липидном профиле и гемостазе в 95,5% случаев.
Важным моментом у II-ой группы больных явилось улучшение когнитивных функций, настроения, сна по данным психологических тестов.
Проведенные исследования показали, что применение мексидола на фоне традиционных средств лечения цереброваскулярных заболеваний у больных с гиперлипидемией привело к одновременному решению нескольких задач. Мексидол обеспечивал включение собственных адаптационных реакций и антигипоксический эффект. Препарат оказывал также антиагрегационное действие. Следовательно, одновременное применение мексидола и традиционных средств, способствует патогенетической коррекции гиперлипидемических, гипоксических и гемостатических нарушений у пациентов с гиперлипидемией, что позволяет повысить эффективность первичной и вторичной профилактики ишемических инсультов.
ЛИТЕРАТУРА
1. Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. "Антиоксиданты в профилактике и терапии патологий ЦНС". М 1995г.
2. Гусев Е.И., Скворцова В.И. "Современные представления о лечении острого церебрального инсульта". Consilium Medicum: том 2. №2 2002г., с.1-18
3. Верещагин Н.В. "Нейронаука и клиническая ангионеврология: проблемы гетерогенности ишемических поражений мозга". Вестник РАМН, 1993г. №7 ., с. 40-42.
4. Суслина З.А. "Лечение ишемического инсульта". Журнал "Лечение нервных болезней" №1.2001г., с.3-7.
5. Федин А.И., Румянцева С.А. "Применение антиоксиданта "Мексидол" у больных с острыми нарушениями мозгового кровообращения". Методические рекомендации М. 2000г.
6. Миронов Н,В., Руднева В.В., Горяйнова И.И. "Новый отечественный препарат мексидол в комплексном лечении больных с ишемическим инсультом в восстановительном периоде". Журнал "Кремлевская медицина" №2., с. 56-59
7. Dugan L.L.,Choi D.W. "Exitotoxicity , free radicals and cell membrane changes". Annals of Neurology.- 1994.- V.-35/- P. 17-21
8. Hall E.D., Braughler J.M., Pazara K.E. "Hydroxyl radical production and lipid peroxidation parallels selective post-ischemic vulnerability in gerbil brain" J.Neurisci. Res. 1993.- V.34.-N. 1.-P.107-112.
| Июнь 2008 г. |