Опубликовано в журнале:
Бюллетень экспериментальной биологии и медицины, 2006, приложение 1НОВЫЙ МЕТОД ВОССТАНОВИТЕЛЬНОГО ЛЕЧЕНИЯ БОЛЬНЫХ С НАРУШЕНИЯМИ ЦЕРЕБРАЛЬНОГО МЕТАБОЛИЗМА ЭЛЕКТРОФОРЕЗОМ С МЕКСИДОЛОМ
Д.Ю.Пенионжкевич
Российский научный центр восстановительной медицины и курортологии МЗ и CP РФ, МоскваРазработана технология электрофореза с мексидолом, определены оптимальные параметры и режимы работы. Введение мексидола в транскраниальный электрофорез способствует существенному улучшению функционального состояния нейродвигательных систем, нормализации мозгового и регионального кровотока, восстановлению баланса вегетативной нервной системы и трофики. Разработанный метод физиотерапии может использоваться в поликлиниках, санаториях и центрах медицинской реабилитации.
Ключевые слова: восстановительный период, цереброваскулярная недостаточность, схема лечения, электрофорез
Окклюзия сосудов, кровоснабжающих головной мозг, является начальным этапом неблагоприятных изменений, которые приводят к грубым нарушениям метаболизма нейронов, структурно-функциональным изменениям, нередко заканчивающимся гибелью нервных клеток. Острая или хроническая ишемия мозговой ткани обусловливает каскад патологических реакций, которые приводят к развитию очагового неврологического дефицита, дисциркуляторной энцефалопатии или к гибели больного. Тесная взаимосвязь нарушений энергетического и пластического обмена, их влияние на течение и прогноз заболевания нередко не учитываются при разработке схем лечения, а основой патогенетической терапии считается восстановление гемодинамики.
В последнее время возможности коррекции нарушений метаболизма уделяется особое внимание. Многие ученые считают, что метаболическая терапия, осуществляемая при острой и хронической недостаточности мозгового кровообращения, является мощным фактором, способным предотвратить повторные инсульты, инвалидизацию больных и их гибель.
Медицинская реабилитация больных с цереброваскулярной патологией всегда индивидуальна и разрабатывается с учетом возраста, особенностей развития, а также клинического течения заболевания, и преимущественно направлена на адаптацию пациента к новым условиям жизни, мобилизацию резервных возможностей организма и компенсацию нарушенных функций.
Несмотря на широкое использование преформированных и естественных физических факторов в сочетании с базисной медикаментозной терапией, при реабилитации больных не удается достичь высоких результатов. Неудачи в лечении обусловлены не только многообразием патофизиологических реакций, лежащих в основе заболевания, но и частым отсутствием в практической медицине комплексного подхода. Даже при вовремя начатой терапии эффективность оказывается недостаточной и заболевание приобретает черты устойчивой патологии.
Применение комплексного лечения способствует повышению клинико-неврологической эффективности восстановления больных данной категории.
В последние годы в клинической нейро-реабилитации активно изучаются возможности электротерапии. В основе механизма ее лечебного действия лежит пространственно-временная модуляция электрохимических процессов цитолеммы нейро- и глиоцитов, способствующая стабилизации ионного состава межклеточной жидкости и аксоплазмы. При очаговых поражениях мозга эти процессы приводят к активации морфологически сохранных, но интактных нейроцитов (вследствие диашиза) и уменьшению поляризации мембран поврежденных клеток. Сочетание этих эффектов приводит к активации тканевого дыхания, повышению синтеза макроэргов, нейромедиаторов и пептидных нейромодуляторов и к функциональному восстановлению - растормаживанию функциональньгх систем ЦНС. Следовательно, запуская механизмы естественной гомеостатической регуляции, токи выступают в роли триггера восстановительных процессов в ЦНС [2,19].
Установлено влияние курсовых воздействий транскраниальных синусоидальных модулированных токов (СМТ) преимущественно на неспецифические (интегративные) системы мозга и тесно связанные с ними механизмы нейроэндокринной регуляции, в том числе центральной и церебральной гемодинамики. Выявлена определяющая роль частоты воздействия в развитии адаптивных реакций ЦНС - оптимизации микроциркуляции и ликворного дренирования, тканевого транспорта и метаболизма мозга [4, 6,12]. Наиболее высокий терапевтический эффект наблюдается при выполнении сочетанного воздействия электротерапии и лекарственного вещества - при лекарственном электрофорезе [15,16].
Применявшийся ранее лекарственный электрофорез был направлен прежде всего на улучшение общего или коллатерального кровообращения (эуфилин-электрофорез СМТ, никотиновой кислоты-электрофорез СМТ и др.) [10,11,14] и не воздействовал на нарушения кислотно-щелочного баланса и метаболических процессов в клеточных структурах области поражения.
Участие нарушений фосфолипидного обмена на уровне клеточных мембран и изменения в восстановительно-окислительных процессах тканей при развитии цереброваскулярной патологии доказаны и достаточно изучены [14]. Однако поиск оптимальных средств, позволяющих корректировать данные нарушения и, соответственно, снизить риск дальнейшего развития заболевания, по-прежнему остается актуальным.
Успехи химии координационных связей позволяют создавать новые, более совершенные методы лечения больных с разными заболеваниями, а также корректировать патологические состояния нервной и сосудистой системы. Наиболее интересной является разработка НИИ фармакологии РАМН и ВНЦ "Мексидола" (этилметилгидроксипиридина сукцинат), препарата нового типа как по механизму, так и по спектру фармакологического действия. Мексидол является ингибитором свободнорадикальных процессов, ПОЛ, активирует СОД, оказывает влияние на физико-химические свойства мембраны, повышает уровень содержания полярных фракций липидов в мембране, уменьшает вязкость липидного слоя, увеличивает текучесть мембраны, активирует энергосинтезирующие функции митохондрий, улучшает энергетический обмен в клетке. Данный препарат вызывает изменение функциональной активности биологической мембраны, которое приводит к конформационным перестройкам белковых макромолекул синаптических мембран, вследствие чего мексидол оказывает модулирующее действие на активность мембраносвязанных ферментов, ионных каналов и рецепторных комплексов (бензодиазепиновый, ацетилхолиновый), усиливая их способность к связыванию с лигандами, повышая активность нейромедиаторов и активацию синаптических процессов. Таким образом, механизм действия мексидола определяет прежде всего его антиоксидантные свойства, способность стабилизировать биомембраны клеток, активировать энергосинтезирующие функции митохондрий, модулировать работу рецепторных комплексов и прохождение ионных токов, усиливать связывание эндогенных веществ, улучшать синаптическую передачу и взаимосвязь структур мозга.
Целью настоящего исследования было выявление терапевтической эффективности проведения электрофореза с мексидолом (МЭ) в оптимально выпрямленном режиме по транскраниальной методике.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для качественных и количественных исследований использовался УФ-спектрофотометрический метод (аппарат "Спектрофотометр SPE-SPEKORT M-40").
Подвижность препарата "Мексидол" под воздействием СМТ изучали с использованием разработанной в Российском научном центре восстановительной медицины и курортологии двухкамерной тефлоновой ячейки с двумя впаянными электродами из платины. Полупроницаемой мембраной служил пищевой целлофан марки 46-ГОСТ 7730-630.
Для исследования устойчивости препарата в поле СМТ регистрировали спектры поглощения до и после воздействия от аппарата "Амплипульс-5" в разных режимах и с максимальной силой тока в течение разного времени (5, 10, 15 мин) при постоянной частоте (70 Гц), глубине модуляций (50%) и длительности полупериодов 3 и 3 с. Использовали 5.0 и 2.5% растворы мексидола при максимально возможной силе тока и длительности воздействия (от 5 до 15 мин) в выпрямленном режиме СМТ. Растворы помещали в камеру последовательно на аноде и катоде.
Местное воздействие рефлекторным путем влияет на топически связанные с патологическим очагом органы и системы. Ионы и частицы лекарственного вещества при электофорезе, проникая через поверхностные слои кожи, депонируются в ней, где могут сохраняться более 20 дней, обеспечивая длительное и непрерывное воздействие. Специфичность механизма транскраниального действия СМТ проявляется в непосредственном влиянии на стволовой сосудодвигательный центр, ауторегуляцию мозгового кровотока и прежде всего на миогенный компонент. СМТ быстро (через 3-5 мин), но непродолжительно (в течение 30-60 мин) приводят к выраженной миорелаксации гладкомышечных клеток медии мозговых артерий. Учитывая эти данные, МЭ СМТ проводили от аппарата "Амплипульс-5" при лобно-сосцевидной локализации электродов (прокладку катода - фильтровальную бумагу - смачивали 2.5% раствором мексидола) при выпрямленном режиме СМТ, частоте модуляции 30 Гц, глубине 75%, I и IV р/р, длительности полупериодов 3 и 3 с, по 7.5 мин каждым родом работы. Сила тока дозировалась по появлению выраженного, но неболезненного ощущения вибрации и покалывания (в среднем 2.5 мА в амплитудном значении). На курс лечения назначали 1012 процедур (ежедневно, 5-6 раз в неделю).
Обследовали 120 больных 42-65 лет с цереброваскулярными заболеваниями: 40 пациентов на этапе ранней и поздней реабилитации после перенесенного церебрального инсульта (ЦИ; полушарные ишемические - 92%, геморрагические - 2%, стволовые ишемические - 6%), 40 пациентов с недостаточностью кровообращения в вертебрально-базилярной системе (ВБН), 40 больных с дисциркуляторной энцефалопатией I-II стадии.
У 64 больных основной сопутствующей патологией была ИБС (у 16 из них - перенесенный инфаркт миокарда). У 14 больных наблюдались признаки сахарного диабета II типа без декомпенсации.
Современная система многоуровневой оценки результатов реабилитации базируется на "Международной классификации нарушений, инвалидности и социальной недостаточности" (ВОЗ, 1998), выделяющей следующие уровни: "заболевание", "повреждение", "инвалидность" и "социальная недостаточность". Нами проведена оценка на уровнях "повреждение" и "инвалидность". На уровне "повреждение" количественная оценка моторно-сенсорного дефицита проводилась с анализом маркеров моторной дисфункции руки, ноги, объема пассивных движений и боли, координации, баланса, походки и сенсорных нарушений, а также определяли степень спастичности мышц, оценивали нейропсихологическое состояние. Данные использовались для оценки на уровне "повреждение" дефицита когнитивных функций: внимания, умственной концентрации и работоспособности, краткосрочной и долгосрочной памяти, воспроизведения.
Кроме фоновой ЭЭГ, проводили тесты с гипервентиляцией, аудио- и фотостимуляцией. Регистрацию биопотенциалов в моно- и биполярных отведениях (система "10-20") и их обработку в реальном масштабе времени проводили на полиграфе "Nichon Kohden".
Состояние экстракраниальных отделов магистральных артерий головы определяли на допплерфлоуметре ("Спектромед") с использованием общепринятой методики [4]. Проводили качественную оценку церебрального гемодинамического резерва по степени реактивности и выраженности гемодинамических ответов в компрессионных тестах.
Для оценки состояния тонико-эластических свойств мозговых сосудов и венозного оттока использовали РЭГ. Запись проводили с помощью отечественной реографической приставки (модель Е-14) на аппарате ЭЭГ. Рассчитывали реографический индекс, отношение восходящей волны к длительности сердечного цикла, коэффициент межполушарной асимметрии кровенаполнения, дикротический индекс, диастолический индекс и амплитуду венозной волны [3,18]. Уменьшение реографического индекса (амплитуда реографических волн порядка 20-30% - норма) свидетельствует о патологическом воздействии на позвоночную артерию.
Термографию области шеи проводили на тепловизоре "AGEMA-680 M". Данный метод предоставляет косвенные данные о состоянии кровообращения в поверхностных тканях и о нейрососудистых реакциях по регистрируемой кожной температуре. Нарушения симметричного распределения светимости кожного покрова относительно средней линии, характерного для здоровых людей, более чем на 0.2°С и появление специфических по форме и отличающихся по яркости участков зон указывает на отклонение от нормы.
Рентгенологические исследования выполнялись на рентгеновской установке "EDR 750В". Шейный отдел позвоночника снимали в 2 стандартных проекциях, при необходимости с функциональными пробами - максимальное сгибание-разгибание, а также в 3/4 поворота для оценки нарушения двигательной функции позвоночника. При дегенеративно-дистрофических изменениях шейного отдела позвоночника почти всегда выполняли магнитно-резонансную томографию.
Коагулологические исследования проводили с использованием комплекса тестов, характеризующих общую коагулирующую активность крови, плазменный фибринолиз, функциональное состояние клеток. О состоянии клеточного звена судили по количеству тромбоцитов в цельной капиллярной крови ("Coulter"); агрегации тромбоцитов венозной крови при индукции аденозиндифосфатом и адреналином (агрегометр "Chronolog"); о состоянии плазменного звена - по фибринолитической активности и фибриногену плазмы, времени рекальцификации плазмы, толерантности плазмы к гепарину [1]. Всем больным проводились общеклинические анализы крови, мочи, ЭКГ и эхокардиография. Все исследования проводились до и после (через 14 дней) лечения. Данные обрабатывали с использованием программ "Биостат".
Больные были рандомизированы на 2 группы: в 1-й (основной, 60 больных) проводили МЭ СМТ по трансцеребральной методике; во 2-й (контрольной, 60 больных) - лечение по стандартной методике трансцеребральной СМТ-терапии с параметрами тока, идентичными таковым в основной группе. В ходе лечения группы были разбиты на подгруппы (по 20 человек в каждой) с учетом основного диагноза: ЦИ, ВБН или дисциркуляторная энцефалопатия.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
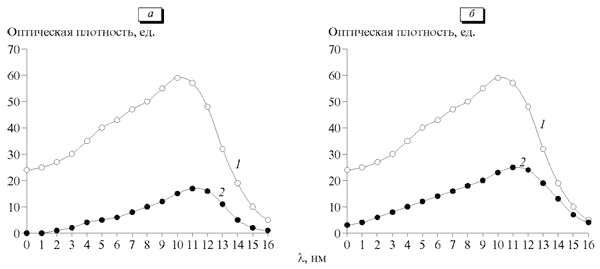
После воздействия СМТ спектр поглощения раствора мексидола остается идентичным таковому нативного раствора препарата (рис. 1). Это свидетельствует о том, что в поле СМТ препарат не подвергается физико-химическим изменениям.
Определение содержания мексидола, проходящего через мембрану, в катодном и анодном растворах показало, что, хотя препарат и передвигается в поле СМТ с обоих полюсов, большее его количество проникает при введении с катода (рис. 1).
Рис. 1. Спектр поглощения раствора мексидола до (1) и после (2) воздействия синусоидальных модулированных токов (СМТ) с анода (а) и с катода (б).
Количественное определение мексидола проводилось по калибровочной кривой при 1=205-350 нм, данные которой представлены на диаграммах (рис. 2, 3). При равных условиях опыта максимальное количество мексидола проникало через мембрану при I и IV р/р и увеличивалось при удлинении времени воздействия тока. Установлено, что большее количество препарата вводится при использовании 2.5% раствора.
Рис. 2. СМТ-электрофорез 5% раствора мексидола. Здесь и на рис. 3: а - 5 мин, б - 10 мин, в - 15 мин. 1 - I р/р, 2 - II р/р, 3 - III р/р, 4 - IV р/р, 5 - диффузия.
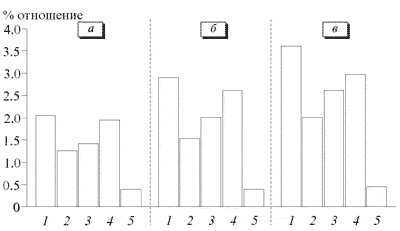
Рис. 3. СМТ-электрофорез 2.5% раствора мексидола.
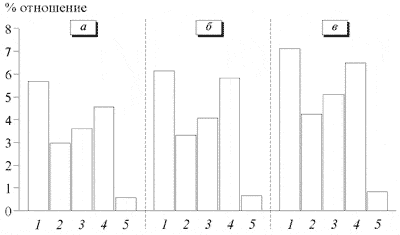
Наши данные согласуются с результатами проведенного ранее исследования [16], в котором было определено, что наиболее результативным для проникновения лекарственного вещества, депонирования его в коже и дальнейшего распределения по внутренним органам являются малые и средние концентрации (до 2-3%).
Параметры СМТ, прежде всего частота модуляции, по-разному влияют на механизмы нейроэндокринной регуляции центральной и церебральной гемодинамики, поэтому нами была определена оптимальная частота (30 Гц) и глубина модуляции (75%). Мы основывались на том, что действие СМТ при заданных параметрах в наибольшей степени сопровождается развитием коллатерального кровообращения (интракраниальный механизм), а также оказывает умеренно выраженное, постепенно развивающееся, пролонгированное гипотензивное действие через ингибицию прессорных систем (симпатико-адреналовую, ренин-ангиотензин-альдостероновую).
Таким образом, можно заключить, что мексидол под воздействием СМТ не разрушается, проникает через полупроницаемую мембрану. Это является доказательством возможности использования препарата для проведения электрофореза СМТ в клинической практике. Оптимальными параметрами являются выпрямленный режим СМТ, I и IV р/р, частота модуляции 70 Гц, глубина 50%, продолжительность воздействия 15 мин. Мексидол вводится с катода 2.5% раствором.
Были подтверждены выраженные изменения симпатико-адреналовой системы: средне-групповая величина β-адренореактивности клеточных мембран у больных с цереброваскулярной патологией до лечения (23.20±0.14 ЕД) была в 2 раза выше нормы. Пациентов с показателем β-адренореактивности клеточных мембран, превысившим 20 ЕД, было 58%. Выявлена зависимость данного показателя от пола и возраста пациентов: у мужчин он заметно превышал таковой у женщин данной возрастной группы, а с возрастом снижался независимо от пола больных. Большое количество пациентов с повышенными величинами β-адренореактивности клеточных мембран вполне обосновано.
Механизм метаболической дезорганизации в патогенетическом звене церебральноваскулярной патологии подтвержден данными, полученными при изучении изменения уровня электролитов сыворотки крови в ответ на ишемию (рис. 4). Нами установлено, что у 42% больных содержание кальция в плазме крови в среднем на 15% превышало верхнюю границу нормы, что коррелировало со степенью активности системы гемостаза. Подобный дисметаболизм мы связывали со стресс-реакцией на ишемию, для которой характерны повышенная паратгормонзависимая резорбция кальция из основных его депо и одновременное увеличение реабсорбции в почечных канальцах, что вызвано необходимостью поддержания стресс-напряжения в цикле гемостаз-пероксид водорода-ПОЛ. Одновременно у 37% снижалась концентрация магния (в среднем на 29% по сравнению с нижней границей нормы), что указывало на его активное потребление в процессе энергетического обеспечения высокого уровня метаболизма, необходимого для поддержания системы адаптации. В то же время это оказывало редуцирующее влияние на свойственные магнию эффекты (торможение нервно-мышечной передачи и усиление мышечно-тонических феноменов, а также седативное действие, обусловливающее повышенную нервную возбудимость во время приступа, после которого больные становятся апатичными, сонливыми, вялыми, что указывает на развитие связанного с недостатком Mg2+ энергетического дефицита).
Рис. 4. Изменение уровня электролитов в ответ на ишемию.
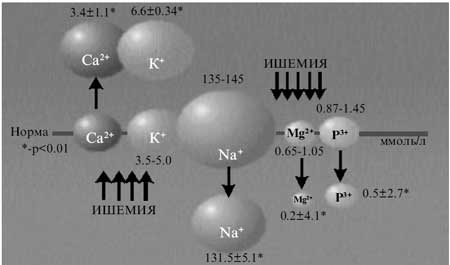
Повышенный уровень содержание калия в сыворотке крови отмечался у 68.6% больных. Подобный дисбаланс в сочетании с достаточно низким уровнем фосфора в плазме крови (до 0.6 ммоль/л у 9% больных) является определяющим фактором активации неферментативного звена ПОЛ. Выявленную диссоциацию можно объяснить особенностями участия этих элементов в формировании ишемических нарушений, протекающих (в связи с преобладанием катаболических процессов) на фоне усиления прооксидантной активности калия и снижения концентрации фосфора в плазме крови (у 75%), что ограничивает тормозное влияние данного биоэлемента на активацию ПОЛ.
На фоне лечения отмечена хорошая переносимость процедур при практически полном отсутствии непосредственных побочных эффектов. Исключение составляли больные с большим очагом поражения полушарной/мозжечковой локализации, а также с выраженной церебральной венозной дисциркуляцией (4 больных) или мягкой внутричерепной гипертензией (2 пациента).
Достоверных различий между показателями в основной и контрольной группах в моторной сфере выявлено не было. Однако тесты когнитивной сферы (краткосрочная вербальная память после процедуры и курса (p<0.05), скорость и качество счета после курса (p<0.05) свидетельствовали о более выраженном улучшении функционального состояния интегративных систем мозга в основной группе (прежде всего таламо-гиппокампально-амигдалярного комплекса).
Отмечено сокращение негрубых психоэмоциональных нарушений, в особенности депрессивных (повышение идеомоторной активности, расширение сферы интересов, улучшение профессиональной мотивации и социальной адаптации и др.). Очевидно, что сочетание мексидола с трансцеребральной электротерапией позволяет расширять спектр клинической эффективности препарата для коррекции когнитивного потенциала и психоэмоциональных нарушений при патологии ЦНС. Однако данные ЭЭГ не подтверждали расширения "зоны ответственности" при сочетанной фармако- и физиотерапии. Нейрофизиологические данные свидетельствовали об отсутствии отрицательных изменений биоэлектрической активности мозга после курса лечения в основной группе у больных с мелкоочаговым полушарным поражением. У 86% таких больных уменьшались явления межполушарной асимметрии (р<0.02, χ2), а у 75% редуцировалась патологическая медленно-волновая и повышалась α-ритмика (р<0.1). Подобных изменений в такой степени в контрольной группе не происходило. Полученные данные свидетельствуют о преимущественном влиянии курса МЭ СМТ на синхронизирующие системы мозга, прежде всего на таламокортикальную.
При исследовании вегетативной нервной системы (по данным индекса Кердо) параметры парасимпатического и симпатического тонуса во всех группах изменились и начали нормализовываться через 5-7 дней лечения, однако в основной группе данные показатели превышали таковые в контрольной на 3-4 усл. ед.: после МЭ СМТ у пациентов с ВБН показатели приблизились к норме в 95% случаев и в 2% случаев вегетативный индекс стал равен нулю.
Показатель β-адренореактивности клеточных мембран после проведенного курса МЭ СМТ достиг величины нормы у большинства больных (93%). В контрольной группе в 11% случаев его значение не изменилось - осталось на высоком уровне, а у 5% пациентов с дисциркуляторной энцефалопатией II степени увеличилось на 4-7 усл. ед. МЭ СМТ, по-видимому, влияет на механизмы симпатико-адреналовой системы и общий вегетативный профиль.
Зарегистрированы изменения показателей гемодинамики. После курса лечения в обеих группах отмечались увеличение скорости кровотока и снижение асимметрии в бассейне общей сонной и позвоночной артерий. Однако в основной группе они были существенно выше: в бассейне общей сонной артерии асимметрия с 27.00±0.52% у больных с ЦИ снизилась до 13.20±0.38% (р<0.05) и у больных с ВБН до 5.2±0.02% (р<0.05), а в контрольной группе - до 19.40±0.13% и 13.40±0.13% соответственно.
В обеих группах наблюдалась тенденция к нормализации показателей термоасимметрии. У больных основной группы эти изменения носили более пролонгированный характер. Высокие показатели в этой группе подтверждают основной (гемопротекторный) фармакокинетический механизм действия мексидола, усиливающийся в сочетании с СМТ.
Наиболее существенными, по-видимому, являются изменения показателей электролитов сыворотки и коагулирующих свойств крови в основной группе. Так, на 14-й день практически у всех больных (98%) уровень фосфора и натрия достиг значения в норме. Нормализация показателей уровня кальция и магния в данном случае была пропорциональна общим изменениям метаболизма в тканях за счет увеличения проницаемости клеточных мембран, уменьшения процессов перекисного окисления и восстановления микромолекулярного звена в тканевом метаболизме. В контрольной группе данные показатели достоверно не изменились.
Сочетанное применение мексидола и трансцеребральной электротерапии СМТ сопровождалось улучшением показателей тромбоцитарно-сосудистого звена гемостаза: показатель агрегации тромбоцитов при индукции АДФ снизился на 32%, адреналина - на 22% (р<0.05) и активации плазменного фибринолиза - на 41% (р<0.01).
Таким образом, МЭ СМТ способствует улучшению состояния неспецифических систем мозга, их интегративной, в том числе межполушарной деятельности, что проявляется редуцированием астенических симптомов, развитием когнитивных функций, нормализацией психоэмоционального фона. Данный метод способствует коррекции пирамидной недостаточности при полушарных очагах поражения и мозжечковой - при инфратенториальных. За счет сочетанного действия мексидола, обладающего прямым мембраностабилизирующим, антигипоксантным, радиопротекторным свойством, и транскраниальных СМТ, анталгический эффект применения которых обусловлен влиянием на неспецифические (интегративные) системы мозга и тесно связанные с ними механизмы нейроэндокринной регуляции, происходит активация адаптивных реакций ЦНС.
На основании интегральной оценки результатов лечения, включавшей динамику клинической симптоматики и данных клинико-лабораторных исследований, терапевтическая эффективность МЭ СМТ у больных после ЦИ с неврологическим дефицитом легкой и средней степени составила 69.6%, у больных с дисциркуляторной энцефалопатией I степени - 79.2%, дисциркуляторной энцефалопатией II степени - 72.4%, ВБН - 81.5%.
Разработанный метод физиотерапии может использоваться в поликлиниках, стационарах, санаториях, центрах медицинской реабилитации и восстановительного лечения.
ЛИТЕРАТУРА
1. Бышевский А.Ш. // Тромбоз, гемостаз и реология. 2000. № 3. С. 35-39.
2. Верещагин Н.В. // Consilium medicum. 2003. Т. 5, № 2. С. 56-61.
3. Гусев Е.И. Методы исследования в неврологии и нейрохирургии. М., 2000.
4. Исаев СВ. Трансцеребральное сочетанное применение СМТ и ПеМП низкой частоты при лечении больных ОНМК в раннем периоде реабилитации. Автореф. дис. ... канд. мед. наук. М., 1996.
5. Исайкин А.И., Яхно Н.Н. // Рус. мед. журн. 2001. Т. 9, № 25. С. 1166-1169.
6. Кочетков А.В. Лечебные физические факторы на этапе ранней реабилитации больных церебральным инсультом. Автореф. дис. ... докт. мед. наук. М., 1998.
7. Кудрин А.В., Скальный А.В. Иммунофармакология микроэлементов. М., 2000.
8. Лебедева Е.В. // Материалы международного конгресса "Здравница-2001". М., 2001. С. 116.
9. Мартынов Ю.С., Гирич Т.И., Кунцевич Г.И. и др. // Журн. неврол. и психиатр. 1999. № 8. С. 14.
10. Миненков А.А. // Материалы Всероссийского форума "Здравница-2002". М., 2002. С. 136-138.
11. Мусаев А.В., Стрелкова Н.И., Масловская С.Г. // Журн. невропат. и психиатр. 1985. № 8. С. 1155-1161.
12. Орехова Э.М. Низкочастотная импульсная электротерапия гипертонической болезни. Автореф. дис. ... докт. мед. наук. М., 1990.
13. Разумов А.Н. Новые технологии восстановительной медицины и курортологии. М., 1999. С. 33.
14. Селезнев А.Н., Козлов С.А., Савин А.А. // Альманах клинической медицины. М., 2001. Т. 4. С. 182-184.
15. Стрелкова Н.И. Физические методы лечения в неврологии. М., 1991.
16. Улащик В.С. // Вопр. курортол., физиотер. и леч. физ. культ. 2003. № 1. С. 9-18.
17. Brouwers P.J., Kottink E.J., Simon M.A., Prevo R.L. // Pain. 2001. Vol. 91, N 3. P. 397-399.
18. Gorbunov F. // Abstracts of I Congress of European Federation of Neurological Societies. Marseille, 2002. P. 81.
19. White P.F, Li S, Chiu J.W. // Anesth. Analg. 2001. Vol. 92, N 4. P. 505-513.
| Апрель 2008 г. |