Опубликовано в журнале:
Бюллетень экспериментальной биологии и медицины, 2006, приложение 1ИНГИБИРОВАНИЕ МЕКСИДОЛОМ ПЕРОКСИДНОГО ОКИСЛЕНИЯ ЛИПОПРОТЕИНОВ СЫВОРОТКИ КРОВИ
Ю.О.Теселкин, Б.В.Давыдов
Клинико-биохимическая лаборатория экстренных методов исследования НИИ скорой помощи им. Н.В.Склифосовского, МоскваВлияние мексидола на процесс Fе2+-индуцированного ПОЛ апо-В-содержащих липопротеинов сыворотки крови изучали с помощью регистрации кинетики хемилюминесценции и определения накопления МДА в реакционной среде. Обнаружено, что мексидол дозозависимым образом уменьшал интенсивность и светосумму хемилюминесценции липопротеинов, а также накопление МДА. Высказано предположение о том, что влияние мексидола на процесс ПОЛ апо-В-содержащих липопротеинов сыворотки крови обусловлено его взаимодействием с ионами Fе2+.
Ключевые слова: кровь, окислительный стресс in vitro, липидный спектр, резистентность к окислению, мексидол
Свободные радикалы и АФК участвуют во многих физиологических процессах в разных клетках. Высокая реакционная способность обусловливает их чрезвычайную токсичность для биологических систем [8]. В норме защита тканей и органов человека от агрессивного воздействия свободных радикалов осуществляется системой антиоксидантной защиты [12,22]. Нарушения в ее работе могут привести к неконтролируемому усилению реакций свободнорадикального окисления. Так, свободнорадикальное окисление и, в частности ПОЛ, играет важную роль в патогенезе нейродегенеративных, сердечно-сосудистых, бронхолегочных и других заболеваний [4,8]. В связи с этим актуальным является создание лекарственных препаратов и биологически активных пищевых добавок, обладающих антиоксидантными свойствами, для профилактики и лечения заболеваний, сопровождающихся развитием оксидантного стресса.
Эффективным антиоксидантным лекарственным препаратом является "Мексидол" [7]. Установлено, что при его применении в составе комплексной терапии при лечении ряда заболеваний у пациентов наблюдается снижение уровня продуктов ПОЛ в сыворотке крови по сравнению с больными, получающими стандартную терапию [3,5,16]. Основное количество липидов сыворотки крови транспортируется в составе белок-липидных комплексов или липопротеинов (ЛП) [2]. К наиболее легко окисляемым ЛП сыворотки крови относятся ЛПНП и ЛПОНП или апо-В-содержащие ЛП (апо-В ЛП) [13]. Нельзя исключить, что взаимодействие мексидола с апо-В ЛП в условиях оксидантного стресса может играть определенную роль в их защите от ПОЛ. Однако влияние мексидола на процесс ПОЛ ЛП сыворотки крови in vitro не исследовалось.
Целью настоящей работы явилось изучение влияния мексидола на способность ЛП сыворотки крови подвергаться ПОЛ.
МЕТОДИКА ИССЛЕДОВАНИЯ
В работе использовали ТБК, 2,6-ди-трет-бутил-4-метилфенол, a-токоферол ("Sigma"), отечественный лекарственный препарат "Мексидол" (2-этил-6-метил-3-оксипиридина сукцинат, 5% раствор). Остальные реактивы также были отечественного производства (квалификация "х.ч." и "ос.ч.").
Апо-В ЛП выделяли из сыворотки крови здоровых доноров методом осаждения в присутствии гепарина и MnCl2 [17]. Для этого к 1 мл сыворотки крови последовательно добавляли 0.04 мл раствора гепарина (5000 ЕД/мл) и 0.05 мл 1 М раствора MnCl2, перемешивали и инкубировали в течение 30 мин при 4°С. Затем образцы центрифугировали при 1500g в течение 30 мин. Супернатант удаляли, а осадок суспензировали в 2 мл дистиллированной воды. Далее образцы центрифугировали при 5000g в течение 30 мин. Супернатант снова удаляли. Осевшие ЛП суспензировали в 1 мл фосфатного буфера (50 мМ KH2PO4, 100 мМ KCl pH 7.4). Все этапы выполняли при 4°С. Содержание белка в полученных суспензиях ЛП определяли по методу Лоури [23].
ПОЛ апо-В ЛП индуцировали ионами Fе2+. За ПОЛ в апо-В ЛП наблюдали, регистрируя кинетику их хемилюминесценции (ХЛ) [14]. Реакционная смесь содержала фосфатный буфер, апо-В ЛП (0.08-0.35 мг белка/мл) и 2.5 мМ сульфат железа. Измерение ХЛ проводили на хемилюминометре "ХЛМ-3М" при 37°С и постоянном перемешивании. Обработку кинетики ХЛ осуществляли с помощью специализированной компьютерной программы. В качестве основных параметров использовали максимальную интенсивность (амплитуду) свечения (I), светосумму свечения (S) и время достижения максимальной интенсивности свечения (T; рис. 1).
Рис. 1. Типичная кинетика Fе2+-индуцированной хемилюминесценции (ХЛ) апо-В-содержащих липопротеинов (апо-В ЛП) сыворотки крови. Апо-В ЛП - 0.2 мг белка/мл, FeSO4 - 2.5 мМ, 50 мМ КН2Р04, 100 мМ KCl рН 7.4. Стрелка - введение раствора FeSO4.
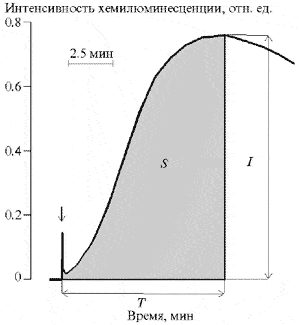
Об уровне процесса Fе2+-индуцированного ПОЛ апо-В ЛП также судили по накоплению в реакционной среде за время Т продуктов, реагирующих с ТБК, которое определяли спектрофотометрическим методом [18] и выражали в виде эквивалентного количества МДА.
Результаты исследования обрабатывали методом вариационной статистики с использованием t критерия Стьюдента и представляли как средние величины±стандартная ошибка средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Представлена типичная кинетика Fе2+-индуцированной ХЛ апо-В ЛП сыворотки крови, которая регистрировалась при инициировании ПОЛ ЛП в фосфатной среде (рис. 1). В реакционной среде происходило накопление МДА - одного из вторичных продуктов ПОЛ, уровень накопления которого составил 8 мкМ.
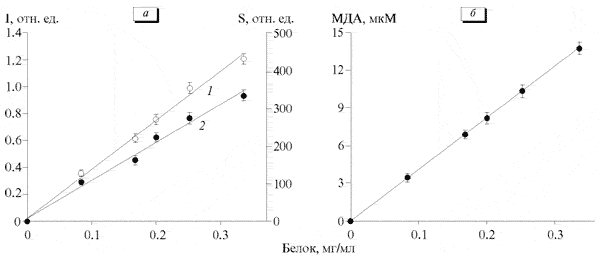
С увеличением уровня содержания апо-В ЛП в реакционной среде наблюдалось прямо пропорциональное увеличение I и S (рис. 2, а), характеризующих количество образующихся возбужденных продуктов ПОЛ. Такое изменение значений I и S сопровождалось аналогичным изменением накопления в исследуемой системе МДА (рис. 2, б). Коэффициент корреляции между значениями I и МДА, S и МДА составил 0.998 (p<0.001). Это свидетельствует о том, что указанные параметры отражают способность апо-В ЛП подвергаться Fе2+-индуцированному ПОЛ, или их окисляемость. При этом одновременная регистрация Fе2+-индуцированного свечения ЛП и накопления МДА позволяет избежать артефактов, возникающих в отдельных случаях при измерении ХЛ или продуктов ПОЛ. В исходной методике определения окисляемости апо-В ЛП [14] коэффициент корреляции между I и МДА, S и МДА составил 0.76 и 0.74 соответственно. Это, по-видимому, обусловлено тем, что авторы использовали не только другой способ осаждения апо-В ЛП - в присутствии гепарина и ионов Са2+, но и не проводили отмывку полученного осадка ЛП от избытка гепарина и Са2+, а также присутствующих в супернатанте антиоксидантов сыворотки крови. В настоящее время существуют методики, которые основаны на изучении окисляемости ЛПНП сыворотки крови, выделенных с помощью ультрацентрифугирования [20]. Однако этот метод является достаточно длительным и трудоемким. Кроме того, во время его выполнения ЛПНП подвергаются дополнительному окислению. Апо-В ЛП, полученные осаждением, и ЛПНП и ЛПОНП, полученные ультрацентрифугированием, имеют одинаковые ХЛ-свойства [13], что позволяет использовать метод осаждения апо-В ЛП в качестве альтернативы методу ультрацентрифугирования при изучении окисляемости ЛП. Так, исследована способность к Сa2+-индуцированному ПОЛ апо-В ЛП сыворотки крови больных ИБС по накоплению МДА, и обнаружено ее повышение по сравнению с показателем у здоровых доноров [15].
Рис. 2. Зависимость интенсивности и светосуммы ХЛ (а), а также накопления МДА (б) в реакционной среде от уровня содержания апо-В ЛП сыворотки крови. 1 - I; 2 - S. FeSO4 - 2.5 мМ, 50 мМ КН2Р04, 100 мМ KCl рН 7.4.
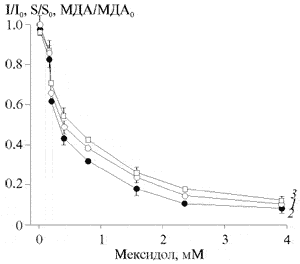
При добавлении мексидола к суспензиям апо-В ЛП наблюдалось изменение кинетики их ХЛ (рис. 3), что проявлялось в уменьшении значений I и S. С увеличением концентрации мексидола зарегистрировано однонаправленное дозозависимое уменьшение указанных показателей, которое также совпадало со снижением накопления в реакционной среде МДА (рис. 4). Это свидетельствует о том, что в присутствии мексидола происходит ингибирование ПОЛ апо-В ЛП, индуцированного ионами Fе2+. В частности, при концентрации мексидола 3.9 мМ значения I, S и МДА уменьшились почти в 10 раз по сравнению с исходными (p<0.001).
Рис. 3. Влияние мексидола и α-токоферола на кинетику Fе2++-индуцированной ХЛ апо-В ЛП сыворотки крови.
а - контроль; б - мексидол (0.39 мМ); в - α-токоферол (0.07 мМ). I0, S0, Т0 - значения показателей без антиоксидантов; I, S, Т - в присутствии антиоксидантов. Стрелка - момент введения раствора FeSO4.
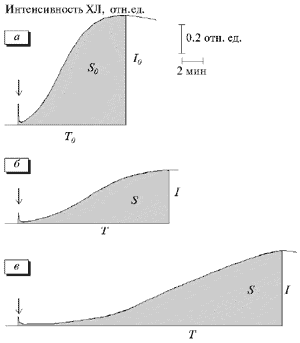
Рис. 4. Влияние мексидола на интенсивность (1), светосумму (2) Fe2+-индуцированной ХЛ апо-В ЛП сыворотки крови, а также на накопление МДА (3) в реакционной среде.
I0, S0, МДА0 - значения показателей без мексидола; I, S, МДА - в присутствии мексидола.
Механизм антиоксидантного действия мексидола на Fе2+-индуцированное ПОЛ апо-В ЛП сыворотки крови до конца не ясен. Одной из важных реакций, участвующих в инициировании липидной пероксидации апо-В ЛП и образовании новых цепей окисления, является реакция взаимодействия ионов Fе2+ с липидными гидропероксидами [4]:
Fе2++ROOH→Fe3++RO*+OH-.
Образовавшиеся RO* вступают в реакции ПОЛ, в результате которых возникают пероксидные радикалы (RO2*), при участии которых образуются ROOH, а также возбужденные молекулярные продукты ПОЛ, испускающие кванты ХЛ. В связи с этим взаимодействие со свободными радикалами (RO2* RO*) и ионами Fe2+ можно рассматривать в качестве основных возможных механизмов антиоксидантного действия мексидола в этих условиях. Поскольку образование RO2* и RO* в процессе липидной пероксидации ЛП происходит внутри их липидной фазы, то антирадикальный механизм действия мексидола должен предполагать его пространственное расположение в этой фазе, в которой находятся такие жирорастворимые радикальные ингибиторы ПОЛ, как витамин Е, каротиноиды, коэнзим Q10 [20].
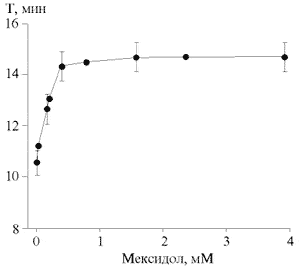
Добавление цепь обрывающих радикальных ингибиторов α-токоферола, 2,6-ди-трет-бутил-4-метилфенола) к модельным липидным мембранам увеличивает время Т кинетики Fe2+-индуцированной ХЛ [1]. С повышением концентрации мексидола в суспензии апо-В ЛП значение Т несколько увеличивалось, достигая максимальных значений при концентрации 0.4 мМ, и далее оставалось на постоянном уровне (рис. 5). При этом показатель Т увеличивался всего в 1.4 раза по сравнению с контролем (p<0.01). При сопоставлении с кинетикой ХЛ апо-В ЛП сыворотки крови в присутствии α-токоферола (рис. 3) видно, что при концентрации 0.07 мМ увеличение Т составило 2.4 раза по сравнению с исходным значением. Перехватывание липидных радикалов, по-видимому, не является основным механизмом антиоксидантного действия мексидола.
Рис. 5. Влияние мексидола на время достижения максимальной интенсивности свечения (Т) Fe2+-индуцированной ХЛ апо-В ЛП сыворотки крови.
При введении ионов Fe2+ в фосфатную среду часть их вовлекается в образование железо-фосфатного комплекса, тогда как оставшаяся часть взаимодействует с субстратом, участвуя в реакциях ПОЛ [6]. Добавление веществ, связывающих или окисляющих оставшиеся ионы Fe2+, изменяет скорость ПОЛ. Так, показано ингибирующее влияние церулоплазмина плазмы крови на ее Fe2+-индуцированную ХЛ в фосфатном буфере [10]. Можно предположить, что при выбранных нами условиях эксперимента мексидол тоже взаимодействует с ионами Fe2+ или влияет на их взаимодействие с апо-В ЛП. Важность взаимодействия ионов Fe2+ со структурированными липидсодержащими объектами отмечалась ранее [19]. К аналогичному заключению пришли и другие авторы [9], исследовавшие влияние мексидола на Fe2+-индуцированную ХЛ липосом из суммарной фракции яичных фосфолипидов, а также на ХЛ люминола, индуцированную системой гемоглобин-пероксид водорода, или водорастворимыми RO2*, образующимися при термогидролизе 2,2'-азобис(2-метилпропионамидина) дигидрохлорида. Мексидол не перехватывал липидные радикалы, водорастворимые RO2*, а также радикалы феррилгемоглобина, но взаимодействовал с ионами Fe2+ и радикалами люминола.
Таким образом, мексидол ингибирует процесс ПОЛ апо-В ЛП сыворотки крови, индуцированный ионами Fe2+. Механизм ингибирования липидной пероксидации апо-В ЛП мексидолом обусловлен его влиянием на состояние ионов Fe2+ и/или эффективность их взаимодействия с ЛП. Установлено, что тканевое повреждение сопровождается освобождением из внутриклеточных депо ионов железа, способных индуцировать свободнорадикальные реакции [11]. При некоторых патологических состояниях организма человека отмечено появление в плазме крови железа, входящего в состав низкомолекулярных комплексов, которые при определенных условиях тоже инициируют ПОЛ [21,22]. В связи с этим обнаруженный антиоксидантный эффект мексидола может являться важным звеном в общем механизме его антиоксидантного действия.
ЛИТЕРАТУРА
1. Бабенкова И.В., Теселкин Ю.О., Ребров Л.Б. и др. // Биомед. технол. и радиоэлектрон. 2003. № 6. С. 37-43.
2. Белова Л.А., Оглоблина О.Г., Белов А.А., Кухарчук В.В. // Вопр. мед. хим. 2000. Т. 46, № 1. С. 8-21.
3. Васильев И.Т., Мумладзе Р.Б., Чудных С.М. и др. // Анн. хир. 2004. № 4. С. 33-38.
4. Владимиров Ю.А. // Вестн. РАМН. 1998. № 7. С. 43-51.
5. Голиков А.П., Голиков П.П., Давыдов Б.В. и др. // Кардиология. 2002. Т. 42, № 3. С. 25-29.
6. Дремина Е.С., Шаров В.С. // Биофизика. 1995. Т. 40, Вып. 2. С. 335-341.
7. Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС. М., 1995.
8. Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс: Биохимический и патофизиологический аспекты. М., 2001.
9. Клебанов Г.И., Любицкий О.Б., Васильева О.В. и др. // Вопр. мед. хим. 2001. Т. 47, № 3. С. 288-300.
10. Клебанов Г.И., Теселкин Ю.О., Владимиров Ю.А. // Биофизика. 1988. Т. 33, Вып. 3. С. 512-516.
11. Козлов А.В., Шинкаренко Л.И., Владимиров Ю.А., Азизова О.А. // Бюл. экспер. биол. 1985. Т. 99, № 1. С. 38-40.
12. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. // Кардиология. 2000. Т. 40, № 7. С. 48-61.
13. Лопухин Ю.М., Владимиров Ю.А., Молоденков М.Н. и др. // Вопр. мед. хим. 1983. Т. 29, № 1. С.116-120.
14. Лопухин Ю.М., Владимиров Ю.А., Молоденков М.Н. и др. // Бюл. экспер. биол. 1983. Т. 95, № 2. С. 61-63.
15. Рагино Ю.И., Душкин М.И. // Клин. лаб. диагност. 1998. № 3. С. 6-8.
16. Смирнов С.В., Голиков П.П., Матвеев С.Б. и др. // Вестн. интенс. тер. 2002. № 1. С. 23-25.
17.Albers J.J., Warnick G.R, Chenng M.C.// Lipids. 1978. Vol. 13, N 12. P. 926-932.
18. Asakawa T, Matsushita S. // Ibid. 1980. Vol. 15, N 3. P. 137-140.
19. Driomina E.S., Sharov V.S., Vladimirov Yu.A. // Free Radic. Biol. Med. 1993. Vol. 15, N 3. P. 239-247.
20. Esterbauer H., Puhl H., Dieber-Rotheneder M. et al. // Ann. Med. 1991. Vol. 23, N 5. P. 573-581.
21. Gutteridge J.M.C. // Med. Biol. 1984. Vol. 64, N 2. P. 101-104.
22. Gutteridge J.M.C, Mitchell J. // Br. Med. Bull. 1999. Vol. 55, N 1. P. 49-75.
23. Lowry O.H., Rosenbrough N.J., Farr A.L., Randell R.J. // J. Biol. Chem. 1951. Vol. 193. P. 263-275.
| Апрель 2008 г. |