Опубликовано в:
Кардиоваскулярная терапия и профилактика, 2009; 8(1) с.63-67Использование аторвастатина и симвастатина в клинической практике у пациентов высокого риска
С.А. Шальнова, А.Д. ДеевГосударственный научно-исследовательский центр профилактической медицины. Москва, Россия
Atorvastatin and simvastatin in clinical management of high-risk patients
S.A. Shalnova, A.D. DeevState Research Centre for Preventive Medicine. Moscow, Russia
Цель. Оценить использование среднетерапевтических доз аторвастатина и симвастатина (Торвакарда и Симвакарда) у пациентов высокого риска в условиях обычной медицинской практики.
Материал и методы. В исследовании принимали участие 347 врачей из 30 городов России; включены 1163 пациента высокого риска, которые были рандомизированы в 2 группы: Торвакарда в дозе 20 мг/сут. (n=672) и Симвакарда в дозе 20 мг/сут. (n=491). Все пациенты опрошены по стандартной анкете, регистрировались показатели антропометрии, артериальное давление, частота сердечных сокращений, определялись уровни общего холестерина (ОХС), активность печеночных трансфераз и креатинфосфокиназы как показателей безопасности. Определяли уровни ХС липопротеидов высокой и низкой плотности (ХС ЛВП, ХС ЛНП) и триглицеридов (ТГ). Продолжительность исследования — 3 месяца. Критерием эффективности липид-снижающей терапии считали достижение целевых уровней ХС ЛНП (≤2,5 ммоль/л).
Результаты. Содержание ОХС иХС ЛНП снизилось на 31,2 % и 38,8 %, соответственно, в группе Торвакарда, и на 21,4 % и 21,5 % в группе Симвакарда (p < 0,001). Оба препарата статистически значимо снижали уровень ТГ на 21,1 % и 15,9 %, соответственно. Целевых уровней ХС ЛНП в группе Торвакарда достигли более половины пациентов, тогда как в группе Симвакарда только 19,6 % (p < 0,0001). Всего в исследовании зарегистрированы 18 нежелательных явлений: 10 (1,5 %) в группе Торвакарда и 8 (1,5 %) в группе Симвакарда (р=0,9).
Заключение. Использование уже в начале лечения более высокой дозы Торвакарда (20 мг) было существенно более эффективным для достижения целевых уровней липидов у пациентов высокого риска и не увеличило число нежелательных событий. Практическому врачу необходимо помнить о прямой зависимости между частотой нежелательных событий и дозировкой статинов, следовательно, мониторировать клинические симптомы и лабораторные показатели безопасности.
Ключевые слова: пациенты высокого риска, статины, эффективность лечения, достижение целевых уровней холестерина липопротеинов низкой плотности.
Aim. To assess the use of average therapeutic doses of atorvastatin and simvastatin (Torvacard and Simvacard) in real-world clinical management of high-risk patients.
Material and methods. The study included 347 doctors from 30 Russian cities and 1163 high-risk patients randomised into two groups: Torvacard, 20 mg/day (n=672) and Simvacard, 20 mg/day (n=491). All patients completed a standard questionnaire, underwent anthropometry and measurement of blood pressure, heart rate, total cholesterol (TCH), low and high-density lipoprotein CH (LDL-CH, HDL-CH), triglycerides (TG), as well as liver enzymes and creatine phosphokinase activity as safety markers. The study lasted for 3 months. Lipid-lowering therapy was regarded as effective if target LDL-CH levels (≤2,5 mmol/l) were achieved.
Results. TCH and LDL-CH levels reduced by 31,2% and 38,8%, respectively, in Torvacard group, and by 21,4% and 21,5% in Simvacard group (p < 0,001). Both medications significantly reduced TG levels — by 21,1% and 15,9%, respectively. In Torvacard group, more than 50% of the patients achieved target LDL-CH levels, and in Simvacard group — only 19,6% (p < 0,0001). In total, 18 adverse events were registered: 10 (1,5%) and 8 (1,5%) in Torvacard and Simvacard groups, respectively (р=0,9).
Conclusion. Early administration of a higher Torvacard dose (20 mg) was much more effective in achieving target lipid levels in high-risk patients, without increasing adverse event risk. Clinicians should remember about the positive correlation between statin dose and adverse effect risk, monitoring clinical and laboratory safety parameters.
Key words: High-risk patients, statins, therapy effectiveness, achieving target levels of low-density lipoprotein cholesterol.
Во второй половине XX столетия первое место по распространенности и вкладу в смертность заняли хронические неинфекционные заболевания, в особенности, сердечно-сосудистые (ССЗ), обусловленные атеросклерозом, которые становятся важнейшей причиной смертности и инвалидизации [1]. Роль холестерина (ХС) в патогенезе остается неизменной на протяжении многих десятилетий. Важность определения общего ХС (ОХС) доказана во многих эпидемиологических исследованиях [2—5]. Дальнейшее усовершенствование аналитических технологий\, позволило получить данные о взаимосвязи ХС липопротеидов низкой плотности (ХС ЛНП) и ишемической болезни сердца (ИБС) [6]. В крупных, клинических исследованиях было доказано, что снижение повышенного уровня ОХС, в частности ХС ЛНП, уменьшает риск развития ИБС [7—10]. Среди препаратов, снижающих содержание ОХС и ХС ЛНП, лидирующее место без сомнения принадлежит ингибиторам 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы или статинам, которые имеют в настоящее время самую значительную доказательную базу в плане снижения риска ССЗ и их осложнений [11]. Снижение уровней ОХС и ХС ЛНП приводит к сокращению сердечно-сосудистой и общей смертности. В настоящее время в распоряжении врачей имеются убедительные доказательства необходимости назначения статинов не только при ИБС, но больным сахарным диабетом (СД) и другим пациентам с высоким риском сердечно-сосудистых осложнений (ССО) [12-14].
Вместе с тем, несмотря на убедительные результаты клинических исследований, энтузиазм в использовании больных липид-снижающей терапии не очень велик. Это, по-видимому, связано с недостаточным пониманием необходимости применения гиполипидемических препаратов, включая лечение ИБС. Следует отметить, что статины если и назначают, то зачастую в низких, недостаточно эффективных дозах. По-прежнему существует боязнь нежелательных эффектов, несмотря на то, что хорошая переносимость статинов показана во всех клинических исследованиях.
Целью настоящего исследования является сравнительная оценка использования среднетерапевтических доз аторвастатина и симвастатина у пациентов высокого риска в условиях обычной медицинской практики.
Материал и методы
В исследовании принимали участие 347 врачей из 30 городов России; были включены 1163 пациента высокого риска ССО. Критерями включения в исследование служили — наличие у пациента ИБС или ее эквивалентов: СД и/или атеросклероза другой локализации, а также наличие суммарного сердечно-сосудистого риска по шкале SCORE (Systematic coronary risk evaluation) > 5.В исследование не включали больных, имевших в анамнезе острый инфаркт миокарда или инсульт, перенесенные менее чем за 6 месяцев (мес.) до начала исследования, тяжелые сопутствующие заболевания, включая тяжелую сердечную недостаточность (СН), повышение активности печеночных ферментов — аланинтрансферазы и аспартаттрансферазы (АЛТ, АСТ) более чем в 2 раза по сравнению с нормальными значениями и повышение креатинфосфокиназы (КФК) более чем в 5 раз.
Таким образом, критерии включения и исключения соответствовали общепринятым при назначении статинов.
Дизайн исследования: открытое, рандомизированное. Всем пациентам исходно проводили опрос по стандартной анкете, регистрировали показатели антропометрии, артериальное давление (АД), частоту сердечных сокращений (ЧСС). Перед началом и в конце исследования определялись уровни ОХС, ХС ЛНП, ХС липопротеидов высокой плотности (ЛВП), триглицеридов (ТГ), а также активность АСТ, АЛТ, КФК как показателей безопасности. Продолжительность исследования составила 3 месяца (мес.).
Пациенты после рандомизации были разделены на две группы: принимающие аторвастатин (Торвакард) в дозе 20 мг/сут. и использующие симвастатин (Симвакард) в дозе 20 мг/сут., на фоне сопутствующей терапии. Оба препарата производятся компанией ЗЕНТИВА, Чешская Республика.
Таблица 1
Характеристика пациентов после рандомизации (M±m)
Примечание: САД — систолическое АД; ДАД — диастолическое АД; ИМТ — индекс массы тела.
Показатель Возраст (лет) ИМТ (кг/м2) ЧСС (уд/мин) САД (мм рт.ст.) ДАД (мм рт.ст) ОХС (ммоль/л) ХС ЛНП (ммоль/л) ТГ (ммоль/л) ХС ЛВП (ммоль/л) ACT (Е/л) АЛТ (Е/л) КФК (Е/л) Таблица 2
Частота показателей сердечно-сосудистого риска у пациентов в зависимости от назначенной терапии (%)
Показатель ИБС Атеросклероз другой локализации СД АГ Курение Ожирение (≥30,0 кг/м2) Критерием эффективности липид-снижающей терапии служило достижение целевых уровней ХС ЛНП в соответствии с современными Российскими рекомендациями по диагностике и коррекции нарушений липидного обмена 2007г.
Статистический анализ результатов проводили, используя систему статистического анализа и извлечения информации — SAS [15]. Применяли стандартные методы описательной статистики и известные критерии значимости: χ2, t-критерий Стьюдента, F-критерий Фишера. Кроме того, использовались методы аналитической статистики: дисперсионно-ковариационный анализ.
Результаты и обсуждение
В группу Торвакарда (аторвастатина) были рандомизированы 672 пациента, в группу Симвакарда (симвастатина) — 491 пациент. Мужчины и женщины составили в группе Торвакарда, 58,1%и41,9% соответственно, в группе Симвакарда — 57,5 % и 42,5 %, соответственно. Средний возраст пациентов был практически идентичен и составил 60,2 лет в группе Торвакарда и 60,3 лет — в группе Симвакарда.Обе группы пациентов по всем показателям, учитываемым в исследовании, между собой статистически не различались, что свидетельствует о хорошей сбалансированности групп, говоря иными словами — грамотно проведенной рандомизации (таблица 1). Важно подчеркнуть, что исследование проводилось силами практических врачей. Не секрет, что в реальной клинической практике бывает достаточно сложно получить удовлетворительную рандомизацию, и поэтому в других работах сравниваемые группы зачастую не сбалансированы, что умаляет полученные результаты.
По факторам риска (ФР) и наличию ССЗ сравниваемые группы пациентов также были сопоставимы (таблица 2). Диагноз ИБС был поставлен у 75 % больных в каждой группе, каждый пятый участник исследования имел СД и почти каждый четвертый — атеросклероз другой локализации.
Несмотря на наличие серьезных ССЗ, каждый пятый пациент высокого риска курит. Следует отметить, что артериальная гипертония (АГ) имела место у > 80 % пациентов высокого риска. К сожалению, это еще раз демонстрирует, что АГ является одним из самых распространенных ФР в российской популяции [16] и самым распространенным заболеванием в реальной практике [17].
Отмечается, что 27,9 % пациентов получали те или иные статины до включения в исследование, из них контролировали уровни ХС ЛНП только 12,8 %. Эти пациенты были исключены из последующего анализа.
При анализе динамики параметров липидного обмена через 3 мес. лечения статинами наблюдалось достоверное снижение уровней ОХС, ХС ЛНП, ТГ и некоторое повышение ХС ЛВП по сравнению с исходными, в обеих сравниваемых группах (рисунок 1: А, Б, В).
К концу исследования в группе Торвакарда уровень ОХС снизился на 31,2 % (2,2 ммоль/л) от исходного, в группе Симвакарда — на21,4%(1,5 ммоль/л) (р=0,001).
Отмечено снижение среднего уровня ХС ЛНП на 38,8 % (1,4 ммоль/л) в группе Торвакарда и на 21,5 % (1,1 ммоль/л) в группе Симвакарда (р=0,001).
Оба препарата статистически значимо снижали уровень ТГ: Торвакард — на 21,1 % (р=0,001), Симвакард - на 15,9 % (р=0,001).
Показатели ОХС, ХС ЛНП, ТГ статистически значимо отличаются от исходных (р=0,001), и различия между группами Торвакарда и Симвакарда достоверны (р < 0,001).
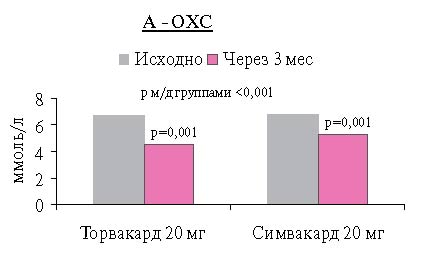
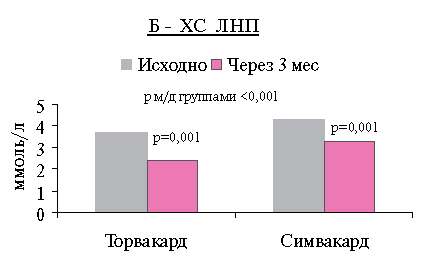
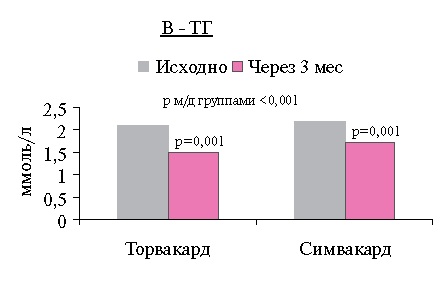
Рис. 1 Динамика уровней ОХС (А), ХС ЛНП (Б) и ТГ (b) до и после терапии.Таблица 3
Динамика показателей АЛТ, АСТ, КФК
Примечание: Δ — изменение показателя.
Терапия Торвакардом привела к увеличению ХС ЛВП на 17,3 % (0,09 ммоль/л), а Симвакардом — на 11,7 % (0,07 ммоль/л). Оба показателя статистически значимо отличаются от исходных (p < 0,01), но не различаются между группами (р=0,6).
Эффективность терапии статинами оценивалась и по такому показателю как процент достижения целевого уровня ХС ЛНП. В качестве критериев эффективности в этом исследовании были выбраны значения для ХС ЛНП < 2,5 ммоль/л.
Оказалось, что в группе Торвакарда в дозе 20 мг/ сут., через 3 мес. терапии целевых уровней ХС ЛНП достигли 67,9 %, тогда как среди пациентов, принимавших Симвакард в аналогичной дозе, таких оказалось 19,6 % (рисунок 3); иными словами, Торвакард оказался существенно эффективнее. Безусловно, подобный результат, в известной степени, ожидали. При сравнении эффективности различных статинов было показано, что аторвастатин более существенно снижает содержание ОХС и ХС ЛВП, чем симвастатин в аналогичных дозах [18]. Аналогичные результаты были получены в краткосрочном исследовании, проведенном в отделе профилактической фармакологии ГНИЦ ПМ [19].
Динамика показателей АЛТ, АСТ и КФК, являющихся биохимическими гарантами безопасности терапии статинами, представлена в таблице 3. Клинически незначимое повышение уровней печеночных ферментов, которое наблюдалось при приеме изучаемых препаратов, между группами статистически не различалось.
В то же время под влиянием Симвакарда КФК повышался более значительно, чем под влиянием Торвакарда (4,65 Е/л vs 2,98 Е/л).
Всего в исследовании зарегистрированы охс ХСЛНП ХСЛВП 18 неблагоприятных побочных реакций (НПР): 10 (1,5 %) в группе Торвакарда и 8 (1,5 %) - в группе Симвакарда (р=0,9). Все отмеченные НПР включены в инструкцию по медицинскому применению препаратов.
На фоне приема Торвакарда у 4 пациентов появилась тошнота, 3 — жаловались на головную боль и головокружение, 2 — на боли в животе, 1 — на слабость. У 5 пациентов НПР связаны с приемом Торвакарда, у 3 — связь расценена, как маловероятная, и у 2 больных связь с препаратом не установлена. Большинству пациентов (6 из 10) не потребовалось дополнительного вмешательства, 4 лечились симптоматически.
Прием Симвакарда вызвал боли в животе у 5 пациентов, тошнота отмечена у 3. Все случаи были расценены, как связанные с приемом препарата. В то же время, 5 пациентов не нуждались в дополнительной терапии, 3 — принимали симптоматическое лечение. Отмеченные НПР как в группе Торвакарда, так и в группе Симвакарда не привели к отмене препарата.
Изменения гемодинамических параметров в ходе исследования отсутствовали. Необходимо подчеркнуть, что одной из важнейших задач исследования было показать, что назначение более высоких доз статина уже в начале терапии больным высокого риска не только оправдано, но и безопасно.
Клинические исследования, в которых жестко контролируется достижение целевых значений ХС ЛНП, демонстрируют убедительные результаты в снижении риска ССО у пациентов высокого риска. Но в реальной клинической практике только незначительная часть больных с ИБС получают статины достигают целевых значений липидного профиля еще меньший процент, что связано с недостаточной приверженностью лечению и назначением статинов в низких дозах.
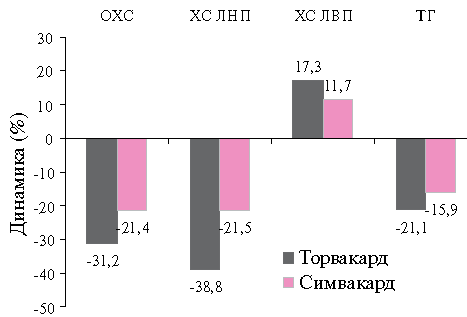
Рис. 2 Изменение показателей липидного обмена под влиянием терапии в конце исследования (Δ%).
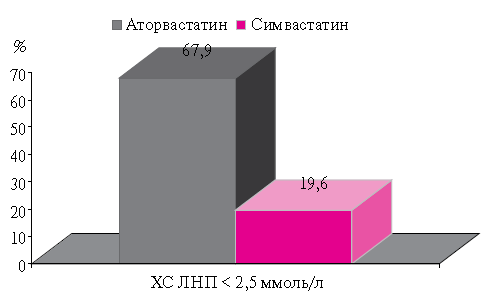
Рис. 3 Достижение целевого уровня ХС ЛНП под влиянием терапии.Настоящее исследование относится к числу наиболее приближенных к реальной практике. Использование рандомизации и хорошая сбалансированность групп делает полученные результаты надежными и убедительными. Использование уже в начале лечения более высокой дозы Торвакарда (20 мг/сут.) было существенно более эффективным для достижения целевых уровней липидов у пациентов высокого риска и безопасным, что, собственно, и является целью липид-снижающей терапии.
Литература
- Murray CJ, Lopez AD. Alternative projections of mortality and disability by cause 1990—2020: Global Burden of Daisease Study. Lancet 1997; 349: 1498-504.
- Keys A. Seven Countries: A multivariate analysis of death and coronary heart disease. Cambridge, Harvard University Press, 1980;
- Stamler J, Wenthworth D, NeatonJD, forthe MRFIT Research Group. Is the relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? JAMA 1986; 256: 2823-8.
- Anderson KM, Castelli WP, Levy D. Cholesterol and mortality: 30 years of follow-up from the Framingham study. JAMA 1987; 257: 2176-80.
- Psaty BM, Anderson M, Kronmal RA, et al. The association between lipid levels and the risks of incident myocardial infarction, stroke, and total mortality: The Cardiovascular Health Study. J Am Geriatr Soc 2004; 52: 1639-47.
- Kane JP, Kunitake ST. Isolation of plasma lipoproteins by ultracentrifugation and immunosorption. In Betteridge DJ, Illingworth DR, Shepherd J (eds): Lipoproteins in Health and Disease. New York, NY, Oxford University Press, 1999.
- Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease (4S). Lancet 1994; 344: 1383-9.
- Shepherd J, Cobbe SM, Ford I, et al. for the West of Scotland Coronary Prevention Study Group. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N EnglJ Med 1995; 333: 1301-7.
- Downs JR, Clearfield M, Weis S, еt al. for the AFCAPS/ TexCAPS Research Group, (1998). Primary Prevention of Acute Coronary Events With Lovastatin in Men and Women With Average Cholesterol Levels: Results of AFCAPS/TexCAPS. JAMA 2001; 279: 1615-22.
- Heart Protection Study Collaborative Group. MRC/BHR Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: A randomised placebo-controlled trial. Lancet 2002; 360: 7-22.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults: Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-97.
- Serruys PW, de Feuter P, Macaya C, et al., Intervention Prevention Study (LIPID) Investigators. Fluvastatin for prevention of cardiac events following successful first percutaneous coronary intervention: a randomized controlled trail. JAMA 2002; 287: 3215-22.
- Sever PS, Dahlof B, Poulter N, et al. for the ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or low then average cholesterol coycentrations, in the Anglo-Scandinavian Cardiac Output Trail — Lipid Lowering Arm (ASCOT-LLA): a multi-centre randomized controlled trail. Lancet 2003; 361: 1149—58.
- Colhoun HM, Bettrbrige DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomized placebe-controlled trail. Lancet 2004; 364: 685-96.
- SAS/STAT User's Guide, Version 6, Fourth Edition, Vol.1 & 2, SAS Institute Inc., Cary, NC, USA, 1990.
- Шальнова С.А. Эпидемиология артериальной гипертонии. В кн. Руководство по артериальной гипертонии. Под. Ред. Е.И.Чазова и И.Е.Чазовой. Москва Медиа-Медика 2005; 79-94.
- Шальнова СА, Деев АД, Вихирева О.В. Артриальная гипертония глазами амбулаторных пациентов. Первые данные исследования ГАРАНТ. Кардиоваск тер профил 2007; 5: 30-3.
- Jones PH, Davidson MH, Stein EA, et al. and STELLAR study group. Comparison of the efficacy of rosuvastatin and pravastatin across doses (STELLAR Trail). Am J Cardiol 2003; 92: 152-60.
- Семенова Ю.Э., Марцевич С.Ю., Перова Н.В. и др. Оценка эффективности и безопасности дженерика аторвастатина у больных с гиперлипидемией. РФК 2005; 3: 24—8.
| Февраль 2010 г. |