Опубликовано в журнале:
«Український біохімічний журнал», 2005, Т. 77, №4 с. 25-45ВИТАМИНОПОДОБНЫЕ СОЕДИНЕНИЯ L-КАРНИТИН И АЦЕТИЛ-L-КАРНИТИН: ОТ БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ К МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ
В. М. КОПЕЛЕВИЧ
ФГУП “Государственный научно-исследовательский институт витаминов”, Москва, Россия.В огляді наведено результати досліджень останніх років, які стали науковою основою для розуміння молекулярних аспектів застосування карнітину в медицині.
Карнітин – сполука, що є необхідною для транспортування ацильних похідних коферменту А крізь внутрішню мітохондріальну мембрану для їхнього пЃў-окислення в матриці мітохондрії. Біологічно активним є тільки L-ізомер карнітину, в той самий час D-ізомер конкурентно гальмує активність системи захоплення та перенесення L-карнітину і перешкоджає окисленню жирних кислот у мітохондрії. За взаємодії з системою СоА карнітин включається у проміжний обмін речовин шляхом модуляції пула вільного СоА у клітині. Наведено детоксикувальні властивості L-карнітину, його участь в анаболічних процесах, апоптозі, а також його нейрозахисну дію.
Недостатність карнітину спричинює різноманітні прояви і поділяється на первинну та вторинну. Первинну недостатність генетично обумовлено порушенням транспортування карнітину у клітини та тканини, а вторинна є наслідком великої групи спадкових та набутих захворювань.
Обговорено патофізіологічні стани, що є наслідком дефіциту карнітину. Показано ефективність використання L-карнітину для корекції первинної та вторинної його недостатності. Ацетил-L-карнітин поліпшує когнітивні функції мозку, значною мірою уповільнює процеси старіння, що зумовлені порушеннями в мітохондріях, поліпшує якість життя в похилому віці. Обговорюються терапевтичні можливості L-карнітину та ацетил-L-карнітину.
Ключовi слова: карнiтин, ацетилкарнiтин, карнiтинацилтрансфераза, карнiтинова недостатнiсть, клiнiчне використання карнiтину, кофермент А.
VITAMINE-LIKE SUBSTANCES L-CARNITINE AND ACETYL-L-CARNITINE: FROM BIOCHEMICAL STUDIES TO MEDICINE
V. M. Kopelevich
Institute of Vitamines, Moscow, Russia;
Summary
Recently reported data clarify our understanding of the molecular aspects of carnitine in medicine. Carnitine is a compound necessary for the transport of acyl-CoA across the inner mitochondrial membrane for their β-oxidation. Only L-isomer of car-nitine is biologically active. The D-isomer may actually compete with L-carnitine for absorption and transport, increasing the risk of carnitine deficiency. By interaction with CoA, carnitine is involved in the intermediary metabolism by modulating free CoA pools in the cell. Detoxification properties and anabolic, antiapoptotic and neuroprotective roles of car-nitine is presented. Carnitine deficiency occurs as a primary genetic defect of carnitine transport and secondary to a variety of genetic and acquired disorders. The pathophysiological states associated with carni-tine deficiency have been summarized. L-Carnitine is effective for the treatment of primary and secondary carnitine deficiencies. Acetyl-L-carnitine improves cognition in the brain, significantly reversed age-associated decline in mitochondrial membrane potential and improved ambulatory activity. The therapeutic effects of carnitine and acetylcarnitine are discussed.
K e y w o r d s: carnitine, acetylcarnitine, car-nitine acyltransferase, carnitine deficiency, clinical use of L-carnitine, coenzyme A.
Современная наука о витаминах и витаминоподобных веществах – витаминология достигла в последние годы значительных успехов в расшифровке механизма их действия, что послужило основой более грамотного применения таких препаратов. Витамины так широко вошли в нашу жизнь, что сейчас невозможно переоценить тот импульс в истории человеческого познания, который сделал открытие витаминов в первой половине 20 века, установление их роли в жизни человека, перевернувшее наши представления об окружающем мире. Развитие витаминологии началось в 30–40 годы 20 века на стыке химии, биохимии, медицины и физиологии. Следует отметить, что большой вклад в это внесли ученые бывшего СССР, в частности академики А. В.Палладин и Р. В. Чаговец, 100-летний юбилей которого широко отмечался в 2004 году. Своими исследованиями академик Р. В. Чаговец и его сотрудники доказали, что витамины действительно способны излечивать от многих заболеваний, отдалять старость, побеждать немощь и продлевать жизнь. Они обосновали положение о дозазависимом эффекте витаминов и витаминоподобных веществ, что в настоящее время имеет большое практическое значение для клинического применения этой группы соединений, включая L-карнитин и его производные.
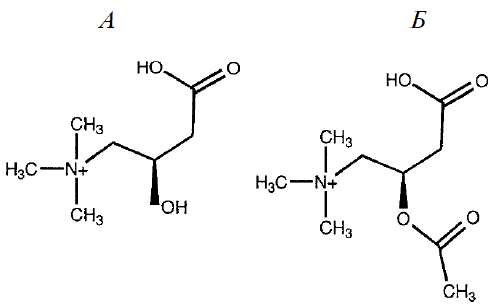
L-Карнитин (L-3-гидрокси-4-N– (триметил-аммоний)масляная кислота), который по химическому строению можно рассматривать как производное у-аминомасляной кислоты, присутствует в биологических системах как в свободном виде, так и в форме О-ацильных эфиров, включая ацетил- L-карнитин (АЛК) (рисунок). L-Карнитин впервые выделили в 1905 году В. С. Гулевич и Р. Кримберг из экстракта тканей мышц (отсюда и название: carnis по-латыни - мясо). В 1927 году с помощью химического синтеза была установлена его структура. С момента открытия L-карнитина прошло ровно 100 лет и за это время накоплен огромный фактический материал о его распространении в природе, биологических функциях, а также применении в медицине.
Химическая структура L-карнитина (А) и ацетил-L-карнитина (Б).
В 1952 г. А. Френкель опытным путем установил, что L-карнитин является незаменимым фактором роста для мучного червя Tenebrio molitor, в связи с чем его назвали витамином ВТ. Позднее было установлено, что L-карнитин синтезируется также в организме человека и высших животных. И. Фритц в 1958 г. определил, что L-карнитин повышает скорость окисления жиров в митохондриях. Эта работа заложила основы изучения фундаментальной его роли в окислении жиров. В 1960–1970 годы появилось значительное число работ по изучению функциональной роли L-карнитина. В эти же годы разработаны химические методы синтеза рацемического карнитина. В 1980 годы L-карнитин становится коммерчески доступным. С этого года и до настоящего времени отмечается заметное повышение числа научных публикаций по изучению роли L-карнитина в обмене веществ. Эти исследования раскрывают возможности его применения для поддержания нормального функционирования организма человека, лечения различных заболеваний и улучшения качества жизни. К 2004 году имелось уже более 10 000 научных сообщений и ежегодно публикуется около 300 работ по изучению L-карнитина. В течение последних 30 лет лекарственные препараты и биологически активные добавки на основе L-карнитина и АЛК получили признание и появились на прилавках аптек и специализированных магазинов. Из приведенной краткой исторической хроники видно, какой значительный период времени прошел от открытия L-карнитина до его практического использования в качестве лечебного средства и доступной пищевой добавки [1,2]. Многие эксперты определяют сейчас витамины как низкомолекулярные органические компоненты пищи, абсолютно необходимые для поддержания жизненных функций, которые не образуются или образуются в недостаточном количестве в организме и поступают в него с пищей. Они регулируют самостоятельно или в составе ферментов обмен веществ и оказывают разностороннее влияние на жизнедеятельность организма. В эту группу нутриентов, наряду с витаминами, некоторыми каротиноидами, биофлавоноидами, а также различными их метаболитами в организме человека, такими как кофермент Q10, а-липоевая кислота, холин, инозит, оротовая кислота, включен и L-карнитин. Важно также отметить функциональную взаимосвязь между L-карнитином и коферментом А на уровне регуляции внутриклеточного метаболизма. Более того, вполне вероятно, что терапевтический эффект L-карнитина и его эфиров обусловлен интегральным влиянием карнитиновой системы на содержание свободного СоА. Все это дает нам основание относиться к L-карнитину как “забытому” витамину группы В, хотя в настоящее время в большинстве научных публикаций, различных монографиях и документах L-карнитин определяется как витаминоподобное соединение. В настоящей статье рассматривается лишь незначительная часть той обширной литературы, которая опубликована, в основном, в последние 5–10 лет, о роли L-карнитина в метаболических процессах, а также о клиническом применении L-карнитина и его ацетильного производного.
1. Биосинтез L-карнитина и его биохимические функции
В организме человека и животных L-карнитин синтезируется в печени и почках, из которых транспортируется в другие ткани и органы. Для того, чтобы происходил его синтез необходимы следующие исходные продукты: две незаменимые аминокислоты лизин и метионин, витамин С, витамин В3 (ниацин), В6, В12, фолиевая кислота и железо. При дефиците хотя бы одного из этих веществ собственный синтез L-карнитина заметно снижается. При этом установлено, что недостаток витамина С является определяющим и приводит к симптомам недостаточности L-карнитина, поскольку его биосинтез в этом случае практически не происходит. Для синтеза L-карнитина требуется 5 ферментов.
Промежуточный продукт синтеза N-триметиллизин превращается в гидрокситриметиллизин, который в цепи реакций, протекающих как в митохондриях, так и в цитозоле клетки, далее образует у-бутиробетаин. Необходимые для этих этапов биосинтеза ферменты обнаружены в скелетных мышцах, сердце, печени, почках и мозгу. Превращение у-бутиробетаина в L-карнитин происходит в реакции гидроксилирования под действием специфического фермента гидроксилазы, который обнаружен исключительно в печени, почках и мозгу, но его нет в скелетных или сердечных мышцах [3].
В организме млекопитающих L-карнитин не катаболизируется и выводится с мочой в неизменном виде или в форме О-ацильных производных [2,4]. В митохондриях печени образуется ряд производных L-карнитина как с эндогенными веществами, так и с ксенобиотиками [5]. Он находится во всех тканях и органах и у взрослого человека его содержание составляет 20–25 г, из которых 97% находится в скелетных мышцах и миокарде, т.е. в тканях, использующих жирные кислоты как главный источник энергии. Это связано с тем, что L-карнитин играет важнейшую роль в переносе активированных жирных кислот через внешнюю мембрану митохондрий для процесса β-окисления.
Большие успехи в изучении роли L-карнитина в метаболических процессах, происходящих в организме, способствовали усовершенствованию способов его применения в практической медицине. На первом этапе применение L-карнитина было основано на простом принципе заместительной терапии: если при некотором заболевании происходит уменьшение содержания какого-либо метаболита, то последний может быть введен извне и таким образом он окажет лечебное действие. Благодаря научному прогрессу последних десятилетий большое число заболеваний и метаболических состояний, таких как, например, старение, стало возможным описать биохимическими терминами. Следовательно, созданы возможности для направленного изыскания лекарственных веществ, нормализующих метаболические процессы, что является основой современного подхода к вопросам метаболической терапии (регуляции нарушенных обменных процессов). Однако для успешного применения этого принципа необходимо понимание того, какие звенья метаболизма нарушаются при конкретной патологии, а также какова роль отдельного метаболита в биохимических реакциях, протекающих в клетках и определяющих физиологические функции клетки, ткани, органа.
Что касается L-карнитина, то он, являясь объектом более чем 30-летнего широкого научного изучения, может служить в качестве примера исследований, которые должны быть проведены для рационального создания и применения метаболического лекарственного средства. Итак, остановимся более подробно на биохимических функциях L-карнитина в метаболизме живого организма.
1. Транспорт длинноцепочечных жирных кислот в митохондриальный матрикс. L-Карнитин играет роль “челнока” в процессе образования ацетил-СоА из жирных кислот. Поскольку процесс активации жирных кислот и их окисление пространственно разделены, в клетке функционирует механизм переноса длинноцепочечных жирных кислот через внутреннюю митохондриальную мембрану в митохондриальный матрикс с участием карнитина и специальной ферментной системы. Эта система обратимо перебрасывает ацил на внешней стороне мембраны с СоА на карнитин, а на внутренней – с карнитина на внутримитохондриальный СоА. Жирные кислоты сначала с затратой энергии превращаются в длинноцепочечный ацил-СоА (ДЦАСоА), который не способен проходить через внутреннюю мембрану митохондрий, в то время как такой способностью обладает ацилкарнитин (ДЦАКар), образующийся в результате реакции карнитина с ДЦА-СоА. Образование ДЦАКар на митохондриальной мембране катализируется карнитинацилтрансферазами и карнитин является субстратом для этих ферментов. Этот процесс является обратимым и катализируется несколькими ферментами, которые классифицируются по их сродству к ацил-СоА [2]. Карнитинацетилтрансфераза (КАТ, 2.3.1.7) катализирует реакции короткоцепочечных ацилов с длиной цепи от 2 до 10 углеродных единиц. Для трансферазы длинноцепочечных ацилов (>10 атомов углерода) используют название карнитиноктаноилтрансфераза в случае внемитохондриальных белков или карнитинпальмитоилтрансфераза (КПТ I) для митохондриальных ферментов. Последние две подгруппы ферментов проявляют широкую специфичность по отношению к среднецепочечным и длинноцепочечным ацил-СоА, обладая наибольшим сродством для деканоил-КоА [6].
Ацилкарнитины переносятся через внутреннюю митохондриальную мембрану с помощью транспортного белка, называемого карнитинацилтранслоказа. В митохондриальном матриксе ацилкарнитин взаимодействует с СоА при участии КПТ II, в результате чего вновь образуется ацил-СоА, который в процессе β-окисления превращается в ацетил-СоА, участвующий в цикле трикарбоновых кислот (ЦТК), и свободный карнитин. Высокая утилизация субстратов в окислительных процессах требует оптимальной активности карнитинзависимых трансфераз.
2. Контроль и модуляция внутриклеточного пула СоАSH. Помимо переноса активированных ацильных радикалов между компартментами клетки без затраты энергии, карнитиновая система играет также важную роль в сохранении стабильного уровня КоА, который необходим для активирования карбоксилсодержащих метаболитов. Тем самым карнитин включается также в промежуточный обмен в целом, модулируя соотношение ацил-СоА/СоАSH и поддерживая необходимый уровень свободного СоАSH в клетке. Эта функция карнитиновой системы зависит, главным образом, от образования короткоцепочечных ацилкарнитинов (КЦАКар), катализируемого КАТ [2,7]. Карнитин способствует удалению короткоцепочечных жирных кислот из митохондрии, освобождая внутримитохондриальный СоА, стабилизация уровня которого и функциональная взаимосвязь между пулами СоА и карнитина являются жизненно важными для оптимизации энергетического метаболизма. Участвуя в биохимических процессах образования и деградации жирных кислот, стероидов, фосфолипидов, синтезе ацетилхолина, окислении пировиноградной кислоты, образовании кетоновых тел и других процессах, СоАSH является важнейшим метаболитом клетки. Он необходим для β-окисления, для катаболизма некоторых аминокислот, для дезинтоксикации органических кислот и ксенобиотиков, для функционирования пируватдегидрогеназы [8], α-кетоглутаратдегидрогеназы [9] и, следовательно, для работы ЦТК [10]. Снижение поступления карнитина вызывает уменьшение содержания СоА в матриксе и сопутствующее этому повышение соотношения ацил-СоА/ СоАSH, что вызывает ингибирование ферментативной активности вышеупомянутых дегидрогеназ. Следовательно, ослабляется не только окисление жирных кислот [11], но также и утилизация углеводов, катаболизм некоторых аминокислот, дезинтоксикация органических кислот и ксенобиотиков [12]. Взаимосвязь СоА – карнитин в клетке осуществляется посредством карнитин-ацилтрансфераз [13].
Поскольку защита митохондриального и цитозольного пулов свободного СоА при различных заболеваниях достигается экскрецией ацилкарнитинов, то в тех случаях, когда происходит образование нежелательных ацильных групп, как, например, при некоторых наследственных нарушениях окисления жирных кислот, дополнительный прием L-карнитина является необходимым. В целом терапевтический эффект L-карнитина и его эфиров, по-видимому, во многом опосредован через интегральное влияние карнитиновой системы на пулы СоА.
3. Дезинтоксикация органических кислот и ксенобиотиков. Удаление биогенных «шлаков», накапливающихся в митохондриях в результате окислительного разложения жиров, а также ксенобиотиков – еще одна важная функция L-карнитина. Цитотоксические органические кислоты, как и ксенобиотики, биотрансформируются превращением в производные ацил-СоА, которые удаляются из дальнейшего катаболического процесса. Кроме того, ацил-СоА может накапливаться внутри митохондриального матрикса при дефиците ферментов их деградации. В этом случае трансформация ацил-СоА в соответствующие ацилкарнитины позволяет вывести избыток ацильных остатков из митохондрий в цитозоль. В отличие от соответствующих производных ацил-СоА, ацилкарнитины, в особенности короткоцепочечные, способны диффундировать через клеточные мембраны и могут быть элиминированы в мочу.
4. Анаболические функции. Анаболический эффект L-карнитина был установлен в эксперименте, а также в медицинской и спортивно-медицинской практике без объяснения механизма действия. Возможно, анаболические функции L-карнитина осуществляются путем участия в метаболизме фосфолипидов за счет поддержания оптимального соотношения ацил-СоА/СоАSH. Действительно, оборот и восстановление жирно-кислотного состава фосфолипидов мембраны зависит от доступности ДЦАСоА. В этом отношении роль L-карнитина и КПТ двойная: снабжение ацильными остатками без расхода АТР и поддержка клеточного уровня СоАSH на необходимом уровне [15].
5. Защитное действие при апоптозе. Участие L-карнитина как в энергетическом метаболизме, так и в обороте фосфолипидов указывает на важнейшую роль этого соединения в поддержании жизнеспособности клетки. В ряде исследований было установлено, что L-карнитин в различных биологических системах оказывает защитное действие при апоптозе. В этот процесс включены различные группы веществ, в частности церамиды – мощные эндогенные промоторы клеточного апоптоза и аспартатспецифические цистеиновые протеазы, называемые каспазами, являющиеся ключевыми медиаторами апоптоза. Протективные свойства L-карнитина при апоп-тозе обусловлены как ингибированием синтеза церамидов [16], так и активности каспаз [17], и, вероятно, не связаны с функционированием карнитиновых трансфераз. Экспериментально было показано, что введение карнитина в кардиомиоциты, в которых апоптоз был вызван действием доксорубицина, снижает внутриклеточный уровень церамида [16,18]. Ингибирование L-карнитином образования церамидов происходит, по-видимому, в результате действия двух различных механизмов. Так, отвлечение пальмитоил-СоА от синтеза церамидов в окислительный метаболизм [19] усиливает ингибиторный эффект L-карнитина на кислую сфингомиелиназу, которая генерирует образование церамидов в ответ на множественные причины апоптоза [16]. Кроме того, показано, что L-карнитин ингибирует активность каспаз-3 и каспаз-8 [17].
6. Нейрозащитный эффект. Нейрозащитное действие L-карнитина было выявлено у крыс на модели митохондриальных нарушений, вызванных 3-нитропропионовой кислотой (3-НПК). Ранее было показано, что 3-НПК является мощным митохондриальным токсином, который вызывает снижение нейронального уровня АТР через ингибирование сукцинатдегидрогеназы комплекса II митохондриальной транспортной цепи электронов. Предварительный прием L-карнитина крысами полностью предотвращал снижение температуры мозга, вызванное введением 3-НПК. Защитный эффект L-карнитина, по-видимому, обусловлен его митохондриотропными свойствами [20].
В другой серии экспериментов было показано, что некоторые нарушения ЦНС, вызванные амфетамином и метамфетамином (МЕТ), связаны с повышением образования свободных радикалов. Это повышение может быть частично связано с митохондриальными дисфункциями, а, следовательно, приводить к недостаточности энергетического метаболизма в клетке и повышению вторичной эксцитотоксичности. Токсичность метамфетамина связана с повышением образования под его влиянием активных форм кислорода (гидроксил, супероксид, пероксид) и азота (NO). Наиболее опасным радикалом является пероксинитрит, который образуется из NO и включается в патогенез ряда заболеваний, в частности множественного склероза. Как было показано, токсическое действие метамфетамина приводит, как в опытах in vitro, так и in vivo, к образованию 3-нитротирозина – стресс маркера пероксинитрита. Предположили, что усиление митохондриального энергетического метаболизма, вызываемое L-карнитином, может предотвратить образование пероксинитрита и других свободных радикалов под действием метамфетамина. Действительно, установлено экспериментально, что прием L-карнитина заметно ослабляет образование 3-нитротирозина у экспериментальных животных, которым вводили метамфетамин [21]. Защитный эффект L-карнитина может быть связан с предотвращением нарушения метаболических процессов, вызванных метамфетамином и приводящих к дефициту энергии. Роль L-карнитина в снижении токсичности, вызываемой введением метамфетамина, продолжает изучаться, что дает надежду на возможность его использования в лечении ряда заболеваний нервной системы [22].
2. Изомеры карнитина
В организме человека, животных и различных биологических источниках присутствует L-изомер карнитина, который и участвует в метаболических реакциях в качестве субстрата карнитинзависимых ферментов. Благодаря наличию в структуре асимметрического атома углерода, молекула карнитина, подобно многим биологически активным веществам, может существовать в двух изомерных формах: L- и D-стереоизомеров. В природе D-изомер карнитина не обнаружен и может быть получен только в результате химического синтеза. Многочисленные исследования показали, что D-карнитин является биологически неактивной формой и негативно влияет на различные стороны обмена веществ. Он препятствует окислению жирных кислот в митохондриях и образованию энергии [23,24], конкурентно ингибирует активное усвоение L-карнитина органами и тканями [25,26], а также вызывает нарушение биосинтеза L-карнитина в печени [23]. Как показали специальные исследования, прием D-карнитина в течение двух дней приводит к значительному снижению содержания L-карнитина в печени, сердечной и скелетных мышцах и почках [23]. Также показано, что прием D-карнитина вызывает острую недостаточность L-карнитина в организме, особенно в сердечной и скелетных мышцах, что способствует миастении и сердечной аритмии. Поэтому концепция использования препаратов карнитина в качестве средства метаболической терапии относится к природному L-изомеру и в настоящем обзоре рассматриваются свойства только L-карнитина.
3. Потребность человека в L-карнитине и его недостаточность
Для человека установить пищевую потребность в L-карнитине (далее карнитин) достаточно сложно и в отличие от большинства известных витаминов не существует официально утвержденной рекомендуемой нормы его потребления. В норме биосинтез карнитина из предшественников у человека составляет от 0,16 до 0,48 мг/кг веса тела в день (не более 50 мг). Среднее его количество в нормированной пище, содержащей мясные продукты, составляет около 100–300 мг. При очень высоком содержании в дневном рационе мясных продуктов можно получить до 1 г карнитина в день. Учитывая его фактическое содержание в пищевых рационах и некоторые другие данные, ученые-диетологи в США пришли к заключению, что норма потребления карнитина должна составлять 20 мг на 1 кг массы тела (1–2 г/день для человека весом 50 и 100 кг соответственно). Приведенные нормы, естественно, дают ориентировочное представление о необходимых пределах поступления карнитина, обеспечивающих нормальное осуществление некоторых жизненных процессов, и имеют усредненный характер. Очевидно, что потребность в карнитине зависит от возраста человека и определяется его соматическим состоянием [27]. В ряде случаев потребность организма в нем существенно возрастает и может достигать 3 г в день (например, у женщин в период беременности и кормления, спортсменов, больных диабетом, у пациентов с болезнями сердца и почек). Использование карнитина в дозах более 50 мг/кг обычно осуществляется в терапии различных заболеваний.
Симптомы недостаточности карнитина разнообразны и неспецифичны. В настоящее время принято считать, что недостаточность карнитина – это метаболическое состояние, при котором его концентрация в плазме и тканях меньше того уровня, который необходим для нормального функционирования организма. Биологический эффект от низкого содержания карнитина может быть клинически незначимым, но только до тех пор пока он не достигнет величины менее 10– 20% от нормы. Содержание общего карнитина в плазме у здоровых людей составляет от 30 до 89 мкмоль/л (у мужчин 59,3 ± 11,9 мкмоль/л, у женщин 51,5 ± 11,6 мкмоль/л) и может быть довольно точно определено ферментативным методом [28].
Впервые карнитиновая недостаточность человека была обнаружена и описана в научной литературе только в 1973 г. у 19-летней девушки, страдавшей миопатией. С тех пор многочисленные исследования, проводимые за рубежом, а в последние годы также и в России, однозначно показывают существование фактической недостаточности карнитина, которая вызывается неполноценным питанием, нарушением его биосинтеза или всасывания, врожденными или приобретенными нарушениями обмена веществ, заболеваниями печени и почек [29,30]. Причиной карнитиновой недостаточности может быть также повышенная потеря карнитина в результате гемодиализа, длительного физического или нервно-психического напряжения, побочного действия различных лекарств. Некоторые больные не могут в полной мере синтезировать карнитин из-за нарушения ферментных систем его биосинтеза вследствие генетических дефектов, старения организма или различных патологических состояний. Известны случаи, когда достаточное количество карнитина циркулирует в кровяном русле, но не поступает в мышечные ткани.
Карнитиновая недостаточность (КН) разделяется на первичную и вторичную. Первичная КН наследуется по аутосомно-рецессивному типу. Вероятно, она связана с нарушением механизма транспорта карнитина из циркуляторной системы в клетки тканей и вызывается дефицитом в плазменной мембране Na+-зависимого белка-транспортера карнитина (OCTN2) [31]. При этом происходит выделением карнитина с мочой, вызывающее выраженное снижение его уровня в тканях. Внутриклеточная КН ослабляет вхождение длинноцепочечных жирных кислот в митохондриальный матрикс. Следовательно, они становятся недоступны для р-окисления и образования энергии, а также ослабляется образование кетоновых тел (которые используются мозгом). Нарушена также регуляция уровня внутримолекулярного свободного СоА с накоплением ацил-СоА в митохондриях. Это, в свою очередь, нарушает различные пути промежуточного обмена, для которых требуется СоА.
При КН нарушается работа трех основных систем организма: 1 - сердечной мышцы, повреждение которой приводит к кардиомиопатии (несомненно, наиболее общая форма описания болезни), 2 - центральной нервной системы, нарушение которой приводит к энцефалопатии, вызванной недостаточным образованием кетоновых тел (гипокетозная гипогликемия), и 3 - скелетных мышц, повреждение которых приводит к миопатии. Обычно в клинике выделяют мышечную и системную формы КН.
Мышечная КН (ограниченная мышцами) характеризуется снижением уровня карнитина в мышцах и обычно нормальным уровнем в плазме. Данные исследований указывают, что причиной этого является дефект в мышечном карнитиновом переносчике, что клинически характеризуется медленно прогрессирующей мышечной слабостью, гипотонией или атонией, атрофией. На поздних стадиях развивается сердечная недостаточность [32].
Системная КН характеризуется снижением уровня карнитина в плазме и тканях. Нарушен транспорт карнитина в скелетные мышцы, а возможно и в сердечную мышцу, фибробласты и почечные канальцы, что клинически проявляется тяжелой гипогликемией, печеночной энцефалопатией по типу синдрома Рейе, тяжелой кардиомиопатией [33].
Вторичная КН может быть врожденной и приобретенной, но в обоих случаях она характеризуется снижением биодоступности свободного карнитина. Врожденная КН вызывается различными метаболическими заболеваниями (например нарушением окисления жирных кислот или расщеплением аминокислот, вызывающих органические ацидурии). В этом случае снижение уровня карнитина может быть вторичным по отношению к образованию ацилкарнитиновых аддуктов и ингибированию карнитинового транспорта в почечных канальцах ацилкарнитинами [34].
При нарушениях окисления жирных кислот происходит чрезмерное накопление жиров в мышцах, сердце и печени с кардиальной или скелетной миопатией и гепатомегалией. При органической ацидурии (пропионовая, метилмалоновая, изовалериановая) возможно накопление ацилпроизводных СоА внутри митохондрий, что клинически выражается мышечной слабостью, дискоординацией, замедлением роста. Длинноцепочечные ацилкарнитины являются, как и ацил-СоА, токсичными соединениями и могут оказывать аритмогенный эффект, вызывающий внезапную остановку сердца.
Энцефалопатия может быть вызвана снижением доступности кетоновых тел, связанной с гипогликемией. Следует отметить дефицит карнитина у детей раннего возраста, особенно у недоношенных детей. Дети раннего возраста обладают недостаточной способностью накапливать карнитин и относительно неразвитой системой его биосинтеза и, в то же время, в этом возрасте жиры являются главным источником энергии для сердечной и скелетных мышц (в женском молоке до 40% общей калорийности приходится на жиры). В этом случае карнитин абсолютно необходим. Поэтому дети в значительной степени зависят от экзогенного снабжения карнитином и для достижения нормального уровня в плазме они должны получать с пищей относительно большое его количество [35].
В основе приобретенной вторичной КН лежит целый ряд причин: заболевания почек или печени, в которых осуществляется биосинтез карнитина, повышенное его выведение при гемодиализе, приеме некоторых лекарств, при метаболизме которых образуются органические кислоты, недостаточное поступление с пищей карнитина или аминокислот, необходимых для его образования (парентеральное или вегетарианское питание), повышенный расход карнитина (стресс, физические нагрузки, беременность, ишемические поражения, травма и т.д.).
Целый ряд лекарств по своей химической природе являются органическими кислотами или их производными и удаляются из организма в форме эфиров карнитина. Отмечено, что длительный прием препаратов вальпроевой кислоты, пивалоилсодержащих и антрациклиновых антибиотиков, сульфадиазина, ибупрофена и ряда других лекарств приводит к значительному снижению содержания карнитина в плазме крови и может вызывать приобретенный тип вторичной КН.
| Ноябрь 2010 г. |