АНАЛИЗ ЭФФЕКТИВНОСТИ КОМПЛЕКСНОЙ ТЕРАПИИ БОЛЬНЫХ С СИНДРОМОМ ДИСПЕПСИИ В СОЧЕТАНИИ С ОЖИРЕНИЕМ
М. М. Романова, кандидат медицинских наук
А. П. Бабкин, доктор медицинских наук, профессор
ГБОУ ВПО ВГМА им. Н. Н. Бурденко МЗ РФ, ВоронежКлючевые слова: синдром диспепсии, ожирение, таурин, вариабельность сердечного ритма, суточное мониторирование артериального давления.
В Политической декларации Совещания высокого уровня Генеральной Ассамблеи Организации Объединенных Наций по профилактике неинфекционных заболеваний и борьбе с ними от 19 сентября 2011 г. главы государств отметили, что растет «уровень ожирения в разных регионах, особенно среди детей и молодежи», что «ожирение, нездоровый режим питания и недостаток физической активности тесно связаны с четырьмя главными неинфекционными заболеваниями и сопровождаются увеличением расходов на поддержание здоровья и снижением производительности», а «глобальное бремя и угроза неинфекционных заболеваний — это один из основных вызовов развитию в XXI веке, который подрывает социально-экономическое развитие во всем мире и ставит под угрозу достижение согласованных на международном уровне целей в области развития» [1].
Одной из таких проблем является синдром диспепсии, который определяется в настоящее время как ощущение боли или дискомфорта (тяжесть, переполнение, раннее насыщение), локализованное в подложечной области ближе к срединной линии (Римские критерии III, 2006) [2-4].
По литературным данным, частота диспепсических жалоб среди населения развитых стран составляет 30-40%. В 40% случаев гастроэнтерологические консультации проводятся по поводу диспепсии, из них в 60% диагностируются различные варианты функциональной диспепсии. При этом лишь треть случаев обусловлена заболеваниями, относящимися к группе органической диспепсии. Диагноз синдрома функциональной диспепсии является диагнозом исключения. Преобладающее большинство случаев не имеет органической природы и обусловлено нарушением гастродуоденальной моторики. Несмотря на то, что к врачу обращается лишь каждый четвертый или пятый больной с синдромом диспепсии, столь высокая распространенность диспепсических расстройств среди населения определяет огромные расходы по обследованию и лечению таких пациентов, которые несет здравоохранение [3, 4].
Проблема поиска путей повышения эффективности терапии больных синдромом диспепсии, несмотря на определенный прогресс в клинических результатах и методических рекомендациях, по-прежнему весьма актуальна для практического здравоохранения, особенно с учетом того факта, что у ряда пациентов (до 50%) с синдромом диспепсии в качестве сопутствующей патологии выявляют избыточную массу тела и/или ожирение, метаболический синдром [5, 6]. В настоящее время не разработаны стандартизованные подходы к диетотерпии при синдроме диспепсии [7], а существующие рекомендации по лечению синдрома диспепсии не учитывают наличие коморбидной патологии [5, 8].
По этой причине актуальными являются исследования по повышению эффективности лечебных мероприятий с применением фармакологической коррекции при данной коморбидной патологии. Таурин является естественным продуктом обмена серосодержащих аминокислот: цистеина, цистеамина, метионина. Он обладает осморегуляторным и мембранопротекторным свойствами, положительно влияет на фосфолипидный состав мембран клеток, нормализует обмен ионов кальция и калия в клетках. У таурина выявлены свойства тормозного нейромедиатора, регулирующего высвобождение ряда биологически активных веществ и гомонов. Таурин оказывает антистрессорное действие, влияние на артериальное давление и метаболические процессы. Однако сведений об эффективности его применения в комплексной терапии синдрома диспепсии и коморбидного алиментарного ожирения в доступной литературе не найдено.
Целью настоящей работы была оценка эффективности комплексного лечения с применением таурина (Дибикор) и индивидуальной диетотерапии больных с синдромом диспепсии и коморбидным алиментарным ожирением.
Материалы и методы исследования
Под наблюдением находилось 86 больных (66 женщин и 20 мужчин) в возрасте от 20 до 60 лет (средний возраст 47,94 ± 4,9 года) с синдромом диспепсии и избыточной массой тела или ожирением. Критериями включения в исследование являлись: возраст от 20 до 60 лет; наличие синдрома диспепсии; отсутствие психических, инфекционных заболеваний и заболеваний в стадии декомпенсации. Все пациенты были разделены на две группы, рандомизированные по полу, возрасту, индексу массы тела (ИМТ): 1-я — контрольная (30 больных), получавшая стандартную терапию, 2-я — основная (56 пациентов), получавшая препарат таурина (Дибикор) в дозе 1 г в сутки в течение 2 месяцев и индивидуальную диетотерапию. Характеристика групп пациентов представлена в табл. 1.Таблица 1
Характеристика больных в группах
Показатель Контрольная группа (n = 30) Основная группа (n = 56) Возраст, лет 47,7 ± 2,7 48,18 ± 2,3 Кол-во мужчин, чел. (%) 10 (33,3) 10 (17,9) Кол-во женщин, чел. (%) 20 (66,6) 46 (82,1) ИМТ 30,2 ± 3,1 30,7 ± 3,8 Примечание: n — число пациентов в группе.Всем пациентам помимо общеклинического обследования, включающего клинические, биохимические и инструментальные методы, для верификации диагнозов синдрома диспепсии и метаболического синдрома до и после курса лечения проводились оценка пищевого статуса, качества жизни и др. исследования. Для оценки пищевого статуса применяли биоимпедансметрию с помощью аппаратно-программного комплекса «Диамант», для оценки качества жизни использовали опросник SF-36 (версия 1). Оценивались суточные биоритмы вегетативного баланса, артериальное давление (АД), проводилось электрокардиографическое исследование (ЭКГ) с применением суточного мониторирования вариабельности сердечного ритма, ЭКГ и АД с помощью прибора Cardio-Tens-01 (Meditech, Венгрия) с дальнейшим анализом результатов программой Medibase. Исследования проводились в соответствии с принципами Надлежащей клинической практики (Good Clinical Practice). Участники исследования были ознакомлены с целями и основными положениями исследования и подписали письменно оформленное согласие на участие. Локальный этический комитет одобрил протокол исследования. Полученные данные обрабатывали статистически с помощью программ Microsoft Excel 5.0 и Statistica 6.0 for Windows c применением пара- и непараметрических критериев. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным или меньше 0,05: * — p ≤ 0,05.
Результаты и их обсуждение
Согласно результатам комплексного обследовании, проводимого до и после курса терапии, у больных основной группы, получавших индивидуальную диетотерапию и таурин (Дибикор), в отличие от пациентов контрольной группы отмечались в ряде случаев достоверные (р = 0,05) позитивные изменения, в том числе ускорение сроков купирования клинических проявлений на 2,8 ± 0,42 дня.Динамика показателей пищевого статуса представлена в табл. 2. Обращает на себя внимание снижение жировой массы (ЖМ) с 32,1 ± 3,1% до 28,2 ± 2,7%, повышение активной клеточной массы (АКМ) с 43,8 ± 3,3% до 48,2 ± 4,2% по данным биоимпедансметрии, снижение объема талии (ОТ) с 89,8 ± 8,8 см до 85,9 ± 7,1 см, снижение ИМТ с 30,7 ± 3,8 до 27,8 ± 3,1 у пациентов основной группы, получавших таурин (Дибикор) в составе комплексной терапии.
Таблица 2
Динамика показателей пищевого статуса
Показатель
Контрольная группа
Основная группа
До лечения
После лечения
До лечения
После лечения
Вес, кг 92,8 ± 11,3 91,2 ± 9,2 94,6 ± 10,1 89,8 ± 9,0 ИМТ 30,2 ± 3,1 30,0 ± 3,2 30,7 ± 3,8 27,8 ± 3,1 ОТ, см 90,5 ± 8,4 90,1 ± 8,6 89,8 ± 8,8 85,9 ± 7,1 АКМ, % 43 ± 3,9 44,7 ± 4,1 43,8 ± 3,3 49,2 ±4,2* ЖМ, % 31,7 ± 3,2 30,8 ± 2,9 32,1 ± 3,1 28,2 ±2,7* Примечание: * p ≤ 0,05.После курса стандартной терапии у больных контрольной группы достоверных изменений липидного и углеводного статуса не отмечалось. После комплексного лечения с применением Дибикора и индивидуальной диетотерапии у больных основной группы наблюдалось снижение уровня глюкозы натощак (c 5,3 ± 0,3 ммоль/л до 4,7 ± 0,2 ммоль/л), уровня холестерина (5,97 ± 0,2 ммоль/л до 5,5 ± 0,1 ммоль/л) и коррекция липидограммы (уровень триглицеридов снизился с 2,5 ± 0,24 ммоль/л до 1,7 ± 0,12 (р ≤ 0,05) ммоль/л, липопротеинов высокой плотности — с 1,17 ± 0,12 ммоль/л до 1,22 ± 0,8 ммоль/л). Изменения уровня глюкозы натощак, коэффициента атерогенности (КА) и уровня триглицеридов носили статистически достоверный характер (р = 0,05) (табл. 3).
Таблица 3
Динамика показателей углеводного и липидного статуса
Показатель
Контрольная группа
Основная группа
До лечения После лечения До лечения После лечения Холестерин, ммоль/л 5,74 ± 0,2 5,67 ± 0,2 5,97 ± 0,2 5,4 ± 0,1 КА 2,4 ± 0,1 2,31 ± 0,2 2,67 ± 0,1 2,23 ± 0,1* Глюкоза натощак, ммоль/л 5,4 ± 0,4 5,2 ± 0,5 5,3 ± 0,3 4,7 ± 0,2* Иммунореактивный инсулин (ИРИ), мкМЕ/мл 7,9 ± 0,5 7,57 ± 0,3 7,88 ± 0,2 7,2 ± 0,2 Примечание: * p ≤ 0,05.При суточном мониторировании артериального давления (СМАД) в соответствии с международными и российскими рекомендациями [9, 10] за нормальный суточный ритм принимали значения степени ночного снижения АД, равные 10-20% («Dippers»), при снижении ночного АД < 10% — вариант «Non-dippers», > 20% — «Overdippers», < 0% — «Nightpeakers». При оценке динамики показателей суточного мониторирования артериального давления следует отметить, что в основной группе пациентов отмечалась также оптимизация показателей суточного мониторирования артериального давления за счет увеличения количества пациентов с ночным снижением АД «Dippers» с 33% до 45%, снижение количества «Non-dippers» с 50% до 40% (рис. 1 и 2).
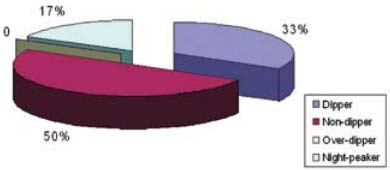
Рис. 1. Результаты СМАД в основной группе больных до лечения
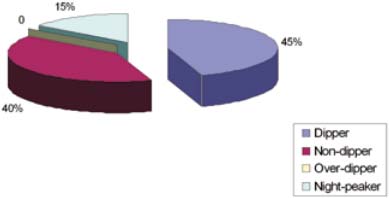
Рис. 2. Результаты СМАД в основной группе больных после леченияУ пациентов основной группы в отличие от пациентов контрольной группы наблюдалась также оптимизация вегетативного баланса по данным суточного мониторирования вариабельности сердечного ритма как по показателям временного (RMSSD, pNN50 и др.), так и спектрального анализа (TP, LF, HF и др.).
На рис. 3 представлена динамика показателя спектрального анализа вариабельности сердечного ритма — LF/HF как интегрального показателя вегетативного баланса, отражающего соотношение симпатических и парасимпатических влияний со стороны вегетативной нервной системы на ритм сердца. В основной группе пациентов, получавших таурин, в отличие от контрольной группы пациентов после лечения наблюдалась тенденция к снижению симпатических влияний (снижение LF/HF с 5,1 ± 0,7 до 3,92 ± 0,5).
Рис. 3. Динамика суточного мониторирования вариабельности сердечного ритма (по показателю спектрального анализа LF/HF)Полученные данные свидетельствуют о позитивном влиянии в комплексной терапии больных синдромом диспепсии с коморбидным ожирением таурина на пищевой статус, клинические проявления, вегетативный баланс, а также артериальное давление, углеводный и липидный обмен. Результаты проведенного исследования перекликаются и согласуются с данными других исследований по изучению влияния таурина на обменные процессы и артериальное давление, в том числе при наличии ожирения и метаболического синдрома [11-13]. Возможно, такие свойства таурина, как эффект тормозного нейромедиатора и регулятора высвобождения ряда биологически активных веществ и гормонов, а также антиоксидантное и антистрессорное действие, оказали позитивное влияние на клиническую симптоматику синдрома диспепсии и коморбидного ожирения. Необходимы дальнейшие научно-практические исследования в этом направлении.
Заключение
Таким образом, включение индивидуальной диетотерапии и таурина в комплексную терапию больных с синдромом диспепсии в сочетании с избыточной массой тела или ожирением приводит к ускорению купирования клинических симптомов, показателей углеводного и липидного обмена, артериального давления, вегетативного баланса, повышению качества жизни больных. Полученные данные следует учитывать при назначении комплексной терапии больным с синдромом диспепсии в сочетании с ожирением, необходимы дальнейшие исследования в этом направлении. Таурин (Дибикор), по нашему мнению, в перспективе, вероятно, можно будет рассматривать как один из препаратов выбора на этапах первичной и вторичной профилактики синдрома диспепсии, ожирения и метаболического синдрома.ЛИТЕРАТУРА
1. Политическая декларация Генеральной Ассамблеи по профилактике неинфекционных заболеваний и борьбе с ними, резолюция 66/2 Генеральной Ассамблеи от 19 сентября 2011 года.
2. Drossman D. A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. 2006; 130: 1377-1390.
3. Monnikes H., Schmidtmann M., Wisser A.-S. Functional dyspepsia — pathomechanisms, diagnostics, therapy and prospects // Future perspectives in gastroenterology/Eds.: Carey M. C., Dite P., Keim V., Mossner J. Springer. 2008: 47-60.
4. Шептулин А. А. Дифференциальный диагноз при синдроме диспепсии // Consilium medicum. 2002; 04; 9: 12-15.
5. Романова М. М., Бабкин А.П. Особенности психоэмоционального статуса, качества жизни и вегетативного баланса у больных метаболическим синдромом в сочетании с синдромом диспепсии // Российский кардиологический журнал. 2012; 4: 30-36.
6. Романова М. М., Бабкин А.П. Особенности аффективных расстройств и суточной вариабельности сердечного ритма у больных синдромом диспепсии в сочетании с ожирением // Системный анализ и управление в биомедицинских системах. 2007; 2: 462-466.
7. Романова М. М. Ретроспективный анализ организации лечебного питания: теоретические и практические аспекты // Системный анализ и управление в биомедицинских системах. 2010; 2: 401-409.
8. Романова М. М. Особенности пищевого статуса и пищевого поведения у больных с синдромом диспепсии в сочетании с метаболическим синдромом // Традиционная медицина. 2011; 5: 381-382.
9. Пшеницын А. И., Мазур Н. А. Суточное мониторирование артериального давления. М.: Медпрактика-М. 2007. 216 с.
10. European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension // J. Hypertension. 2003; 21: 1011-1053.
11. Casey R. G., Chen G., Joyce M., Kelly C. J., Bouchier-Hayes D. J. Taurine reduces high glucose induced leukocyte-endothelial interactions via down-regulation of ICAM-1 // J Anat. 2002, May; 200 (5): 525-526.
12. Nandhini T. A., Carani A. V. Inhibition of lipid peroxidation, protein glycation and elevation of membrane ion pump activity by taurine in RBC exposed to high glucose // Clin Chim Acta. 2003; Oct; 336 (1-2): 129-135.
13. Arany E., Strutt B., Romanus P., Remacle C., Reusens B., Hill D. J. Taurine supplement in early life altered islet morphology, decreased insulitis and delayed the onset of diabetes in non-obese diabetic mice // Diabetologia. 2004; 47: 1831-1837.
| Январь 2014 г. |