Опубликовано в журнале:
«ФАРМАТЕКА», 2009, № 15, с. 81-85ВОЗМОЖНОСТИ КОРРЕКЦИИ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА И СУТОЧНОГО ПРОФИЛЯ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ И МЕТАБОЛИЧЕСКИМ СИНДРОМОМ
А.С. Адамчик, И.В. Крючкова
Кафедра пропедевтики внутренних болезней Кубанского государственного медицинского университета, Краснодар
Представлены результаты исследования по оценке влияния препарата Дибикор (таурин) на углеводный обмен, инсулинорезистентность (ИР) и параметры суточного мониторирования артериального давления (СМАД) у пациентов с метаболическим синдромом (МС) и хронической сердечной недостаточностью (ХСН). В исследование были включены 65 человек в возрасте 31–66 лет. В основной группе к терапии эналаприлом и индапамидом был добавлен Дибикор. На фоне приема Дибикора отмечено преобладание положительной динамики по показателям антропометрии, углеводного обмена, ИР и СМАД. Таким образом, применение Дибикора при лечении больных МС и ХСН значительно улучшает их углеводный статус, снижает степень выраженности ИР, способствует более эффективной коррекции имеющихся нарушений суточного АД.
Ключевые слова: метаболический синдром, хроническая сердечная недостаточность, инсулинорезистентность, суточное мониторирование артериального давления, таурин (Дибикор)
На современном этапе развития общества значительно возросла распространенность сердечно-сосудистых заболеваний (ССЗ) и как следствие этого отмечается высокая инвалидизация и смертность населения [1]. На протяжении ХХ в. постепенно формировалась новая теория, в основе которой лежит патогенетическая взаимосвязь таких общепринятых факторов риска ССЗ, как ожирение, артериальная гипертензия (АГ), нарушение липидного и углеводного обменов [2]. B 1988 г. американский ученый Reaven G. выдвинул теорию, сформировавшуюся в понятие “метаболический синдром” (МС), согласно которой в качестве основного патогенетического звена метаболических нарушений выступает инсулинорезистентность (ИР) [3, 4].
Под ИР понимают нарушение инсулин-опосредованной утилизации глюкозы в трех органах (скелетных мышцах, жировой ткани и печени), в которых патофизиологические изменения зависят от механизма действия инсулина. Снижение чувствительности периферических тканей и печени к инсулину приводит к усиленной секреции инсулина из β-клеток поджелудочной железы; возникает компенсаторная гиперинсулинемия, что в свою очередь способствует активации симпато-адреналовой (САС), ренин-ангиотензин-альдостероновой систем (РААС), нарушению липидного обмена, системы гемостаза, хроническому воспалению и дисфункции эндотелия. По принципу обратной связи эти изменения способствуют усилению ИР, которая является самостоятельным фактором риска ССЗ [4, 5]. Риск развития осложнений кардиоваскулярных заболеваний у пациентов с МС возрастает в 3–4 раза [6]. В связи с этим поиск лекарственных средств, оказывающих положительное влияние на метаболические процессы у пациентов с АГ, на современном этапе остается актуальным.
Одним из таких препаратов является Дибикор (таурин), являющийся природным блокатором кальциевых каналов, мембраностабилизатором, антиоксидантом, осморегулятором. Дибикор также обладает свойствами нейромодулятора и блокатора САС и РААС [7–13].
Целью исследования являлась оценка влияния препарата Дибикор на состояние углеводного обмена, ИР и параметры суточного мониторирования артериального давления (СМАД) у больных МС.
Материал и методы
На условиях добровольного информированного согласия в исследование были включены 65 человек с МС в возрасте 31–66 лет (средний возраст составлял 48,5 года), в т. ч. мужчин 21,7 %, женщин 78,3 %.
Критерии включения в исследование:
- хроническая сердечная недостаточность (ХСН) I–III функциональных классов (ФК)
- АГII стадии.
Критерии исключения:
- ишемическая болезнь сердца;
- острое нарушение мозгового кровообращения;
- острый и перенесенный инфаркт миокарда;
- симптоматические АГ;
- сахарный диабет (СД) типов 1 и 2
Наличие МС определяли на основании классификации АТР III (Adult Treatment Panelm III, 2001) [14, 15] и IDF (International Diabetes Federation, 2005). Диагностика нарушений углеводного обмена проводилась согласно классификации ВОЗ (1999). Наличие ХСН выявляли, пользуясь Российскими национальными рекомендациями ВНОК и ОССН (2007) и классификацией, предложенной ОССН (Обществом специалистов по сердечной недостаточности) и утвержденной Российским съездом кардиологов в 2003 г. [16, 17]. Степень ожирения определялась по индексу массы тела (ИМТ) по ВОЗ (1997):
- нормальная масса – 18–24,9 кг/м2;
- избыточная масса – 25–29,9 кг/м2;
- ожирение I степени – 30-34,9 кг/м2;
- ожирение II степени - 35-39,9 кг/м2;
- ожирение III степени - 40 кг/м2 и выше.
Пациенты были разделены методом последовательных номеров на две группы (32 человека в основной и 33 -в контрольной), сопоставимые по полу и возрасту. Всем пациентам с первого дня лечения были даны рекомендации по диете и дозированной физической активности. В контрольной группе лечение проведено эналаприлом и индапамидом, а в основной группе к данной терапии был добавлен Дибикор. Лечение осуществляли в течение 12 месяцев.
Всем больным исходно и после лечения проведено антропометрическое обследование, офисное измерение АД, определение липидного и углеводного статуса и ИР. Состояние углеводного обмена оценивали с помощью орального теста толерантности к глюкозе с измерением уровня глюкозы плазмы крови натощак (ГПН) и через 2 часа после нагрузки глюкозой в дозе 75 г (Г2ПН), а также определения концентрации инсулина в крови натощак. Наличие ИР оценивали путем расчета индексов НОМА (Homeostasis Model Assessment) и Caro (> 2,27 и < 0,33 соответственно). Для изучения особенностей АГ у пациентов с МС, а также влияния проводимой терапии на уровень АД и его характеристики пациентам проведено СМАД. Эту методику использовали для определения и оценки среднесуточных, дневных и ночных показателей систолического (САД) и диастолического (ДАД) АД, вариабельности среднесуточного АД, индекса времени (ИВ) и степени ночного снижения АД. Степень ночного снижения АД (разница средних значений АД, рассчитанных за периоды бодрствования и сна, выраженная в процентах) оценивалась по суточному индексу (СИ).
По показателям СИ определяли суточный профиль АД:
- “dipper”– нормальная степень ночного снижения АД;
- “non-dipper” – недостаточная степень ночного снижения АД;
- “night-peaker” – устойчивое повышение ночного АД;
- “over-dipper” – повышенная степень ночного снижения АД.
Статистическая обработка результатов проведена с использованием непараметрических критериев Манна-Уитни и Т-критерия Уилкоксона.
Результаты и обсуждение
Основная и контрольная группы были сопоставимыми по клиническим и метаболическим показателям и достоверно не отличались друг от друга. Краткая характеристика пациентов приведена в табл. 1. Отмечена хорошая переносимость терапии в обеих группах.
Таблица 1. Клиническая характеристика пациентов, включенных в исследование (медиана, квартили)
Параметры Показатели Основная группа Контрольная группа ИМТ, кг/м2 32 (29,8–40,5) 32,2 (31,3–34,4) ОТ/ОБ 0,86 (0,83–0,97) 0,93 (0,85–0,98) САД, мм рт. ст. 160 (155,0–177,5) 158,5 (150–200) ДАД, мм рт.ст. 95,5 (90–98) 100 (95,8–101,0) ОХС, ммоль/л 6,27 (5,82–6,33) 5,25 (4,76–5,56) ТГ, ммоль/л 2,15 (1,88–2,25) 2,04 (1,66–2,65) ХС ЛПВП, ммоль/л 0,97 (0,87–1,15) 1,27 (0,91–1,35) ХС ЛПНП, ммоль/л 3,17 (2,53–3,30) 3,18 (2,39–3,94) Глюкоза натощак, ммоль/л 6,0 (5,6–6,3) 5,6 (4,9–7,0) ФК ХСН 2 (1,0–2,5) 2 (1,00–2,25)
Примечание. ОТ – объем талии, ОБ – объем бедер, ОХС – общий холестерин, ХС ЛПВП – холестерин липопротеидов высокой плотности, ХС ЛПНП – холестерин липопротеидов низкой плотности, ТГ – триглицериды.На фоне проводимой терапии в обеих группах наблюдалась достоверная положительная динамика всех антропометрических показателей (р < 0,05). Достоверное различие между основной и контрольной группами выявлено только по соотношению ОТ/ОБ (р = 0,014). С другой стороны, по некоторым показателям в основной группе имелась тенденция к более выраженной положительной динамике (табл. 2).
Таблица 2. Динамика антропометрических показателей в исследуемых группах (медиана, квартили)
Параметры Показатели Исходно Через 12 месяцев Δ, % основная группа контрольная группа основная группа контрольная группа основная группа контрольная группа Вес, кг 89 (84,8–106,0) 89 (86,5–99,0) 84 (79,8–100,0) 88,5 (84,8–96,5) -6,15 ** -1,12 ** ИМТ, кг/м2 32,04 (29,8–40,5) 32,17 (31,3,0–34,41) 30,52 (28,96–36,4,0) 31,31 (30,7–33,5) -4,74 ** -2,68 ** ОТ, см 110,5 (102,3–124,5) 109 (105,3–114,0) 107,5 (100,3–121,0) 107,5 (99,5–109,5) -2,71 ** -1,38 ** ОБ, см 120,5 (108,8–140,0) 114 (110,5–117,5) 117,5 (108,0–137,5) 111,5 (109,5–114,5) -2,49 ** -2,19 ** ОТ/ОБ 0,92 (0,86–0,99) 0,97 (0,90–0,99) 0,89 (0,85–0,95)
(р = 0,014)0,96 (0,89–0,99) -3,26 * -1,03 *
* р < 0,05. ** р < 0,02 по сравнению с исходными данными, р – различие в сопоставлении с контрольной группой.Среди пациентов с МС, включенных в исследование, только 16,7 % не имели нарушений углеводного обмена. У остальных 83,3 % выявлены различные варианты нарушения углеводного статуса, в т. ч. у 16,7 % – повышение уровня ГПН с нормальными показателями постнагрузочной глюкозы, а у 66,6 % – нарушение толерантности к глюкозе, что более неблагоприятно с точки зрения прогноза в отношении развития сердечно-сосудистых осложнений.
В группе пациентов, принимавших Дибикор, в большей степени по сравнению с контрольной снизились показатели ГПН (р = 0,014) и Г2ПН (р = 0,044) на 8,1 против 4,8 % и на 7,6 против 1,8 % соответственно. Концентрация инсулина в крови на фоне применения Дибикора уменьшилась на 7,06 % (р < 0,02). При оценке изменений индексов НОМА и Carо можно отметить снижение выраженности ИР у пациентов в основной группе. Достоверным было различие с контрольной группой по индексу НОМА (р = 0,005; табл.3).
Таблица 3. Динамика показателей углеводного обмена (медиана, квартили)
Показатели Основная группа Контрольная группа исходно через 12 месяцев Δ, % исходно через 12 месяцев Δ, % ГПН, ммоль/л 6,2 (6,03–6,35) 5,7 (5,58–5,85) р = 0,014 -8,1 * 6,30 (5,70–7,05) 6,0 (5,7–6,2) -4,8 * Г2ПН, ммоль/л 8,05 (7,4–9,5) 7,45 (7,13–8,25) р = 0,044 -7,6 * 8,35 (7,25–9,65) 8,2 (7,5–9,5) -1,8 Инсулин, мкЕД/мл 16,29 (14,27–17,53) 15,14 (12,58–16,55) -7,1 * 16,00 (13,00–16,76) 16,42 (14,95–16,74) 2,6 * Индекс НОМА 4,54 (3,92–4,95) 3,69 (3,20–4,15) р = 0,005 -18,6 * 4,02 (3,67–4,96) 4,18 (4,02–4,47) 4,1 Индекс Caro 0,38 (0,35–0,43) 0,37 (0,34–0,42) -2,9 * 0,41 (0,34–0,48) 0,38 (0,33–0,42) -6,4 **
* р < 0,05. ** р ≤ 0,02 по сравнению с исходными данными, р – различия при сопоставлении с контрольной группой.Таким образом, на фоне приема Дибикора отмечено улучшение показателей углеводного обмена. Снижался уровень глюкозы плазмы натощак и после нагрузки, причем эффект в отношении последнего был особенно выраженным по сравнению с контрольной группой. Поскольку постпрандиальная гипергликемия является главной причиной истощения β-клеток и прогрессирования нарушений углеводного обмена, нормализация ее уровня под влиянием Дибикора способствует снижению риска развития СД и ССЗ. Достоверное снижение уровня инсулина и индекса НОМА, а также повышение индекса Caro свидетельствует об уменьшении ИР, которая является ключевым звеном в развитии всех проявлений МС. Такие изменения в углеводном обмене с более выраженной положительной динамикой в основной группе вероятнее всего могут быть связаны только с эффектами Дибикора. Полученные результаты могут служить основанием для применения Дибикора у пациентов с МС как с нарушениями углеводного обмена, так и в отсутствие таковых.
Показатели офисного измерения АД уменьшились по САД на 12,5 и 3,3 %, по ДАД – на 6,8 и 3 % в основной и контрольной группах соответственно.
С современных позиций СМАД является более информативной методикой оценки АГ, поскольку проводится в привычных для пациента условиях и исключает “гипертензию белого халата”, а также позволяет определить уровень АД в ночные и ранние утренние часы [18, 19]. При проведении анализа изменений показателей СМАД, отмечена положительная динамика в целом (табл. 4). Эффект от проведенной терапии в основной группе оказался более выраженным. Практически все показатели СМАД достоверно изменились. Наибольший процент изменения уровня среднего (Ср) АД отмечен по ночному САД (САДн) и дневному ДАД (ДАДдн) – уменьшение на 13,5 и 12,8 % соответственно. ИВ среднесуточных САД (СрСАДсут) и ДАД (СрДАДсут) достиг нормальных значений. Достоверные различия по отношению к контрольной группе выявлены по СрСАДсут, СрСАДдн и СрСАДн, СрДАДсут и СрДАДн. На фоне проведенной терапии отмечено изменение соотношений суточных профилей САД и ДАД в обеих группах с преобладанием положительной динамики в основной группе (рис. 1 и 2).
Таблица 4. Динамика показателей СМАД в основной и контрольной группах (медиана-квартили)
Параметры Показатели основная группа контрольная группа исходно через 12 месяцев Δ, % исходно через 12 месяцев Δ, % СИ САД, % 8,9 (4,5–14,5) 10,6 (7,9–14,2) 11,7 ** 9,8 (6,5–12,7) 10,2 (7,8–12,1) 4 СИ ДАД, % 10,4 (6,1–14,1) 12,1 (6,5–14,8) 16,8 9,51 (2,19–13,12) 10,65 (4,8–13,15) 12 Сутки
САД, мм рт. ст. 141 (136,9–164,1) 126,25 (121,4–131,0) -10,78 * 147,8 (143,0–158,8) 136,0 (130,0–139,6) -8 * ДАД, мм рт. ст. 90,5 (86,6–95,3) 81,0 (77,8–86,6) -10,5 * 94,3 (85,4–96,5) 92,3 (79,3–93,4) -2,1 * ИВ САД, % 41,1 (27,1–53) 20,6 (14,7–25,7) -49,9 * 38,0 (23,0–53,3) 26,3 (17,1–51,3) -30,8 ** ИВ ДАД, % 30,3 (25,6–39,4) 17,0 (14,4–21,3) -42,3 * 35,6 (26,9–48,6) 26,3 (19,4–31,4) -26,2 * ВСАД, мм рт. ст. 16,7 (15,5–21,3) 14,0 (13,78–15,50) -15,9 * 15,8 (15,4–17,6) 15,2 (13,9–17,5) -3,6 ВДАД, мм рт. ст. 14,3 (13,1–16,0) 12,1 (11,75–13,10) -15,4 * 12,8 (11,3–16,0) 12,71 (11,8–16,0) -0,3 День
САД, мм рт. ст. 145,5 (139,8–169,8) 135,5 (123,8–140,5) -6,9 * 151,0 (143,0–158,8) 143,0 (137,0–146,5) -5,3 * ДАД, мм рт. ст. 97,5 (89,3–100,3) 85,0 (82,0–92,5) -12,8 * 95,0 (85,8–99,3) 94,0 (83,5–99,3) -1,1 ** ИВ САД, % 39,5 (21,8–56,2) 21,7 (15,9–40,5) -45,1 * 41,6 (21,0–68,0) 32,2 (20,4–48,5) -22,6 ИВ ДАД, % 33,0 (22,2–38,3) 18,5 (16,7–24,3) -43,9 * 43,5 (33,4–55,2) 32,8 (21,9–45,1) -24,5 * ВСАД, мм рт. ст 16,5 (16,0–20,3) 15,0 (13,0–16,0) -9,1 * 16,0 (15,0–19,5) 16,0 (14,5–19,8) 0 ВДАД, мм рт. ст. 12,5 (11,0–17,0) 13,0 (12,0–14,3) -4,0 15,0 (12,6–18,5) 14,5 (12,0–20,2) -3,3 Ночь
САД, мм рт. ст. 140,5 (128,5–148,3) 121,0 (112,0–123,3) -13,5 * 140,5 (131,0–146,5) 129,5 (126,3–130,3) -7,8 * ДАД, мм рт. ст 86,0 (81,0–90,0) 76,0 (72,8–80,5) -11,6 * 88,0 (77,5–94,0) 83,0 (77,5–94,0) -5,7 * ИВ САД, % 20,0 (13,3–87,3) 12,5 (10,8–20,7) -37,5 ** 19,5 (14,8–38,8) 16,2 (12,0–24,3) -17,2 ИВ ДАД, % 21,0 (17,8–55,0) 15,0 (11,0–19,7) -28,7 * 24,0 (19,3–34,5) 17,4 (15,6–18,8) -27,5 ВСАД, мм рт. ст. 15,3 (14,25–19,00) 13,9 (11,2–15,0) -9,5 * 16,0 (13,3–17,0) 14,5 (11,8–15,8) -9,4 * ВДАД, мм рт. ст. 15,0 (11,8–16,3) 11,5 (10,0–14,6) -23,7 ** 11,0 (9,0–15,3) 11,0 (9,4–12,8) 0
Примечание. САД – среднее систолическое АД, ДАД – среднее диастолическое АД; ВСАД – вариабельность САД; ВДАД – вариабельность ДАД. * р < 0,01. ** р < 0,05 по сравнению с исходными данными.Рис. 1. Динамика типов суточных кривых по САД в основной и контрольной группах
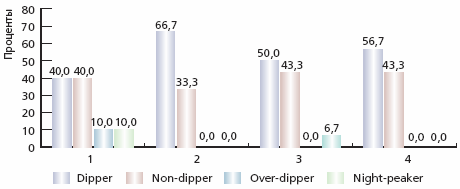
Примечание. 1 и 2 - основная группа исходно и через 12 месяцев от начала терапии соответственно, 3 и 4 - контрольная группа исходно и через 12 месяцев от начала терапии соответственноРис. 2. Динамика типов суточных кривых по ДАД в основной и контрольной группах
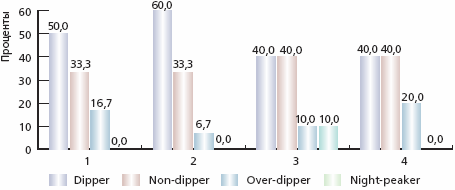
Примечание. 1 и 2 - основная группа исходно и через 12 месяцев от начала терапии соответственно, 3 и 4 - контрольная группа исходно и через 12 месяцев от начала терапии соответственноПоказатель СИ достоверно увеличился с преобладанием изменений в основной группе, что в целом улучшило суточный профиль АД; при этом возросло число пациентов, имевших кривую АД типа “dipper”.
Оказывая мембраностабилизирующее действие, таурин способствует повышению чувствительности инсулиновых рецепторов, что приводит к уменьшению гиперинсулинемии. Кроме того, таурин нормализует повышенный тонус симпатической нервной системы, являющийся одним из ведущих патогенетических звеньев стабилизации АГ на фоне ИР. Таурин препятствует развитию окислительного стресса в эндотелии сосудов; изменяя соотношение цитоплазматического и мембраносвязанного кальция, он нормализует трансмембранные ионообменные механизмы, что способствует восстановлению электролитного баланса в клетках [11]. Можно предположить, что, уменьшая количество рецепторов к ангиотензину II на мембранах эндотелиоцитов [20], таурин оказывает гипотензивный эффект, сходный с таковым у антагонистов рецепторов ангиотензина II.
Заключение
Применение Дибикора у больных МС и ХСН значительно улучшает их углеводный статус, уменьшая число пациентов с нарушенной толерантностью к глюкозе и повышенной ГПН.
На фоне приема Дибикора отмечается снижение степени выраженности ИР, являющейся ключевым звеном в развитии метаболических нарушений, АГ и нарушений углеводного обмена у пациентов с МС.
Снижение уровня средних значений САД и ДАД в течение суток и индекса времени САД и ДАД более выражено на фоне комбинированной терапии эналаприлом и индапамидом с включением Дибикора.
Применение Дибикора в составе комбинированной терапии эналаприлом с индапамидом более значительно улучшает суточный профиль АД.
Введение в комбинированную терапию эналаприлом и индапамидом препарата Дибикор при лечении больных АГ и МС способствует снижению риска развития СД и сердечно-сосудистых осложнений.
ЛИТЕРАТУРА
1. Беляков НА., Чубриева С.Ю. Метаболический синдром и атеросклероз // Медицинский академический журнал. 2007. № 7(1). С. 45-59.
2. Оганов Р., Мамедов М., Колтунов И. Метаболический синдром: путь от научной концепции до клинического диагноза // Врач. 2007. №3. С. 3-7.
3. Reaven G. Role of insulin resistance in human disease. Diabetes 1988;37:1595-607.
4. Небиеридзе Д.В., Оганов Р.Г. Метаболические и сосудистые эффекты антигипертензивной терапии. М., 2005. 104 с.
5. Standl E. Aetiology and consequences of the metabolic syndrome. Eur Heart J 2005; 7(D):10-13.
6. Isomaa B, et al. Botnia study. Diabetes Care 2005;683-89.
7. Торкунов П.А., Сапронов Н.С Кардио-протекторное действие таурина // Экспериментальная и клиническая фармакология. 1997. № 60(5). С. 72-77.
8. Bouckenooghe T. Is taurine a functional nutrient? Curr Opin Clin Nutr Metab Care 2006; 9(6):728-33.
9. Marcinkiewicz J. Anti-inflammatory effects of taurine derivatives (taurine chloramine, taurine bromamine, and taurolidine) are mediated by different mechanisms. Adv Exp Med Biol 2006;583:481–92.
10. Нефедов Л.И. Таурин. Гродно. 1999. 147 с.
11. Осадчий О.Е., Покровский В.М., Шейх-Заде Ю.Р. и др. Специфика вагусных влияний на ритм сердца при действии гуморальных регуляторов // Физиологический журнал им. И.М. Сеченова. 1992. Т. 78. № 10. С. 70–76.
12. Попович М.И., Кобец В.А., Капелько В.И. Поражение сердца, вызываемое норадреналином, и защитный эффект таурина // Физиологический журнал им. И.М. Сеченова.1990. Т. 36. № 6. С. 8-12.
13. Сапронов Н.С, Новиков В.П., Торкунов П.А. и др. Применение таурина для предупреждения изменений системной гемодинамики // Бюллетень экспериментальной биологии и медицины. 1999. Т. 127. №3. С. 282-284.
14. Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of Higt Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285(19):2486–97.
15. Мановицкая А.В. Эффекты Дибикора у больных с метаболическим синдромом // Качество жизни. Медицина. 2008. №3(26). С. 41-46.
16. Российские национальные Рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр). М., 2007. 76 с
17. Национальные рекомендации по диагностике и лечению ХСН (Утверждены съездом кардиологов РФ в октябре 2003 г.) // Сердечная недостаточность. 2003. № 4(6). С. 276-297.
18. Горбунов В.М. Некоторые вопросы практического использования суточного мониториро-вания артериального давления // Клиницист. 2008. №3. С. 30-39.
19. Чазова И.Е., Ратова Л.Г. Роль суточного мони-торирования артериального давления в оценке эффективности антигипертензивной терапии // Consilium medicum. Системные гипертензии. 2007. № 1. С. 18-26.
20. Li C, Cao L, Zend Q, et al. Taurine may prevent diabetic rats from developing cardiomyopathy also by downregulating angiotensin II type2 receptor expression. Cardiovasc Drugs Ther 2005;19(2):105–12.
| Август 2010 г. |