Опубликовано в журнале:
«Российский кардиологический журнал», № 2 (76), 2009, с. 38-42ВОЗМОЖНОСТИ КОРРЕКЦИИ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ
Крючкова И.В.*, Адамчик А.С.
Кубанский государственный медицинский университет, кафедра пропедевтики внутренних болезней, Краснодар
Резюме
Работа выполнена с целью оценки влияния препарата дибикор на углеводный обмен (УО), инсулинорезистентность (ИР) у больных с метаболическим синдромом (МС), выявление корреляционных взаимосвязей показателей УО, хронической сердечной недостаточностью (ХСН) и абдоминального ожирения (АО).
На условиях добровольного информированного согласия в исследование включено 60 человек в возрасте 31–66 лет, мужчин – 21,7%, женщин – 78,3%. Выделены 2 группы по 30 человек. В основной группе к терапии был добавлен дибикор. Всем проводилось антропометрическое обследование, измерение артериального давления, определение липидного и углеводного статуса и степень выраженности ИР.
На фоне приема дибикора через 12 месяцев отмечено улучшение показателей УО, уменьшение выраженности ИР. Выявлена выраженная положительная корреляция функционального класса (ФК) ХСН и степени нарушения УО; АО с уровнем глюкозы плазмы натощак и после нагрузки глюкозой.
Применение дибикора при МС и ХСН значительно улучшает углеводный статус, снижает степень выраженности ИР. Коррекция этих нарушений способствует снижению ФК ХСН.
Ключевые слова: метаболический синдром, хроническая сердечная недостаточность, углеводный обмен, инсулинорезистентность, дибикор.
Abstract
The study was focused on dibicor effects on carbohydrate metabolism (CM) and insulin resistance (IR) in patients with metabolic syndrome (MS), as well as the correlations between various CM parameters, chronic heart failure (CHF), and abdominal obesity (AO).
In total, 61 patients aged 31–66 years gave their informed consent to participate in the study, including 21,7% of men and 78,3% of women. The control group (n=30) received standard therapy only, while the main group (n=30) also received dibicor. All participants underwent anthropometry, blood pressure and IR measurement, lipid and carbohydrate metabolism assessment.
Twelve-month dibicor therapy was associated with improved CM and reduced IR. Functional class (FC) of CHF directly correlated with CM disturbance severity, while AO correlated with fasting and glucose tolerance test levels of plasma glucose.
In MS and CHF, dibicor improved CM, reduced IR, and therefore, facilitated the CHF FC reduction.
Key words: Metabolic syndrome, chronic heart failure, carbohydrate metabolism, insulin resistance, dibicor.
На современном этапе развития человечества среди всех причин смертности наиболее частой является смертность от сердечно-сосудистых заболеваний и осложнений. Это связано с изменением образа жизни людей под влиянием научно-технических достижений: снижение физической активности, увеличение калорийности продуктов питания, изменение режима питания, а также влияние хронических стрессов [1].
В последние годы большое значение придается своевременному выявлению и коррекции факторов риска. На основании масштабных клинических исследований выявлено более 200 факторов риска. Среди них наиболее значимыми считаются артериальная гипертония, дислипидемия, ожирение и сахарный диабет, которые, к тому же, имеют тенденцию к сочетанию [5,10].
Еще в конце прошлого столетия основными факторами риска сердечно-сосудистых заболеваний считались гиперхолестеринемия, курение и артериальная гипертензия (АГ). Но на протяжении ХХ века постепенно формировалась новая теория, в основе которой лежит патогенетическая взаимосвязь таких общепринятых факторов риска как ожирение, АГ, нарушение липидного и углеводного обменов, а также изменения в системе гемостаза [3]. Во второй половине прошлого столетия публиковались работы ведущих ученых из различных стран, мнения которых во многом были схожи. Однако Бантигская лекция американского ученого G.Reaven вошла в историю как рождение концепции о метаболическом синдроме (МС) [9]. Автор называет его синдром Х. Согласно теории G.Reaven инсулинорезистентность выступает в качестве основного патогенетического звена целого ряда метаболических нарушений. В 1988 году появился новый термин “метаболический синдром”. Сочетание метаболических нарушений вокруг инсулинорезистентности (ИР) приводит к ускоренному развитию атеросклероза.
В классическом варианте метаболический синдром представляет собой сочетание артериальной гипертонии, абдоминального ожирения (отложение жира в области живота), атерогенной дислипидемии (высокая концентрация триглицеридов (ТГ) и липопротеидов низкой плотности (ХС ЛПН) и низкий уровень холестерина липопротеидов высокой плотности (ХС ЛПВП)), нарушения толерантности к углеводам (преддиабет); часто метаболический синдром может проявляться и без нарушения толерантности к углеводам. Особое значение придается уровню глюкозы в плазме крови после приема пищи (постпрандиальная гипергликемия), представляющего самостоятельный фактор риска развития сердечно-сосудистых осложнений, мозговых инсультов и преждевременной смерти [2,7]. Крупное международное исследование UKPDS убедительно показало, что риск сердечно-сосудистых осложнений и преждевременной смерти значительно возрастает именно при высоком уровне постпрандиальной гликемии и в меньшей степени определяется уровнем глюкозы плазмы крови натощак [12]. Наряду с классическими компонентами при метаболическом синдроме выявляются “вторичные” признаки: хроническое субклиническое воспаление (увеличение уровня СРБ и др. воспалительных цитокинов), гиперурикемия (повышение концентрации мочевой кислоты в крови) и нарушение системы гемостаза (гиперкоагуляция за счет повышения уровня фибриногена и снижения фибринолитической активности крови).
Несмотря на то, что теория о МС претерпела определенные изменения, роль ИР в развитии цепи метаболических нарушений остается неоспоримой. Под ИР понимают нарушение инсулинопосредованной утилизации глюкозы в трех органах (скелетные мышцы, жировая ткань и печень), где патофизиологические изменения зависят от механизма действия инсулина в каждом конкретном случае. Снижение чувствительности периферических тканей и печени к инсулину приводит к усиленной секреции инсулина в бета-клетках поджелудочной железы; возникает компенсаторная гиперинсулинемия, что, в свою очередь, способствует активации симпато-адреналовой системы, ренин-ангиотензин-альдостероновой системы, нарушению липидного обмена, системы гемостаза, хроническому воспалению и дисфункции эндотелия. По принципу обратной связи эти изменения способствуют усилению ИР [11].
В 2005 году Международной федерацией диабета было дано новое определение МС, согласно которому он включает в себя абдоминальное ожирение (АО), ИР, гипергликемию, дислипидемию, АГ, нарушение системы гемостаза и хроническое субклиническое воспаление [3].
Риск развития сердечно-сосудистых заболеваний и их осложнений (инфаркт миокарда, инсульт) у больных с метаболическим синдромом в 3-4 раза выше, чем у лиц, страдающих одним из этих заболеваний – например, гипертонической болезнью или ожирением [8]. В частности, риск раннего развития ИБС у лиц, имеющих МС, увеличивается в 5 раз. В настоящее время распространенность МС приобретает характер эпидемии и выявляется в 10–30% случаев [3]. Поэтому сейчас активно исследуются и оцениваются различные схемы коррекции нарушений при МС и их влияние на метаболические процессы. Системная гиперинсулинемия на фоне абдоминального ожирения приводит к хронической гипергликемии, которая инициирует окислительный стресс, уменьшает активность антиоксидантной системы, активизирует протеинкиназу С. Учитывая вышесказанное, целесообразно и патогенетически обосновано включение в комплексную терапию МС препаратов с антиоксидантной активностью, одним из которых является дибикор (таурин).
Целью нашего исследования была оценка влияния препарата дибикор на состояние углеводного обмена, инсулинорезистентность у больных с МС и хронической сердечной недостаточностью (ХСН), выявление корреляционных взаимосвязей показателей углеводного обмена, ХСН и антропометрических данных.
Материал и методы
Нами обследовано 78 человек с метаболическим синдромом в возрасте 31–69 лет. Из них мужчин – 19 (24%), женщин – 59 (76%). На условиях добровольного информированного согласия в исследование было включено 60 человек в возрасте 31–66 лет (средний возраст составили 48,5 лет), мужчин было 13 (21,7%), женщин – 47 (78,3% ). Критериями, по которым проводился отбор пациентов, были: хроническая сердечная недостаточность (ХСН) I-III ФК, артериальная гипертензия 2 стадии и отсутствие сахарного диабета.
Критерии исключения из исследования: ишемическая болезнь сердца, острое нарушение мозгового кровообращения, острый и перенесенный инфаркт миокарда, симптоматические артериальные гипертензии, сахарный диабет.
Наличие МС определяли на основании классификации Adult Treatment Panelm III (АТР III), 2001 [6] и International Diabetes Federatio n (IDF), 2005. Диагностика нарушений углеводного обмена проводилась согласно классификации ВОЗ, 1999; ХСН выявляли согласно Российским национальным рекомендациям ВНОК и ОССН [4].
Пациенты были разделены на 2 группы по 30 человек, сопоставимых по полу и возрасту. Всем пациентам с первого дня лечения были даны рекомендации по диете и дозированной физической активности. В контрольной группе лечение проводилось эналаприлом и индапамидом, а в основной к данной терапии был добавлен дибикор.
Всем пациентам проводилось антропометрическое обследование, офисное измерение артериального давления, определение липидного и углеводного статуса исходно и через 12 месяцев после начала терапии. Состояние углеводного обмена оценивалось с помощью орального теста толерантности к глюкозе (ОТТГ) с измерением глюкозы плазмы крови натощак (ГПН) и через 2 часа после нагрузки 75 г глюкозы (Г2ПН), а также определения концентрации инсулина в крови натощак. Наличие инсулинорезистентности определялось путем расчета индексов НОМА и Caro (>2,27 и <0,33 соответственно). Для диагностики ФК ХСН использовался тест 6-минутной ходьбы. Из антропометрических показателей регистрировали вес, рост, индекс массы тела (ИМТ), окружность талии (ОТ), окружность бедер (ОБ), соотношение ОТ/ОБ.
Статистическая обработка результатов проводилась с использованием непараметрических критериев Манна-Уитни и Уилкоксона. Корреляционные связи оценивались по коэффициенту корреляции рангов Спирмена.
Результаты и обсуждение
На фоне проводимой терапии отмечено достоверное изменение антропометрических показателей в обеих группах (табл.1).
Таблица 1. Изменение показателей антропометрии в исследуемых группах
Критерии Исходно (медиана-квартили) Через 12 месяцев (медиана-квартили) Δ, % основная группа контрольная группа основная группа контрольная группа основная группа контрольная группа Вес, кг 99 (89,5–106) 92 (89–98,5) 94,42 (84–102,5) 90,25 (88,5– 95,75) -4,63* -1,9* ИМТ 35,9 (32,04– 40,46) 32,9 (32,17– 33,72) 34,29 (30,52– 37,33) 32,28 (31,31– 32,96) -4,71* -1,88* ОТ, см 106,33 (101,5–117) 104,5 (105,5– 108,25) 104,75 (99–113) 102,8 (103,5– 106,75) -1,49* -2,31* ОБ, см 126,42 (121,5–140) 114,67 (114,5–117,5) 123,75 (117,5–137,5) 112,92 (113– 115,25) -2,11* -1,53* ОТ/ОБ 0,84 (0,84– 0,88) 0,91 (0,92– 0,98) 0,85 (0,85– 0,88) 0,90 (0,92– 0,96) 0,79** -0,82**
Примечание: *р<0,01, **р≤0,05 по сравнению с исходными данными.В основной и контрольной группах отмечено снижение веса на 4,63% и 1,9%, а также ИМТ – на 4,71% и 1,88% соответственно. В исследуемых группах почти у всех пациентов сохранились признаки ожирения 1–2 степени, несмотря на 4%-ю разницу в динамике. Изменение ОТ, ОБ и соотношения ОТ/ОБ не носит закономерного характера, хотя и достоверно по сравнению с исходными данными, что может быть связано с влиянием немедикаментозных методов коррекции избыточного веса, а также особенностями телосложения пациентов.
При оценке взаимосвязи соотношения ОТ/ОБ, что является маркером абдоминального ожирения, с содержанием ГПН и Г2ПН выявлена положительная значимая корреляционная связь, более выраженная для ГПН (rs=0,65, rs=0,44 соответственно, trs=0,41). Следовательно, чем более выражено абдоминальное ожирение, тем выше вероятность нарушения углеводного обмена у пациентов.
При анализе результатов ОТТГ выявлено три варианта углеводного статуса у пациентов с МС: норма, нарушение глюкозы натощак (НГН) и нарушение толерантности к глюкозе (НТГ). Структура состояния углеводного обмена у всех пациентов, включенных в исследование, представлена на рис.1 и 2.
Рис.1. Структура углеводного статуса у пациентов, включенных в исследование.
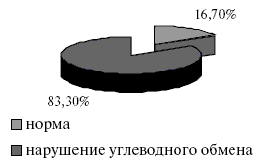
Рис.2. Структура нарушения углеводного обмена у пациентов, включенных в исследование.
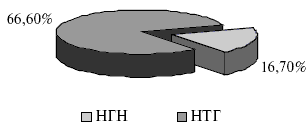
Среди пациентов с МС, включенных в исследование, только 16,7% не имели нарушений углеводного обмена. У остальных 83,3% выявлены различные варианты нарушения углеводного статуса, из которых 16,7% составило повышение уровня глюкозы плазмы натощак с нормальными показателями постнагрузочной глюкозы, а 66,6% -нарушение толерантности к глюкозе, что более неблагоприятно с точки зрения прогноза в отношении развития сердечно-сосудистых осложнений.
Структура углеводного статуса после распределения пациентов по группам представлена на рис.3 и 4.
Рис.3. Структура углеводного статуса у пациентов основной группы.
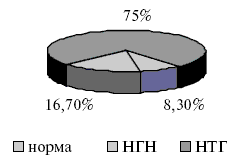
Рис.4. Структура углеводного статуса у пациентов контрольной группы.
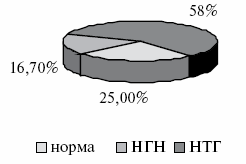
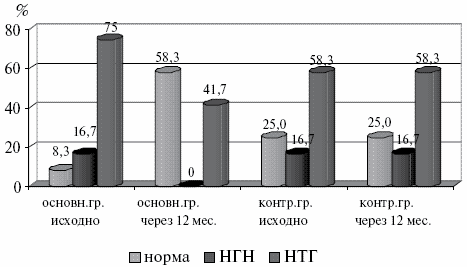
Через 12 месяцев после начала терапии с включением дибикора в основной группе изменилось соотношение вариантов состояния углеводного обмена. Уменьшилось количество пациентов с нарушением толерантности к глюкозе с 75% до 41,7%, а число пациентов с нормальным углеводным статусом возросло с 8,3% до 58,3%. При этом не выявилось ни одного процента НГН. В контрольной группе отсутствовала динамика в состоянии углеводного обмена. Динамика изменений углеводного обмена показана на рис.5.
Рис.5. Динамика углеводного обмена в основной и контрольных группах.
Проведя корреляционный анализ взаимосвязи ФК ХСН и степени нарушения углеводного обмена, выявили наличие выраженной положительной корреляционной зависимости (rs=0,98, trs=0,41). Существует также выраженная положительная корреляция между ФК ХСН и уровнем глюкозы плазмы натощак и постнагрузочной глюкозы плазмы (rs=0,88 и rs=0,91 соответственно, trs=0,41). Учитывая наличие таких взаимосвязей, коррекция углеводного обмена у пациентов с МС, по нашему мнению, будет способствовать уменьшению ФК ХСН на фоне основной терапии, что улучшит как объективное, так и субъективное состояние пациентов.
Для оценки наличия и изменения инсулинорезистентности у пациентов с МС и ХСН выявлялась динамика содержания инсулина в плазме крови натощак и индексов инсулинорезистентности НОМА и Caro. В основной группе отмечено достоверное (р<0,01) снижение уровня инсулина и индекса НОМА в сочетании с недостоверным (р> 0,05) повышением индекса Caro. При оценке этих же показателей в контрольной группе обнаружено снижение обоих индексов инсулинорезистентности, причем изменение индекса Caro достоверно (р<0,01). Уровень инсулина в крови повышается на 4,39%, хотя это изменение недостоверно. Динамика вышеупомянутых показателей представлена в табл.2.
Таблица 2. Динамика показателей углеводного обмена и инсулинорезистентности
Критерии Исходно (медиана-квартили) Через 12 месяцев (медиана-квартили) Δ, % основная группа контрольная группа основная группа контрольная группа основная группа контрольная группа ГПН, ммоль/л 5,73 (5,55– 7,0) 6,13 (6,0–6,3) 5,4 (5,25–6,0) 5,67 (5,7– 5,83) -5,81** -7,48* Г2ПН, ммоль/л 8,41 (8,05– 9,5) 8,34 (8,35– 9,23) 7,83 (7,45– 8,25) 8,36 (8,2–9,2) -6,84* 0,2** Инсулин, мкЕд/мл 16,07 (16,29– 17,53) 15,25 (16,0– 16,86) 14,78 (15,14– 16,55) 15,92 (16,42– 16,88) -8,06** 4,39*** НОМА 4,21 (3,81– 5,07) 4,15 (4,33– 4,64) 3,6 (3,81– 4,02) 4,02 (4,02– 4,35) -14,52** -2,91*** Caro 0,38 (0,39– 0,41) 0,41 (0,39– 0,43) 0,39 (0,37– 0,40) 0,36 (0,35– 0,38) 3,1*** -12,67*
Примечание: *р<0,01, **р≤0,05, ***р> 0,05 по сравнению с исходными данными.Таким образом, на фоне приема дибикора отмечено улучшение показателей углеводного обмена. Снижается уровень глюкозы плазмы как натощак, так и постпрандиальной, в особенности по сравнению с контрольной группой. Поскольку постпрандиальная гипергликемия является главной причиной истощения β-клеток и прогрессирования нарушений углеводного обмена, нормализация ее уровня под влиянием дибикора способствует снижению риска развития сахарного диабета и сердечно-сосудистых осложнений. Достоверное снижение уровня инсулина и индекса НОМА, а также повышение индекса Caro свидетельствует об уменьшении инсулинорезистентности, которая является ключевым звеном в развитии всех проявлений МС. В контрольной группе при снижении уровня глюкозы плазмы натощак отсутствует положительная динамика, более того, отмечается некоторое повышение уровня инсулина в крови и значительное снижение индекса Caro.
Положительное действие дибикора на углеводный обмен у больных с МС может быть связано с его мембранопротективными и осморегуляторными свойствами, а также с нормализацией кальциевого и калиевого обменов в клетках, что повышает активность ферментов антиоксидантной защиты.
Анализ показателей индексов инсулинорезистентности у пациентов с МС позволил предположить, что индекс НОМА более точно выявляет наличие ИР у пациентов, имеющих различные нарушения углеводного обмена, а индекс Caro более чувствителен при наличии ИР, но при отсутствии изменений в углеводном статусе.
Выводы
1. Применение дибикора у пациентов с МС и ХСН значительно улучшает углеводный статус, уменьшая число больных с НТГ и повышенной ГПН, что способствует снижению риска развития сахарного диабета и сердечно-сосудистых осложнений.
2. На фоне приема дибикора отмечается снижение степени выраженности инсулинорезистентности, являющейся ключевым звеном в развитии метаболических нарушений, АГ и нарушения углеводного обмена у пациентов с МС.
3. Выраженная корреляционная взаимосвязь степени нарушения углеводного обмена, уровня ГПН и Г2ПН с ХСН позволяет считать, что коррекция этих нарушений будет способствовать снижению ФК ХСН.
ЛИТЕРАТУРА
1. Беляков Н.А., Чубриева СЮ. Метаболический синдром и атеросклероз.//Медицинский академический журнал. 2007. Т.7. № 1. С.45 – 59.
2. Маколкин В.И. Необходимость гликемического контроля при лечении метаболического синдрома.//Consilium medicum. 2007. Т.9. № 5. С.58 – 62.
3. Оганов Р., Мамедов М., Колтунов И. Метаболический синдром: путь от научной концепции до клинического диагноза. // Врач.2007. № 3. С. 3 – 7.
4. Российские национальные Рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр). Москва, 2007г.-76с.
5. Чибисов СМ., Рапопорт СИ., Колесников Д.Б. и др. Метаболический синдром: больше вопросов, чем ответов.// Клиническая медицина. 2008. № 6. С.30 – 35.
6. Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of Higt Blood Cholesterol in Adults (Adult Treatment Panel III)// JAMA 2001; 285 (19): 2486–97.
7. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: full text. Eur. Heart J. Supplements 2007, 9 (Suppl. C) ISSN 1520– 765X/.
8. Isomaa B et al. Botnia study // Diabetes Care. – 2005; 683–689.
9. Reaven G. Role of insulin resistance in human disease // Diabetes. – 1988; 37: 1595 – 1607.
10. Shen S.J., Todaro J.F., Niaura R. et al. Are metabolic risk factors one unified syndrome? Modeling the structure of the metabolic syndrome X // Am. J. Epidemiol. 2003; 157: 701 – 711.
11. Standl E. Aetiology and consequences of the metabolic syndrome // Eur. Heart J. – 2005; 7(D): 10 – 13.
12. UKPDS Prospective Diabetes Study Group. Effect of intensive blood-glucose control with metformin on complication in overweight patients in type 2 diabetes (UKPDS 34)//BMJ 1998; 317: 703–13.
| Август 2010 г. |