Опубликовано в: "Рациональная Фармакотерапия в Кардиологии" 2006г. ;№4 С. 47-52ОТ ИССЛЕДОВАНИЯ «НОРЕ» К ИССЛЕДОВАНИЮ ONTARGET: «НАДЕЖДА» ДОСТИЧЬ «ЦЕЛЬ» -УЛУЧШИТЬ ПРОГНОЗ У БОЛЬНЫХ ВЫСОКОГО РИСКА
Ю.М.Лопатин
Волгоградский государственный медицинский университет, Волгоградский областной кардиологический центрОт исследования HOPE к исследованию ONTARGET: «надежда» достичь «цель» - улучшить прогноз у больных высокого риска
Проанализированы результаты исследования НОРЕ. Отмечено, что назначение ингибитора ангиотензинпревращающего фермента (иАПФ) рамиприла больным высокого сердечно-сосудистого риска приводит к улучшению прогноза. Представлены цели и дизайн исследований ONTARGET/TRANSCEND. Обсуждаются перспективы совместного применения иАПФ и антагонистов рецепторов к ангиотензину II.
Ключевые слова: высокий сердечно-сосудистый риск, рамиприл, телмисартан, исследование НОРЕ, исследование ONTARGET
From HOPE trial to ONTARGET trial: the «hope» to reach the «target» - to improve prognosis in high risk patients
Yu.M. Lopatin
Volgograd medical state university, Volgograd regional cardiology centre
Results of HOPE trial are analyzed. It is noted, that treatment with angiotensine converting enzyme inhibitor (iACE) ramipril improves the prognosis in high risk cardio-vascular patients. The objectives and study design of ONTARGET/TRANSCEND trials are introduced. Perspectives of joint use of ACE inhibitor and antagonist of angiotensin II receptor are discussed.
Keywords: high cardio-vascular risk, ramipril, telmisartan, HOPE trial, ONTARGET trial
Rational Pharmacother. Cardiol. 2006; 4: 47-52
Co времен публикации результатов исследования HOPE (The Heart Outcomes Prevention Evaluation study) [1 ] возможность дальнейшего улучшения прогноза у больных с высоким риском сердечно-сосудистых осложнений (ССО) продолжает оставаться в центре внимания.
Цель исследования HOPE состояла в том, чтобы доказать, что включение ингибитора ангиотензинпревращающего фермента (иАПФ) рамиприла и/или витамина Ε в терапию больных высокого риска ССО без сердечной недостаточности (СН) или дисфункции миокарда левого желудочка (ЛЖ) снизит сердечно-сосудистую заболеваемость и смертность. В двойное слепое, плацебоконтролируемое рандомизированное клиническое испытание (РКИ) HOPE были включены 9 297 пациентов в возрасте ≥ 55 лет, имевших в анамнезе ИБС, перенесенный инсульт, атеросклероз периферических артерий, сахарный диабет (СД) в сочетании хотя бы еще с одним фактором риска (артериальная гипертония - АГ, повышенный уровень общего холестерина, липопротеидов низкой плотности или микроальбуминурия - МАУ). Критериями исключения из исследования служили СН, низкая фракция выброса ЛЖ, терапия иАПФ или витамином Е, неконтролируемая артериальная гипертония, нефропатия, инфаркт миокарда или инсульт в течение предыдущих 4 нед. После рандомизации лечение рамиприлом начинали с 2,5 мг 1 раз в сутки, через неделю суточную дозу препарата увеличивали до 5 мг, а через 3 нед - до 10 мг/сут. Витамин Ε назначали в дозе 400 ME. Контрольные осмотры осуществляли через 1 и 6 мес, а затем каждые 6 мес. Длительность терапии составила 5 лет.
В качестве первичной конечной точки была обозначена комбинация инфаркта миокарда (ИМ), инсульта или смерти от сердечно-сосудистой причины. При этом каждый из этих исходов анализировали отдельно. Вторичными и другими конечными точками были смерть от любых причин, случаи реваскуляризации миокарда, нестабильной стенокардии (включая госпитализации), СН (включая госпитализации), остановки сердца, а также новые случаи сахарного диабета и его осложнения.
Было установлено, что у больных с высоким риском сердечно-сосудистых осложнений прием иАПФ рамиприла приводил к снижению риска развития ИМ, инсульта или сердечно-сосудистой смерти на 22% (14,0% событий в группе рамиприла и 17,8% в группе плацебо; 95% доверительный интервал (ДИ) от 0,70 до 0,86; p<0.001) (рис. 1). Более того, по каждому анализируемому показателю (смерть от сердечно-сосудистых причин, инфаркт миокарда, инсульт) было продемонстрировано положительное действие рамиприла: снижение риска составило 26, 20 и 32% (для всех показателей по сравнению с плацебо, p<0,001). Риск смерти от всех причин при лечении рамиприлом снизился на 26% (95% ДИ 0,75-0,95, р=0,005).
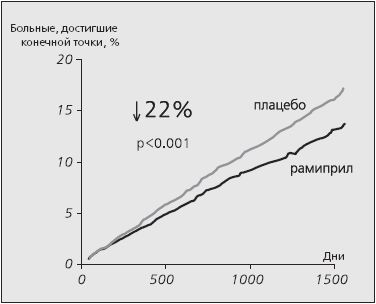
Рис. 1. Снижение риска развития первичной конечной точки (инфаркт миокарда, инсульт и смерть от сердечно-сосудистых причин) в исследовании НОРЕ
Следует отметить, что иАПФ рамиприл у больных с высоким риском ССО вызывал достоверное снижение потребности в процедурах по реваскуляризации миокарда (на 15%, p=0,002), частоты случаев остановки сердца (на 38%, p=0,02), прогрессирования стенокардии (на 11%, p=0,004), случаев развития СН (на 23%, p<0,001), но не госпитализаций по поводу данного состояния (на 12%, p=0,25), а также новых случаев СД (на 34%, p<0,001) и осложнений, связанных с СД (на 16%, p=0,03).
Примечательно, что благоприятный эффект рамиприла в отношении развития ИМ, инсульта или сердечно-сосудистой смерти был сопоставим в подгруппах больных СД и без него, мужчин и женщин, страдавших и не страдавших сердечно-сосудистыми заболеваниями, в возрасте моложе и старше 65 лет, страдавших и не страдавших АГ, с МАУ и без MAY Результаты лечения были сходными у пациентов, страдавших и не страдавших ИБС, перенесших и не перенесших ИМ, эффект лечения не зависел от сопутствующей терапии (аспирин и другие антитромбоцитарные средства, бета-блокаторы, гиполипидемические и антигипертензивные препараты).
Основными причинами прекращения лечения в группе больных высокого риска, принимавших рамиприл, стали кашель (7,3% против 1,8% в контроле), гипотония или головокружение (1,9% против 1,5% в контроле). В свою очередь, плацебо чаще отменяли вследствие неконтролируемой АГ (3,9% против 2,3% в группе рамиприла).
Отметим, что доля больных, продолжавших прием рамиприла в дозе 10 мг/сут, через 1 год составила 82,9%, через 2, 3 и 4 года - 74,6%, 70,9%, 62,4%, соответственно, а в конце исследования -65%. Значение дозы иАПФ рамиприла, равной 10 мг/сут для лечения больных с высоким риском ССО было продемонстрировано в ряде дополнительных исследований, выполненных в рамках РКИ НОРЕ.
Так, в исследовании SECURE (Study to Evaluate Carotid Ultrasound changes in patients treated with Ramipril and vitamin E) [2] были изучены антиатеросклеротические эффекты рамиприла. Исследование SECURE было рандомизированным двойным слепым в параллельных группах, по факторному протоколу 3x2 испытанием, в которое были включены 732 пациента старше 55 лет с высоким риском ССО (у 61 2 из них имела место ишемическая болезнь сердца (ИБС), АГ и гиперхолестеринемия - 36,1 и 46,7%, соответственно). После рандомизации больные принимали рамиприл в дозах 2,5 и 10 мг/сут или плацебо. Длительность наблюдения составила 4.5 года. При ультразвуковом исследовании сонных артерий осуществлялось измерение толщины слоя интима-медиа (ТИМ) в 1 2 сегментах (в области общей сонной артерии и бифуркации).
Было обнаружено, что при отсутствии достоверных различий в реакции артериального давления (АД) на прием 2,5 и 10 мг рамиприла в сутки (обе дозировки препарата обеспечивали достоверное по сравнению с плацебо снижение АД) только максимальная доза рамиприла вызывала значимое по сравнению с плацебо замедление прогрессирования толщины комплекса интима-медиа сонной артерии (рис. 2). Так, в группе плацебо прирост ТИМ сонной артерии составил 0,022 мм в год, а у пациентов с высоким риском сердечно-сосудистых осложнений, принимавших рамиприл в дозах 2,5 и 10 мг/сут -0,018 мм в год (н.д.) и 0,014 мм в год (на 37% по сравнению с плацебо, p=0,028) соответственно.
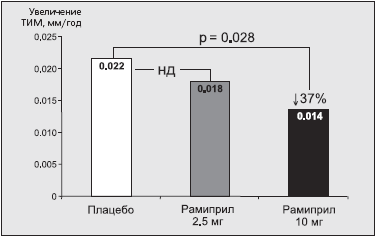
Рис. 2. Дозозависимое влияние рамиприла на атеросклероз сонных артерий в исследовании SECURE
Нельзя не отметить тот факт, что антиатеросклеротическому эффекту рамиприла, наблюдаемому при приеме 10 мг препарата, соответствовали наименьшие значения первичной конечной точки, принятой в исследовании HOPE (инфаркт миокарда+инсульт+ смерть от сердечно-сосудистых причин): 16,8% в группе плацебо против 13,9 и 1 2,7% в группах больных, принимавших рамиприл в дозах 2,5 и 10 мг/сут.
Следует заметить, что дозозависимое влияние рамиприла проявлялось не только в его антиатеросклеротическом действии, но и позитивном влиянии препарата на процессы ремоделирования левого желудочка. E.M.Lonn и соавт. [3] проанализировали влияние рамиприла на массу ЛЖ, толщину межжелудочковой перегородки и задней стенки ЛЖ, фракцию выброса ЛЖ, а также конечно-диастолический и конечно-систолический объемы ЛЖ. Изменения большинства изучаемых параметров были достоверны в случаях, если пациенты с высоким риском сердечно-сосудистых осложнений принимали рамиприл в суточной дозе 10 мг. Динамика изменений конечно-диастолического и конечно-систолического объемов (АКДО, АКСО) ЛЖ в процессе терапии рамиприлом приведена на рис. 3.
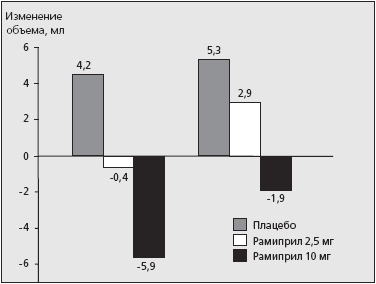
Рис. 3. Дозозависимое влияние рамиприла на ремоделирование левого желудочка у больных высокого риска сердечно-сосудистых осложнений.
Вслед за исследованием НОРЕ [1] проведен ряд РКИ [4-6], в которых изучалась эффективность иАПФ при стабильной ИБС (напомним, что указания на ИБС в анамнезе в исследовании HOPE имели место у 79,5% пациентов, принимавших рамиприл, и у 81,4% больных, получавших плацебо). При этом исследование HOPE стало тем РКИ, с которым в последующем сравнивались другие исследования, а также явилось основой для формирования современных рекомендаций по лечению больных стабильной стенокардией иАПФ (наряду с исследованием EUROPA) [7,8].
Необходимо подчеркнуть, что не во всех РКИ, посвященных изучению эффективности иАПФ при ИБС были достоверные различия в пользу иАПФ. Для объяснения полученных различий в эффективности действия препаратов приводят различия в выборе доз применяемых иАПФ. В исследованиях с положительным результатом они были высокими - 10 мг рамиприла и 8 мг периндоприла. Особенно часто различия в эффективности иАПФ связывают с базисной терапией после рандомизации больных ИБС (табл. 1). Последний аргумент (например, в отношении статинов) может быть принят лишь с учетом частоты назначения препаратов на протяжении всего исследования, а также частоты использования препаратов в реальной клинической практике на сегодняшний день (отметим, что результаты исследования HOPE были опубликованы еще в 2000 году !).
Таблица 1. Базисная медикаментозная терапия в исследованиях HOPE, EUROPA, PEACE, QUIET
* В конце исследования, t Через 3 года
Количество больных, получающих базисную терапию в различных исследованиях, % НОРЕ EUROPA PEACE QUIET Аспирин 76 92 91 73 Бета-блокаторы 40 62 62 26 Стати ны 29/49* 58/68| 70 0/14* Антагонисты Са 47 32 36 0/7* Диуретики 15 15 13 Последний общий анализ трех РКИ - НОРЕ, EUROPA и PEACE (опубликован в 2006 г), включивший в целом 29 805 больных, продемонстрировал достоверное по сравнению с плацебо снижение общей смертности (7,8 против 8,9%, p=0,0004), сердечно-сосудистой смертности (4,3 против 5,2%, p=0,0002), частоты развития нефатальных ИМ (5,3% против 6,4%, p=0,0001), инсультов (2,2% против 2,8%, p=0,0004), СН (2,1%, против 2,7%, p=0,0007) и потребности в коронарном шунтировании (6,0% против 6,9%, p=0,036) [9]. Было показано, что результаты назначения иАПФ у больных без СН сопоставимы с таковыми у пациентов с дисфункцией ЛЖ и СН. Поэтому основным выводом данного анализа стало утверждение авторов о необходимости назначения иАПФ всем больным с атеросклерозом.
Таким образом, начиная с исследования НОРЕ, появились убедительные доказательства способности иАПФ оказывать благоприятное действие у больных с высоким риском ССО. Однако можно ли добиться дальнейшего улучшения прогноза у данной категории пациентов путем применения других препаратов, действие которых также направлено на блокаду ренинангиотензинальдостероновой системы?
В 2007 г. ожидаются результаты 2 крупных исследований ONTARGET (the ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) и TRANSCEND (the Telmisartan Randomized AssessmeNt Study in aCE iNtolerant subjects with cardiovascular Disease) [10], которые должны определить перспективы применения антагонистов рецепторов к ангиотензину II (АРА) у больных с высоким риском ССО.
Целью ONTARGET является выявление дополнительных преимуществ совместного применения АРА телмисартана в дозе 80 мг/сут и рамиприла 10 мг/сут по сравнению с применением одного рамиприла в отношении снижения сердечно-сосудистой смертности, ИМ, инсультов или госпитализации по поводу СН. Кроме того, в цели исследования ONTARGET входит также доказательство гипотезы о том, что телмисартан в дозе 80 мг/сут так же эффективен, как и рамиприл 10 мг/сут. В свою очередь целью исследования TRANSCEND стало выявление преимуществ телмисартана в дозе 80 мг/сут по сравнению с плацебо у пациентов высокого риска ССО, которые не переносят терапию иАПФ. Основу программы составили позитивные результаты исследования НОРЕ [1], причем исследование ONTARGET стало самым крупным РКИ, в котором изучается эффективность АРА. В РКИ ONTARGET включено 23 400 больных с высоким риском ССО, а в исследование TRANSCEND - 5000 пациентов (в исследовании принимали участие 730 центров из 40 стран). Критерии включения в исследование ONTARGET соответствовали таковым в РКИ HOPE: возраст ≥ 55 лет с наличием в анамнезе ИБС, перенесенного инсульта в пределах > 7 дней и < 1 года, атеросклероза периферических артерий, СД, а также с такими признаками поражения органов-мишеней как МАУ, величина коленно-плечевого индекса < 0,8, гипертрофия ЛЖ, а также отсутствие противопоказаний к терапии АРА или ингибитором АПФ. Дизайн исследования ONTARGET приведен на рис. 4.
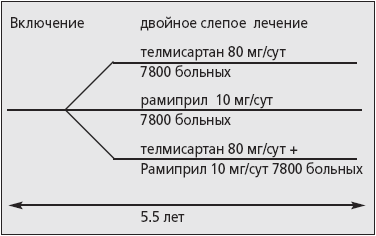
Рис. 4. Дизайн исследования ONTARGET.
В качестве первичной конечной точки обозначено сочетание сердечно-сосудистой смертности, инсульта, ИМ и госпитализации по поводу СН. Вторичными конечными точками стали новые случаи СН, реваскуляризации миокарда, СД, деменция, новые случаи фибрилляции предсердий, а также микроваскулярные осложнения СД.
Выбор рамиприла и телмисартана в исследовании ONTARGET оказался не случайным. С одной стороны, рамиприл явился не только одним из самых изученных препаратов данного класса в РКИ, но и уже доказал свою эффективность у больных с высоким риском ССО (исследование НОРЕ). С другой стороны, телмисартан эффективно блокирует рецепторы кангиотензину II 1 типа (AT·,) , имея наиболее высокий период полувыведения среди АРА, высокую способность проникать в ткани, медленно высвобождаясь из рецептора, при этом сохраняется действие на протяжении 24 ч после однократного приема препарата (включая ранние утренние часы) при его отличной переносимости [11, 12].
Исходные характеристики пациентов с высоким риском ССО, включенных в РКИ HOPE, ONTARGET и TRANSCEND, приведены в табл. 2.
Таблица 2. Исходные характеристики пациентов с высоким риском ССО при включении их в исследования HOPE, ONTARGET* и TRANSCEND*
* информация на 10 мая 2004 г.; ТИА - транзиторная ишемическая атака САД - систолическое АД ДАД - диастолическое АД ЧСС - частота сердечных сокращений
Показатель НОРЕ (n=9 541) ONTARGET (n=25 620) TRANSCEND (n=5 776) Возраст, лет 65,9 66,4 66,9 Мужчины, % 73,3 73,3 57,1 САД, мм рта. 139 143 142 ДАД, мм рт.ст 79 82 82 ЧСС, уд/мин 68,6 67,9 68,8 ИМ, в анамнезе % 52,8 48,7 46,2 Стабильная стенокардия, % 55,8 34,8 36,9 Реваскуляризация (в анамнезе), % 51,7 36,9 33,8 Мозговой инсульт/ТИА, % 10.8 20,7 22,1 Артериальная гипертония, % 46,5 68,3 75,9 Сахарный диабет, % 38,3 37,3 35,4 Аспирин, % 73,6 75,6 74,5 Бета-блокаторы, % 39,5 56,9 57,9 Стати ны, % 28,8 60,7 54,5 Антагонисты Са, % 47,6 33,5 41,1 Диуретики, % 15,1 27,9 32,9 В рамках программы ONTARGET выполняется ряд дополнительных исследований, в которых будет проведена фармакоэкономическая оценка терапии, изучение структуры и функции сердца с помощью магнитно-резонансной томографии, изучение артериальной жесткости, эректильной дисфункции и др. [10].
Почему результаты исследований ONTARGET и TRANSCEND ожидаются с таким нетерпением? Главную интригу составляет возможность получения дополнительного преимущества от совместного применения телмисартана и рамиприла по сравнению с применением одного рамиприла в отношении снижения риска неблагоприятных сердечно-сосудистых событий у пациентов, относящихся к категории высокого риска ССО. Теоретически такая комбинация оправдана, поскольку она позволяет сочетать преимущества каждого из препаратов (рис. 5).
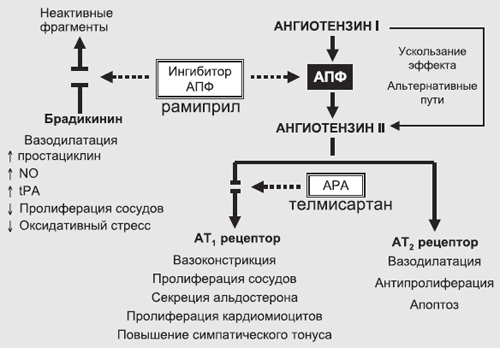
Рис. 5. Преимущество комбинации телмисартана и рамиприла
Действительно, телмисартан, обеспечивая блокаду рецепторов 1 типа к ангиотензину II, препятствует всем негативным эффектам ангиотензина II, которые опосредуются через этот тип рецептора (вазоконстрикция, антидиурез, пролиферация клеток и др.). С другой стороны, усиливается действие ангиотензина II на рецепторы 2-го типа (через которые, возможно, реализуются защитные вазодилатирующие и антипролиферативные свойства ангиотензина II). В свою очередь у АРА отсутствует влияние на калликреин-кининовую систему, усиление действия которой во многом объясняет позитивные эффекты иАПФ. Так, нарушение деградации брадикинина при назначении иАПФ способствует росту синтеза простациклина, оксида азота, тканевого активатора плазминогена tPA, обеспечивая дополнительный позитивный вклад рамиприла в комбинацию препаратов.
Помимо теоретических обоснований целесообразности сочетания 2 препаратов, в настоящее время в нашем распоряжении имеются результаты ряда РКИ, в которых иАПФ и АРА применялись совместно для лечения больных с хронической сердечной недостаточностью (ХСН). В качестве примера можно привести результаты исследований RESOLVD (The Randomized Evaluation of Strategies for Left Ventricular Dysfunction) [13] и CHARM-Added (The Candesartan in Heart Failure - Assessment of Reduction in Mortality and Morbidity) [14].
Так, в РКИ RESOLVD [13], явившемся первым исследованием, в котором изучались эффекты совместного применения иАПФ и АРА (n=768), было показано, что комбинация эналаприла и кандесартана в большей степени снижает АД, конечно-диастолический и конечно-систолический объемы ЛЖ, чем монотерапия, а тенденция к повышению фракции выброса ЛЖ была выражена сильнее (особенно у пациентов, получавших высокие дозы) по сравнению с группами больных ХСН, находящихся на монотерапии препаратами.
В исследовании CHARM-Added [14] установлено, что добавление АРА кандесартана в терапию больных ХСН (n=2 548, фракция выброса ЛЖ < 40%), уже находящихся на лечении оптимальными дозами
иАПФ, приводит к снижению каждого компонента первичной конечной точки: на 16% сердечно-сосудистой смертности и на 17% - госпитализаций по поводу СН по сравнению только с терапией иАПФ.
В заключение необходимо отметить, что пациенты с высоким риском ССО представляют собой тот контингент больных, с которым наиболее часто встречается практикующий врач. Улучшение прогноза у данной группы пациентов представляется актуальной задачей, поэтому результаты РКИ, посвященных возможности снижения риска ССО, имеют важное значение.
Литература
1.The Heart Outcomes Prevention Evaluation study Investigators. Effects of an angiotensin-convertingenzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N. Engl. J. Med. 2000; 342: 14Б-1БЗ.
2. Lonn Ε.Μ., Yusuf S., Dzavik V. et al. Effects of Ramipril and Vitamin Ε on Atherosclerosis : The Study to Evaluate Carotid Ultrasound Changes in Patients Treated With Ramipril and Vitamin E (SECURE). Circulation. 2001; 103: 919-92Б.
3.The EUropean trial on Reduction Of cardiacevents with Perindopril in patients with stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003; 362: 782-788.
4. Pitt В., O'Neill В., Feldman R. et al. The Quinapril Ischemic Event Trial (QUIET): evaluation of chronic ace inhibitor therapy in patients with ischemic heart disease and preserved left ventricular function. Am.J.Cardiol. 2001; 87: 1 0Б8-1 063.
5.The EUropean trial on Reduction Of cardiacevents with Perindopril in patients with stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003; 362: 782-788.
6.The PEACE Trial Investigators. Angoitensin-converting enzyme inhibition in stable coronary artery disease. N. Engl. J. Med. 2004; 351: 2058-2068.
7. Российские рекомендации по диагностике и лечению стабильной стенокардии. Приложение к журналу Кардиоваскулярная терапия и профилактика, 2004.
8.Guidelines on the management of stable angina pectoris: executive summary. The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur. Heart J. 2006; 27: 1341-1381.
9. Dagenais G.R., Pogue J., Fox K. Et al. Angiotensin-convertingenzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure: a combined analysis of three trials. Lancet. 2006; 368: Б81-Б88.
10. The ONTARGET/TRANSCEND Investigators. Rationale, design, and baseline characteristics of 2 large, simple, randomized trials evaluated telmisartan, ramipril, and their combination in high-risk patients: The Ongoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial/Telmisartan Randomized Assessment Study in ACE intolerant subjects with Cardiovascular Disease. Am. Heart J. 2004; 148: 52-61.
11. Neutel J.M., Smith D.H.G. Dose response and anti-hypertensiveefficacy of the AT1 receptor antagonist telmisartan in patients with mild to moderate hypertension. Adv. Ther. 1 998; 1 5: 206-21 7.
12. Wienen W, Entzeroth M., van Meel J.C.A. et al. A review on telmisartan: a novel, long-acting angiotensin II receptor antagonist. Cardiovasc. Drug Rev. 2000; 1 8: 1 27-1 56.
13. McKelvieR.S., Yusuf S., Pericak D. et al. Comparison of candesartan, enalapril, and their combination in congestive heart failure : randomized evaluation of strategies fro left ventricular dysfunction (RESOLVD) pilot study : the RESOLVD Pilot Study Investigators. Circulation. 1999; 100: 10Б6-1064. 14. McMurray J.J.V., Ostergrin J., Swedberg K. et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-convertingenzyme inhibitors: the CHARM-Added trial. Lancet. 2003; 362: 767-771.
| Октябрь 2007 г. |