Опубликовано в журнале:
«Современная терапия в психиатрии и неврологии», №3, 2012г.Изучение эффективности и безопасности Алзепила (донепезила) для лечения болезни Альцгеймера
на стадии мягкой и умеренно выраженной деменцииВ.А. Карпюк, С.Л. Дудук, Кафедра психиатрии и наркологии УО «Гродненский государственный медицинский университет», Гродно ,
И.А. Лелявко, УЗ ГОКЦ «Психиатрия и наркология», Гродно
И.В. Колыхалов, С.И. Гаврилова, ФГБУ «Научный центр психического здоровья» РАМН, МоскваКлиническое исследование эффективности и безопасности применения Алзепила проводилось как простое открытое на невыборочной группе из 33 пациентов с болезнью Альцгеймера (БА) на стадии мягкой и умеренно выраженной деменции, обратившихся за помощью в УЗ ГОКЦ «Психиатрия и наркология» и на кафедру психиатрии и наркологии Гродненского государственного медицинского университета. Возраст включенных в исследование больных колебался от 48 до 74 лет и в среднем составил 65,8 ± 5,8 лет.
Целью данного исследования являлось изучение клинической эффективности и безопасности применения Алзепила (компания Эгис) - дженерического препарата донепезила у пациентов с БА на стадии мягкой и умеренно выраженной деменции.
Все пациенты получали пероральную терапию Алзепилом один раз в сутки вечером после еды в течение первых четырех недель в дозе 5 мг, в дальнейшем - в дозе 10 мг. Курс лечения продолжался 12 недель.
Ни у одного больного не было серьезных нежелательных явлений, приведших к прекращению приема препарата.
Клиническая эффективность 12-недельного курса лечения Алзепилом установлена с помощью когнитивных шкал MMSE и ADAS-cog, шкалы повседневной активности больных DAD. В соответствии с общим клиническим впечатлением (шкала CIBIC-Plus) положительный эффект на момент завершения исследования был отмечен у 87,9 % от общего числа включенных в исследование больных, при этом у 45,5 % улучшение было оценено как умеренное и значительно выраженное. Полученные данные хорошо согласуются с предыдущим отечественным и международным опытом применения донепезила для лечения больных с БА на стадии мягкой и умеренно выраженной деменции. На основании полученных данных можно сделать заключение о том, что Алзепил является безопасным и эффективным средством лечения БА на стадии мягкой и умеренно выраженной деменции.
Ключевые слова: болезнь Альцгеймера, деменция, ингибиторы АХЭ, донепезил.
Study of the efficacy and safety of Alzepil (donepezil) for Alzheimer's disease (AD) at stage of mild and moderate dementia
V.A. Karpuk, S.L Duduk, LA. Lelyavko, I.V. Kolykhalov, S.L Gavrilova
Efficacy and safety of Alzepil (generic of donepezil, produced by Egis) were investigated in an open-label clinical study in a group of 33 AD patients with mild to moderate dementia stage at the Grodno medical center «Psychiatry and narcology» and at department of psychiatry and narcology of State Grodno Medical University. The age of patients enrolled ranged from 48 to 74 years, in average 65,8 ± 5,8 years. All patients received Alzepil once daily evenings after a meal. Dosage regimen 5 mg during the first 4 weeks, and further 10 mg. The treatment duration was 12 weeks. Serious side effects that led to discontinuation of treatment were not recorded. Clinical efficacy of 12 weeks course of Alzepil treatment was proved by the positive dynamic of MMSE, ADAS-cog and DAD assessments. According to overall clinical impression (CIBIC-Plus) effect to the end of the study was recorded in 87,9 % and in particular moderate and significant improvement - in 45,5 % of the total enrolled patients. The date obtained correlated well with the results of previous clinical trials of donepezil in patients with mild to moderate AD. So, based on the results of the present study we can conclude that Alzepil is safe and effective for treatment of AD patients at the stage of mild to moderate dementia.
Key words: Alzheimer's disease, dementia, inhibitors of AChE, donepezil, alzepil.
Болезнь Альцгеймера (БА) входит в первую тройку общественно значимых заболеваний XXI века. Ожидается, что число пациентов с деменцией в мире удвоится к 2020 г. и достигнет 40 млн, а к 2040 г. возрастет в четыре раза (до 80 млн) [3]. На основе экстраполяции половозрастных показателей, определенных для московского пожилого населения [2], на демографическую структуру России в целом было установлено, что общая численность больных, страдающих БА, должна составлять в России не менее 1,4 млн человек. Соответствующие повозрастные показатели болезненности для московской популяции составили 0,6 % (в возрастной группе 60-69 лет), 3,6 % (в возрасте 70-79 лет) и 15 % (в возрасте 80 лет и старше) [1].
За последние 30 лет во всем цивилизованном мире был существенно расширен круг эффективных медицинских услуг для пациентов с деменцией и лиц, ухаживающих за ними. Терапевтические возможности в лечении больных с прогрессирующими когнитивными расстройствами, в частности с БА, в последние десятилетия также значительно возросли. На основании данных об установленных нейрохимических нарушениях при БА, в основном связанных с дефицитом холинергической системы, для лечения БА были разработаны различные лекарственные препараты, в основном ингибиторы холинэстеразы (АХЭ).
Донепезил - производное пиперидина - является высоко специфичным обратимым ингибитором центральной АХЭ. Донепезил ингибирует этот фермент более чем в 1000 раз сильнее, чем бутирилхолинэсте-разу содержащуюся в основном вне ЦНС. Препарат обладает высокой биодоступностью (100 %). Пик его концентрации в плазме крови наступает через 3-4 часа после перорального приема. Период полувыведения составляет около 70 часов, что позволяет назначать препарат один раз в сутки - на ночь. Абсорбция препарата не зависит от приема пищи. Схема с одноразовым приемом ингибитора АХЭ по сравнению с двухразовой способствует большей приверженности терапии пациентов с БА, обеспечивая необходимый лечебный эффект и простоту применения, и позволяет снизить частоту нарушения режима на 10-20 %. Донепезил выводится в неизменном виде почками и метаболизируется цитохромом Р-450 в печени. Ввиду отсутствия гепатотоксичности применение препарата не требует проведения в процессе терапии исследований функций печени [13].
Минимальная длительность терапии составляет три месяца. Максимальная длительность в случае хорошей переносимости не ограничена и продолжается до тех пор, пока сохраняется клинический эффект.
Уже в первых клинических испытаниях были установлены дозозависимые эффекты донепезила и его хорошая переносимость.
Эффективность донепезила была подтверждена и в мультицентровом двойном слепом плацебо-контролируемом исследовании, проводившемся на протяжении 24 недель более чем у 900 больных с мягкой и умеренной БА [10]. Применение препарата достоверно улучшало когнитивные функции больных. На протяжении лечения состояние большинства (80 %) пациентов, получавших донепезил, улучшилось или осталось на исходном уровне. Аналогичный терапевтический эффект имел место только у 30 % больных из контрольной группы, получавших плацебо. Была установлена более высокая эффективность дозировки 10 мг/сут препарата по сравнению с 5 мг/сут. Исследователи отметили, что положительный эффект препарата по сравнению с плацебо сохранялся в течение шести недель после завершения приема донепезила.
Таблица 1.
Распределение больных по основным демографическим параметрам
Показатель Больные с мягкой деменцией Больные с умеренной деменцией Число больных, n 11 22 Средний возраст, Me [Q1; Q3] 64,0 [62; 69] 67,5 [65;70] Пол, n (%) мужской 6 (54,5) 9 (40,9) женский 5 (45,5) 13 (59,1) B. Winblad и соавт. [12] сравнили динамику когнитивного функционирования при долговременной (в течение 12 месяцев) терапии донепезилом у больных с мягкой и умеренной БА в плацебо-контролируемом исследовании. Был показан положительный эффект донепезила по сравнению с плацебо как в отношении улучшения общего состояния больных, так и по отношению к нарушению когнитивных функций.
K. Rockwood и соавт. [9], выполнившим мультицентровое 52-недельное открытое исследование у больных с мягкой-умеренной стадией БА, удалось определить актуальные мишени позитивного терапевтического действия донепезила в зависимости от оценки, данной врачом или опекуном больного. По оценке клинициста, терапевтическими мишенями донепезила являются:
Лица, ухаживающие за больными, оценили как терапевтические мишени:
- когнитивные функции (85 % из всех больных);
- функциональные возможности пациентов (68 %);
- поведенческие нарушения (57 %);
- социальное взаимодействие (52 %);
- досуг (20 %).
В другом 52-недельном плацебо-контролируемом исследовании донепезила [8], проведенном в группе из 431 пациента с умеренной БА, основные положительные эффекты донепезила проявились на начальных этапах исследования, а по мере течения времени исчезали. Тем не менее с использованием LOCF-анализа динамики общего среднего балла (по шкале MMSE) было показано, что к окончанию исследования нарастание когнитивного дефицита и тяжести деменции оказалось меньшим при применении донепезила по сравнению с плацебо. В группе больных, получавших донепезил, медиана времени до клинически значимого снижения была отсрочена на пять месяцев, а ухудшение когнитивного состояния у этих пациентов на 38 % было менее вероятно, чем в группе плацебо на протяжении года исследования.
- функциональную активность (86 %);
- познавательные функции (83 %);
- досуг (76 %);
- поведение (57 %);
- социальное взаимодействие (49 %).
Изучение эффективности и безопасности донепезила при лечения БА проводилось и в России [1]. Клиническая эффективность трехмесячного курса лечения донепезилом была установлена с помощью оценки динамики когнитивных функций больных по шкалам MMSE и ADAS-cog, а также на основании общего клинического впечатления об эффекте терапии по оценке врача и лица, ухаживающего за больным. На основании полученных данных авторы пришли к заключению, что донепезил является безопасным и эффективным средством лечения болезни Альцгеймера на стадии мягкой и умеренно выраженной деменции. Таким образом, полученные результаты хорошо согласуются с данными международных клинических исследований.
Целью настоящего исследования являлось изучение клинической эффективности и безопасности применения Алзепила (компания Эгис) - дженерическо-го препарата донепезила у пациентов с БА на стадии мягкой и умеренно выраженной деменции.
ПАЦИЕНТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническое исследование эффективности и безопасности применения Алзепила (донепезил) проводилось как простое открытое на невыборочной группе из 33 пациентов с БА на стадии мягкой и умеренно выраженной деменции, обратившихся за помощью в УЗ ГОКЦ «Психиатрия и наркология» и на кафедру психиатрии и наркологии Гродненского государственного медицинского университета. Возраст включенных в исследование больных колебался от 48 до 74 лет и в среднем составил 65,8 ± 5,8 лет.
В исследование включали больных, соответствовавших критериям диагностики деменции альцгеймеровского типа по DSM-IV и клиническому диагнозу «вероятной» болезни Альцгеймера по критериям NINCDS/ADRDA [6]. Состояние больных должно было соответствовать мягкой или умеренной стадии деменции или 4 и 5 стадии по шкале общего снижения когнитивного функционирования (GDS) и оценке по шкале MMSE в диапазоне от 13 до 24 баллов. Оценка по шкале Хачински не должна была превышать 4 баллов.
Из исследования исключались больные, имеющие:
В исследование также не включали больных, имевших оценку выше 18 по шкале Гамильтона для депрессии, артериальную гипертензию с уровнем систолического давления свыше 180 мм рт. ст., лиц, имеющих дефицит фолиевой кислоты и/или витамина В12, и пациентов, лечившихся психофармакологическими средствами в течение 30 дней, предшествовавших началу исследования.
- неврологические заболевания;
- врожденные и/или приобретенные метаболические энцефалопатии;
- токсические и лекарственные энцефалопатии;
- болезнь Паркинсона;
- мультиинфарктную деменцию;
- инсульт; эпилепсию;
- инфекционные заболевания;
- демиелинизирующие и наследственно-дегенеративные заболевания ЦНС;
- неопластические и/или травматические повреждения головного мозга; системные заболевания; психические болезни; тяжелую органную патологию;
- злокачественные опухоли;
- ВИЧ-инфекцию;
- сахарный диабет в стадии декомпенсации или другие эндокринные заболевания; алкоголизм и/или лекарственную зависимость; медикаментозную или иную интоксикацию.
Клиническое исследование выполнялось в соответствии с правилами GCP.
Психическое состояние 11 включенных в исследование пациентов соответствовало мягкой деменции, 22 - умеренной деменции по шкале GDS. Исследование начиналось с периода скрининга продолжительностью две недели. Курс лечения продолжался 12 недель. Препарат назначали один раз в сутки вечером после еды в течение первых четырех недель в дозе 5 мг, в дальнейшем - в дозе 10 мг.
Оценка эффектов препарата производилась до начала терапии, к окончанию 4-й и 12-й недель лечения. Для оценки терапевтической динамики когнитивного функционирования использовались краткая шкала оценки психического статуса (MMSE, Mini-Mental State Examination) [4] и шкала оценки когнитивных нарушений при болезни Альцгеймера (ADAS-Cog, Alzheimer’s Disease Assessment Scale) [7], оценка повседневной активности больных проводилась по шкале DAD (Disability Assessment for Dementia) [5].
Эффективность терапии также оценивалась через 4 и 12 недель лечения по показателям клинического интервью, основанного на общем впечатлении независимого рейтера о характере изменений состояния больных - CIBIC-Plus [11]. Статистический анализ данных проводился с применением пакета прикладных программ Statistica 6. Для описания выборочного распределения количественных признаков использовалась медиана (Ме) и верхний (Q1) и нижний квартили (Q3) (интерквартильный размах). Для сопоставления двух групп по количественным признакам использовались непараметрические методы статистического анализа - критерий Вилкоксона для связанных групп.
РЕЗУЛЬТАТЫ
В соответствии с общим клиническим впечатлением о характере изменений состояния больных (шкала CIBIC-Plus) положительный эффект на момент завершения исследования был отмечен у 87,9 % от общего числа включенных в исследование больных, при этом у 45,5 % улучшение было оценено как умеренное и значительно выраженное. У 9,1 % пациентов изменений состояния не наблюдалось, а у 3,0 % больных состояние ухудшилось (рис. 1).
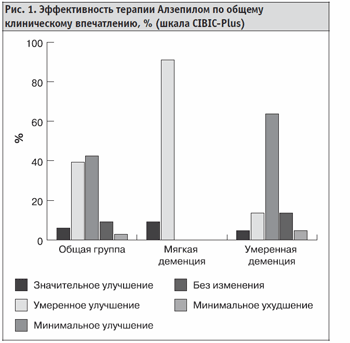
Улучшение в состоянии больных отмечалось как за счет улучшения когнитивного функционирования, так и улучшения повседневной активности. У всех пациентов с мягкой деменцией отмечалось значительное и умеренно выраженное улучшение состояния. На стадии умеренно выраженной деменции у большинства больных к окончанию исследования преобладало минимальное улучшение в состоянии (63,6 %). В общей группе больных достоверное улучшение средней суммарной оценки по шкале MMSE было установлено не только после завершения терапевтического курса, но и уже к окончанию четвертой недели лечения (рис. 2, табл. 2).

Таблица 2.
Терапевтическая динамика когнитивного функционирования (по шкалам MMSE и ADAS-cog) и повседневной активности (шкала DAD) в общей группе больных БА, Me [Q1; Q3]
Шкалы 0 день 4 неделя 12 неделя MMSE 15,0 [14; 20] 17,0 [15; 21]*,
P = 0,001817,0 [15; 21]*,
P = 0,000027ADAS-cog 37,0 [25; 40] 34,0 [23; 39]*,
P = 0,0005232,0 [22; 38]*,
P = 0,000003DAD (%) 62,0 [52; 68] 62,0 [55; 72],
P = 0,1824266,0 [57; 72]*,
P = 0,00883*В табл. 2-4 различия достоверны по сравнению с оценкой до начала терапии. К моменту завершения терапии достоверное улучшение показателей (по сравнению с исходной оценкой) установлено кроме того по следующим пунктам этой шкалы: «ориентировка во времени» и «ориентировка в месте». Достоверное улучшение средней суммарной оценки по шкале MMSE (по сравнению с исходными показателями) к окончанию терапии наблюдалось у больных как с мягкой, так и с умеренной деменцией (табл. 3, 4).
Таблица 3.
Терапевтическая динамика когнитивного функционирования (по шкалам MMSE и ADAS-cog) и повседневной активности (шкала DAD) у больных БА на стадии мягкой деменции, Me [Q1; Q3]
Шкалы 0 день 4 неделя 12 неделя MMSE 21,0 [20; 22] 22,0 [21; 23],
P = 0,1305722,0 [21; 23]*,
P = 0,0159ADAS-cog 24,0 [20; 26] 22,0 [20; 23],
P = 0,023320,0 [18; 22]*,
P = 0,00257DAD (%) 72,0 [66; 76] 72,0 [69; 79],
P = 0,0305776,0 [72; 83]*,
P = 0,00766Таблица 4.
Терапевтическая динамика когнитивного функционирования (по шкалам MMSE и ADAS-cog) и повседневной активности (шкала DAD) у больных БА на стадии умеренной деменции, Me [Q1; Q3]
Шкалы 0 день 4 неделя 12 неделя MMSE 14,0 [13; 15] 15,0 [14; 17]*,
P = 0,0010316,0 [14; 17]*,
P = 0,00138ADAS-cog 40,0 [37; 42] 36,5 [34; 40]*,
P = 0,015335,5 [32; 39]*,
P = 0,0008DAD (%) 52,0 [45; 62] 55,0 [48; 62]*,
P = 0,0032859,0 [52; 66]*,
P = 0,00006У больных с мягкой деменцией улучшение к окончанию терапии достигнуто по следующим пунктам шкалы MMSE: «ориентировка в месте» и «внимание и счет». Однако эти улучшения не достигли уровня достоверности, по-видимому из-за малого числа наблюдений. У больных с умеренно выраженной деменцией к окончанию терапии достоверно улучшились «ориентировка во времени» и «ориентировка в месте». За время лечения ухудшения показателей шкалы MMSE ни в одной из групп не было обнаружено.
Достоверное снижение показателей, оценивающих выраженность нарушений когнитивных функций (шкала ADAS-cog), к окончанию курса терапии отмечалось как в общей группе больных, так и в подгруппах больных с умеренной и мягкой деменцией (рис. 2, табл. 2-4). При сопоставлении ранних эффектов лечения Алзепилом (к окончанию четвертой недели) в зависимости от тяжести деменции установлено, что показатели шкалы ADAS-cog достоверно улучшались только у пациентов с умеренно выраженной деменцией. На момент завершения терапии в общей группе больные достоверное лучше выполняли копирование четырех геометрических фигур, ориентировались в месте и времени, а также лучше узнавали 12 ранее предъявленных слов. У больных БА с мягкой деменцией к окончанию терапии достоверно улучшалась только ориентировка в месте и времени и узнавание 12 слов, тогда как на стадии умеренной деменции, помимо достоверного улучшения ориентировки в месте и времени, достоверно улучшились оценки по тесту на отправление письма.
ОЦЕНКА ПОВСЕДНЕВНОГО ФУНКЦИОНИРОВАНИЯ ПАЦИЕНТОВ ПО ШКАЛЕ DAD
Шкала DAD включает в себя 40 пунктов, оценивающих навыки физического самообслуживания (прием пищи и лекарств, одевание, уход за собой), бытовой и социальной деятельности (работа по дому, приготовление еды, передвижение, распоряжение финансами и переписка). Показатель, характеризующий качество повседневной активности больных, достоверно улучшился к моменту окончания терапии (через 12 недель) по сравнению с исходной оценкой на 4 %.
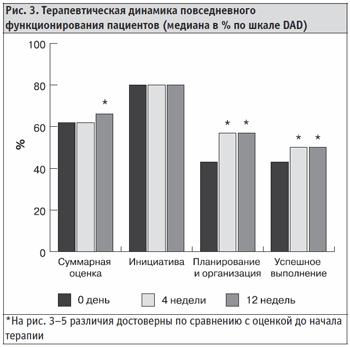
В общей группе больных достоверно улучшились также показатели, оценивающие планирование и организацию деятельности и успешность выполнения различных видов повседневной деятельности, причем эти показатели улучшились достоверно уже после четвертой недели терапии (рис. 3).
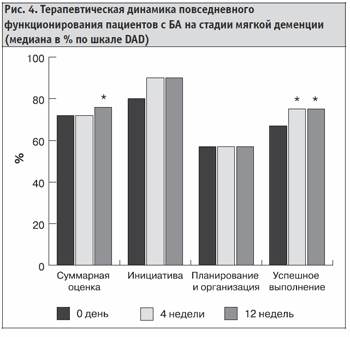
На стадии мягкой деменции по шкале DAD у пациентов к моменту окончания исследования достоверно улучшалась суммарная оценка и они достоверно успешнее начинали выполнять различные виды повседневной деятельности, причем достоверное улучшение наблюдалось уже с четвертой недели терапии (рис. 4).
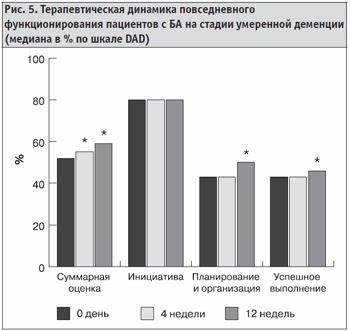
У пациентов с умеренной деменцией по шкале DAD к моменту окончания исследования достоверно улучшалась суммарная оценка, а также показатели, оценивающие планирование и организацию деятельности и успешность выполнения различных видов повседневной деятельности (рис. 5).
На протяжении всего курса лечения лица, ухаживающие за больными, отмечали улучшение у них таких видов повседневного функционирования, как заинтересованность больных в общении, умение пользоваться телефоном, бытовой техникой, поддержание контактов в обществе, сохранение или возобновление прежних увлечений (хобби).
Из 33 пролеченных больных ни в одном случае не было серьезных нежелательных явлений, приводивших к прекращению приема препарата. Как правило, нежелательные явления наблюдались в течение последнего месяца лечения. Наиболее частыми из них были головные боли на протяжении 1-2 дней (4 больных), тошнота (3 больных), два пациента перенесли ОРВИ. Кроме того, у одного больного отмечалось головокружение, у другого пациента - подъем АД до 170/100 мм рт. ст., которое было купировано приемом гипотензивных препаратов. Один больной на протяжении трех дней испытывал тахикардию, и еще одного больного на протяжении дня беспокоили боли в области сердца. В конце курса терапии (на 12-й неделе лечения) у одного пациента случилось обострение хронического бронхита, а у другого обострение хронического пиелонефрита.
На основании полученных данных можно сделать заключение о том, что Алзепил является безопасным и эффективным средством лечения БА на стадии мягкой и умеренно выраженной деменции. Клиническая эффективность 12-недельного курса лечения Алзепилом установлена с помощью когнитивных шкал MMSE и ADAS-cog, шкалы повседневной активности больных DAD, а также с помощью оценки по шкале общего клинического впечатления (CIBIC-Plus), выполненного независимым рейтером. Полученные данные хорошо согласуются с предыдущим отечественным и международным опытом применения донепезила для лечения больных с БА на стадии мягкой и умеренно выраженной деменции.
Литература
1. Гаврилова СИ. Фармакотерапия болезни Альцгеймера. - М.: Пульс 2007. - 359с
2. Калын Я.Б. Психическое здоровье населения пожилого и старческого возраста (клинико-эпидемиологическое исследование) / Автореф дисс. ... д-ра мед. наук. - М., 2001
3. Ferri C., Prince V., Brayne C. et al. Global prevalence of dementia: a Delphi consensus study // Lancet 2005; 366: 2112-2117
4. Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State. A practical method of grading the cognitive state of patients for the clinician // Journal of Psychiatry Research 1975; 12: 189-198.
5. Gelinas I., Gauthier L, McIntyre M. Development of a functional measure for persons with Alzheimer's disease: the Disability Assessment for Dementia // American Journal of Occupational Therapy 1999; 3: 471-481
6. McKhann G., Drachman D., Folstein M., et al. Clinical diagnosis of Alzheimer`s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer`s disease // Neurology1984; 146: 939-944.
7. Mohs R.C., Cohen L. Alzheimer’s Disease Assessment Scale (ADAS) // Psy-chopharmacology Bulletin 1988; 24: 627-628.
8. Mohs R.C., Doody R.S., Morris J.C. et al. A 1-year, randomized, placebo-controlled, study of donepezil in patients with mild to moderate AD // Neurology 2001; 57:489-495.
9. Rockwood K., Graham J., Fay S. Goal setting and attainment in patients with Alzheimer’s disease treated with donepezil // Journal of Neurology, Neurosurgery, and Psychiatry 2002; 73: 500-507
10. Rogers S.L., Friedhoff L.T. and Donepezil Study Group. The efficacy and safety of donepezil in patients with Alzheimer's disease: results of a US multicentre, randomized, double-blind, placebo-controlled trial // Dementia 1996; 7: 293-303
11. Schneider L.S., Olin J.T., Doody R.S., Clark C.M., Morris J.C., Reisberg B. et al., Validity and reliability of the Alzheimer’s disease cooperative study -clinical global impression of change // Alzheimer Dis Assoc Disord 1997 11(Suppl 2): S 22-32
12. Winblad B., Engedal K., Soininen H. et al. A 1-year, randomized, placebo-controlled study of donepezil in patients with mild to moderate AD // Neurology 2001; 57: 489-495.
13. Yamanishi Y, Ogura H., Kosasa T, et al. Inhibitory action of E2020, a novel acetylcholinesterase inhibitor, on cholinesterase: comparison with other in-hibitors. In: Nagatsu T, Fisher A., Yoshida M. (eds.): Basic, Clinical, and Therapeutic Aspects of Alzheimer's and Parkinson's Diseases. New York: Plenum Press 1990; 2: 409-413.
| Май 2014 г. |