Опубликовано в журнале:
Центральный научно-исследовательский институт
гастроэнтерологии, Москва
РЕЗЮМЕ
Статья составлена по материалам доклада на симпозиуме "Helicobacter pylori: свойства, диагностика и лечение", проходившего в рамках VII Российского национального конгресса "Человек и
лекарство" 10-14 апреля 2000 года. В работе отражены проблемы лечения
язвенной болезни, ассоциированной с Helicobacter pylori, а также вопросы
современной диагностики хеликобактериоза.
SUMMARY
PEFTICULCER AND HELICOBACTER PYLORI. THEDIAGNOSIS AND TREATMENTPROBLEMS
В настоящее время опубликовано необозримое количество работ посвященных
проблеме хеликобактериоза. Если в первые годы еще дискутировался вопрос о
возможной патогенной роли Helicobacter pylori (Нр), то в настоящее время
многочисленные исследования убедительно доказали значение этого микроорганизма
в развитии различной гастродуоденальной патологии, в первую очередь,
хронического гастрита и язвенной болезни. Проведенные практически во всех
странах мира эпидемиологические исследования показали широкое распространение
хеликобактериоза, в том числе и в России. В связи с этим первостепенное
значение в проблеме хеликобактериоза приобретают вопросы, связанные с
диагностикой Нp и лечением заболеваний, ассоциированных с хеликобактериозом.
Современная концепция ульцерогенеза предполагает нарушение динамического
равновесия между факторами агрессии и факторами защиты слизистой оболочки. Нр
хорошо вписывается в общую схему этой концепции. Условно можно выделить три
основных пути, образования эрозивно-язвенных дефектов.
Первый путь связан с приемом лекарственных средств, в частности, нестероидных противовоспалительных препаратов (НПВП). При этом образование язвенных
дефектов происходит как бы изнутри, так как основным механизмом действия этих
препаратов является подавление синтеза внутриклеточных простагландинов,
играющих важную регуляторную роль в обеспечении жизнедеятельности эпителиоцита.
Второй путь - классический вариант - повреждение слизистой оболочки в
результате кислотно-пептического воздействия. И, наконец, колонизация слизистой
оболочки Нр также может приводить к образованию язвенных дефектов. С одной
стороны, Нp за счет ферментной активности Нр разжижает пристеночную слизь, с
другой стороны, наличие цитотоксинов оказывает повреждающее действие на
эпителий. Процесс усугубляется за счет развития каскада воспалительных реакций
в результате иммунного ответа со стороны хозяина.
При тесном контакте Нр с эпителиоцитом (фото 1), последний начинает
вырабатывать цитокины, наиболее важный из которых - интерлейкин-8. Этот цитокин
активизирует лейкоциты, регулирует хемотаксис и хемокинез, а также процессы
освобождения лизосомальных ферментов из нейтрофилов [18, 24]. Для того, чтобы
добраться до микроба, нейтрофил должен пройти через эпителий.
Это не безобидный лейкопедез - лейкоцит активизирован, он разрушает
межклеточные контакты и становится опасен призвавшему его для защиты эпителию
своими ферментами и свободными радикалами кислорода [7].
В настоящее время получены новые данные, свидетельствующие о том, что Нр
задерживает заживление язв путем торможения миграции эпителиоцитов в зону
язвенного дефекта, а также стимулирует апоптозы, усиливая тем самым гибель клеток в краях язв. При этом интенсивность
апоптоза значительно превышает процессы пролиферации. В конечном итоге, все это
приводит к хронизации язвенного процесса [17, 19, 21].
Последними исследованиями установлено, что колонизация Нр приводит к гипергастринемии и повышает кислотопродуцирующую функцию желудка. После
эрадикации Нр продукция соляной кислоты в течение года приближается к
нормальным показателям.
Естественно в организме человека трудно представить изолированное действие
какого-то одного агрессивного фактора. Более вероятным является сочетание в той
или иной степени нескольких причин, что в конечном итоге и приводит к нарушению
защитных функций слизистой оболочки. Так, у больных, получающих НПВП и с
профилактической целью фамотидин, частота появления язв остается низкой и не
превышает 12%. В то время как при колонизации слизистой оболочки Нр,
сопровождающейся нейтрофильной инфильтрацией, прием этих же препаратов
приводит к более частому возникновению язв, достигающему 47% [25].
Таким образом, конец ушедшего столетия ознаменовался существенным изменением
представлений о патогенезе язвенной болезни, что позволило разработать
эффективные методы лечения этого заболевания.
Практически до начала 70-х годов лечение больных язвенной болезнью
ограничивалось возможностью применения, в основном, антацидов и диетического
питания. Конечно, подобное лечение не могло оказать влияния на основные звенья
патогенеза заболевания, что приводило к частым осложнениям и оперативному
лечению.
Появление препаратов, блокирующих продукцию соляной кислоты, значительно
повысило эффективность противоязвенной терапии, что привело к резкому снижению
числа операций по поводу осложнений язвенной болезни. Однако эти препараты не
решили важной проблемы, касающейся рецидивов язвенной болезни, частота которых
в течение года достигала 80-100%. В то же время были получены результаты, указывающие на то, что эрадикация Нр способна значительно уменьшить число
рецидивов язвенной болезни. Исследования, проведенные в Центральном
научно-исследовательском институте гастроэнтерологии в начале 90-х годов также
подтвердили это положение. Было обследовано 57 больных язвенной болезнью
двенадцатиперстной кишки в стадии обострения (30 Нр-положительных и 27
Нр-отрицательных), у которых рубцевание язвенных дефектов достигнуто без
применения антихеликобактерных средств. Рецидивы среди Нр-положительных
больных составили 57%, среди Нр-отрицательных 7% [12].
Анализ большого клинического материала, полученного в крупнейших
гастроэнтерологических центрах Европы, позволил в 1996 году разработать
Маастрихтские рекомендации по применению антихеликобактерной терапии, среди
хеликобактер-ассоциированных заболеваний в группу с абсолютными показаниями
входит и язвенная болезнь (таблица 1).
Таблица 1. Показания к антихеликобактерной терапии (Маастрихт, 1996)
На протяжении последних 7-10 лет во всем мире интенсивно велся поиск наиболее
оптимальных схем антихеликобактерной терапии, опубликовано необозримое
количество работ, посвященных этой проблеме. Следует отметить, что in vitro Нр чувствительны к широкому спектру
антибактериальных средств, однако in vivo эффективность этих средств
существенно отличается. Применяемые для эрадикации Нр условно можно разделить
на 4 группы, основные из которых представлены в таблице 2.
Таблица 2. Антихеликобактерная терапия
Еще до открытия Нр в гастроэнтерологии широко применялись различные препараты
висмута, однако, как показали собственные исследования, антихеликобактерный
эффект оказывают лишь коллоидные (фото 2) соли висмута, которые обладают
однородностью со слизью, хорошо перемешиваются с ней, а за счет адгезивных
свойств способны длительно фиксироваться на слизистой оболочке (фото 4). В то
время, как, например, основной нитрат висмута, давно применяющийся в
гастроэнтерологии, не обладает такими свойствами (фото 3).
Препараты висмута практически не всасываются в кровь и выделяются кишечником,
окрашивая испражнения в темный цвет, в связи с этим побочные эффекты при их
применении сравнительно редки. Однако при длительной фиксации на слизистой оболочке, препарат частично метаболизируется слизистой оболочкой и подвергается резорбции, что можно наблюдать при растровой электронной микроскопии (фото 5). Исследованиями установлено, что признаки висмутовой
энцефалопатии развиваются при концентрации висмута в сыворотке крови выше 50
мкг/л. Это обстоятельство длительное время было сдерживающим фактором для
клинического применения коллоидного субцитрата висмута (де-нола) в США. Во Франции по этой причине препарат не разрешен для
клинического применения и до настоящего времени. Для избежания побочного
эффекта препарат не рекомендуется принимать более 4 недель. Важным
преимуществом препаратов висмута по сравнению с другими антихеликобактерными
средствами является отсутствие к ним резистентных штаммов Нр, а недостатком -
слабая эрадикация Нр, расположенных в глубине ямок слизистой оболочки.
Вероятно, этим фактом можно объяснить, что антихеликобактерная эффективность при
монотерапии препаратами висмута составляет всего 15-45%. Данное обстоятельство
послужило основанием для включения этих препаратов в состав различных
антибактериальных схем.
Эрадикационная эффективность антибактериальных средств зависит не только от
прямого воздействия на Нр, но и от устойчивости их в кислой желудочной среде,
что требует предварительного подавления кислотопродуцирующей функции, а также
от возможности создавать необходимую терапевтическую концентрацию препарата в
месте наибольшей колонизации микроба.
В качестве антихеликобактерных средств широко применяются в различных схемах
лечения тетрациклин и амоксициллин. В последние годы получены антибиотики, входящие в группу макролидов, которые способны селективно накапливаться
в слизистой оболочке желудка - кларитромицин, азитромицин, джозамицин, что
существенно повышает эрадикационный эффект.
Экспериментальные данные показали, что кларитромицин накапливается в
тканях желудка в концентрации 19.64+5.88 мг/кг, по сравнению с эритромицином,
ампициллином и тетрациклином, содержание которых в тканях соответствует
0.98+0.40, 0.36+0.10, 1.18+0.25 [6]. Концентрация азитромицина в слизистой
оболочке желудка может достигать 18.5 мг/кг [3]. Этот факт послужил основанием
ддя включения их в состав современных схем лечения хеликобактер-ассоциированных
заболеваний.
В комбинированных антихеликобактерных схемах широко применяется метронидазол,
а в последние годы и тинидазол. Следует отметить, что первое сообщение в
отечественной литературе, свидетельствующее об эффективности метронидазола у
больных язвенной болезнью, было в 1981 году, т.е. еще за два года до открытия
Нр [16].
Применение антибиотиков с целью эрадикации Нр породило новые проблемы в
терапии язвенной болезни. С одной стороны появились штаммы, резистентные к
антибиотикам, с другой стороны, мощная антибактериальная терапия вызывает
побочные эффекты в том числе и дисбиотические изменения в кишечной микрофлоре.
Наиболее распространены штаммы, резистентные к метронидазолу (производным
нитроимидазола). Имеются страны с высокой популяционной резистентностью. Так,
в странах Латинской Америки и Африки процент штаммов Нр, первично резистентных к производным
нитроимидазола, достигает 50-100. В России, странах СНГ и Восточной Европы этот
процент составляет 20-40. Доля резистентных штаммов Нр меньше 20% наблюдается в
большинстве стран Западной Европы и Северной Америки [4]. Широкое применение
антибиотиков привело к развитию вторичной или приобретенной резистентности. При
этом отмечается устойчивая тенденция к увеличению доли приобретенной
резистентности. Так, проведенное в Гонконге исследование (Ling Т. и соавт.,
1996) больных язвенной болезнью, показало, что в 1991 году, когда всем больным
стали стандартно применять антихелико-бактерную терапию, доля штаммов Нр,
резистентных к производньм нитроимидазола, составляла у них 22%, что можно было
расценить как первичную резистентность. В 1995 году эта доля резистентных
штаммов составляла уже 73,2% [цит. 4]. Аналогичные исследования проведены Okada
М. с соавт. (22), изучавшие чувствительность штаммов Нр к амоксициллину,
метронидазолу, кларитромицину и рокситромицину у 50 больных на протяжении
1996-98 гг. (таблица 3)
Таблица 3. Динамика резистентности штаммов Нр к амоксициллину, метронидазолу,
кларитромицину и рокситромицину [22]
Основными причинами появления резистентных штаммов Нр являются неполноценные
схемы антихеликобактерной терапии, нарушение больными режима приема препаратов.
По мнению Tytgat G. (1998) в настоящее время лишь меньшая часть больных язвенной болезнью получает
адекватную антихеликобактерную терапию [цит. 4]. В свою очередь резистентные
штаммы Нр могут существенно снижать эффективность лечения. В связи с этим в
ряде стран ведутся динамические наблюдения за ростом уровней резистентности
H.pylori к антибактериальным препаратам, которые входят в схемы
противохеликобактерной терапии на популяционном уровне и предпринимаются
адекватные меры для предотвращения этого роста [11].
В последние годы установлена еще одна особенность Нр - под влиянием
неблагоприятных условий, в том числе, и неадекватной антибактериальной терапии,
этот микроб способен переходить из вегетативной формы в кокковую [2, 13]. При
этом микроб редуцирует ферментативную активность и его трудно обнаружить с
помощью уреазных тестов.
Еще до широкого применения антихеликобактерной терапии у больных язвенной
болезнью достаточно часто выявлялись различной степени выраженности
дисбиотические изменения в составе микрофлоры кишечника, заключающиеся в
уменьшении лакто- и бифидобактерий и увеличении условно-патогенной микрофлоры
[5, 8, 9]. При этом было показано, что ципрофлоксацин не только селективно
влияет на кишечную микрофлору, но и оказывает антихеликобактерный эффект [5, 9, 10]. В последующем наши исследования были подтверждены и в более поздних работах
зарубежных ученых, установивших, что ципрофлоксацин эффективен не только у
больных язвенной болезнью, но и у лиц, имеющих резистентные штаммы Нр к
метронидазолу или кларитромицину как в отдельности, так и к обоим антибиотикам
одновременно [20]. Это позволяет считать ципрофлоксацин препаратом выбора у
больных язвенной болезнью, ассоциированной с Нр и имеющих дисбиотические
изменения в микрофлоре кишечника.
Ингибиторы продукции соляной кислоты сохранили свое значение в терапии язвенной
болезни. С одной стороны эти препараты, подавляя кислотно-пептический фактор,
даже при монотерапии оказывают хороший противоязвенный эффект. С другой
стороны, повышая внутрижелудочный рН, они создают наиболее благоприятные
условия для действия антибиотиков. В клинике широкое распространение получили в
основном препараты, блокирующие Н-рецепторы гистамина (ранитидин, фамотидин и
др.) и ингибиторы H+-K+-АТФ-азы (омепразол, ланзопрозол и др.). Последние
обладают мощным антисекреторным эффектом, вплоть до паралича желудочной
секреции и могут повышать внутрижелудочный рН не только до нейтрального, но и
щелочного уровня. Полагают, что при высоком значении рН в желудке нейтрализация
аммония, продуцируемого Нр посредством гидролиза мочевины, невозможна, поэтому
накопление аммония может стать токсичным для самого микроорганизма. Такое
"самоубийство" Нр было продемонстрировано in vitro. Однако в
организме человека этот эффект имеет место только в антральном отделе желудка.
В кислотопродуцирующей зоне желудка (эпителии тела и фундального отдела), где
повышение рН не достигает критических значений, популяция Нр, наоборот,
увеличивается за счет спиралевидных форм, так как условия, создающиеся под
воздействием омепразола, становятся благоприятны для бактерии. Феномен
"перемещения" Нр из антрального отдела в тело и фундальный отдел
желудка представляет собой важнейшее свойство омепразола [7].
Получен и новый комбинированный препарат - ранитидин висмут цитрат (пилорид),
оказывающий как антимикробный эффект, так и подавляющий кислотопродуцирующую
функцию желудка.
В настоящее время эти антисекреторные препараты в сочетании с антибиотиками
составляют основу антихеликобактерных схем лечения. Имеется мнение, что
препараты и их комбинации с эрадикационной эффективностью ниже 60-70% не
должны применяться в клинической практике. Антихеликобактерная эффективность
современных схем достаточно высока и колеблется в пределах 80-96%. Наибольшее
распространение получили схемы, включающие ингибитор Н+-К+-АТФ-азы с
метронидазолом и кларитромицином или в сочетании с амоксициллином и
кларитромицином. В другой схеме лечения базисным препаратом может быть
пилорид.
Не решен вопрос о продолжительности курсов антихеликобактерной терапии. В
Европе большее распространение получила 7-дневная схема тройной терапии.
Частота эрадикации при этом колеблется достаточно широко - от 76% до 90%. С
одной стороны, это связано с популяционной резистентностью к антибиотикам. С
другой стороны, недостаточным набором диагностических тестов для обнаружения
Нр. Во многих случаях качество антихеликобактерной терапии оценивается с
помощью уреазных тестов, в частности, по данным, широко распространенного на
Западе, дыхательного уреазного теста. В этом плане более достоверными можно
считать исследования в США, выполненные в рамках государственной программы.
Многоцентровыми исследованиями были охвачены жители 46 городов, которые по
специальным критериям отбирались на лечение. В зависимости от продолжительности лечения все пациенты были разделены на 2
группы. Первая группа (n=136) получала одну капсулу ланзопразола (30 мг) или
плацебо и 4 капсулы амоксициллина (250 мг) или плацебо и одну таблетку
исследуемого лекарственного препарата (кларитромицин 500 мг или плацебо) 2
раза в день перед завтраком и ужином в течение 14 дней. Вторая группа (n=148)
получала аналогичное лечение, но в течение 10 дней. Контроль через 4-6 недель
проводили по данным 5 биопсий (3 из антрального отдела и 2 из тела желудка) с
применением уреазного теста, гистологического исследования и
бактериологического исследования с выделением чистой культуры, определением
чувствительности к антибиотикам, а также проводили исследование сыворотки крови
на наличие Нр-антител класса IgG. Частота эрадикации в обеих группах
существенно не отличалась и составила соответственно 85% и 84%.[23].
В прямой зависимости от эффективности антихеликобактерной терапии находится и
частота рецидивов язвенной болезни. При полной эрадикации частота рецидивов
снижается до минимума и, как правило, не превышает 10% в течение 1 года. На
этом основании возрастают требования к чувствительности и специфичности
методов, применяемых для обнаружения Нр.
Этот факт может быть обусловлен двумя основными причинами - некачественной
диагностикой хеликобактериоза, либо реинфекцией.
Для обнаружения Нр распространение получили различные модификации уреазного
теста и гистологический метод, считавшиеся до недавнего времени "золотым
стандартом". Однако, каждый из них имеет свои определенные преимущества
и недостатки. Так, уреазный метод не позволяет определить функциональное
состояние покоящегося (неактивного) микроорганизма, в том числе и после
неадекватной антихеликобактерной терапии, в связи с этим не исключается возможность получения ложноотрицательных результатов.
Корректность данных гистологического исследования также зависит от ряда причин:
биопсии только из антрального отдела желудка, скудных биоптатов, не содержащих
эпителия и слизи, участков кишечной метаплазии, плохой окраски. Этим и
определяется частота ложноотрицательных результатов при изучении материалов
прицельных биопсий. В то же время для определения прогноза течения язвенной
болезни особенно важны чувствительность и специфичность методов обнаружения НР.
Нельзя исключить, что именно снижением уровня этих показателей можно объяснить
определенный процент рецидивов язвенной болезни после проведенной
эрадикационной терапии. В связи с этим особое значение приобретает разработка
более чувствительных методов обнаружения НР. В последние годы достигнуты
впечатляющие успехи в диагностике инфекционных и наследственных заболеваний с
использованием полимеразной цепной реакции (ПЦР) [14].
В Центральном НИИ гастроэнтерологии для оценки эрадикационной эффективности
современных схем лечения применяли модифицированный уреазный тест [13], с
помощью которого отбирали больных на лечение, а также гистологический метод и
ПЦР. 30 больных язвенной болезнью двенадцатиперстной кишки были разбиты на 2
группы.
Первая (n=13) получала в качестве базисного препарата омепразол (лосек) по 20
мг 2 раза в сутки в течение первой недели, затем по 20 мг 1 раз в течение 3-х
недель в сочетании с кларитромицином по 250 мг 3 раза в день и метронидазолом
по 500 мг 2 раза в течение 10 дней. Вторая группа (n=17) получала ранитидин
висмут цитрат (пилорид) 400 мг 2 раза в течение 4 недель в сочетании с
кларитромицином и метронидазолом в дозах и продолжительностью лечения
аналогично первой группе. Заживление дуоденальных язв в первой и второй группах составило соответственно 92,3% и 94,1%. Контрольные исследования были
проведены через 1 и 6 месяцев после лечения (рис. 1). Рисунок 1. Частота обнаружения НР после эрадикационной
терапии Как видно из таблицы антихеликобактерная терапия оказала санирующий эффект у
подавляющего большинства больных и по данным уреазного теста и гистологического
исследования она составила 90-95%, в то время как по данным ПЦР только 77%.
Через 6 месяцев частота обнаружения Нр с помощью уреазного теста и
гистологического исследования оставалась на низком уровне и показатели мало
отличались друг от друга. В то время как по данным ПЦР более чем у половины
больных были обнаружены Нр. Пока трудно говорить, с чем это связано.
Маловероятно, что в таком большом количестве случаев произошло повторное
заражение Нр. Более вероятным представляется активация собственной Нр-инфекции, у той части больных, у которых
под влиянием антихеликобактерной терапии не наступило полной эрадикации и
микробы могли трансформироваться из вегетативной формы в дормантное состояние.
Ответить на этот вопрос могут лишь специальные методы, позволяющие
идентифицировать изолированные штаммы Нр, в частности метод fingerprinting [15].
Литература
1. Аруин Л.И. Роль Helicobacter pylori в формировании морфологического
субстрата язвенной болезни. Материалы VIII тематической сессии Российской
группы по изучению Helicobacter pylori, 18 мая 1999, Уфа. С.7-11.
ЯЗВЕННАЯ БОЛЕЗНЬ И Helicobacter pylori
А.А. Ильченко
ПРОБЛЕМЫ ДИАГНОСТИКИ И
ЛЕЧЕНИЯ
Ilchenko A.A.
There are materials of the report on the "Helicobacter pylori properties, diagnosis and treatment" symposium, that had place on the VII
Russian National Congress "Person and medicine", on 10-14 April, 2000. The
treatment problems of peptic ulcer, that is associated with Helicobacter
pylori, as well as the mordem diagnosis of HP are discussed.
Фото 1. Тесный контакт Нр с мембраной эпителиоцита с участком
плотного их соприкосновения. Контуры поверхности микробной клетки и
эпителиоцита повторяют друг друга. На значительном протяжении поверхности
эпитетелиальной клетки отсутствуют микроворсинки, гликокаликс распределяется
неравномерно. В апикальной части эпителиоцита большое количеством секреторных
гранул. Трансмиссионная электронная микроскопия. Х40000. Абсолютные показания
язвенная болезнь (обострение, ремиссия, осложнения)
хронический гастрит
MALT-лимфома
резекции желудка по поводу рака
Относительные показания
функциональная неязвенная диспепсия
ГЭРБ при длительном лечении омепразолом
после операции по поводу ЯБ
латентное носительство НР для профилактики лимфомы и рака желудка (по желанию больного) Препараты висмута
коллоидный субцитрат висмута
коллоидный субсалицилат висмута
Антибактериальные средства
тетрациклин, амоксициллин, кларитромицин, азитромицин, метронидазол, тинидазол и др.
Ингибиторы желудочной секреции
ранитидин, фамотидин, омепразол
Комбинированные препараты
ранитидин + висмут цитрат (пилорид)
Фото 2. Гранулы де-нола на слизистой оболочке желудка человека
через 2 часа после приема препарата. Равномерное распределение препарата.
Растровая электронная микроскопия. Х3000
Фото 3. Гранулы основного нитрата висмута на слизистой оболочке
желудка человека через 2 часа после приема препарата. Распределение препарата в
виде отдельных скоплений. Растровая электронная микроскопия. Х3000
Фото 4. Гранулы де-нола на слизистой оболочке человека через
12 часов после приема препарата. Растровая электронная микроскопия. Х3000
Фото 5. "Растворение" гранул де-нола на
слизистой оболочке антрального отдела желудка человека через 12 часов после
приема препарата. Растровая электронная микроскопия. Х4000
Период 1996 1997 1998 P
(n=50) (n=50) (n=50)
Амоксициллин R (%) 0/50 (0) 0/50 (0) 1/50 (2) ns
Метронидазол R (%) 3/50 (6) 4/50 (8) 11/50 (22) 0,027
Кларитромицин R (%) 5/50 (10) 4/50 (8) 8/50 (16) ns
Рокситромицин R (%) 5/50 (10) 5/50 (10) 8/50 (16) ns 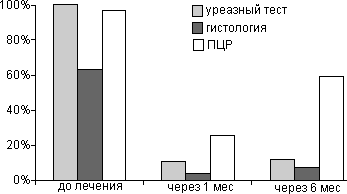
2. Аруин Л.И., Ильченко А.А., Городинская В.С. и др. Влияние длительного
воздействия антибиотиков на слизистую оболочку желудка и Helicobacter pylori.
Клин. мед. 1995. N5. С.78.
3. Васильев Ю.В. Суммамед и новые перспективы рациональной эрадикации
Helicobacter pylori при язвенной болезни и гастрите. Московский медицинский
журнал. 1999. N.6 C.33-37.
4. Иванников И.О. Клиническое значение преодоления резистентности Helicobacter
pylori к антибиотикам. Материалы VIII тематической сессии Российской группы по
изучению Helicobacter pylori, 18 мая 1999, Уфа. С. 13-16.
5. Ильченко А.А. Роль Helicobacter pylori в этиологии и патогенезе язвенной
болезни двенадцатиперстной кишки. Патогенетическая терапия. Дисс. Докт.
мед. наук. 1991. 297 с.
6. Ильченко А.А. Лечение язвенной болезни, ассоциированной с хеликобактериозом.
Российский гастроэнтерологический журнал. 1995. N1. С. 50-53.
7. Исаков В.А. Лечение язвенной болезни, ассоциированной с H.pylori: достижения
и нерешенные проблемы. Клиническая фармакология и терапия. 1997, 6(1). С.12-17.
8. Коршунов В.М., Дугашева Л.Г., Ильченко А.А. и др. Микрофлора кишечника и
кислотообразующая функция желудка у больных язвенной болезнью с пилорическим
хеликобактериозом. Журнал микробиологии, эпидемиологии и иммунологии. 1991.
N10. С.17-19
9. Коршунов В.М., Буш Б., Ильченко А.А. и др. Влияние ципрофлоксацина на
микрофлору желудочно-кишечного тракта в эксперименте и клинике. Журнал
микробиологии, эпидемиологии и иммунологии. 1991. N5. С. 14-17.
10. Коршунов В.М., Буш Б., Ильченко А.А. и др. Изучение влияния
различных антимикробных препаратов на микрофлору кишечника (экспериментальное и клиническое исследование). Материалы Международного симпозиума
"Достижения антибиотиковой терапии. Ципрофлоксацин. Москва. 1989.
С.3-13.
11. Кудрявцева Л.В. Динамика резистентности штаммов Нр. у городского населения
России в 1996-98 годах и ее клиническое значение. Материалы VIII тематической
сессии Российской группы по изучению Helicobacter pylori, 18 мая 1999, Уфа.
C23-25.
12. Логинов А.С., Аруин Л.И., Ильченко А.А. Helicobacter pylori и язвенная
болезнь. Новые аспекты патогенетической терапии. 1993. 230 с.
13. Логинов А.С., Решетняк В.И., Мукамолова Г.В. и др. О возможности
пребывания Helicobacter pylori в покоящемся состоянии в слизистой оболочке
желудка у больных язвенной болезнью после лечения. Тер. архив. 1999.
N2. С.13-18.
14. Логинов А.С., Ильченко А.А., Мукамолова Г.Ф. и др. Сравнительная
эффективность различных методов обнаружения Helicobacter pylori у больных
язвенной болезнью. Российский гастроэнтерологический журнал. 1998.
N3. С.3-11.
15. Логинов А.С., Капрельянц А.Д., Решетняк В.И. и др. Возможности
генодиагностики штаммов Нр изолированных из биоптатов слизистой оболочки
желудка, методом "отпечатков пальцев". Российский гастроэнтерологический
журнал. - 1999. N4. С.127-128.
16. Широкова К.И. с соавт. Применение метронидазола в лечении больных
язвенной болезнью. Клин. Мед. 1981. N.2. С.48-50.
17. Brzozowski Т., Konturek P.O., Konturek S.J. et al. Water extracts of
Helicobacter pylori delay healing of chronic gastric ulcers in rats: role
of citokines and gastrin-somatostatin link. Digestion. - 1999. Vol.60. P.22-33.
18. Kobayashi K., Kashima K., Higuchi K., Arakava T. (The mechanisms
of gastrointestinal mucosal injury and repair). Nippon Rinsho 1998. Vol.56, P.2215-22.
19. Kubota Т., Nasu M. Helicobacter pylori infection delays the healing
of acetic acid-induced gastric ulcer in Japanese monkeys. J. Gastroenterol.
Hepatol. 1996. Vol. 11. P.1097-1102.
20. Lamarque D., Tankovic J., Berrhouma A. Et al. Triple therapy using
ciprofloxacin for eradication of claritromicin and metronidazole-resistant
Helicobacter pylori. 6th United European Gastroenterology Week. 18-23 October,
1997. Birmingham. United Kingdom. Abstract: 29.05.
21. Li H., Kalies I., Mellgard B., Helander H.F. Aratmodel of chronic Helicobacter
pylori infection. Studies of epithelial cell turnover and gastric ulcer
healing. Skand. J. Gastroenterol. 1998. Vol.33. P.370-378.
22. Okada M. et al. Prevarence of H.pylori resistence to antimicrobial agents in
Japan between 1996 and 1998. 7th European gastroenterology week, 13-17 november
1999, Roma, Italy. Abstract: p.0179.
23. Fennerty M.B. et al. Сравнение эффективности 10- и 14-дневного курса тройной
терапии с ланзопразолом в отношении Helicobacter pylori.
Jama-Russia-Vol.1 / November, 1998, C.15-21.
24. Shimada Т., Terano A. Chemokine expression in Helicobacter pylori-infected
gastric mucosa. Gastroenterology. 1998. Vol.33 P.613-617.
25. Taha A.S. et al. Neutrophils, Helicobacter pylori and nonsteroidal
antiinflammatory drug ulcer. Gastroenterology. 1999. Vol. 116. P.254-258.
Апрель 2001 г.