Опубликовано в журнале:
»» N3 2005 ОЦЕНКА ВЛИЯНИЯ МИОКАРДИАЛЬНЫХ ЦИТОПРОТЕКТОРОВ НА ПРОЦЕССЫ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ У БОЛЬНЫХ СТАБИЛЬНОЙ СТЕНОКАРДИЕЙ ДО И ПОСЛЕ ХИРУРГИЧЕСКОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА
Гордеев И.Г., Бекчиу Е.А., Люсов В.А., Волов Н.А., Ильина Е.Е., Лебедева А.Ю., Клыков Л.Л.
Российский государственный медицинский университет, кафедра госпитальной терапии №1 лечебного факультета, МоскваРезюме
В данной статье представлены результаты влияния миокардиальных цитопротекторов: милдроната и триметазидина (предуктал МВ) на свободнорадикальные процессы, протекающие в кардиомиоцитах, у пациентов со стабильной стенокардией в предоперационный и послеоперационный период транслюминальной ангиопластики и стентирования коронарных артерий. Показано, что применение данных препаратов перед проведением реваскуляризации миокарда способствует снижению активности свободнорадикальных процессов за счет активации защитных антиоксидантных ферментов.
Ключевые слова: стенокардия, перекисное окисление липидов, миокардиальные цитопротекторы, баллонная ангиопластика, стентирование.
В настоящее время можно считать установленным фактом участие процессов свободнорадикального окисления липидов в ишемическом повреждении миокарда. При многих сердечно-сосудистых заболеваниях, связанных с повышением активности перекисного окисления липидов, первопричиной возникающих нарушений является гипоксия [9]. Окислительный стресс, приводящий к резкой интенсификации свободнорадикальных процессов в организме, является следствием усиленного образования активных форм кислорода (АФК) – супероксидного анион-радикала О·2 , гидроксил-радикала НО· и оксида азота NO·, а также потенциальных эндогенных прооксидантов (пероксид водорода, липогидропероксиды и т.д.) и органических свободных радикалов (прежде всего – радикалов ненасыщенных липидов) – L·, LO·2 и LO· [2]. При этом повреждающую роль играют не только первичные, но и вторичные продукты свободнорадикального окисления липидов, образующиеся при окислительной деструкции липидных гидропероксидов. Это, прежде всего, соединения альдегидной природы – такие, как 4 гидроксиноненаль и малоновый диальдегид (МДА). МДА является, в свою очередь, показателем активности перекисного окисления липидов [4, 9]. Важнейшую роль в регуляции свободнорадикальных процессов в клетке играют также высокомолекулярные биооксиданты – антиоксидантные ферменты, такие как супероксиддисмутаза (СОД), каталаза, глутатионпероксидаза (ГП), глутатион-S-трансферазы, а также NAD(P)H–, глутатион– и аскорбатзависимые ферментные системы биогенерации антиоксидантов и окисленного глутатиона. Таким образом, детоксикация АФК и свободных радикалов в клетке представляет собой сложный многоступенчатый процесс, в котором участвуют низкомолекулярные антиоксиданты и антиоксидантые ферменты [4, 5]. Таким образом, можно говорить о том, что нарушение функционирования любого звена этой многоступенчатой системы, контролирующей каскад свободнорадикальных реакций [4, 5], неизбежно отразится на эффективности процессов детоксикации АФК и свободных радикалов в клетке и может привести к возникновению окислительного стресса и связанных с ним необратимых изменений в органах и тканях [2].
Поскольку АФК, а также первичные и вторичные продукты свободнорадикального перекисного окисления липидов, оказывают повреждающее действие на биомембраны и молекулы жизненно важных биополимеров (таких, как белки и нуклеиновые кислоты), в организме существуют регуляторные механизмы, ограничивающие накопление этих высокотоксичных продуктов. Первая линия защиты предусматривает возможность детоксикации потенциально опасных АФК – О·2 и H2O2 с участием СОД и каталазы, что позволяет предотвратить образование НО·.
Если образование НО· произошло, и этот активный радикал индуцировал окисление полиеновых липидов, образовавшиеся липидные радикалы могут быть обезврежены на второй линии защиты при взаимодействии с природным антиоксидантом витаминов Е – α-токоферолом (α-ТОН), при этом α-ТОН функционирует как «ловушка радикалов». Третья линия защиты представлена глутатионзависимыми ферментами– глутатионпероксидазами и глутатион- S-трансферазами, а также ферментными системами биорегенерации окисленного глутатиона. В настоящее время выявлено четыре вида ферментов глутатионпероксидаз, три из них являются ферментами: это «классическая» ГП, найденная в цитозоле и митохондриях большинства клеток организма, ГП плазмы крови и ГП, выделенная из цитозоля клеток печени и кишечника человека. Все эти ферменты катализируют реакцию восстановления глутатионом нестойких органических гидропероксидов, включая гидропероксиды полиненасыщенных жирных кислот в стабильные соединения-оксикислоты. Поэтому СОД и ГП можно вполне точно назвать «антиоксидантными» ферментами [4].
Интенсификация процессов свободнорадикального окисления – один из важных факторов ишемического повреждения кардиомиоцитов. При ишемии создается парадоксальная ситуация – снижение содержания кислорода приводит к увеличению генерированных цитотоксичных супероксидных анион-радикалов и других АФК[3, 4, 6]. Ишемизированный миокард инфильтрируется нейтрофилами, активация которых продуктами фосфолиполиза и протеолиза инспирирует «респираторный взрыв», приводящий к гиперпродукции АФК и последующему усилению ишемического повреждения [3]. В ряде экспериментальных исследований было установлено, что в ишемизированной ткани происходит резкое необратимое ингибирование активности антиоксидантных ферментов СОД и ГП, что препятствует своевременному обезвреживанию цитотоксичных продуктов, накапливающихся в условиях ишемии [3, 4]. Таким образом, активация свободнорадикальных процессов в зоне ишемии ускоряет некротическую дегенерацию ишемизированных клеток, вследствие чего ингибирование свободнорадикальных реакций может способствовать уменьшению последствий ишемического повреждения [3]. Известно, что некоторые продукты перекисного окисления липидов вызывают сокращение гладкой мускулатуры, нарушение проницаемости сосудов и способны провоцировать спазм коронарных сосудов. У больных стабильной стенокардией повышено содержание липопероксидов крови, тогда как активность ГП достоверно снижена по сравнению со здоровыми людьми [11]. Также в ряде клинических исследований показано, что уровень МДА у больных ИБС превышает показатели контрольной группы [9].
Последнее время наблюдается заметный интерес к цитопротекторному направлению в лечении ИБС и стабильной стенокардии – повышению эффективности утилизации кислорода миокардиальной тканью[6].
К препаратам данной группы относятся, в частности, триметазидин и милдронат. Они ингибируют окисление жирных кислот в ишемизированных кардиомиоцитах, влияя на основное звено метаболизма миокарда в условиях ишемии. Триметазидин улучшает энергетический обмен в миокарде посредством селективного ингибирования длинноцепочечной 3-кетоацил-КоА-тиолазы – ключевого фермента в β-окислении жирных кислот. Действие милдроната заключается в ингибировании биосинтеза переносчика жирных кислот через митохондриальную мембрану, т. е., в угнетении транспорта жирных кислот. Таким образом, в отличие от милдроната, триметазидин не тормозит транспорт жирных кислот в митохондрии [3,10]. В соответствии с данными экспериментальных исследований, было доказано, что триметазидин оказывает выраженное цитопротективное, противоишемическое и антигипоксическое действие на сердечную мышцу, усиливая синтез АТФ в ишемизированном миокарде за счет переключения энергетического метаболизма с окисления жирных кислот на окисление глюкозы [3]. Милдронат также обладает цитопротективным, антиангинальным и антиоксидантным действием за счет уменьшения поступления жирных кислот в цитозоль и митохондрии, торможения β-окисления, восстановления транспорта АТФ из митохондрии в цитозоль [10].
В настоящее время для лечения ИБС применяют методы хирургической реваскуляризации миокарда. Одним из них является транслюминальная баллонная ангиопластика (ТЛАП), которая широко используется при лечении стабильной стенокардии [7]. Однако во время проведения баллонной ангиопластики и стентирования коронарных артерий возможно возникновение ишемии миокарда как следствия проводимой лечебной манипуляции, приводящей к развитию различных осложнений как в интраоперационном, так и послеоперационном периоде [1]. При этом известно, что препараты цитопротекторного действия, за счет уменьшения продукции свободных радикалов, способны уменьшать ишемическое и реперфузионное повреждение миокарда во время проведения хирургической реваскуляризации миокарда.
Целью нашего исследования являлась оценка изменений показателей перекисного окисления липидов (ПОЛ) у пациентов стабильной стенокардией напряжения на фоне лечения препаратами милдронат и триметазидин (предуктал МВ) до и после проведения баллонной ангиопластики и/или стентирования коронарных артерий.
Материалы и методы
В исследование было включено 55 пациентов со стабильной стенокардией, в возрасте от 35 до 65 лет, которым планировалось проведение баллонной ангиопластики и /или стентирования коронарных артерий с высоким риском развития ишемических осложнений: поражение одной и более магистральных коронарных артерий, устьевые и проксимальные поражения одной коронарной артерии, кровоснабжающей большую часть жизнеспособного миокарда, обширные участки дисфункции миокарда в сочетании с поражением одной коронарной артерии, кровоснабжающей большую часть жизнеспособного миокарда. Критериями исключения являлись: поражение ствола левой коронарной артерии, наличие инфаркта миокарда в течение последнего месяца, поражение клапанного аппарата сердца с нарушением центральной и внутрисердечной гемодинамики, аневризма верхушки сердца, фракция выброса менее 40%, хронические нарушения сердечного ритма и проводимости.
Все больные были разделены на 3 группы. В первой группе больных к стандартной терапии ИБС, включающей применение нитратов, бета-блокаторов, антагонистов кальция, иАПФ, дезагрегантов, добавляли милдронат в дозировке 750 мг в сутки в течение 3 дней, затем по 750 мг в сутки два раза в неделю, во второй группе к стандартной терапии добавляли триметазидин ( предуктал МВ) в дозе 70 мг/сутки, третья (контрольная) группа получала стандартную терапию ИБС.
Характеристики групп больных представлены в табл. 1 и 2. Пациентам проводилось определение показателей ПОЛ: исходно, на 8-10 сутки терапии и в первые сутки после ТЛАП и стентирования по трем показателям: малоновый диальдегид (МДА), супероксиддисмутаза (СОД) и глутатионпероксидаза (ГП).
Результаты
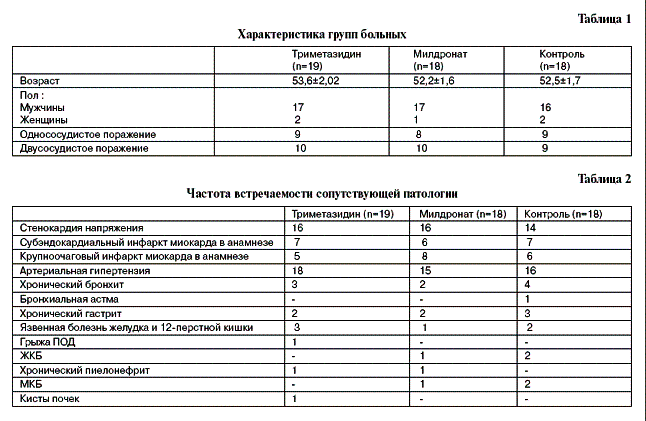
На фоне терапии препаратами, обладающими цитопротекторными свойствами, отмечается достоверное повышение уровня СОД – с 404,06±13,6 до 458,27±11,4 (р<0,001) в группе пациентов, получавших милдронат, и в группе пациентов, получавших триметазидин – с 401,97±13,8 до 459,63±13,2 Е/мл эр (р<0,001) и уровня ГП – с 4,12±0,18 до 4,62±0,16 (p<0,001) в группе I и с 4,1±0,15 до 4,68±0,13 мкмоль/млхмин (р<0,001) – в группе II, а также достоверное снижение МДА как в группе пациентов, получавших милдронат – с 6,02±0,18 до 4,72±0,2 (р<0,001), так и в группе пациентов, получавших триметазидин, – с 6,23±0,19 до 4,81±0,14 мкмоль/л (р<0,001). На фоне стандартной терапии наблюдается тенденция к повышению показателей СОД – с 400,0±10,4 до 414,78±15,8 Е/мл эр (р>0,05), достоверное повышение уровня ГП – с 4,25±0,18 до 4,54±0,16 мкмоль/млхмин (р<0,01) и достоверное снижение МДА – с 6,03±0,26 до 5,39±0,32 мкмоль/л (р<0,01). В первые сутки после ТЛАП и стентирования СОД достоверно повышается как в I группе – 488,61±7,2 (р<0,01) и во II группе – 476,2±13,1 Е/мл эр (р<0,001), так и в контрольной группе – 443,95±13,7 Е/мл эр (р<0,01); ГП достоверно повышается как в группе пациентов, получавших милдронат, – 5,04±0,14 (р<0,001), так и в группе пациентов, получавших триметазидин, – 5,33±0,19 мкмоль/млхмин (р<0,01), тогда как в контрольной группе показатель ГП практически не изменяется – 4,45±0,17 мкмоль/ млхмин (р>0,05). Также достоверно повышается МДА и в I группе составляет 5,26±0,26 (p<0,01), во II группе – 6,26±0,3 мкмоль/л (р<0,01), в контрольной группе – 7,19±0,38 мкмоль/л (р<0,001). Динамика описанных показателей ПОЛ представлена на рисунке.
Обсуждение
Проводимая больным стабильной стенокардией антиангинальная терапия призвана максимально оптимизировать соотношение между потребностями сердца в кислороде, с одной стороны, и его доставкой к миокарду– с другой. Основным механизмом действия большинства современных препаратов (нитраты, бета-блокаторы, антагонисты кальция) является гемодинамическая разгрузка миокарда путем уменьшения частоты сердечных сокращений, пред– и постнагрузки. Исходя из этого, можно говорить о том, что данные группы препаратов оказывают опосредованное влияние на кислородное обеспечение миокарда [9]. В последние годы разрабатываются принципиально новые подходы к лечению пациентов с ишемической болезнью сердца (ИБС), основанные на использовании лекарственных препаратов, нивелирующих нарушения метаболизма в ишемизированных кардиомиоцитах [3]. Известно, что ишемия приводит к активизации перекисного окисления липидов с образованием свободных радикалов, которые в свою очередь, оказывают повреждающее действие на
кардиомиоцит [4]. Регуляция процессов свободнорадикального окисления находится под контролем таких ферментов, как супероксиддисмутаза и глутатионпероксидаза, активность которых в условиях ишемии заметно снижается [8]. Полученные нами данные говорят о том, что в группе пациентов со стабильной стенокардией, получающих как милдронат, так и триметазидин, происходит достоверное снижение в крови продуктов ПОЛ (МДА) за счет активации защитных антиоксидантных ферментов, так как в обеих группах происходит достоверное повышение уровня СОД и ГП. После проведения ТЛАП и стентирования коронарных артерий в группе пациентов, получавших милдронат, отмечается достоверное повышение МДА по сравнению с показателем, полученным перед хирургической реваскуляризацией, но остается достоверно более низким, чем исходный.
Активность антиоксидантных ферментов продолжает увеличиваться после проведения ТЛАП. Полученные данные позволяют судить о способности милдроната уменьшать процессы ПОЛ у пациентов со стабильной стенокардией, а также после реваскуляризации миокарда за счет активации защитных антиоксидантных ферментов. В группе пациентов, получавших триметазидин, также не удается избежать активации процессов ПОЛ, т.к. происходит достоверное повышение МДА. Также происходит дальнейшее повышение антиоксидантных ферментов (СОД, ГП). Однако, в этой группе активность ГП наиболее высока по сравнению с группой пациентов, получавших милдронат, а т.к. ГП относится к ферментам, обладающим более выраженной антиоксидантной активностью, то можно говорить о том, что антиоксидантное действие наиболее выражено у триметазидина. Известно, что ГП является наиболее эффективным природным антиоксидантом плазмы крови, участвующим в защите ЛПНП от атерогенной окислительной модификации [3]. Поэтому можно сказать, что данный фермент оказывает именно непрямой антиоксидантный эффект, воздействуя на активность защитных ферментов. Триметазидин не является прямым антиоксидантом, т.к не взаимодействует напрямую со свободным радикалом, он действует опосредованно, за счет активации антиоксидантных ферментов наибольшей степени – повышения уровня ГП [3, 8]. В контрольной группе, получавшей стандартную терапию ИБС, отмечается достоверное уменьшение МДА с сопутствующим увеличением активности ГП, также происходит незначительное повышение СОД. Скорее всего, это связано с приемом лекарственных препаратов, назначаемых при терапии стабильной стенокардии – таких, как бета-блокаторы, иАПФ. Однако после ТЛАП у пациентов этой группы не удается избежать активации процессов ПОЛ, что отражает достоверное повышение МДА к концу первых суток после реваскуляризации миокарда, также отмечатся достоверное повышение СОД в первые сутки после ТЛАП. Учитывая, что достоверных данных о повышении ГП в данной группе нет, можно говорить о том, что увеличение активности СОД недостаточно для уменьшения ПОЛ, т.к ГП является одним из наиболее активных антиоксидантных ферментов. Поэтому недостаточная активация защитных антиоксидантных систем привела к наиболее выраженной, по сравнению с группами пациентов, получавших препараты цитопротекторного действия (милдронат, триметазидин), активации процессов ПОЛ и повышению МДА после хирургической реваскуляризации миокарда, в процессе которой возникает ишемия и, как следствие этого, активиция свободнорадикальных процессов в кардиомиоцитах. И милдронат, и триметазидин являются ингибиторами бета-окисления жирных кислот в ишемизированных кардиомиоцитах, тем самым влияя на ключевое звено метаболизма в условиях ишемии.
Так как в процессе ТЛАП и стентирования коронарных артерий неизбежно возникает интраоперационная ишемия миокарда, это, в свою очередь, способствует активизации свободнорадикальных процессов в кардиомиоцитах и проявляется прямой корреляционной связью между состоянием продуктов ПОЛ и защитных антиоксидантных систем в условиях ишемии[2, 4, 8]. На фоне лечения милдронатом и предукталом в первые сутки после реваскуляризации наблюдается повышение активности защитных ферментов – СОД и ГП, вследствие чего происходит снижение активности процессов ПОЛ и повреждающего действия свободных радикалов на кардиомиоциты.
Литература
1. Бабунашвили А.М., Рабкин И.Х., Иванов В.А. Коронарная ангиопластика// Москва, 1996, с.188-224
2. Ланкин В.З., Тихадзе А.К., Беленков Ю.Н. «Антиоксиданты в комплексной терапии атеросклероза: pro et contra» //Кардиология, №2, 2004, с.72-81
3. Ланкин В.З., Тихадзе А.К., Жарова Е.А., Беленков Ю.Н. Исследование антиоксидантных свойств цитопротекторного препарата триметазидина //Кардиология, том 41. №3, 2001, с.21-28
4. Ланкин В.З., Тихадзе А.К., Беленков Ю.Н. «Свободнорадикальные процессы при заболеваниях сердечно-сосудистой системы» //Кардиология, том 40, №7,2000, с.48-61
5. Ланкин В.З., Тихадзе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях (Пособие для врачей). Издание 2Fе, исправленное и дополненное//М:РКНПК МЗ РФ 2001,78
6. Ланкин В.З., Тихадзе А.К., Осис Ю.Г. Моделирование каскада ферменных реакции в липосомах, включающих свободнорадикальное окисление, восстановление и гидролиз полиеновых анилов фосфолипидов для исследования влияния этих процессов на структурно-динамиеческие параметры мембраны //Биохимия, 2002, №5, с.679-689
7. «Лечение стабильной стенокардии» Рекомендации специальной комиссии Европейского общества кардиологов//Прил. РМЖ, т.2,№1, 1998
8. Маколкин В.И., Глезер М.Г., Жарова Е.А., Капелько В.И., Карпов Ю.А., Ланкин В.З., Сыркин А.Л. Ишемия миокарда: от понимания механизмов к адекватному лечению// Кардиология, том 40, №9, 2000,
9. Сыркин А.Л., Добровольский А.В. «Антиишемические препараты метаболического действия» //Consilium Medicum том 4, №11, 2002, с.572-575
10. Неверов И.В. Место антиоксидантов в комплексной терапии пожилых больных ИБС//РМЖ том 9, №18, 2001
11. Ferrari R Metabolic disturbances during myocardial ischemia and reperfusion//Am. J. Cardiol 1995;76Abstract
This article is focused on myocardial cytoprotectors – mildronate and trimethazidine (Preductal MB)- influence on free-radical myocardial processes in stable angina patients before and after transluminal coronary angioplasty and coronary stenting. Administration of these medications before myocardial revascularization facilitated decrease in free-radical peroxidation, due to activation of protective antioxidant enzymes.
Keywords: Angina, lipid peroxidation, myocardial cytoprotectors, balloon angioplasty, stenting.
Поступила 21/02/2005
Май 2006 г.