Опубликовано в журнале, Фарматека, № 6 - 2012Мексидол в консервативном лечении пояснично-крестцовых радикулопатий
Е.Б. Лихачева - кандидат медицинских наук, ассистент кафедры нервных болезней
ГОУ ВПО "Саратовский государственный медицинский университет им. В.И. Разумовского" Росздрава, СаратовПредставлены результаты исследования эффективности применения антиоксиданта Мексидола (2-этил-6-метил-3-гидроксипиридина сукцинат) 205 пациентами с клиническими проявлениями пояснично-крестцовых радикулопатий (ПКР). Больные были распределены в две группы и далее в подгруппы в зависимости от наличия двигательных нарушений. Всем больным был проведен курс общепринятого медикаментозного лечения и физиотерапии, в основной группе дополнительно применяли Мексидол. В дальнейшем был проведен клинико-неврологический контроль отдаленных результатов лечения в подгруппах больных. Результаты исследования показали, что применение Мексидола в составе комплексной терапии больных ПКР по сравнению с общепринятой терапией значительно и стойко уменьшает выраженность болевого синдрома, ускоряет восстановление функции спинномозговых корешков и периферических нервов.
Ключевые слова: пояснично-крестцовые радикулопатии, болевой синдром, двигательные нарушения, нейропротекторные средства, Мексидол
The article presents the results of evaluation of the effectiveness of use of antioxidant Mexidol (2-ethyl-6-methyl-3-hydroxypyridine succinate) in 205 patients with clinical manifestations of lumbosacral radiculopathy (LSR). Patients were divided into two groups, and further were divided into subgroups depending on the presence of motor disturbances. All patients received a course of conventional medical treatment and physiotherapy; main group additionally received Mexidol. Thereafter, clinical-neurological control of long-term results of treatment in subgroups of patients was performed. The results showed that the use of Mexidol in the combined therapy of patients with LSR lead to significant and persistent reduction of severity of pain syndrome and rapid recovery of function of spinal roots and peripheral nerves compared with conventional therapy.
Key words: lumbosacral radiculopathy, pain syndrome, motor disturbances, neuroprotective agents, Mexidol
Пояснично-крестцовые радикулопатии (ПКР) достаточно часто встречаются в клинической практике, а в структуре патологии периферической нервной системы занимают ведущее место, составив 70% [8]. По числу лиц с временной утратой трудоспособности радикулопатии занимают второе место после травм.
По современным представлениям, причиной ПКР могут быть вертеброгенные (чаще всего остеохондроз позвоночника) и невертеброгенные факторы. Корешковые синдромы выявляются среди 37,4% больных остеохондрозом позвоночника [11]. По данным собственных наблюдений, провоцирующим фактором развития ПКР в 13,7% случаев было переохлаждение, в 4,4% - перенесенная вирусная инфекция, в 30,7% - тяжелая физическая нагрузка, а подавляющее большинство (51,2%) больных указывают на сочетание 1-3 факторов. При вертеброгенном поражении корешка, связанном со сложностью его взаимоотношений с образованиями позвоночного канала, проявляется действие вегетативно-сосудистых, реактивно- воспалительных, застойных и других факторов, а клинические проявления корешковых расстройств зависят от степени вовлечения корешков в патологический процесс [1]. Сегментарная демиелинизация, возникающая при таком типе повреждения, тем выраженнее, чем интенсивнее и продолжительнее фактор давления [20]. Повреждение волокон нервного корешка в результате механического воздействия на него грыжи межпозвонкового диска носит смешанный характер: часть волокон подвергается сегментарной демиелинизации, другая часть - валлеровскому перерождению [21, 23]. Нарушение ультраструктуры нервных волокон корешка приводит к негативному изменению его физиологических функций - страдают проведение электрических импульсов и аксональный транспорт. Блокада электрических импульсов приводит к двигательным и чувствительным расстройствам в соответствующих миотоме и дерматоме. Несомненным является тот факт, что при ПКР в условиях гипоксии и отека корешка нарушается одна из важнейших функций нервной клетки - обеспечение трофическими факторами и обмен веществ между телом нейрона и его отростками. Блок аксонального транспорта в ортоградном направлении угнетает трофическое влияние нерва на иннервируемые ткани. Блок ретроградного транспорта сказывается на жизнедеятельности нервной клетки, угнетает и изменяет ее метаболизм, вызывая увеличение ее регенеративного потенциала. Замечено, что чем ближе к телу клетки повреждается аксон, тем более грубая дегенеративная реакция в нервной клетке и тем больше риск ее гибели. Поэтому повреждение нервного корешка может приводить к более существенным, чем повреждение периферического нерва, последствиям [11, 15].
Имеются работы, посвященные роли перекисного окисления липидов (ПОЛ) в развитии гипоксии нервной ткани, при которой происходит усиление свободно-радикального окисления в липидном слое ее биологических мембран. В частности, у больных ПКР отмечается активация ПОЛ, проявляющаяся в повышении уровня диеновых конъюгатов и малонового диальдегида [7, 17]. При ПКР продукты распада и токсины из мест дегенерации корешка за счет большего проксимально-дистального аксоплазменного градиента стремительно переносятся в нижние отделы сплетения, периферические нервы, вызывая там процессы, которые клинически проявляются дистальными парезами. С помощью ретроградного транспорта те же продукты распада попадают в тело нервной клетки, нарушая работу ее цитоплазменных структур и изменяя защитную функцию всего неврального аппарата. В результате происходят уменьшение выработки миелина, дальнейшее повреждение гемато-неврального барьера (вторичная демиелинизация), в итоге - хронизация заболевания [8].
Лечение пациентов с данной патологией комплексное. Важнейшим должно быть этиологическое лечение, однако принципы его в настоящий момент недостаточно разработаны.
Основные направления лекарственной терапии:
Этот далеко не полный перечень основных медикаментозных средств, которые можно применять в лечении ПКР, позволяет выбирать индивидуальную схему для конкретного больного в зависимости от патогенеза ведущих клинических симптомов. Основная часть лекарственных препаратов, используемых в консервативной терапии ПКР, имеет много противопоказаний и побочных эффектов.
- купирование основных механизмов раздражения синувертебрального нерва, устранение сосудистых и дистрофических изменений в области экстравертебральных очагов (стероидные и нестероидные противовоспалительные средства, сосудистые препараты, миорелаксанты);
- активизация трофических процессов (биогенные стимуляторы, протеолитические ферменты, хондропротекторы, препараты витаминов, анаболические препараты);
- симптоматическая терапия (транквилизаторы, антидепрессанты, гастропротекторы).
Поэтому тактика лечения должна быть направлена на рациональное назначение лекарственных препаратов, не допуская полипрагмазии.
В связи с этим лечение нервных расстройств, в основе которых лежит дефицит трофических веществ, должно заключаться в восполнении этого дефицита. С учетом общности патогенетических механизмов поражения центральной и периферической нервной системы при ряде заболеваний представляет интерес изучение эффективности применения при ПКР отечественного нейропротекторного препарата Мексидол.
Мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат) является антиоксидантом, ингибитором свободных радикалов, мембранопротектором, уменьшает активацию ПОЛ, повышает активность антиоксиднтной системы, активируя физиологическую систему ферментов (супероксиддисмутазу, каталазу, ферменты системы глутатиона). Мексидол подвергается метаболизму в печени, и в процессе гидролиза из него освобождается сукцинат. Протективное действие Мексидола в печени можно объяснить его мембраностабилизирующим действием, в результате которого наблюдаются угнетение ПОЛ мембран и изменение их фосфолипидного состава, а также нормализация функционирования мембраносвязанных ферментов. Наряду с этим сукцинат Мексидола легко проникает в клетки и окисляется в цикле трикарбоновых кислот, что способствует поддержанию уровня макроэргов при стрессорной гипоксии [7]. Нейропротекторное действие Мексидола проявляется в восстановлении нарушенных при различной патологии структуры и функций мембран; модулирующем влиянии на мембраносвязанные ферменты, ионные каналы, транспортеры нейромедиаторов, рецепторные комплексы, в т. ч. бензодиазепиновый, γ-аминомасляный, ацетилхолиновый; оптимизации синаптической передачи между структурами центральной нервной системы. Мексидол улучшает мозговой метаболизм и кровоснабжение мозга, улучшает реологические свойства крови; подавляет агрегацию тромбоцитов, улучшает деятельность иммунной системы. Антигипоксическое действие Мексидола проявляется в снижении потребности нейронов в кислороде в условиях гипоксии. Мексидол оказывает антиатерогенное действие, вызывая регресс атеросклеротических изменений в артериях и восстанавливая липидный гомеостаз путем уменьшения уровня общего холестерина и липопротеидов низкой плотности, замедляет процесс старения. Таким образом, Мексидол обладает широким спектром фармакологических эффектов, проявляющихся как на нейрональном, так и на сосудистом уровнях. Он оказывает церебропротекторное, противогипоксическое, транквилизирующее, антистрессорное, ноотропное (улучшение памяти, внимания, умственной работоспособности), антиалкогольное, противосудорожное, противопаркинсоническое, вегетотропное действия. У Мексидола практически отсутствуют побочные эффекты (кроме индивидуальной непереносимости), он имеет низкую токсичность.
Целью исследования был сравнительный анализ применения Мексидола в составе комплексного лечения ПКР.
Материал и методы
Проведено обследование и лечение 205 больных с клиническими проявлениями ПКР (104 женщины и 101 мужчина). Возраст больных составил от 18 до 74 лет. Больные были разделены на две сопоставимые по полу и возрасту группы - основную (ОГ) и группу сравнения (ГС). Численность ОГ составила 110 человек (56 мужчин и 54 женщины), ГС - 95 (49 мужчин и 46 женщин). В исследовании также участвовали 30 практически здоровых человек в качестве группы контроля. Наличие пареза отдельных мышц либо пареза мышц стопы (сгибательной и/или разгибательной группы) стало основным критерием, по которому больные были разделены на подгруппы, поскольку именно двигательные нарушения свидетельствуют о выраженных клинических проявлениях ПКР, приводящих к длительной нетрудоспособности или инвалидизации больных. В 1-ю подгруппу ОГ (ПОГ-1) вошли 87 (79,1%) пациентов с чувствительными и рефлекторными нарушениями, в 1-ю подгруппу ГС (ПГС-1) - 79 (83,2%). Подгруппы 2 (ПОГ-2 и ПГС-2) составили пациенты с чувствительными и рефлекторными нарушениями в сочетании с периферическим дистальным парезом мышц нижней конечности численностью 23 (20,9%) и 16 (16,8%) соответственно. Всем больным проведен курс общепринятой медикаментозной и физиотерапии, в ОГ дополнительно применен Мексидол по 2 мл 5%-ного раствора 2 раза/сут внутримышечно или внутривенно 10-20 дней в зависимости от клинической картины и тяжести состояния больного. Затем Мексидол принимали перорально по 250 мг (2 таблетки) 3 раза/сут до 2 месяцев, т. е. пациенты продолжали прием препарата в амбулаторных условиях.В динамике в обеих группах провели тщательное неврологическое обследование, клинико-лабораторное и биохимическое исследования (уровни сиаловых кислот, фибриногена, С-реактивного белка), стимуляционную электронейромиографию (ЭНМГ), нейровизуализирующие методики (компьютерную томографию, ядерно-магнитнорезонансную томографию). Клинико-неврологические методы исследования дополнили обследованием пациентов по шкалам и опросникам: визуальной аналоговой шкале боли (ВАШ); опроснику Роланда-Морриса "Боль в нижней части спины и нарушение жизнедеятельности"; Шкале оценки адаптационного статуса больных с патологией позвоночника [4, 18, 22, 25]. Магнитно-резонансная томография (МРТ) в положении лежа в сагиттальной и фронтальной плоскостях проведена на аппарате "Образ-2 " (Россия) с напряженностью магнитного поля 0,14 Тс, толщиной "среза" 4 мм. ЭНМГ проводилась по стандартным методикам [2, 3] на аппарате "Нейромиан" (Таганрог, Россия) всем больным ОГ и 55 пациентам ГС. С помощью стимуляционной определяли прямой мышечный ответ (М-ответ), амплитуду измеряли в милливольтах (мВ) от пика до пика [3]. Кроме амплитуды оценены латентный период (мс), скорость проведения импульса (СПИ). С помощью параметров F-волны (частоты ее возникновения, латентности) оценили состояние мотонейронов и их аксонов на самом проксимальном участке. В качестве нормативов были использованы показатели контрольной группы (30 практически здоровых людей). Статистическая обработка полученных данных осуществлялась с помощью программы С. Гланца "Медико-биологическая статистика" [9].
Результаты исследования
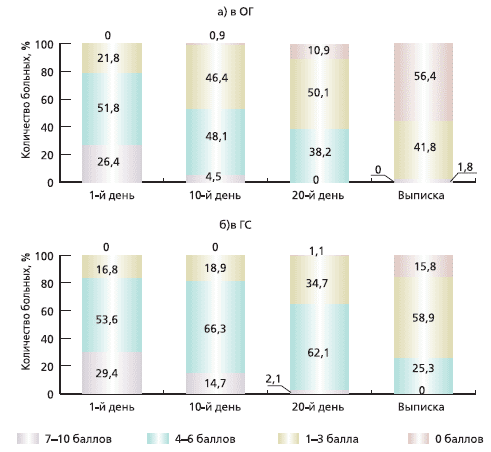
Диагноз ПКР был поставлен пациентам обеих групп на основании подробного сбора анамнеза и тщательного неврологического обследования. Следует отметить, что в ОГ у 19 (17,3%) больных заболевание было выявлено впервые, у остальных 91 (82,7 %) - повторно, в ГС - 14 (14,7 %) и 81 (85,3%) соответственно. Практически всем обратившимся за стационарной помощью был проведен курс амбулаторного лечения, который или не дал положительного результата, или ожидаемый эффект был неполным. Так как все больные в сравниваемых группах испытывали болевые ощущения в той или иной мере, большое внимание уделялось оценке регресса болевого синдрома. Наиболее простым и информативными тестом для количественной оценки восприятия боли, по мнению ряда исследователей [4], является визуальная аналоговая шкала (ВАШ), которая представляет собой отрезок прямой линии длиной 10 см, где начальная точка (ноль) соответствует отсутствию боли, а конечная (десять) - невыносимым болевым ощущениям. Больному предлагали на данном отрезке изобразить силу испытываемой боли ежедневно в течение всего периода обследования, что позволило оценить динамику восприятия пациентом своих болевых ощущений и эффективность проводимой терапии. В ГС выраженный болевой синдром (7-10 баллов) наблюдался у 29,4% пациентов, средней интенсивности (4-6 баллов) - у 53,6%, умеренный (1-3 балла) - в 16,8% случаев (28, 51 и 16 человек соответственно). В ОГ те же показатели распределились следующим образом: 7-10 баллов - 26,4% (29), 4-6 балла - 51,8% (57) и 1-3 балла -21,8% (24). После завершения курса лечения при оценке болевого синдрома в ОГ снижение боли на 5 и более баллов отмечено у 48 (43,6%) пациентов, снижение на 1-4 балла - у 62 (56,4%). В ГС снижение на 5 баллов и более наблюдалось у 8 (8,4%) пациентов, на 1-4 балла - у 48 (50,5%), без динамики - у 38 (40%), усиление боли отмечено в 1 (1,05%) случае. Таким образом, при проведении комплексной терапии с использованием Мексидола результаты по уменьшению интенсивности болевого синдрома в ОГ значительно оптимистичнее, нежели в ГС.Динамика снижения интенсивности болевого синдрома в процессе лечения представлена на рис. 1а, б, на котором видно, что в ОГ наибольший темп снижения боли происходит с 10-го по 20-й день лечения, причем ко дню выписки (25-30-й день) более чем у 50% пациентов болевой синдром полностью купируется, у остальных становится умеренным, что требует применения обезболивающих средств лишь периодически. В ГС (рис. 1б) также наблюдается регресс болевого синдрома, но менее значительный, чем в ОГ. К моменту завершения курса лечения в ГС преобладают пациенты (51,6%) с умеренным болевым синдромом, однако остается значительным (25,3%) число лиц с болью средней интенсивности, требующей постоянного приема обезболивающих средств.
Рис. 1. Динамика интенсивности болевого синдрома по ВАШ
У больных ПКР в сравниваемых группах до лечения выявлена различная неврологическая симптоматика в виде анизорефлексии, симптомов натяжения (Ласега, Нери, Дежерина, Бонне, Вассермана, Сикара), изменения статики и динамики позвоночника, мышечно-тонический синдром, выпадение чувствительности в соответствующих дерматомах, вегетативно-трофические расстройства (сухость кожи, поредение волосяного покрова на нижних конечностях, гиперкератоз стоп), в ряде случаев отмечено снижение силы в отдельных мышечных группах.
Подавляющее большинство пациентов: 92 (83,6%) - в ОГ и 88 (92,6%) - в ГС имели одностороннее поражение, 18 (16,4%) и 7 (7,4%) человек соответственно - двустороннее. Оценивая динамику клинических симптомов в обеих группах, следует отметить, что в ОГ все пациенты, кроме одного, претерпели обратное развитие мышечно-тонического синдрома, тогда как в ГС - только 6 (33,3%) из 18; у 72 (69,2%) больных ОГ купировались симптомы натяжения, в ГС - лишь у 11 (11,6%). Наблюдалась динамика в рефлекторной сфере: восстановление (полное или частичное) зарегистрировано в ОГ у 40 (42,6%) больных, в ГС - у 14 (16,3%). У остальных пациентов динамики не отмечено. Положительная динамика в восстановлении чувствительности имела место в ОГ у 36 (36,7%) пациентов, в ГС - у 13 (14,6%); мышечной силы в ОГ у 5 (21,7%) пациентов, в ГС - у 1 (6,3%). Отрицательной динамики не отмечено. Таким образом, наиболее значительный регресс неврологического дефицита был достигнут в ОГ, особенно в отношении мышечно-тонического синдрома и симптомов натяжения, которые вкупе с болью причиняют больным наибольшие страдания.
Кроме того, следует отметить более быстрое, нежели в ГС, восстановление рефлексов и чувствительности, что может свидетельствовать об уменьшении воспалительных и гипоксических нарушений в корешке и периферических нервах, уменьшении отека, а также начавшихся процессах ремиелинизации. В ОГ отмечена положительная тенденция в восстановлении двигательной активности у пациентов с дистальными парезами: у 5 (21,7%) - полное восстановление, у остальных 18 (78,3%) - положительная динамика; в ГС-полное восстановление у 1 (6,2%) больного, положительная динамика - у 4 (25%) пациентов, без динамики - у 11 (68,8%). Следует отметить, что полное восстановление было зарегистрировано среди пациентов с изначально нетяжелыми парезами (3,5-4,5 балла) и относительно небольшим "стажем" заболевания (до 6 месяцев). При субъективной оценке эффективности лечения в ОГ "улучшение" отметили 108 (98,2%) пациентов, в ГС - 37 (38,9%).
Данные опросника Роланда- Морриса "Боль в нижней части спины и нарушение жизнедеятельности" до лечения выявили выраженное нарушение всех сторон жизнедеятельности больных, особенно активного пердвижения вне дома и эмоционально-психической сферы, сна. Общее число пунктов у больных составило в ПОГ-1 - 11,6 ± 0,4; в ПГС-1 - 11,3 ± 0,6; в ПОГ-2 - 13,2 ± 0,9 и в ПГС-2 - 14,2 ± 0,8. Наличие дистального пареза значительно ухудшало многие стороны повседневной жизни больных (p<0,05). После лечения средние значения общего числа пунктов у больных составили в ПОГ-1 - 6,8 ± 0,3; в ПГС-1 - 9,6 ± 0,8; в ПОГ-2 - 8,1 ± 0,5 и в ПГС-2 - 11,9 ± 0,6. В подгруппах ОГ различия между показателями до и после лечения были существенными (р<0,001). В ГС улучшение (р<0,05) было достигнуто после лечения только в ПГС-2. Комплексное лечение с включением Мексидола оказало положительное влияние на восстановление сна и уменьшение эмоциональных переживаний, особенно убедительным был отказ от внешней опоры 13 (56,5%) пациентов ПОГ-2, что свидетельствовало о значительном улучшении двигательной функции.
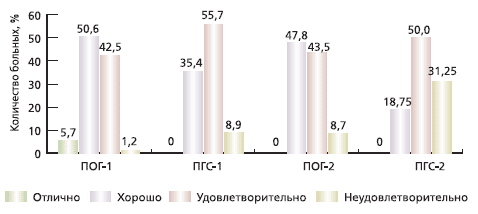
Для объективной оценки показателя утраты способности к самообслуживанию по Шкале оценки адаптационного статуса больных с патологией позвоночника высчитывалась степень дезадаптации (СД), составившая до лечения в ПОГ-2 37,6 ± 2,2 %, в ПГС-2 - 36,8 ± 1,8%, в ПОГ-1 - 22,4 ± 1,2%, в ПГС-1 - 24,2 ± 1,4%. Различия между подгруппами внутри групп были существенными (p<0,001). После лечения более значимое снижение СД выявлено среди пациентов ОГ: в ПОГ-1 - на 80,4%, в ПГС-1 - на 47,1 %; у больных с парезами: в ПОГ-2 - на 37,8%, в ПГС-2 - только на 15,2%. СД значительно (p<0,001) уменьшилась среди пациентов ПОГ-1, ПОГ-2 и ПГС-1; в ПГС-2 существенного снижения добиться не удалось (p >0,05). Результаты терапии оценивали по коэффициенту эффективности проведенного лечения. Отличные результаты наблюдались только в ПОГ-1. В основном у больных в группах преобладали хорошие и удовлетворительные результаты лечения с явным преобладанием хороших оценок в ОГ (рис. 2). Неудовлетворительные результаты в ПГС-2 превысили 30%.
Рис. 2. Объективная оценка эффективности проведенного лечения у больных ПКР
По данным рентгенологического исследования и МРТ, у всех больных обеих групп выявлены признаки остеохондроза позвоночника, спондилеза и спондилоартроза (от 1-2 позвонков до полного поражения пояснично-крестцового отдела). Грыжи Шморля диагностированы в 9 (4,4%) случаях, у 1 больного множественные; в 100% случаев выявлены межпозвонковые задние протрузии и (или) грыжи: у 28 (13,7%) - срединная, у 147 (71,7%) - парамедианная, у 30 (14,6 %) - боковая, в т. ч. множественные у 25 (12,2%) больных. Локализация протрузий и грыж была следующей: у 128 (62,4%) пациентов на уровнях L5-S1, у 71 (34,6%) - L4-L5, у 4 (1,95%) - L3-L4, по одному (0,5%) - на уровнях L2-L3 и L1-L2. В 133 (64,8%) случаях протрузии и грыжи компремировали переднюю стенку дурального мешка, в 20 (9,8%) - отмечено нарушение ликвородинамики. Поясничный стеноз был выявлен в 47 (22,9%) случаях.
При сопоставлении клинической картины с результатами МРТ в 181 (88,3%) случае выявлено соответствие уровня локализации и направления выпячивания с уровнем выявленной радикулопатии, что говорит о высокой чувствительности данного метода обследования. В остальных случаях локализация протрузии или грыжи не соответствовала стороне и уровню радикулопатии. К примеру, у больного З. были выявлены задние срединные протрузии дисков L1-L2 и L2-L3 размером 3,0 и 3,5 мм без признаков компрессии дурального мешка, а клинически и по результатам ЭНМГ определена двусторонняя радикулопатия L5, S1 c вторичным аксонально демиелинизирующим поражением обоих большеберцовых нервов.
Результаты ЭНМГ представлены в таблице.
Таблица Динамика ЭНМГ в подгруппах больных ПКР (M ± m)
ЭНМГ-феномен Точки стимуляции ОГ, n = 110; до/после лечения ГС, n = 55; до/после лечения Контроль, n = 30 ПОГ-1, n = 87 ПОГ-2, n = 23 ПГС-1, n = 39 ПГС-2, n = 16 Амплитуда М-ответа, мВ n. tibialis 4,75 ± 0,44/
5,12 ± 0,282,02 ± 0,39/
3,54 ± 0,64*4,91 ± 0,41/
4,98 ± 0,532,12 ± 0,38 /
2,22 ± 0,84 #5,78 ± 1,2 n. peroneus 4,59 ± 0,38/
4,98 ± 0,391,69 ± 0,34/
3,14 ± 0,55 *4,78 ± 0,32/
4,81 ± 0,411,96 ± 0,36/
2,24 ± 0,35 #5,65 ± 1,05 Терминальная латентность М-ответа, мс n. tibialis 5,68 ± 0,41/
5,52 ± 0,327,09 ± 0,36/
5,94 ± 0,22 *5,81 ± 0,23/
5,73 ± 0,297,37 ± 0,42/
6,98 ± 0,455,46 ± 0,65 n. peroneus 4,95 ± 0,55/
4,65 ± 0,345,45 ± 0,37/
5,21 ± 0,334,89 ± 0,61/
4,66 ± 0,425,61 ± 0,46/
5,63 ± 0,34,88 ± 0,76 СПИ по ДВ, м/с n. tibialis 35,1 ± 1,18/
42,9 ± 1,32 **29,3 ± 1,43/
39,9 ± 1,24 **,#34,9 ± 1,28/
38,6 ± 1,65 ##29,9 ± 1,36/
33,5 ± 1,74 ##47,8 ± 2,13 n. peroneus 37,2 ± 1,27/
40,6 ± 1,12*33,4 ± 1,23/
37,9 ± 1,27 *, #38,6± 1,12/
38,7± 1,2834,3 ± 1,24/
34,6 ± 1,4 #42,3 ± 1,52 Латентность F-волны, мс n. tibialis 45,92 ± 2,2/
39,54 ± 2,1 *47,85 ± 3,2/
41,23 ± 2,845,89 ± 2, /
45,12 ± 1,9 #48,12 ± 1,6/
48,11 ± 1,8 #37,0 ± 3,9 n. peroneus 44,14 ± 2,5/
35,24 ± 2,8 *44,58 ± 3,6/
37,12 ± 2,2 *44,2 ± 2,8/
43,58 ± 2,1 #44,98 ± 2,9/
44,08 ± 2,3 #34,8 ± 3,1 Блокирование F-волны, % n. tibialis 65,9 ± 10,2/
41,2 ± 7,6 *67,9 ± 9,3/
40,3 ± 6,5 *66.2± 9,9/
59.3± 6,8 #68,5 ± 12,4/
61,5 ± 7,4 #23,9 ± 4,9 n. peroneus 68,7 ± 8,8/
32,4 ± 8,6 *71,2 ± 9,2/
41,2 ± 7,6 *69,9 ± 7,9/
56,5 ± 8,5#70,1 ± 8,4/
62,4 ± 9,6 #25,1 ± 4,3 Статистически значимые различия между показателями у пациентов до и после лечения (* p<0,05; ** p<0,001); # статистически значимые различия между показателями пациентов после лечения и показателями контрольной группы (# p<0,05; ## p<0,001).
По данным ЭНМГ, до лечения в обеих группах, даже при клиническом отсутствии двигательного дефицита, у пациентов с рефлекторными и чувствительными нарушениями выявлены признаки демиелинизации не только спинномозговых корешков, но и периферических нервов (см. таблицу). При этом формирование периферического дистального пареза мышц нижних конечностей возникало при аксонально-демиелинизирующем поражении периферических нервов, о чем свидетельствовало снижение амплитуды М-ответа (во вторых подгруппах p<0,05 по сравнению с ГК) и еще более выраженного (p<0,05), чем в первых подгруппах, уменьшения СПИ по двигательным волокнам (ДВ). Поражение большеберцовых нервов у больных парезами было более выраженным, поскольку выявлено еще и статистически значимое (p<0,05) по сравнению с ГК увеличение терминальной латентности. Исследование Н-рефлекса показало, что процессы демиелинизации затрагивали и чувствительные, и ДВ корешков S1-S2, и большеберцового нерва. Существенных различий латентности Н-рефлекса между подгруппами в ОГ и ГС обнаружено не было (p>0,05), показатели в подгруппах (ПОГ-1 - 33,2 ± 1,6 мс, ПОГ-2 - 35,6 ± 1,8, ПГС-1 - 32,9 ± 1,3, ПГС-2 - 36,1 ± 1,7 мс) были повышены и достоверно отличались от ГК (p<0,05). В результате проведенного лечения (см. таблицу) в ПОГ-2 существенно увеличилась (p<0,05) амплитуда М-ответа; статистически значимых различий с ГК не было (p>0,05); в ГС полученные результаты значительно отличались от ГК (p<0,05). Положительная динамика во вторых подгруппах в виде снижения терминальной латентности при стимуляции большеберцового нерва преобладала в ПОГ-2 (p<0,05). В подгруппах ОГ существенно увеличилась СПИ по ДВ большеберцового (p<0,001) и малоберцового (p<0,05) нервов, однако во вторых подгруппах результата ГК достичь не удалось, различия были существенными (p<0,05). В ГС значительного увеличения СПИ после лечения выявлено не было (p>0,05), полученные результаты (кроме СПИ по малоберцовому нерву в ПГС-1) знаметно отличались от таковых в ГК (p<0,001). В ОГ восстановление проводимости в корешках (уменьшение латентности F-волны) отмечено в обеих подгруппах, особенно в ПОГ-1. В ГС положительная динамика была незначительной в обеих подгруппах, результаты после лечения существенно отличались от таковых в ГК (p<0,05). Восстановление проведения нервного импульса (уменьшение латентности Н-рефлекса) выявлено в ПОГ-1 (29,1 ± 1,3 мс, p<0,05). В ПГС-1 (32,1 ± 1,5 мс) и ПОГ-2 (31,2 ± 1,4 мс) эффект был неполным; полученные значения достоверно не отличались от таковых в ГК (p>0,05). Лишь в ПГС-2 положительный эффект был незначительным (34,3 ± 1,6 мс).
Клинико-неврологический контроль отдаленных результатов лечения в подгруппах больных
Для проверки стойкости достигнутых результатов лечения и их оценки в более отдаленные сроки нами были обследованы 38 пациентов с ПКР спустя 6 месяцев после завершения лечения. На повторный визит явился 21 человек из ОГ (11 - из ПОГ-1 и 10 -из ПОГ-2) и 17 - из ГС (8 - из ПГС-1 и 9 - из ПГС-2). Сохранение или даже улучшение клинического эффекта на протяжении полугода было зарегистрировано у 17 (81,0%) из 21 больного в ОГ: 8 (72,7%) пациентов - из ПОГ-1 и 9 (90,0%) - из ПОГ-2 и лишь у 3 (17,6%) из 17 пациентов ГС (все из ПГС-1). Ухудшения состояния в виде усиления болевого синдрома в ОГ не отмечено, в ГС боли возобновились или усилились у 14 (82,4%) больных, а 6 (35,3%) пациентов в течение этого периода времени повторно проходили курс лечения. При исследовании динамики интенсивности боли в подгруппах ОГ отмечено существенное (p<0,05) снижение: с 2,78 ± 0,25 до 1,34 ± 0,18 балла; напротив, в ГС интенсивность боли увеличилась с 3,56 ± 0,79 до 4,86 ± 0,52 балла. В подгруппах ОГ наблюдался также дальнейший регресс неврологической симптоматики и улучшение жизнедеятельности (по данным шкалы Роланда-Морриса). В ГС отмечено ухудшение данных показателей, особенно во второй подгруппе. В подгруппах ОГ имело место неуклонное уменьшение СД (в ПОГ-1 СД снизилась с 6,4 до 3,8 %, в ПОГ-2 - с 12,8 до 8,4%), в ПГС-1 положительный результат был незначительным (с 23,4 до 22,6%), в ПГС-2 дезадаптация увеличилась с 31,2 до 32,4%.Таким образом, дальнейший регресс неврологической симптоматики, связанное с ним улучшение социальной адаптации и основных аспектов жизнедеятельности у пациентов основной группы свидетельствовали о пролонгированном действии Мексидола, его положительном влиянии на частоту обострений и длительность ремиссии больных ПКР вне зависимости от наличия двигательного дефицита.
Выводы
Применение Мексидола в составе комплексной терапии больных ПКР по сравнению с общепринятой терапией значительно и стойко уменьшает выраженность болевого синдрома, ускоряет восстановление функции спинномозговых корешков, периферических нервов и связанное с ним улучшение социальной адаптации и основных аспектов жизнедеятельности пациентов. При клинико-неврологическом контроле отдаленных результатов лечения получены данные о пролонгации положительного действия Мексидола, выраженного в дальнейшем регрессе боли и неврологического дефицита, уменьшения частоты обострений и стойкости ремиссии больных ПКР.У больных ПКР с рефлекторными и чувствительными нарушениями рекомендовано включать в состав консервативной терапии нейропротекторный препарат Мексидол по 2 мл 5%-ного раствора 2 раза/сут внутримышечно или внутривенно курсом 15-20 дней. У пациентов с дистальными парезами рекомендуется использовать Мексидол в тех же дозах курсом 20-25 дней.
С целью профилактики обострений ПКР необходимо продолжить лечение Мексидолом перорально по 250 мг (2 таблетки) 3 раза/сут в течение месяца. При необходимости курс лечения можно повторно назначать через 3-6 месяцев.
Литература
1. Антонов И.П. Вопросы классификации и формулировка диагноза вертеброгенных (спондилогенных) заболеваний нервной системы// Периферическая нервная система 1983. № 6. С. 49-56.
2. Бадалян Л.О. Клиническая электронейромиография: Руководство для врачей /Под ред. Л.О. Бадаляна, И.А. Скворцова. М., 1986. 365 с.
3. Байкушев С.Т. Стимуляционная электромиография и электронейрография в клинике нервных болезней / Под ред. С.Т. Байкушева, З.Х. Мановича, В.П. Новиковой. М., 1974. 144 с.
4. Белова А.Н. Шкалы, тесты и опросники в медицинской реабилитации/ Подред.А.Н.Беловой, О.Н. Щепетовой. М., 2002. 440 с.
5. Васильев П.П. Клинико-магнитно-резонансные соотношения при остеохондрозе пояснично-крестцового отдела позвоночника / Под ред. П.П. Васильева, В.И. Шмырева / Клиническая вертебрология: Сборник материалов Московского мануалогического общества. М., 1996. № 1. С. 81-4.
6. Веселовский В.П. Клиническая классификация вертеброневрологических синдромов / Под ред. В.П. Веселовского, А.П. Ладыгина, О.С. Кочергина // Неврологический вестник 1995. Т. XXVII. Вып. 3-4. С. 45-50.
7. Воронина Т.А. Механизм действия и обоснованиепримененияпрепаратамексидол в неврологии / Под ред. Т.А. Ворониной, Л.Д. Смирнова, И.И. Горейновой / Научно-практическая конференция по неврологии. М., 2000. С. 2-4.
8. Герасимова М.М. Цитомедины в комплексной терапии пояснично-крестцовых радикулопатий. В кн.: Кортексин - пятилетний опыт отечественной неврологии / Под ред. А.А. Скоромца, М.М. Дьяконова. СПб., 2005. С. 156-67.
9. Гланц С. Биомедицинская статистика. Пер. с англ. 1999. 459 с.
10. Дривотинов Б.В., Ходосовская В.М.. Роль аутоиммунных реакций в патогенезе рецидивов и ремиссий корешкового болевого синдрома при поясничном остеохондрозе // Периферическая нервная система 1978. № 1. С. 62-67.
11. Жулев Н.М. Остеохондроз позвоночника: Руководство для врачей / Под ред. Н.М. Жулева, Ю.Д. Бадзгарадзе, С.Н. Жулева. СПб., 2001. 592 с.
12. Заславский Е.С. Болевые мышечно-дистрофические синдромы (этиология, патогенез, клиника, лечение). Дисс. докт. мед. наук. М., 1980.
13. Клюшник Т.П. Аутоантитела к фактору роста нервовпринервно-психическихзаболеваниях и нарушениях развития нервной системы. Дисс. докт. мед. наук М., 1997.
14. Коган О.Г. Иммунопатологические аспекты остеохондроза позвоночника и его неврологических синдромов // Проблемы аутоаллергии 1975. С. 224-25.
15. Крыжановский Г.Н. Общая патофизиология нервной системы: Руководство. М., 1997. 352 с.
16. Сороковиков В.А. Хирургическое лечение дискогенного пояснично-крестцового радикулита с иммунокоррекцией. Дисс. канд. мед. наук. Иркутск, 1995.
17. Бабенков Н.В., Халецкая В.А., Клачкова Л.Б., Ваулина Т.С. Применение мексидола при дискогенных радикулопатиях // Кремлевская медицина: Клинический вестник 2001. № 2. С. 59-62.
18.Ульрих Э.В. Вертебрология в терминах, цифрах, рисунках / Под ред. Э.В. Ульрих, А.Ю. Мушкина. СПб., 2002. С. 154-57.
19. Brunner C, Lassman H, Waehneldt TV, et al. Differential ultrastructural localization of myelin basic protein, myelin - oligodendroglial glicoprotein and 2,3-cyclic nucleotid 3- phosphodiesterase in the CNS of adult rats. 1989; 52:296-304.
20. Giles LGF. Innervation of spinal structures. In: Clinical anatomy and management of low back pain. Oxford, Butterworth-Heinemann 1997:219-31.
21. Ochoa J. Histopathology of common mononeuropathies. In: Nerve Repair and Regeneration. Edited by Jewett DL, McCarroll HR, Louis Jr-St, Mosby CV. 1980:36-52.
22. Roland MO, Morris R. A study of the natural history of back pain; part 1: development of a reliable and sensitive measure of disability in low -back pain. Spine 1983;8:141-43.
23. Ross JS, Masaryk TJ, Schrader M, et al. MR imaging of the postoperative lumbar spine: assessment with gadopentetate dimeglumine. Amer J Roentgenol 1990;155:867-72.
24. Rydevik В, Lundborg G, Bagge U. Effects of graded compression on intraneural blood flow -an in vivo study on rabbit tibial nerve. J Hand Surg 1981;6:3-12.
25. Stratford PW, Binkley JM. Measurement Properties of the RM - 18: a modified version of the Roland-Morris disability scale. Spine 1997;22:2416-21.
26. Wilder RL. Neuroendocrine-immune system interactions and autoimmunity. Ann Rev Immunol 1995:13:307-38.
| Июнь 2012 г. |