Опубликовано в журнале:
«Вестник анестезиологии и реаниматологии» »» 2012. Т.9, №2
Выбор инфузионных сред для коррекции микроциркуляторных нарушений при тяжёлой черепно-мозговой травме
Т.О. Токмакова1, Е.В. Григорьев1-2, Е.А. Каменева1, С.Ю. Пермякова1, Ю.А. Чурляев3
Choice of infusion media for the correction of microcirculatory disorders in severe brain injury
Т.O. Tokmakova1, E.У. Grigoryev1-2, E.A. Kameneva1, S.Yu. Permyakova1, Yu.A. Churlyaev3
1Кемеровская государственная медицинская академия,
2УРАМН НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН, г. Кемеров
3Филиал УРАМН НИИ общей реаниматологии им. В. А. Неговского РАМН, г. Новокузнецк
Цель исследования - обоснование выбора инфузионных сред с позиции коррекции микроциркуляторных нарушений у пострадавших с тяжёлой черепно-мозговой травмой. Исследовательский массив разделили на 4 группы. В 1-й группе (n = 21) инфузионная терапия включала модифицированный желатин в суточной дозе 7 мл/кг массы тела, во 2-й группе (n = 19) - сбалансированный раствор кристаллоидов в дозе 6,5 мл/кг массы тела, в 3-й (n = 19) - 6% раствор гидроксиэтилированного крахмала 130/0,4 в дозе 6 мл/кг массы тела, а в 4-й группе (n = 21) - 0,9% раствор натрия хлорида в суточной дозировке 14 мл/кг массы тела.
Помимо общеклинических исследований, всем больным проводили мониторинг центральной гемодинамики и оценку микроциркуляции методом лазерной допплеровской флоуметрии. В результате работы доказана необходимость коррекции микроциркуляции у всех пациентов с тяжёлой черепно-мозговой травмой.
Включение в алгоритм работы врача методов контроля микроциркуляции (показателя лазерной допплерофлоуметрии) облегчает выбор инфузионных сред. Гидроксиэтилированный крахмал 130/0,4 обладает наилучшим сочетанием свойств по коррекции микроциркуляции. Менее эффективными являются препараты модифицированного желатина. Сбалансированные и несбалансированные кристаллоиды не способствуют восстановлению микроциркуляторного кровообращения.Ключевые слова: тяжёлая черепно-мозговая травма, микроциркуляторные нарушения, выбор инфузионных сред.
The objective of the investigation was to provide a rationale for the choice of infusion media in order to correct microcirculatory disorders in victims of severe brain injury. The victims were divided into 4 groups:
1) 21 patients who received infusion therapy comprising modified gelatin in a daily dose of 7 ml/kg body weight;
2) 19 patients who had a balanced crystalloid solution in a dose of 6.5 ml/kg body weight;
3) 19 patients who had 6% hydroxyl ethyl starch 130/0.4 in a dose of 6 ml/kg body weight;
4) 21 patients received 0.9% sodium chloride solution in a daily dose of 14 ml/kg body weight. In addition to general clinical tests, all the patients underwent central hemodynamic monitoring and microcirculation evaluation by laser Doppler flowmetry. The investigation provided evidence for the necessity of correcting microcirculation in all patients with severe brain injury. The incorporation of microcirculation controlling techniques (such as the readings of laser Doppler flowmetry) into a physician's work algorithm makes it easy to choose infusion media. Hydroxy ethyl starch 130/0.4 has the best combination of properties in correcting the microcirculation. Modified gelatin preparations are less effective. Balanced and unbalanced crystalloids do not favor the recovery of microcirculation.Key words: severe brain injury, microcirculatory disorders, choice of infusion media.
В критических состояниях снижение доставки кислорода происходит либо за счёт уменьшения сердечного выброса, либо критического снижения концентрации гемоглобина, реже - из-за критической гипоксической гипоксии. Чтобы сохранить доставку кислорода к тканям при шоке, особенно к сердцу и мозгу, включаются механизмы компенсации, приводящие к шунтированию капиллярного кровотока с перераспределением и «централизацией» кровообращения. Если микроциркуляторная гипоперфузия своевременно не корригируется, то развивается полиорганная недостаточность (ПОН) [14,16]. В качестве примеров могут быть приведены работы авторов, которые указывают на возможность нормального (или повышенного) сердечного индекса при неудовлетворительных «классических» маркёрах микроциркуляторного кровотока (лактат сыворотки крови, уровень парциального давления С02 при тонометрии слизистой желудка), что является косвенным признаком регионарной дизоксии [3,4,14].
Прямая оценка микроциркуляторного кровотока с использованием инструментальных методов исследования обладает рядом преимуществ по отношению к косвенным методикам. Варианты подобного мониторирования довольно активно изучены в экспериментах на животных. Благодаря современным техническим достижениям стало возможным продвижение современных методов исследования микроциркуляции в клиническую практику [1,4,9].
Оптимальный выбор раствора для интенсивного лечения отсутствует несмотря на двадцатилетние исследования на животных и людях. Высказывается мнение, что качественные характеристики инфузионной среды являются определяющими в реализации так называемых «эффектов, не связанных с волемическим статусом раствора». Последние эффекты не менее важны при условии первичной стабилизации гемодинамики у пострадавших, проявляя подобные свойства на вторые сутки интенсивного лечения. Мониторирование прямых и непрямых показателей, составляющих микроциркуляторный кровоток, является перспективным и может быть использовано для выбора вариантов инфузионной терапии, направленной на коррекцию центральной и микрогемодинамики [5,7,8,13].
Цель исследования: обосновать выбор инфузионных сред для коррекции микроциркуляторных нарушений у пострадавших с тяжёлой черепно-мозговой травмой (ЧМТ).
Материалы и методы
Исследование одобрено этическими комитетами Кемеровской государственной медицинской академии и Городской клинической больницы № 3 (г. Кемерово). Проспективно в него было включено 80 пострадавших с изолированной тяжёлой ЧМТ (диагноз: тяжёлая закрытая ЧМТ, ушибы головного мозга тяжёлой степени, субдуральные гематомы у 38 пациентов; исходная оценка по шкале ком Глазго - 8 баллов; оценка по шкале APACHE II - 19,8 ± 9,8 балла; средний возраст больных - 42,2 ± 3,5 года; мужчины составили 87,5% всех пострадавших).
Критерии включения: пострадавшие с изолированной тяжёлой ЧМТ в возрасте от 18 до 60 лет с исходной оценкой по шкале ком Глазго 8 баллов.
Критерии исключения: сочетанная ЧМТ; декомпенсированная соматическая патология, известная и/или манифестирующая на момент включения в исследование.
Больные были разделены на группы:
Точки исследования: до инфузии, через 60 и 120 мин после инфузии.
- первая группа (n=21) - инфузионная терапия включала модифицированный желатин (Гелофузин) в суточной дозе 7 мл/кг массы тела;
- вторая группа (n=19) - инфузионная терапия включала сбалансированный раствор кристаллоидов (Стерофундин изотонический) в дозе 6,5 мл/кг массы тела;
- третья группа (n=19) - инфузионная терапия включала 6% раствор гидроксиэтилированного крахмала 130/0,4 (Волювен) в дозе 6 мл/кг массы тела;
- четвёртая группа (n=21) - инфузионная терапия не расширялась и включала 0,9% раствор натрия хлорида в суточной дозировке 14 мл/кг массы тела.
Всем пострадавшим проводили интенсивное лечение согласно стандартам (руководство Brain Trauma Foundation): инфузионную терапию в процессе первичной стабилизации состояния больного, вазоинотропную поддержку для поддержания среднего артериального давления (АД) на уровне 80 мм рт. ст., энтеральное питание стандартными сбалансированными изокалорическими смесями, искусственную вентиляцию лёгких (ИВЛ) в режиме контроля по давлению. По данным нейровизуализации всем больным выполняли декомпрессивную костно-пластическую/резекционную (варианты) трепанацию черепа, удаление гематом, постановку датчика контроля внутричерепного давления. Уровень седации определяли по шкале RASS.
Помимо общеклинических исследований (биохимический и клинический анализ крови), проводили объективную оценку тяжести состояния по шкале ком Глазго (Teasdale GM, 1974), APACHE II (Knaus WA, 1985). Тяжесть повреждения головного мозга, согласно данным компьютерной томографии, оценивали по шкале Marshall (Marshall L. F., 1991). Всем больным выполняли мониторинг центральной гемодинамики методом интегральной тетраполярной реовазографии («Диамант-М», НПО «Диамант», г. Санкт-Петербург). Микроциркуляцию оценивали методом лазерной допплеровской флоуметрии (анализатор ЛАКК-02, НПП «Лазма», г. Москва). Анализ осуществляли на коде тенара, фиксацию датчика - с использованием устройства, рекомендованного фирмой-производителем и входящего в комплект монитора ЛАКК. Запись проводили трёхкратно, в течение 5 мин каждый цикл, с последующим усреднением показателей. Исключали вероятность холодовой вазоконстрикции путём использования локального нагревающего элемента. Измерения начинали после первичной стабилизации и коррекции гиповолемии для исключения артефактов, обусловленных гиповолемической вазоконстрикцией.
При анализе микроциркуляторного кровотока оценивали средние значения изменения перфузии:
Амплитудно-частотный анализ использовали для оценки вклада пассивных компонентов в регуляцию тканевого кровотока:
- показатель микроциркуляции (ПМ): скорость кровотока в микроциркуляторном русле за определённый промежуток времени (пф. ед.);
- средняя квадратичная отклонения (СКО): характеризует временную изменчивость микроциркуляции (пф. ед.). Чем выше СКО, тем лучше миогенная, нейрогенная и дыхательная модуляция тканевого кровотока;
- коэффициент вариации (Кв): даёт представление о вкладе вазомоторного компонента в модуляцию тканевого кровотока (%).
Контрольная группа (сформирована для нормативных ПМ, сопоставимая по возрасту и полу с группами исследования) представлена 22 здоровыми добровольцами (средний возраст 33,1±5,5 года).
- низкочастотные (миогенные) колебания (Low Flux 2-4 колебаний/мин) создаются колебаниями миоцитов стенок артериол и прекапиллярных сфинктеров;
- респираторные (высокочастотные) колебания (High Flux 31-49 колебаний/мин) обусловлены периодическими колебаниями давления в венозной части сосудистого русла и связаны с дыхательными экскурсиями;
- сердечные колебания (Cardiac Flux 100-180 колебаний/мин) образуются за счёт работы сердечной мышцы, как правило, синхронизированные с пульсовой волной и формированные за счёт пропульсивного движения крови в систолу.
Статистическую обработку полученных данных осуществляли при помощи программы Statistica 6.0. Использовали критерий Вилкоксона для внутри- и межгруппового сравнения. При определении ненормального распределения использовали критерий Манна - Уитни для непараметрических величин. Критический уровень значимости был принят р<0,05. Данные представлены в виде средней (М) ± стандартного отклонения (SD).
Результаты и обсуждение
У всех пациентов, поступивших в стационар, в первые 12 ч с момента поступления отмечали признаки гиповолемии как по данным гемодинамического мониторинга, так и по данным клинического обследования (снижение ударного объёма, гипердинамический синдром за счёт увеличения частоты сердечных сокращений, повышенные показатели общего периферического сопротивления, компенсированный смешанный ацидоз и умеренная задолженность по смешанной венозной сатурации, тенденция к олигурии). Данные проявления потребовали инфузионной терапии в объёме 2670,0±345,9 мл/сут (больные в исследуемых группах не отличались по объёму и качеству базисной инфузии в первые сутки). У 30% пострадавших были использованы катехоламины для стабилизации гемодинамики [допамин в дозе 10,5±7,4 мкгДкг•мин-1) и адреналин в дозе 0,04±0,01 мкгДкг•мин-1)].
В первые сутки у всех больных отмечено снижение показателей тканевой перфузии согласно мониторингу лазерной допплерофлоуметрии. Отметим, что восстановление центральной гемодинамики путём проведения инфузионной терапии в первые 12 ч с достижением адекватных показателей среднего АД, нормализацией метаболических констант не сопровождалось нормализацией микроциркуляции. Согласно ранее предложенному алгоритму, больным проводили коррекцию микроциркуляторных расстройств. В качестве методов воздействия на микроциркуляцию апробировали инфузионные среды с учётом того, что на данный момент нет чётких характеристик и не отмечено абсолютного превосходства какой-либо инфузионной среды в плане воздействия на систему микроциркуляторного кровообращения (коллоиды против кристаллоидов, гидроксиэтилированный крахмал против модифицированного желатина, несбалансированные против сбалансированных кристаллоидов) [12,13].
Исходные показатели при сравнении групп с ГЭК и модифицированным желатином по исследуемым микроциркуляторным характеристикам были сопоставимы и зафиксированы на значениях, достоверно меньших контрольных величин в среднем на 45-50%. Через 60 и 120 мин с момента завершения инфузии (табл. 1) отмечали достоверное повышение ПМ и увеличение СКО как в группе ГЭК, так и в группе модифицированного желатина. Показатели не доходят до нормальных величин и не отличаются между собой на этапах исследования при проведении межгруппового сравнения. Однако при межгрупповом сравнении, проведённом на вторые сутки, отмечено достоверное увеличение ПМ в группе с инфузией ГЭК, ПМ достигал контрольных значений (рис. 1,2). Группа модифицированного желатина на вторые сутки исследования подобных результатов не имела.
Таблица 1. Показатели микроциркуляции у пострадавших с тяжёлой черепно-мозговой травмой - инфузия коллоидов (М±SD)
Примечание: * - достоверность различия в группах в сравнении с контролем при р<0,05; # - достоверность различия при межгрупповом сравнении при р<0,05.
Показатель Контрольная группа (n=22) Динамика показателей на этапах исследования ГЭК 6% (n=19) модифицированный желатин (n=21) до инфузии через 60 мин через 120 мин до инфузии через 60 мин через 120 мин Среднее значение показателя микроциркуляции, пф.ед. 10,34±0,83 5,01±0,73* 6,01±0,74* 7,77±0,87* 6,05±0,77* 6,24±0,56* 7,81±0,4* Среднее квадратичное отклонение, пф.ед. 0,66±0,05 0,19±0,03* 0,23±0,02* 0,68±0,03* 0,24±0,04* 0,44±0,03*# 0,49±0,05# Коэффициент вариации,% 5,67±0,59 3,17±0,29* 3,63±0,25* 4,29±0,36 3,83±0,54* 4,73±0,51 5,5±0,62# CF 100-180, мин-1 0,14±0,01 0,03±0,01* 0,05±0,01* 0,07±0,01* 0,09±0,02** 0,14±0,02# 0,17±0,03# HF 31-49, мин-1 0,29±0,03 0,09±0,02* 0,12±0,02* 0,18±0,03* 0,19±0,05* 0,26±0,04 0,32±0,04# LF 2-4, мин-1 0,79±0,09 0,29±0,06* 0,34±0,06* 0,48±0,06* 0,42 ±0,06 0,62±0,15 0,78±0,17# Рост Kв (CF, HF и LF) в группах вмешательства свидетельствует об увеличении вклада сосудистого компонента в регуляцию кровотока. Исходные показатели СКО достоверно отличались (группа ГЭК 0,19±0,03 пф. ед. и группа желатина 0,24±0,04 пф. ед. против контрольной группы 0,66±0,05 пф. ед.). Через 120 мин Кв нормализовался во всех группах, не отличаясь при межгрупповом сравнении и при сопоставлении с контролем. На вторые сутки Кв в группе ГЭК сохранялся на прежнем уровне, тогда как в группе модифицированного желатина - достоверно ниже контроля и группы сравнения.
Рис. 1. Показатель микроциркуляции в группах вмешательства (оценка через сутки)
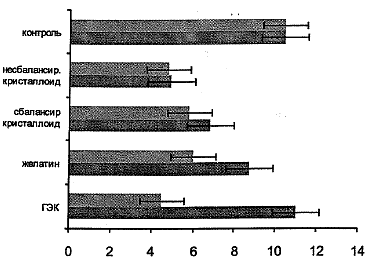
Рис. 2. Вклад низкочастотных колебаний в регуляции сосудистого тонуса в группах вмешательства (оценка через сутки)
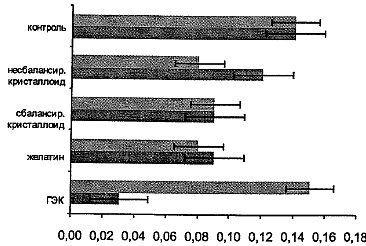
Анализ амплитудно-частотного спектра позволил выявить степень изменения активных и пассивных факторов регуляции тканевого кровотока. В процессе инфузии зафиксировали увеличение как низко-, так и высокочастотных колебаний по обеим группам обследуемых больных. Снижение амплитуд низкочастотных колебаний может ассоциироваться с нарушением ауторегуляции мозгового кровотока. На вторые сутки отметили достижение низкочастотных колебаний контрольных значений для группы ГЭК, что может быть объяснено изменением регуляции сосудистого тонуса. В группе модифицированного желатина на вторые сутки не наблюдали аналогичной нормализации показателей амплитудно-частотного анализа.
Группы с использованием коллоидов и группы с применением кристаллоидов были сопоставимы по исходным показателям микроциркуляторного кровотока, и в совокупности у пациентов были определены значения флакса эритроцитов, среднего отклонения и амплитуд частотных колебаний, достоверно меньшие контрольных величин (табл. 2).
Таблица 2. Показатели микроциркуляции у пострадавших с тяжёлой черепно-мозговой травмой инфузия кристаллоидов (М±SD)
Примечание: * - достоверность различия в группах в сравнении с контролем при р<0,05; # - достоверность различия при межгрупповом сравнении при р<0,05.
Показатель Контрольная группа (n=22) Динамика показателей на этапах исследования Стерофундин (n=19) 0,9% раствор натрия хлорида (n=21) до инфузии через 60 мин через 120 мин до инфузии через 60 мин через 120 мин Среднее значение показателя микроциркуляции, пф.ед. 10,34±0,83 5,88±0,73* 5,94±0,72* 6,06±0,70* 4,63±0,53* 4,6±0,5*# 4,66±0,52*# Среднее квадратичное отклонение, пф. ед. 0,66±0,05 0,37±0,05* 0,34±0,05* 0,35±0,05* 0,33±0,03* 0,32±0,03* 0,36±0,03* Коэффициент вариации, % 5,67±0,59 4,86±1,07 4,93±1,05 5,02±1,04 3,9±0,52 3,97±0,33# 3,98±0,41# CF 100-180, мин-1 0,14±0,01 0,09±0,02 0,09±0,01 ОД±0,01 0,12±0,02 0,13±0,02 0,14±0,02 HF ЗМ9, мин-1 0,29±0,03 0,2±0,03 0,22±0,03 0,23±0,03 0,2±0,04 0,22±0,04 0,23±0,04 LF 2-4, мин-1 0,79±0,09 0,45±0,06* 0,46±0,06* 0,48±0,06* 0,43±0,07* 0,42±0,08* 0,52±0,08* Ни одна из групп с применением кристаллоидов (группа сбалансированных растворов и группа «классических» несбалансированных кристаллоидов) не демонстрировала стабилизации средних значений ПМ и показателей квадратичного отклонения. Через 60 и 120 мин с момента завершения инфузии (табл. 2) отмечали недостоверное повышение ПМ и увеличение СКО в группах с использованием кристаллоидов, однако уровня контрольных значений данные показатели так и не достигали. Худшие значения выявлены в группе несбалансированных кристаллоидов, значения ПМ и Кв в которой так и не увеличились и были в течение всего времени наблюдения достоверно ниже контрольных (равно как и ниже группы коллоидов в точках наблюдения). Единственным достоверным отличием были значения Кв, показатель увеличивался на 60 и 120 мин исследования в группе сбалансированных кристаллоидов, достигая контрольных значений в конце инфузии.
Основная цель проводимой инфузионной терапии в критических ситуациях - поддержание адекватного сердечного выброса для обеспечения перфузии тканей. В отношении больных с тяжёлой ЧМТ справедливым является поддержание оптимального перфузионного давления головного мозга для профилактики вторичных церебральных повреждений. Считается, что коллоидные растворы более эффективно восстанавливают объём циркулирующей крови и сердечный выброс. Другие утверждают, что кристаллоидные растворы не менее эффективны для стабилизации и первичного поддержания волемии. Вторым важным свойством коллоидных растворов является нормализация системы микроциркуляции путём создания оптимального перфузионного давления и коррекции сладжирования, в том числе и путём прямого воздействия на активированные нейтрофилы и эндотелиоциты [5,9,13,16,17].
В результате ряда исследований показано, что модифицированный желатин оказывает позитивное влияние на реологические свойства крови. Использование данной инфузионной среды является целесообразным для создания гемодилюции, восстановления объёма циркулирующей крови, коррекции микроциркуляции. Однако недостатком данного раствора является непродолжительное время эффективной циркуляции препарата. В сравнении с модифицированным желатином более продолжительным волемическим эффектом обладает ГЭК. Данный вывод продемонстрирован в нашем исследовании, поскольку в группе ГЭК мы отметили наибольшее время поддержания адекватной микроциркуляции, что подтверждается сохранением ПМ, Кв на достоверно больших значениях в сравнении с группой модифицированного желатина и кристаллоидов [15].
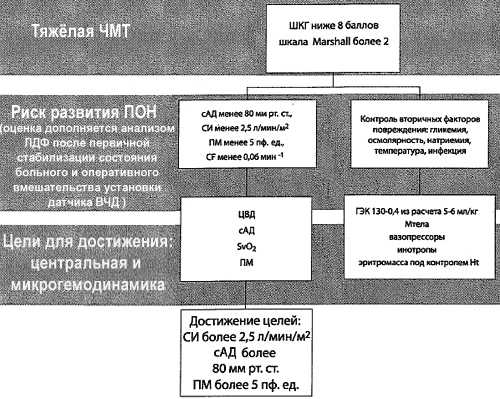
Рис. 3. Алгоритм целенаправленной коррекции на основе мониторирования центральной гемодинамики, микроциркуляции и кислородного баланса
Отдельным направлением при сравнении коллоидов и кристаллоидов может быть исследование степени эндотелиальной активации и системного воспалительного ответа в зависимости от вида инфузионной среды. Отмечено, что ГЭК 130/0,4 способен ослаблять системную воспалительную реакцию в критических состояниях. Есть сведения о том, что использование несбалансированных кристаллоидов приводило к усилению системного воспаления и эндотелиальной активации, нарушению оксигенации, смещению жидкости в интерстиций. Указанные негативные свойства солевых растворов вполне объяснимы. Сбалансированные растворы кристаллоидов призваны нивелировать вышеобозначенные недостатки «классических» кристаллоидов. Входящие в состав подобных растворов носители резервной, щёлочности позволяют избежать ацидоза и тканевой гипоксии, вероятно, - эндотелиального повреждения. Возможность модуляции системного воспаления и уменьшения его выраженности является косвенным способом коррекции микроциркуляторных нарушений, однако данные выводы требуют дальнейших исследований [6, 8,13].
Согласно данным ряда исследований, использование показателей микроциркуляторного гомеостаза, основанных как на прямых, так и на непрямых методах исследования, может быть рекомендовано для профилактики прогрессирования критического состояния и полиорганной недостаточности. Дискутабельными остаются вопросы, связанные с дифференциацией методов исследования микроциркуляции, целевых значений, точек исследования [16]. Предложенный алгоритм требует дальнейшей валидации, включения большего числа пациентов и расширения мониторинга за счёт использования методов нейровизуализации и оценки внутричерепного гомеостаза (внутричерепное давление, оксигенация головного мозга) (рис. 3).
Выводы
- С учётом расстройств микроциркуляции у всех пациентов с тяжёлой ЧМТ показано интенсивное лечение, направленное на коррекцию микроциркуляторного кровообращения. Выбор инфузионных сред может быть обусловлен включением в алгоритм гемодинамической коррекции методов контроля микроциркуляции - показателей лазерной допплерофлоуметрии.
- Гидроксиэтилированный крахмал 130/0,4 обладает оптимальным сочетанием свойств по коррекции микроциркуляции. Менее эффективными являются препараты модифицированного желатина. Сбалансированные и несбалансированные кристаллоиды не показали достоверных эффектов восстановления микроциркуляторного кровообращения по данным лазерной допплерофлоуметрии.
Для корреспонденции:
Кемеровская государственная медицинская академия
650029, Кемерово, ул. Ворошилова, д. 22а.Токмакова Т.О.
аспирант кафедры анестезиологии и реаниматологии.Григорьев Е.В.
заведующий кафедрой анестезиологии и реаниматологии.Каменева Е.А.
профессор кафедры анестезиологии и реаниматологии.Пермякова С.Ю.
аспирант кафедры анестезиологии и реаниматологии.Чурляев Ю.А.
Филиал УРАМН НИИ общей реаниматологии им. В. А. Неговского РАМН, директор.
654080, Кемеровская обл., г. Новокузнецк, ул. Кирова, д. 57.
Список использованной литературы
- Крупаткина А.И., Сидорова В.В. Лазерная допплеровская флоуметрия микроциркуляции крови: Руководство для врачей. - М.: Медицина, 2005. - С. 24-29.
- Мороз В.В., Чурляев Ю.А. Вторичные повреждения головного мозга при тяжелой черепно-мозговой травме. - М., 2006. - С. 403.
- Токмакова Т.О., Дербенёва О.А., Каменева Е.А. Микрогемодинамика у пострадавших с тяжёлой черепно-мозговой травмой // Сб. докл. и тез. IV Всерос. конф. «Беломорский симпозиум». - Архангельск, 2011. - С. 16.
- Чурляев Ю.А., Вереин М.Ю., Данцигер Д.Г. и др. Нарушения микроциркуляции, внутричерепного давления и церебрального перфузионного давления при тяжёлой черепно-мозговой травме // Общ. реаниматол. -2008. - Т. 5. - С. 5-9.
- Bayer О., Sakr Y., Kabisch В. et al. Fluid therapy change from synthetic colloids to only crystalloids in patients with severe sepsis // Critical Care. -2010. - Vol. 14 (Suppl. 1). - P. 500.
- Boldt J., Ducke M., Kumle B. et al. Influence of different volume replacement strategies on inflammation and endothelial activation in the elderly undergoing major abdominal surgery // Intens. Care Med. - 2004. - Vol. 30.;- P. 416-422.
- Chen H., Koustova E., Shults C. et al. Differential effect of resuscitation on toll-like receptors in a model of hemorrhagic shock without a septic challenge // Resuscitation. -2007. - Vol. 74. - P. 526-537.
- Cotton B. A., Guy J. S., Morris J. A. Jr. et al. The cellular, metabolic, and systemic consequences of aggressive fluid resuscitation strategies // Shock. - 2006. - Vol. 26. - P. 115-121.
- De Backer D., Hollenberg S., Boerma C. et al. How to evaluate the microcirculation: report of a round table conference // Crit. Care. - 2007. - Vol. 11. - P. R101.
- Hiltebrand L. В., Kimberger O., Arnberger M. et al. Crystalloids versus colloids for goal-directed fluid therapy in major surgery // Crit. Care. - 2009. - Vol. 13. -P. R40.
- Lang K., Suttner S., Boldt J. et al. Volume replacement with HES 130/0,4 may reduce the inflammatoiy response in patients undergoing major abdominal surgery // Can. J. Anaesth. - 2003. - Vol. 50. - P. 1009-1016.
- McSwain N. E., Champion H. R., Fabian Т. C. et al. State of the art of fluid resuscitation 2010: prehospital and immediate transition to the hospital // The Journal of Trauma, Injury, Infection, and Critical Care. - 2011. - Vol. 70, № 5. -P. S2-S10.
- Perel P., Roberts I. Colloids versus crystalloids for fluid resuscitation in critically ill patients // Cochrane Database Syst. Rev 2007; 4: CD000567.
- Safar P. Resuscitation after brain ischemia. Brain failure and resuscitation (eds. A. Grenvic, P. Safar). N. Y.: Livingston, 1986. - P. 155-184.
- Sossdorf M., Marx S., Schaarschmidt B. et al. HES 130/0,4 impairs haemostasis and stimulates pro-inflammatory blood platelet function // Crit. Care. - 2009. - Vol. 13. -P. R208.
- Trzeciak S., McCoy J.V., Dellinger R.P. et al. On behalf of the Microcirculatory Alterations in Resuscitation and Shock (MARS) investigators: Early increases in microcirculatory perfusion during protocol-directed resuscitation are associated with reduced multi-organ failure at 24 h in patients with sepsis // Intens. Care Med. - 2008. - Vol. 34. - P. 2210-2217.
- Wagner D.D. New links between inflammation and thrombosis // Arterioscler Thromb. Vase. Biol. - 2005. - Vol. 25. -P. 1321-1324.
| Ноябрь 2012 г. |