Многократное применение больших доз нового препарата гидроксиэтилкрахмала 130/0,4 у больных с тяжелой черепно-мозговой травмой.
Thomas A. Neff, MD, Martin Doelberg, PhD, Cornelius Jungheinrich, MD, Andrea Saurland, Donat R. Splahn, MD, Reto Stocker, MD.
Институт Анестезиологии и отделение хирургической интенсивной терапии,
Университетская клиника, Цюрих, Швейцария;
Отдел клинических исследований, Fresenius Kabi, Германия.В этом проспективном контролируемом, рандомизированном, моноцентровом исследовании мы изучали безопасность повторного применения больших доз нового препарата гидроксиэтилкрахмала (6% HES 130/0,4) у больных с черепно-мозговой травмой. Пациенты были рандомизированы и неоднократно получали или препарат HES 130/0,4 (n=16) в дозе до 70 мл/кг/сут (эта доза, по данным литературы, является максимальной суточной), или контрольный препарат гидроксиэтилкрахмала 200/0,5 (n=15) в рекомендуемой максимальной дозе до 33 мл/кг/сут и раствор человеческого альбумина в общей дозе (гидроксиэтилкрахмал 200/0,5 + альбумин) 70 мл/кг/сут. Между этими группами не было обнаружено различий по следующим параметрам: смертность, функция почек, развитие осложнений в виде кровотечений и необходимость применения компонентов крови. Не было также значимых различий по параметрам коагуляции. Однако, в то же время, уровни факторов VIII и Виллебранда, кофактора ристоцитина были выше у больных первой группы, несмотря на применение более высоких доз гидроксиэтилкрахмала. Мы пришли к выводу, что препарат гидроксиэтилкрахмала 130/0,4 можно безопасно применять у больных с черепно-мозговой травмой, находящихся в критическом состоянии, в течение нескольких суток в дозе до 70 мл/кг/сут.
Адекватный подбор объемов инфузионной терапии является наиболее важным для больных, находящихся в критическом состоянии. Особенно при тяжелой черепно-мозговой травме этот аспект терапии является чрезвычайно важным. В данном исследовании мы придерживались широко распространенной стратегии активного восполнения жидкостью с целью достижения высокого церебрального перфузионного давления (ЦПД). Для повышения системного артериального давления и церебрального перфузионного давления требуются большие объемы вводимых инфузионных растворов. Положительные эффекты инфузионной терапии ограничены увеличивающимся внутричерепным давлением (ВЧД), что типично для больных с тяжелой черепно-мозговой травмой (1,2). Для повышения церебрального перфузионного давления могут применяться различные инфузионные растворы: препараты крови (свежезамороженная плазма, эритроцитарная масса), человеческий альбумин, кристаллоиды (раствор Рингера-лактат или физиологический раствор) и синтетические коллоиды (желатин, декстран, гидроксиэтилкрахмал [HES]). Каждый из препаратов имеет ограничения к применению.
Растворы гидроксиэтилкрахмала являются синтетическими коллоидами и часто применяются у хирургических больных, в том числе, с травмами с целью увеличения объема плазмы. Поскольку нативный крахмал быстро гидролизируется a-амилазой, существующие на рынке препараты гидроксиэтилкрахмала представляют собою полимеры натурального амилопектина, химически преобразованного гидроксиэтилированием углеродных атомов (С2, С3 или С6) молекулы глюкозы. Наиболее важными физико-химическими характеристиками являются молярное замещение (МЗ; моль гидроксиэтилового остатка на моль глюкозы), структура гидроксиэтилирования (соотношение С2:С6) и средняя молекулярная масса (Мср). Молярное замещение и соотношение гидроксиэтилирования принципиально определяют in vivo свойства этих растворов. Чем выше показатели молярного замещения и соотношения С2:С6, тем медленнее метаболизируется данный препарат гидроксиэтилкрахмала. Показатель молекулярной массы менее важен для метаболизма по сравнению с показателем молярного замещения. От описанных физико-химических свойств различных препаратов гидроксиэтилкрахмала зависит безопасность их применения в плане влияния на коагуляцию (3-9) и функцию почек (10-12). В частности, препараты гидроксиэтилкрахмала с более высокими молярным замещением и, в меньшей степени, молекулярной массой после их неоднократного применения могут накапливаться в плазме в силу более медленного ферментативного расщепления. Известно, что макромолекулы снижают в плазме концентрации фактора VIII, фактора Виллебранда, кофактора ристоцетин. Хотя остается до конца не понятным патогенетический механизм неблагоприятного влияния макромолекул на комплекс фактор VIII – фактор Виллебранда. Ускорение элиминации после комплексообразования является возможным объяснением данного феномена. Ряд исследований и анализ нескольких клинических наблюдений установили связь между применением препаратов гидроксиэтилкрахмала предыдущих поколений, которые хуже метаболизируются, и нарушением функции почек, а также ухудшением морфологической картины в почках у больных после трансплантации почек. Хотя механизмы этого не ясны, такие условия, как длительное назначение препаратов гидроксиэтилкрахмала без достаточной гидратации или повышение вязкости первичной мочи предрасполагают к развитию нефропатии и могут привести к повреждению почек (13).
Таким образом, физико-химические свойства нового препарата гидроксиэтилкрахмала 130/0,4 (молекулярная масса 130000 Да, молярное замещение 0,4 и соотношение С2:С6=9:1) обуславливают более быстрый метаболизм, отсутствие накопления в плазме макромолекул после неоднократного применения при наличии волюмического эффекта, сравнимого с имеющимся у препарата гидроксиэтилкрахмала 200/0,5. Это, в конечном счете, приводит к уменьшению воздействия на коагуляцию в послеоперационном периоде, увеличению почечной элиминации (3-9, 12, 14), что особенно важно в случаях, когда требуется проведение длительной терапии большими дозами коллоидных растворов.
Целью данного исследования стало изучение безопасности в плане коагуляции и функции почек неоднократного применения препарата гидроксиэтилкрахмала 130/0,4 в высоких дозах. Ряд препаратов гидроксиэтилкрахмала влияют на VIII-ой фактор, фактор Виллебранда и кофактор ристоцетин. Тогда как альбумин и кристаллоиды не влияют на данные факторы.
Методы.
Это проспективное, контролируемое, рандомизированное, моноцентровое исследование было проведено в срок с апреля 1999 года по май 2000 года. Исследование осуществлялось в соответствии с принципами Good Clinical Practice и Хельсинской Декларацией. Информированное согласие подписывали ближайшие родственники больных. Исследование было согласовано с общественным и региональным этническими комитетами.
Пациенты с тяжелой черепно-мозговой травмой оценивались после поступления в отделение интенсивной терапии травматологического профиля первого уровня клиники при Университете, Цюрих, Швейцария. В исследование были включены пациенты, 18-65 лет, с очаговыми изменениями головного мозга выявленными, при компьютерно-томографическом исследовании, оценкой по шкале комы Глазго <5 баллов, в период не позднее 24 часов с момента травмы и стабильными гомеостатическими показателями. В исследование не были включены больные с двусторонними фиксированными и расширенными зрачками, а также пациенты, у которых в анамнезе были сведения о наличии заболеваний свертывающей системы, хронической почечной недостаточности или сердечной недостаточности. Всем пациентам проводилась управляемая искусственная вентиляция легких. Пациенты были рандомизированы на две группы слепым методом. До включения больного в исследуемую группу и проведения начальных измерений четко соблюдались принципы слепого метода так, что исследователь заранее не имел сведений о больных, которые войдут в данную группу.
Больные исследуемой группы неоднократно получали препарат гидроксиэтилкрахмала 130/0,4 (Voluven 6%, Fresenius Kabi,Германия) в больших дозах – до 70 мл/кг/сут на протяжении 28 суток. Пациенты контрольной группы на протяжении 28 суток получали стандартную терапию препаратом гидроксиэтилкрахмала 200/0,5 (6% Fresenius Kabi) в суточной дозе до 33 мл/кг и 5% раствор альбумина (Baxter, Германия) так, что общая суточная доза (гидроксиэтилкрахмал 200/0,5 + альбумин) была 70 мл/кг (Рис.1).
Терапия всем пациентам осуществлялась в соответствии со стандартизированным протоколом, суть которого заключается в поддержании контролируемых параметров, а именно – среднее артериальное давление (САД) ³ 80 мм.рт.ст., церебральное перфузионное давление (ЦПД) (ЦПД=САД-ВЧД) ³ 70 мм.рт.ст. Показаниями для инфузии коллоидов больным контрольной и исследуемой групп были САД менее 80 мм.рт.ст. или снижение церебрального перфузионного давления менее 70 мм.рт.ст. несмотря на проводимую коррекцию внутричерепной гипертензии (анальгезия, седация, нейромышечная блокада, изменение параметров вентиляции, установка наружного вентрикулярного дренажа, инфузия маннитола, контроль температуры тела). Инфузию коллоидов сочетали с постоянным введением норадреналина, при условии наличия нормоволемии, для купирования периферической вазодилятации. Ограничениями для терапии коллоидами были давление заклинивания легочной артерии ³ 16 мм.рт.ст., центральное венозное давление ³ 20 мм.рт.ст., симптомы сердечной недостаточности. Свежезамороженная плазма назначалась при показателях протромбинового времени ³ 14,2 сек. при отсутствии кровотечений и при - ³10,7 сек. при наличии кровотечений. Показанием для трансфузии тромбоцитарной массы было количество тромбоцитов в отсутствии кровотечений £ 50*10*9/л и £ 80*10*9/л – при наличии кровотечений. Мониторировались стандартные биохимические, гематологические показатели, а также клиренс креатинина в суточной моче и параметры коагуляции. Дополнительно исследовались следующие параметры свертывающей системы: активность VIII-го фактора (Behring, Германия), уровень антигена фактора Виллебранда (Asserachrom vWF, Diagnostica Stago, Франция), активность кофактора ристоцетин (APACT-4, Labor GmbH, Германия), а также проводились тромбоэластография (Haemoscope, США) и анализ функциональной активности тромбоцитов (PFA-100, Dade Behring, Германия).
Первоначально выбранный размер выборки больных - 40 (2*2) пациентов не основывался на принципах статистического анализа, так как работа носила исследовательский характер. Был осуществлен скрининг 128 больных. 95 из них не удовлетворяли предъявляемым критериям, двое пациентов не могли быть включены в исследование по логистическим причинам. Затем 31 пациент был включен в исследование, проведено их рандомизирование (гидроксиэтилкрахмал 130/0,4, n=16; гидроксиэтилкрахмал 200/0,5 + альбумин, n= 15). Общественный этический комитет поставил вопрос о частоте развития такого осложнения, как внутричерепное кровоизлияние в обеих группах и потребовал провести временный анализ. После проведения анализа исследование решено было прекратить, так как данный эксперимент не являлся полностью безопасным для контрольной группы.
Объем лабораторных исследований определялся лечебной такикой. Рандомизация (размер блока, 6) и все анализы были произведены на DATA-MAP GmbH (Freiburg, Германия) и с помощью программного обеспечения компании SAS, версия 6,12 (SAS Institute, Cary, NC). Данные групп были сравнены между собой с помощью теста Вилкоксона, ковариационного анализа и c2-теста. Данные представлены в виде средних величин ± среднее отклонение.
Результаты.
Две группы (HES 130/0,4, n=16; HES 200/0,5 + альбумин, n=15) не отличались между собой по демографическим признакам, а также, в начале исследования, по балльным показателям 6-ти шкал (Табл.1). Группы также существенно не отличались и были сопоставимы по следующим параметрам: характер медикаментозной терапии, в том числе применение норадреналина (14 из 16 в сравнении с 15 из 15); количество койко-дней (20,1 ± 15,4 в сравнении с 22,6 ± 11,8), суммарное количество и типы осложнений (см. ниже), смертность (4 из 16 в сравнении с 3 из 15).
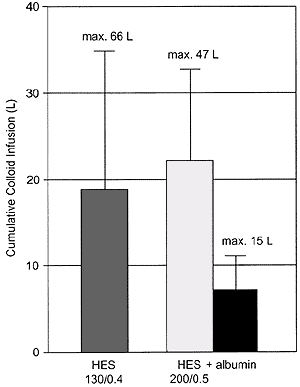
Средняя доза препаратов гидроксиэтилкрахмала, полученная больными обеих групп, была сопоставима: 19 ± 16 л препарата гидроксиэтилкрахмала 130/0,4 (6-66 л) и 22 ± 11 л препарата гидроксиэтилкрахмала 200/0,5 (6-47 л) (Рис. 2). Все 16 больных первой группы неоднократно на протяжении нескольких дней получали препарат гидроксиэтилкрахмала 130/0,4 в дозе> 30 мл/кг/сут, 10 больных (63%) > 60 мл/кг/сут, а трое больных получали данный препарат в суточной дозе > 70 мл/кг. В контрольной группе 14 из 15 пациентов (93%) многократно получали препарат гидроксиэтилкрахмала 200/0,5 в суточной дозе > 30 мл/кг (Табл.2). Дополнительно больные контрольной группы получали альбумин в общей дозе 7 ± 4 л (1-15 л). Суточные дозы коллоидов (гидроксиэтилкрахмал 130/0,4 и гидроксиэтилкрахмал 200/0,5 + альбумин) были также сопоставимы в обеих группах в те дни, когда требовалась инфузия коллоидов (дни терапии коллоидами). В то же время, общая суточная доза препаратов гидроксиэтилкрахмала была значительно выше в первой группе (гидроксиэтилкрахмал 130/0,4) (Табл.3). Однако, это закономерно, учитывая протокол исследования и режим дозирования препаратов гидроксиэтилкрахмала. Уровень кровопотери и необходимость применения компонентов крови не имели групповых различий (Табл.3).
Параметры свертывающей системы были сравнимы между обеими группами. В частности, не было отмечено существенных различий по следующим параметрам: тромбоэластография, анализ функциональной активности тромбоцитов, АЧТВ, протромбиновое время, фибриноген, количество тромбоцитов. В период между 2-ыми и 6-ыми сутками терапии – у больных первой группы, получавших препарат гидроксиэтилкрахмала 130/0,4, значительно больше, в сравнении с первым измерением, возрастали следующие показатели: фактор VIII, фактор Виллебранда, кофактор ристоцетин, что не наблюдалось в контрольной группе (Табл.4). Такое осложнение, как внутричерепное кровоизлияние (в 5 из 16 в сравнении с 5 из 15 случаев) было связано непосредственно с травмой, а не с нарушениями коагуляции. Почечная недостаточность развилась у двух больных с синдромом полиорганной недостаточности (оба больных из контрольной группы, но развитие острой почечной недостаточности не связано с применением коллоидных растворов). У оставшихся 29 пациентов клиренс креатинина при исследовании суточной мочи (Табл.5) и уровень креатинина в плазме оставались в пределах нормы на протяжении всего периода исследования. Больные, получавшие препарат гидроксиэтилкрахмала 130/0,4, характеризовали более низкие показатели: количества дней, проведенных на искусственной вентиляции легких (в среднем, 9,6 ± 7,8 в сравнении с 15,6 ± 6,2; р<0,01), количества дней с необходимостью терапии коллоидными растворами (6,6 ± 5,8 в сравнении с 11,8 ± 5,1; р< 0,01) и количества койко-дней, проведенных в ОРИТ (12,7 ± 11,3 в сравнении с контрольной группой 19,5 ± 9,1; р<0,05). Кроме того, количество наблюдений с выраженными подъемами внутричерепного давления до 30-35 мм.рт.ст. и выше в группе больных, получавших препарат гидроксиэтилкрахмала 130/0,4, было значительно меньше по сравнению с контрольной группой. Показатель кумулятивного количества часов повышенного внутричерепного давления демонстрировал групповые различия на всех четырех тестируемых уровнях (Рис.3). Оценка неврологического статуса больных по Шкале Исходов Глазго спустя 3 и 6 месяцев после выписки из стационара не выявила статистически достоверных групповых различий (через 3 месяца – 2,9 ± 1,4 в сравнении с 3,0 ± 1,1; через 6 месяцев – 3,5 ± 1,8 в сравнении с 3,5 ± 1,5).
Обсуждение.
Это проспективное исследование было проведено для изучения безопасности применения больших доз нового препарата гидроксиэтилкрахмала 130/0,4 у больных с тяжелой черепно-мозговой травмой. Основные параметры, изученные в рамках оценки безопасности применения препарата гидроксиэтилкрахмала 130/0,4, были показатели коагуляции и функции почек. Многократно назначавшиеся больным данного исследования дозы препаратов гидроксиэтилкрахмала были максимальными, которые упоминаются в литературе. Препарат гидроксиэтилкрахмала 130/0,4 в дозе до 70 мл/кг/сут (то есть, 5,6 л/сут для больного массой 80 кг) назначался больным с черепно-мозговой травмой в течение нескольких дней. При этом не было зафиксировано нарушений функции почек и свертывающей системы, а также осложнений в виде развития кровотечений.
Наш протокол лечения в плане восстановления и поддержания артериального давления соответствовал Руководству по лечению тяжелой черепно-мозговой травмы, опубликованному Brain Trauma Foundation и Американской Ассоциацией Нейрохирургов в 1996 году. Руководство постулирует постоянное поддержание церебрального перфузионного давления>70 мм.рт.ст. (среднее артериальное давление>90 мм.рт.ст. и предел внутричерепного давления 20 мм.рт.ст. для больных, склонных к внутричерепной гипертензии). Данная концепция основана на доказанном факте, заключающимся в том, что поддержание артериального давления у больных с тяжелой ЧМТ (на до- и госпитальном этапах) улучшают исход (17).
Факторы коагуляции (VIII-ой, Виллебранда, а также кофактор ристоцетин) часто превышают нормальные уровни, что расценивается как компонент реакции острой фазы после хирургического вмешательства или травмы. Эта физиологическая реакция подавляется определенными продуктами гидроксиэтилкрахмала, что не происходит под влиянием кристаллоидов или альбумина (15,16). Хотя посттравматическое увеличение содержания вышеперечисленных факторов коагуляции было обнаружено также и в контрольной группе, но в период до 6-х суток в первой группе, у больных, получавших препарат гидроксиэтилкрахмала 130/0,4, повышение концентраций данных факторов было более существенным. Это свидетельствует о меньшем подавлении нормальной физиологической реакции препаратом гидроксиэтилкрахмала 130/0,4, что совпадает с выводами предыдущих работ (3-9). Подобные данные получены in vitro. Наши результаты представляют особый интерес, поскольку препарат гидроксиэтилкрахмала 130/0,4 применялся в более высокой суточной дозе, чем препарат гидроксиэтилкрахмала 200/0,5 (в соответствии с протоколом).
Как и в предыдущих исследованиях препарата гидроксиэтилкрахмала 130/0,4, мы не обнаружили нарушений функций почек, несмотря на назначения высоких доз данного препарата. Сообщения о потенциальном эффекте нарушения функций почек препаратами гидроксиэтилкрахмала (10,11) были получены при работе с препаратом гидроксиэтилкрахмала 200/0,62, который является представителем особого типа из группы гидроксиэтилкрахмала. Данный препарат медленно метаболизируется и элиминируется по сравнению с препаратом гидроксиэтилкрахмала 130/0,4.
Необходимо подчеркнуть, что в группе больных, получавших препарат гидроксиэтилкрахмала 130/0,4, были значительно ниже следующие параметры: количество дней, потребовавших проведения искусственной вентиляции легких; количество дней, когда требовалось назначение коллоидных растворов; количество пациентов с подъемами внутричерепного давления выше 30-35 мм.рт.ст.; кумулятивное время изменяющегося внутричерепного давления выше определенных уровней (было определено 4 уровня). Причины такого влияния на течение данной патологии препарата гидроксиэтилкрахмала 130/0,4 не понятны. Две группы различались по типу применяемого препарата гидроксиэтилкрахмала. Альбумин, как коллоидный препарат второго ряда применялся только в контрольной группе. Предполагая наличие регионарно разрушенных гематоэнцефалического и гематоликворного барьеров, очевидно, что альбумин, в отличие от препарата гидроксиэтилкрахмала, распростаняясь экстравазально, перемещается в ликвор (18,19). Это может приводить к увеличению внутричерепного объема и повышению внутричерепного давления. Вероятность благоприятного исхода обратно пропорциональна значениям максимального уровня внутричерепного давления и кумулятивного времени внутричерепного давления, выше определенного уровня (20). Это могло объяснить уменьшение дней, когда больные нуждались в инфузии коллоидных растворов и проведении искусственной вентиляции легких, в группе больных, получавших препарат гидроксиэтилкрахмала 130/0,4. Даже если данные параметры (пиковые значения внутричерепного давления и уровни кумулятивного времени повышенного внутричерепного давления) могут негативно влиять на неврологические исходы, больные двух групп не имели статистически достоверного различия по исходам, оцененным по Шкале Исходов Глазго через 3 и 6 месяцев после выписки из стационара.
Учащение случаев пикового повышения внутричерепного давления у больных контрольной группы послужило основанием преждевременного завершения исследования после проведения временного анализа, осуществление которого потребовал общественный этический комитет. Поскольку дизайн исследования не был изменен, и мы не могли подвергать последующих пациентов более частым и продолжительным эпизодам повышенного внутричерепного давления во второй группе (гидроксиэтилкрахмал 200/0,5 + альбумин), исследование было прекращено. Мы приступили к окончательному анализу.
Должны быть отмечены некоторые ограничения исследования. Число выбранных больных было небольшим, так как запланированное количество (2*20) не могло быть набрано по причине преждевременного окончания исследования. Исследование было прекращено для предотвращения дополнительного риска дестабилизации биометрических показателей пациентов. Первоначально выбранное количество больных не основывалось на принципах статистического анализа для одного единственного параметра (пилотный характер исследования), следовательно, и исследование девяти пациентов, которых мы не смогли включить в работу, не имело значительного влияния на определение безопасности применения данного препарата. Использование альбумина в качестве коллоидного препарата второй линии в контрольной группе имело отрицательный эффект. Так был опубликован мета-анализ применения альбумина у больных, находящихся в критическом состоянии, в котором группа Cochrane отметила полезные и потенциально опасные эффекты альбумина (21, 22). Тем не менее, до сих пор имеют место дискуссии относительно применения альбумина (23-25). Однако, альбумин все еще применяется в качестве коллоидного препарата второй линии во многих клиниках, в том числе, - в нашей. Мы надеемся, что выбранная нами контрольная группа является достоверной для сравнения групп и оценки влияния изучаемых препаратов на коагуляцию и функции почек.
Мы установили, что препарат гидроксиэтилкрахмала 130/0,4 может безопасно применяться многократно на протяжении нескольких дней в суточной дозе до 70 мл/кг у больных с ЧМТ, находящихся в критическом состоянии.
Рисунок 1.
Максимальная суточная доза коллоидов, определенная протоколом. Исследуемая группа: гидроксиэтилкрахмал (HES) 130/0,4 в суточной дозе до 70 мл/кг. Контрольная группа: гидроксиэтилкрахмал 200/0,5 (коллоид первой линии) в суточной дозе до 33 мл/кг, затем, альбумин (коллоид второй линии) в общей суточной дозе (гидроксиэтилкрахмал 200/0,5 + альбумин) 70 мл/кг.
Таблица 1.
Демографические показатели и шкальная оценка при первом исследовании.Средние значения ± среднее отклонение; HES – гидроксиэтилкрахмал.
HES 130/0.4 (и = 16)
HES 200/0.5 + albumin (n = 15)
Пол (n мужчин\ n женщины) 14/2
13/2
Возраст (лет) 36 ±13
39 ±12
Вес (кг) 77 ±7
80 ±10
Рост (см) 177 ±5
178 ±7
Шкала APACHE II (а) 21 ±5
20 ±6
Шкала Тяжести Повреждения (б) 32 ±14
29 ±11
Шкала Ком Глазго (в) 7.7 ± 2.9
8.0 ± 3.4
Шкала Травм Маршалла (г) 3.2 ± 1.5
3.4 ± 1.6
SAPS II (д) 39 ±11
37 ±12
Модифицированная шкала полиорганного повреждения (MOF) (е) 7.1 ± 0.9
7.0 ± 1.0
Рисунок 2.
Общее количество введенных коллоидов (Средние значения ± среднее отклонение), которые назначались на протяжении среднего периода в 6,6 суток (диапазон 2-24 сут.) в группе гидроксиэтилкрахмала 130/0,4 и 11,8 сут. (диапазон 4-19 сут.) в группе гидроксиэтилкрахмала 200/0,5+альбумин. Значение «максимальный» указывает на наибольшую общую дозу инфузий (было у 1-го пациента) коллоидов на протяжении всего периода исследования. Слева вертикальная надпись: «Общая доза введенных коллоидов»
HES - гидроксиэтилкрахмал
HES 130/0.4
HES 200/0.5
na
Средняя продолжительность (сутки)
n
Средняя продолжительность (сутки)
>20 mL • kg"1 • d"1
16
4.8
15
7.8
>30 mL • kg"1 • d"1
16
3.9
14
5.7
>40 mL • kg"1 • d"1
13
3.1
1
1.0
>50 mL • kg"1 • d"1
12
2.0
-
-
>60 mL • kg"1 • d"1
10
1.8
-
-
>70 mL • kg"1 • d"1
3
1.0
-
-
а – Количество больных, получавших соответствующие дозы.
b – средняя продолжительность повторного применения.Таблица 3.
Количество введенной и выделенной жидкости за сутки.Средние значения ± среднее отклонение. HES – гидроксиэтилкрахмал. Р<0,01 для групповых отличий.
HES 130/0.4 (n = 16)
HES 200/0.5 + albumin (n = 15)
Введенная жидкость
HES
2297 ± 610
1756 ± 308**
Альбумин
-
602 ± 437**
HES+альбумин
2297 ± 610
2358 ± 638
Кристаллоиды
1773 ± 574
1995 ± 445
Эритроцитарная масса
179 ± 206
329 ± 407
Свежезамороженная плазма
274 ± 518
251 ± 385
Тромбоцитарная масса
4± 11
34 ±72
Энтеральное питание
1080 ± 429
1297 ± 352
Выделенная жидкость
Кровь по дренажам
129 ± 167
183 ± 289
Оцененная кровопотеря с другим источником
15 ±41
61 ± 136
Моча
3909 ± 1238
3964 ± 770
Таблица 4.
Фактор 8, фактор Виллебранда, кофактор ристоцетин.Отмечено, что на поздних сроках исследования, количество больных (n) снизилось, что было связано с завершением исследования. В таблице показаны данные тех временных точек, где nі3. Последние 3-е суток – 3 дня спустя окончания исследования – введения коллоидов. Нормальный диапазон значений для всех трех параметров составил 50-200%.
HES 130/0.4
HES 200/0.5 + albumin
и
mean ± SD
и
mean ± SD
Активность 8-го фактора (%)
Начальный уровень
16
83 ±23
15
86 ±34
2-ые сутки
16
82 ±23
14
88 ±35
4-ые сутки
13
133 ± 24
15
107 ± 45*
6-ые сутки
9
145 ± 19
14
144 ± 45
8-ые сутки
6
128 ± 24
12
147 ± 36
10-ые сутки
3
135 ± 16
9
145 ± 50
Последующие 3-е суток
10
161 ± 31
10
161 ± 31
Антиген фактора Виллебранда (%)
Начальный уровень
16
106 ± 25
13
106 ± 33
2-ые сутки
15
114 ± 37
13
108 ± 42
4-ые сутки
10
161 ± 47
11
135 ± 55*
6-ые сутки
5
157 ± 31
9
120 ± 39*
8-ые сутки
5
122 ± 31
9
145 ± 47
10-ые сутки
4
139 ± 30
6
154 ± 59
Последующие 3-е суток
4
177 ± 37
4
193 ± 46
Активность кофактора ристоцетин (%)
Начальный уровень
15
100 ± 21
15
120 ± 40
2-ые сутки
15
145 ± 48
14
117 ± 46*
4-ые сутки
12
156 ± 35
15
141 ± 50
6-ые сутки
9
158 ± 37
14
145 ± 31*
8-ые сутки
6
144 ± 70
12
148 ± 50
10-ые сутки
5
143 ± 12
9
140 ± 59
Последующие 3-е суток
9
164 ± 35
9
166 ± 67
Таблица 5.
Клиренс креатинина (мл/мин), используя сбор мочи.
HES 130/0.4
HES 200/0.5 + albumin
n
mean ± SD
n
mean ± SD
2-ые сутки
14
116 ± 24
14
123 ± 32
4-ые сутки
13
111 ± 19
13
124 ± 26
8-ые сутки
4
93 ±15
10
108 ± 37
Последующие 3-е суток после
окончания исследования терапии коллоидами10
119 ± 18
9
108 ± 48
Примечание. Исследование частично финансировано грантом фирмы Fresenius Kabi, Германия.
Передано для публикации 29 января 2003 года.
Адрес для корреспонденции и просьб о перепечатке: Thomas A. Neff, MD, Медицинский Факультет Мичиганского Университета, отделение патологии.
Волювен® -
| Март 2005 г. |