КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИОСТРЫЙ РИНОСИНУСИТ: ЭТИОЛОГИЯ, ПАТОГЕНЕЗ, ДИАГНОСТИКА И ПРИНЦИПЫ ЛЕЧЕНИЯ
А. С. ЛОПАТИН, В. М. СВИСТУШКИН
РОССИЙСКОЕ ОБЩЕСТВО РИНОЛОГОВСинуситом называют воспаление слизистой оболочки околоносовых пазух (ОНП). В зависимости от поражения тех или иных пазух различают верхнечелюстной синусит или гайморит этмоидит (воспаление пазух решетчатой кости), фронтит (воспаление лобной пазухи), сфеноидит (воспаление клиновидной пазухи), а также сочетанные поражения нескольких или всех пазух - полисинусит и пансинусит Поскольку воспаление в ОНП неизменно сопровождается в той или иной степени выраженными воспалительными изменениями слизистой оболочки полости носа, к более широкому использованию рекомендован термин "рино-синусит".
В зависимости от длительности заболевания различают:
1) острый синусит (длительность болезни менее 12 недель и полное исчезновение симптомов после выздоровления,
2) рецидивирующий синусит (от 1 до 4 эпизодов острого синусита в год, периоды между обострениями длятся не менее 8 недель, в это время симптомы заболевания отсутствуют, лечение не проводится),
3)хронический синусит (наличие симптомов в течение более чем 12 недель).В данных рекомендациях речь пойдет об остром и рецидивирующем риносинусите (РС), который является одним из самых распространенных заболеваний человека.
ЭПИДЕМИОЛОГИЯ
До 15% взрослого населения в мире страдают различными формами синусита, у детей он встречается еще чаще. РС - один 10 наиболее распространенных диагнозов в амбулаторной практике. Он занимает 5 место среди заболеваний, по поводу которых назначаются антибиотики: в СЫА на покупку антибиотиков для лечения РС тратится около 6 млрд. долларов. Примерно 8,4% населения Нидерландов переносит хотя бы один эпизод острого РС в год. По самым скромным подсчетам, в России данное заболевание ежегодно переносят около 10 млн человек. Однако реальное количество больных в несколько раз выше указанных цифр, т к. многие пациенты не обращаются к врачу при относительно легких катаральных формах заболевания. По мнению ряда авторов, в структуре заболеваний ЛОР-стационаров синусит составляет от 15 до 36%.
Чаще всего РС развивается на фоне острой респираторной вирусной инфекции. Считается, что практически при любом ОРЗ в процесс в той или иной степени вовлекаются ОНП. Исследования с использованием компьютерной и магнитно-резонансной томографии выявили признаки синусита в 95% случаев острого респираторного заболевания. Однако лишь в 1-2% случаев течение ОРЗ осложняется бактериальным синуситом. Тем не менее, эти 2% составляют весьма внушительную долю, например, по статистике США - это порядка 20 млн случаев в год.
Согласно эпидемиологическим данным, взрослые в среднем переносят 2-3 эпизода, а дети - до 10 эпизодов ОРЗ в год. Заболеваемость ОРЗ носит сезонный характер: с ростом в осенне-зимний период и относительно стабильным уровнем в летний период. Для острого синусита характерны те же сезонные тенденции, что и для ОРЗ.
РС не только часто приводит к временной потере трудоспособности, но и существенно сказывается на качестве жизни больных. Установлено, что клинические проявления и острого, и хронического РС приводят к ухудшению качества жизни пациента, причем это ухудшение даже более выражено, чем при ишемической болезни сердца и хронической обструктивной болезни легких (ХОБЛ). У 26% больных РС сопровождается развитием или прогрессированием психической депрессии.
Этиология
Результаты многолетних исследований подтверждают что острый синусит вирусной природы связан в основном с респираторными вирусами (риновирусы, респираторно-синцитиальные, аденовирусы, коронавирусы). Спектр возбудителей острого бактериального синусита остается относительно постоянным, наиболее часто встречаются Streptococcus pneumoniae и Haemophilus influenzae. Реже возбудителями могут быть Streptococcus pyogenes, Moraxella catarrhalis, Staphylococcus aureus, анаэробы. M.catarrhalis чаще является возбудителем острого РС у детей. Считается, что синусит вызванный M.catarrhalis, чаще имеет легкое течение и высокую тенденцию к саморазрешению.
Для правильного выбора адекватного антибиотика при эмпирической терапии важно знание спектра основных возбудителей риносинусита и их антибиотикорезистентности в конкретном регионе. Наиболее достоверными для России являются результаты исследования, проведенного в Смоленске, Москве и Санкт-Петербурге в 2003 году. Это исследование показало, что S.pneumoniae является возбудителем РС у 42,0% больных, H.influenzae - у 25,4%. Среди прочих возбудителей РС фигурировали β-гемолитические стрептококки (15,5%), S.pyogenes (6,9%), H.parainfluenzae (2,3%), S.aureus (1,7%), M.catarrhalis (1,1%). Результаты данного исследования показали, что основными отличиями спектра патогенов при РС в России является относительно низкий процент выявления M.catarrhalis и существенная роль β-гемолитических стрептококков (в основном группы F), с которыми авторы связывают наиболее тяжелые формы воспаления ОНП.
Антибиотикорезистентность является очень серьезной проблемой в терапии РС в странах Западной Европы. Так, в Испании процент штаммов пневмококка, резистентных к пенициллинам, составляет 28%, резистентным к макролидам - 37%, а резистентных к цефалоспоринам - 39%. Аналогичные показатели во Франции составляют 27%, 58% и 41% соответственно. В России, где системное назначение антибиотиков при острых РС не носило столь повального характера, показатели антибиотикорезистентности на порядок ниже. По данным упомянутого уже исследования, пневмококки характеризуются высокой резистентностью лишь к двум антимикробным препаратам: ко-тримоксазолу (32,4% резистентных штаммов) и тетрациклину (29,4%). Процент штаммов, резистентных к пенициллину, составляет 7,4%, к макролидам (азитромицину и кларитромицину) - 1,5%. В ходе исследования не выявлено штаммов, резистентных к амоксициллину цефотаксиму цефепиму и моксифлоксацину
Этиологическая роль нетипичных возбудителей в настоящее время активно дискутируется. Считают, что анаэробы (анаэробные стрептококки, Bacteroides, Fusobacterium) вызывают воспалительный процесс в ОНП в среднем у 10% взрослых пациентов, как правило, при одонтогенных и осложненных синуситах. Есть сведения, что при остром фронтите рост анаэробов получен у 43% больных (30% в чистой культуре, 13% в ассоциации), а при осложненном синусите - у 81% (38%+43%). Поэтому вероятность анаэробной инфекции должно учитываться при эмпирическом выборе адекватного антибиотика, особенно при тяжелых формах РС.
Значение внутриклеточных возбудителей в этиологии острого РС пока окончательно не выяснено. По мнению некоторых авторов, Mycoplasma pneumoniae и Chlamydophila pneumoniae могут быть источником воспаления ОНП в 8-25% случаев. Отмечено, что синуситы, вызванные данными возбудителями, часто встречаются при сопутствующей патологии нижних отделов дыхательных путей (хронический бронхит бронхиальная астма, ХОБЛ). Внутриклеточные возбудители могут длительно персистировать в клетках эпителия, лимфоглоточном кольце и обусловливать более тяжелое нестандартное течение заболевания. Выделение этих возбудителей с помощью традиционного бактериологического исследования невозможно, однако существуют чувствительные методы этиологической диагностики микоплазменных и хламидийных инфекций (иммуноферментный анализ, иммунохроматография, ферментспецифическая реакция, полимеразная цепная реакция - ПЦР).
M.pneumoniae чаще вызывает острый процесс в ОНП. Данный возбудитель требует специфического антибактериального лечения, т. к. не все группы антибиотиков способны вызвать его эрадикацию. Это связано с особым строением микоплазмы: вместо клеточной стенки она защищена трехслойной цитоплазматической мембраной. В связи с этим препараты β-лактамного ряда (пенициллины, включая защищенные - амоксициллин/клавуланат, цефалоспорины) оказываются неэффективными, т. к. эти препараты подавляют синтез именно клеточной мембраны бактерий. Препаратами выбора являются антибиотики макролидного ряда.
Ch.pneumoniae чаще встречается при хроническом синусите. Этот внутриклеточный возбудитель также оказывается устойчивым к действию целого ряда антибиотиков. Под влиянием трансформирующих агентов (β-лактамных антибиотиков и др.) в цитоплазме клеток появляются аномальные формы хламидий, морфологически сходные с L-формами, которые не могут быть диагностированы с помощью классических биологических тестов. Как и в случае микоплазмы, активными против данного микроорганизма являются макролиды.
ТАБЯИЦА 1. ОСНОВНЫЕ ВОЗБУДИТЕЛИ ОСТРОГО РИНОСИНУСИТА
Основные возбудители Частота встречаемости Взрослые Дети Вирусы Риновирус 15% - Вирус гриппа 5% - Вирус парагриппа 3% 2% Аденовирус - 2% Бактерии Streptococcus pneumonia 31% (20-35) 36% Haemophilus influenzae 21% (6-26) 23% S.pneumonia+H.influenzae 5% (1-9) - α-Streptococcus 9% (3-19) - Moraxella catarrhalis 8% (2-10) 19% Анаэробы 6% (0-10) - Staphylococcus aureus 4% (0-8) - Streptococcus pyogenes 2% (1-3) 2% Грам (-) флора 9% (0-24) 2% ПАТОГЕНЕЗ
Пусковым моментом в развитии острого синусита обычно бывает ОРВИ, наиболее типичным возбудителем которой являются риновирусы. Вызванное вирусом воспаление вызывает отек слизистой оболочки, транссудацию плазмы и гиперсекрецию желез. Синусит практически всегда вызывается застоем секрета и нарушением воздухообмена в ОНП, когда страдает механизм мукоцилиарного клиренса и продляется время контакта патогенных бактерий с клетками слизистой оболочки. Еще одним патогенетическим фактором острого РС может быть привычка к частому высмаркиванию. Очищение полости носа посредством высмаркивания создает давление порядка 60-80 мм рт. ст., которого достаточно для проталкивания инфицированного секрета из среднего или верхнего носового хода в полость пазухи. Наиболее подвержена этому верхнечелюстная пазуха при наличии у нее дополнительного соустья в задней фонтанелле. В случае острого воспаления слизистая оболочка пораженной пазухи, которая в норме имеет толщину папиросной бумаги, утолщается в 20-100 раз, формируя подушкообразные образования, иногда заполняющие практически весь просвет пазухи. В условиях выраженного отека, блокады естественного соустья, стагнации секрета и снижения парциального давления кислорода в пазухах создаются оптимальные условия для развития бактериальной инфекции (рис.1). При вирусном и бактериальном воспалении обычно одновременно поражаются несколько пазух (полисинусит); изолированное поражение одной пазухи (моносинусит) характерно для специфических форм синусита, в частности грибкового и одонтогенного.
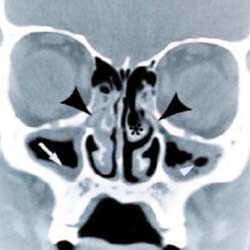
Рис.1. Механизм развития воспалительного процесса в ОНП при обструкции естественного соустья: а) КТ, коронарная проекция; б) схематическое изображение (черные стрелки - блокированные соустья верхнечелюстной пазухи, белые стрелки - утолщенная слизистая оболочка и экссудат в пазухах).
КЛАССИФИКАЦИЯ
По степеням тяжести выделяют синусит легкого течения (обычно катаральный, вирусный), средней степени тяжести и тяжелый. Последние, как правило, являются гнойными и вызываются бактериальной флорой. В каждом конкретном случае степень тяжести оценивается по совокупной выраженности всех симптомов заболевания. Согласно международным документам (EP3OS, редакция 2007 года), определение степени тяжести острого РС должна базироваться на субъективной оценке своего состояния пациентом по 10-сантиметровой визуальной аналоговой шкале (VAS). На этой шкале сам пациент указывает точку соответствующую выраженности симптомов заболевания. Значения от 0 до 3 см (баллов) соответствуют легкой степени заболевания, 4-7 баллов - среднетяжелой, 8-10 баллов - тяжелой форме заболевания.
Сложно выделить конкретные формы острого РС в зависимости от локализации воспалительного процесса. Дело в том, что в отличие от хронических, острые изолированные поражения отдельных пазух редки, и более 80% воспалительных процессов протекают в форме полисинусита, т. е. в той ли иной степени охватывают одновременно несколько или все пазухи. Скорее следует говорить о формах с преимущественным поражением одной из пазух (верхнечелюстной, лобной и т. д.)
ДИАГНОСТИКА
Целями обследования больного с подозрением на РС являются:
- подтверждение самого диагноза синусита;
- уточнение формы заболевания.Как уже указывалось, диагноз синусита подтверждается на основании совокупности типичных клинических симптомов заболевания. Ни рентгенография ОНП, ни диагностическая пункция верхнечелюстной пазухи в настоящее время не считаются необходимыми для подтверждения этого диагноза (EP3OS, редакция 2007 года). В клиническом плане наиболее важна вторая задача - уточнение степени тяжести заболевания и, в какой-то степени, его этиологии, что позволяет решить основной вопрос в тактике лечения - о необходимости назначении системных антибиотиков. Микробиологическое исследование в рутинных случаях острого РС не считается необходимым, и дифференциальная диагностика между вирусной и бактериальной формами проводится на основании клинических данных. Проблема заключается в том, что клинические проявления острого бактериального РС и затянувшегося вирусного ОРЗ очень схожи, что часто приводит к гипердиагностике. Правильный диагноз бактериального РС в условиях первичной медицинской помощи ставится примерно в 40-50% случаев.
Симптоматика легких форм РС ограничивается местными проявлениями (затруднение носового дыхания, выделения из носа слизистого, реже -слизисто-гнойного характера, нарушение обоняния, незначительная головная боль в области лба либо в области проекции пазухи). При этом отсутствуют или незначительно выражены признаки интоксикации, температура остается нормальной или субфебрильной. Острый РС легкого течения имеет выраженную тенденцию к самостоятельному разрешению, его лечение обычно ограничивается приемом симптоматических средств, назначаемых при ОРЗ. Лишь при прогрессировании симптомов или сохранении их на протяжении длительного времени (более 5 дней) следует думать о присоединении бактериальной флоры и системном назначении антибиотиков.
При средней тяжести и тяжелом остром РС, помимо местных, выражены признаки общей интоксикации. У таких больных отмечается повышение температуры до 38°С и выше, беспокоит интенсивная головная боль, выражена болезненность в местах проекции пазух, может быть реактивный отек век, легкая отечность мягких тканей лица. Особенностью бактериального синусита является не только более тяжелое течение, но и возможность развития орбитальных и внутричерепных осложнений, а также переход заболевания в хроническую форму.
Только в тех случаях, когда традиционные схемы лечения оказываются неэффективными, требуется точная идентификация возбудителя. "Золотым стандартом" в этом случае должно быть исследование содержимого пораженной пазухи, полученного при пункции. Однако, к сожалению, в реальной жизни в 2/3 случаев материалом для исследования служит мазок из полости носа, который не может быть точным ориентиром, т. к. обладает незначительной информативностью из-за контаминации "путевой" микрофлорой преддверия носа, обычно золотистым или эпидермальным стафилококком.
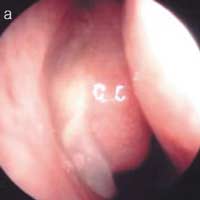
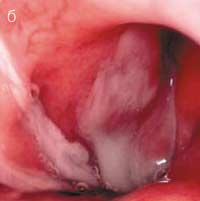
Основным методом объективной диагностики РС является передняя риноскопия, при которой на фоне диффузной застойной гиперемии и отека слизистой оболочки полости носа выявляется типичный признак гнойного синусита - наличие патологического отделяемого в области выводных отверстий пораженных ОНП. При поражении верхнечелюстной и лобной пазух такое отделяемое можно увидеть в среднем (рис. 2а), а при сфеноидите - в верхнем носовом ходе. Патологические изменения в среднем и верхнем носовых ходах лучше видны после анемизации слизистой оболочки, которая достигается аппликацией 0,1% раствора адреналина или распылением 0,1% раствора ксилометазолина или оксиметазолина. Патологический секрет может быть выявлен и на задней стенке глотки при задней риноскопии и фарингоскопии (рис. 2б).
Рис.2. Гнойное отделяемое - основной симптом острого бактериального синусита: а) гной в правом среднем носовом ходе; б) гнойное отделяемое в носоглотке (0° эндоскоп).
Эндоскопическое исследование полости носа
Исследование может быть выполнено торцевым или 30° жестким или гибким эндоскопом диаметром 4 мм. В том случае, если носовые ходы очень узкие (например, в детском возрасте), полость носа можно исследовать жесткими эндоскопами диаметром 2,7 мм или 1,9 мм. Этот неинвазивный метод требует минимума времени и безболезненно переносится пациентом. Исследование проводят после анемизации и однократного смазывания слизистой оболочки носа 3-5% раствором лидокаина.
Диафаноскопия
Позволяет выявить снижение пневматизации верхнечелюстной и лобной пазух. Для этого специальную лампочку или световод вводят в полость рта или располагают на нижней стенке глазницы и сравнивают свечение исследуемых пазух с обеих сторон. Разница особенно хорошо заметна при одностороннем поражении. Исследование должно проводиться в затемненной комнате, интерпретация требует хорошего навыка.
Ультразвуковое исследование (УЗИ)
Быстрый неинвазивный метод, который используется в основном в скрининговых целях, например при профосмотрах. УЗИ может использоваться для диагностики воспалительных заболеваний и кист верхнечелюстной и лобной пазух. Принцип УЗИ основан на отражении ультразвукового излучения, которое происходит на границе двух субстанций, имеющих различные акустические характеристики (кость-воздух, воздух-экссудат и т д.) УЗИ может проводиться как в А (линейном), так и в В (двухмерном) режиме. В первом случае используются специальные аппараты для сканирования околоносовых пазух ("Синускан" и др.), во втором - стандартная аппаратура для УЗИ.
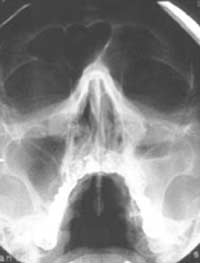
Рентгенография ОНП
Обычно выполняется в носо-подбородочной проекции. Дополнительно исследование может быть проведено в носо-лобной и боковой проекциях для уточнения состояния лобной и клиновидной пазух. В типичной ситуации выявление утолщенной слизистой оболочки ОНП, горизонтального уровня жидкости или тотального снижения пневматизации пазухи считают признаком синусита (рис. 3). Однако в некоторых случаях интерпретация рентгенограмм может представлять определенные сложности, например, при наложении окружающих костных структур или гипоплазии пазухи. Первостепенное значение имеют правильная укладка пациента и соблюдение оптимального режима исследования. Некачественные рентгенограммы часто приводят к диагностическим ошибкам. Считается, что рентгенологическое исследование не показано при неосложненных формах синусита, так как оно не позволяет дифференцировать вирусное воспаление от бактериального и характеризуется довольно низкой информативностью. Данные рентгенографии и КТ ОНП совпадают только в 34% случаев, для верхнечелюстной пазухи этот показатель составляет 77%.
Рис. 3. Рентгенография ОНП в носо-подбородочной проекции, левосторонний верхнечелюстной синусит.
Компьютерная томография (КТ)
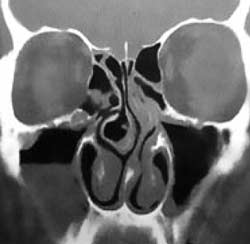
КТ является наиболее информативным методом и становится "золотым стандартом" исследования ОНП. КТ не только позволяет установить характер и распространенность патологических изменений, но и выявляет причины и индивидуальные особенности анатомического строения полости носа и ОНП, приводящие к развитию и рецидивированию синусита (рис. 4). КТ позволяет визуализировать структуры, которые не видны при обычной рентгенографии. Однако и этот метод не применяется рутинно в диагностике острого РС: также как рентгенография он не позволяет отличить вирусное воспаление от бактериального, а изменения в ОНП на КТ отмечаются у 87% больных с респираторными вирусными инфекциями.
Рис. 4. Правосторонний верхнечелюстной синусит, уровень жидкости в правой верхнечелюстной пазухе, искривление перегородки носа, буллезное увеличение средней носовой раковины(concha bullosa), парадоксальное искривление средней носовой раковины слева. КТ коронарная проекция.
Диагностическая пункция и зондирование
Эти виды диагностики дают возможность оценить объем и характер содержимого пораженной пазухи и косвенным путем получить представление о проходимости ее естественного отверстия. Пункцию верхнечелюстной пазухи производят через нижний носовой ход, лобную пазуху пунктируют тонкой иглой через глазничную стенку или производят трепанопункцию через переднюю стенку бором или трепанами различных модификаций. Зондирование лобной пазухи выполняют через лобно-носовое соустье специальной изогнутой канюлей, клиновидной пазухи - также выполняют через естественное отверстие в верхнем носовом ходе модифицированной аттиковой канюлей, лучше под контролем ригидного эндоскопа.
Бактериологическое исследование
Материал для исследования может быть получен из полости носа либо из пораженной пазухи при ее пункции. При синусите целесообразен забор отделяемого из конкретной области, например из среднего носового хода, и это лучше делать под контролем эндоскопа. Мазок следует брать, максимально отодвинув крыло носа носовым зеркалом и следя за тем, чтобы при введении и выведении тампона он не прикасался к коже и волоскам преддверия носа. Чем тоньше зонд и чем меньше закрепленный на нем кусочек ваты, тем меньше вероятность попадания в материал для посева "путевой" микрофлоры. Для того чтобы исключить попадание "путевой" микрофлоры, отделяемое полости носа может прицельно, под контролем зрения собираться при помощи отсоса. Полученный материал помещают в стерильную пробирку: либо пустую, либо на транспортную среду в зависимости от предполагаемого характера исследования. В первом случае материал следует максимально быстро доставить в лабораторию. Задержки с доставкой, хранение материала, особенно в холодильнике, могут сказаться на достоверности полученной бактериограммы.
При интерпретации полученных результатов возникает ряд проблем, в первую очередь связанных с тем, что большинство синуситов, особенно в их начальной стадии, вызывается вирусами. В этой связи отсутствие роста патогенной микрофлоры при посеве может объясняться как недочетами в заборе, транспортировке и культивировании материала, так и вирусной (или иной) этиологией заболевания. Бактериологическое исследование пунктата пораженной пазухи часто дает ложноотрицательный результат который объясняют феноменом аутостерилизации гноя в полостях.
ЛЕНЕНИЕ.
Основными целями при лечении острого и рецидивирующего РС являются:
- сокращение длительности заболевания;
- предупреждение развития орбитальных и внутричерепных осложнений;
- эрадикация возбудителя.С этих позиций базисным методом лечения острого бактериального синусита и обострения хронического синусита является системная антибиотикотерапия, которая базируется на знании основных (типичных) возбудителей или на тестировании чувствительности культуры конкретных микроорганизмов, выделенных из среднего носового хода или из пораженной пазухи.
Лечению антибиотиками подлежат далеко не все формы синуситов, а только их среднетяжелые и тяжелые формы. Поскольку дополнительные методы исследования (рентгенография, КТ, УЗИ и диафаноскопия) не позволяют дифференцировать между вирусным и бактериальным поражением пазух и не являются показателями степени тяжести заболевания, основными критериями при решении вопроса о назначении антибиотика становятся общее состояние и жалобы больного, анамнез и наличие гнойного отделяемого в носовых ходах.
Выбор антибиотика, направленный на конкретного возбудителя, идентифицированного при бактериологическом исследовании, отнюдь не гарантирует успех в связи с высокой вероятностью попадания в исследуемый материал "путевой" микрофлоры при заборе материала. Кроме того, клиническая картина среднетяжелых и тяжелых форм бактериальных РС диктует необходимость системного назначения антибиотиков, не дожидаясь результатов микробиологического исследования, которое занимает несколько дней.
Таким образом, хотя микробиологические исследования и играют определенную роль в выборе оптимального антибиотика, основным методом лечения острого бактериального РС остается эмпирическая антибиотикотерапия. При выборе антибактериального препарата первостепенное значение имеет чувствительность к нему типичных возбудителей заболевания: S.pneumonia и H.influenzae. Растущая в последние годы резистентность этих микроорганизмов к основным антибиотикам является основной проблемой в рациональной антибиотикотерапии при остром РС. С учетом спектра типичных возбудителей и российских данных об их антибиотикорезистентности препаратом первого выбора при остром синусите является амоксициллин. Адекватная доза для взрослых - 1,5-3,0 г/сут, для детей - 30-60 мг/кг/сут., суточную дозу делят на три приема, независимо от приема пищи. Однако следует помнить о том, что уже сейчас более 5% штаммов H.influenzae в России не чувствительны к незащищенным пенициллинам. Поэтому эффект эмпирической антибиотикотерапии должен мониторироваться, и критериями эффективности являются, в первую очередь, динамика основных симптомов синусита (головной боли, выделений, заложенности носа) и общего состояния больного. При отсутствии заметного клинического эффекта по прошествии трех дней следует сменить амоксициллин на антибиотик, активный против пенициллин-резистентностных пневмококков и продуцирующих Ψ-лактамазы штаммов гемофильной палочки. В этом случае, если лечение проводится амбулаторно, перорально назначают амоксициллин-клавуланат. Маленьким детям препарат назначают в виде порошка для приготовления суспензии. Другим вариантом лечения являются цефалоспорины, например, цефуроксим аксетил.
Помимо амоксициллина и цефалоспоринов в лечении ОБРС могут использоваться современные макролиды, такие как азитромицин и кларитромицин.
Макролиды являются препаратами выбора при непереносимости препаратов пенициллинового ряда, когда в силу возможности перекрестной аллергии нельзя назначать и цефалоспорины. Исследования последних лет показывают что по клинической эффективности и бактериологическому показателю эрадикации возбудителя макролиды мало уступают защищенным пенициллинам и цефалоспоринам.
Если больной госпитализирован и предпочтительным является внутримышечный путь введения, целесообразно назначение цефалоспоринов: цефотаксима или цефтриаксона. Оптимальными препаратами для внутривенного введения являются амоксициллин/клавуланати цефалоспорины.
Средствами второго выбора, которые назначают в случае неэффективности первого курса антибиотикотерапии, в настоящее время являются макролиды и фторхинолоны III-IV поколений: левофлоксацин, моксифлоксацин, спарфлоксацин. Спектр антимикробного действия этой группы препаратов максимально адаптирован к возбудителям инфекций ВДП, и их калькулируемая бактериологическая эффективность приближается к 100%, что подтверждается и исследованиями, проведенными в России. Главным побочным эффектом фторхинолонов III-IV поколения является их негативное действие на растущую соединительную и хрящевую ткань, поэтому эти препараты противопоказаны детям и подросткам. В этой ситуации препаратами второй линии у больных моложе 16 лет опять становятся макролидные антибиотики либо клиндамицин. Длительность курса антибиотикотерапии при остром РС обычно должна составлять не менее 10 дней.
ТАБЛИЦА 2. ДОЗИРОВКИ ОСНОВНЫХ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ острого БАКТЕРИАЛЬНОГО РС
Педиатрическая дозировка Дозировка для взрослых Амоксициллин 30-60 мг/кг/сут. в 3 приема 1,5-3,0 г/сут. в, 3 приема Амоксициллин/клавуланат 50 мг/кг/сут. в 2 приема 500-875 мг 2 раза в день Цефуроксим 30 мг/кг/сут в 2 приема 250-500 мг 2 раза в день Цефиксим 8 мг/кг 1 раз в день 400 мг 1 раз в день Цефтибутен 9 мг/кг 1 раз в день 400 мг 1 раз в день Цефотаксим Парентерально - 50-100 мг/кг/сут. в 3 введения Парентерально 3-8 г/сут в 2-3 введения Цефтриаксон Парентерально 20-75 мг/кг/сут в 1-2 введения Парентерально 1,0-2,0 г/сут в 1 введение Азитромицин 10 мг/кг 1 раз в день 500 мг 1 раз в день Кларитромицин 15 мг/кг/сут. в 2 приема 500 мг1 раз в день (СР-форма) Моксифлоксацин - 400 мг 1 раз в день Левофлоксацин - 500 мг1 раз в день Клиндамицин 15 мг/кг 3 раза в день 150-450 мг 3 раз в день Следует особо остановиться на тех препаратах, которые заведомо не следует назначать для лечения острого РС. К ним относятся, в частности, линкомицин, оксациллин и гентамицин, которые малоактивны в отношении S.pneumoniae и не действуют на H.influenzae, ко-тримоксазол из-за высокой резистентности к нему основных возбудителей РС в России. Ципрофлоксацин также отсутствует в традиционных схемах лечения синуситов из-за низкой природной активности в отношении пневмококка.
Фармакоэпидемиологические исследования, проведенные в России (С. Н. Козлов, 2004), показывают, что наши врачи пока далеко не всегда следуют общепринятым стандартам эмпирической антибиотикотерапии при острых РС. По-прежнему самым любимым препаратом первого выбора остается линкомицин, который назначают 18% больных. В 13,5% случаев назначается ципрофлоксацин, в 12% - ампициллин, в 7,7% - доксициклин, в 5,5% - гентамицин, 2,1% врачей все еще назначают ко-тримоксазол. Амоксициллин был препаратом первого выбора лишь у 16,7% больных, амоксициллин/клавуланат - только у 3,1%.
Пожалуй, наиболее (причем незаслуженно) "забытыми" при лечении острого РС остаются макролидные антибиотики. По данным того же исследования, азитромицин больным острым РС назначают всего 0,3% врачей. Возможно, на то есть свои основания. В российских клинических рекомендациях по диагностике и лечению РС издания 2007 года макролиды почему-то не упоминаются вовсе. Мы уже отмечали высокий уровень резистентности пневмококков к макролидам в странах Западной Европы, в частности во Франции и в Испании. В этой связи стандарты эмпирической антибиотикотерапии синуситов в некоторых европейских странах практически нивелируют роль данного класса антибиотиков. "Амоксициллин и макролиды больше не годятся для лечения синуситов" - это цитата из французских клинических рекомендаций 2002 года, на "ограниченную роль макролидов вследствие резистентности S.pneumoniae, низкой активности в отношении H.influenzae" указывают испанские клинические рекомендации.
Однако именно в России из-за особенностей структуры патогенов и национальных параметров антибиотикорезистентности роль этого класса антибиотиков выглядит совершенно по-иному. Поэтому в данных рекомендациях мы сочли уместным более подробно остановиться на особенностях макролидов именно в аспекте их потенциального использования в лечении острого РС.
МАКРОЛИДЫ
Класс антибиотиков, основу химической структуры которых составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, рокситромицин, кларитромицин), 15-членные (азитромицин) и 16-членные (мидекамицин, спирамицин, джозамицин). Основное клиническое значение имеет активность макролидов в отношении грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы). Резистентность к макролидам в России остается предельно низкой, так, число штаммов S.pneumonia, резистентных к азитромицину составляет всего 1,5%, а резистентных штаммов H.influenzae в 2003 году не было выявлено вовсе. В отличие от цефалоспоринов макролиды не обладают свойством перекрестной аллергии с β-лактамами. Высокие концентрации в тканях (в 5-10-100 раз выше плазменных), длительный период полувыведения (до 55 ч), удобный режим дозирования, короткие курсы лечения, сохранение лечебного эффекта в течение 5-7 дней после отмены являются отличительными чертами этого класса препаратов. Некоторые макролиды (в частности, кларитромицин) демонстрируют значительное усиление антибактериальной активности в результате однонаправленного эффекта антибиотика и его метаболита и способность целенаправленно достигать бактерицидных концентраций именно в очаге инфекции. Помимо этого, макролиды относятся к числу наименее токсичных и наименее аллергенных антибиотиков.
ТАБЛИЦА 3 КЛАССИФИКАЦИЯ МАКРОЛИДОВ
14-членное кольцо 15-членное кольцо 16-членное кольцо Природные
Эритромицин
ОлеандомицинПолусинтетические
Диритромицин
Рокситромицин
КларитромицинАзалиды
АзитромицинПриродные
Спирамицин
ДжозамицинПолусинтетические
Рокитамицин
МидекамицинАнтимикробный эффект макролидов обусловлен нарушением синтеза белка на рибосомах микробной клетки. Как правило, они оказывают бактериостатическое действие, но в высоких концентрациях способны действовать на пневмококк бактерицидно. Кроме антибактериального действия, макролиды обладают иммуномодулирующей и противовоспалительной активностью.
Чаще всего антибиотики-макролиды назначают перорально. После приема внутрь эти препараты частично подвергаются разрушению под действием соляной кислоты. Наименее чувствительным к соляной кислоте является кларитромицин, наиболее - эритромицин и олеандомицин. Так как все макролиды обладают хорошей липофильностью, они легко всасываются. Основное всасывание происходит в тонком кишечнике. Биодоступность варьируется от 30 до 90% в зависимости от препарата и наличия или отсутствия энтерорастворимой оболочки. Биодоступность минимальна у эритромицина и максимальна у кларитромицина. При этом обычно увеличение дозировки слегка повышает биодоступность.
При поступлении в кровь макролиды в основном связываются с белками и в меньшей степени с клетками крови и поступают в различные органы, ткани и среды организма. В среднем, концентрация в тканях антибиотиков-макролидов примерно в 10 раз выше концентраций в плазме крови. Наиболее высокие тканевые концентрации характерны для джозамицина, азитромицина и кларитромицина (в 10-100 раз выше плазменных), наиболее низкие - для эритромицина (в 5-10 раз выше плазменных). Препараты, имеющие высокую степень пенетрации в ткани, более высокие тканевые концентрации, чем плазменные, обладающие способностью аккумулироваться в клетках, наиболее эффективны против внутриклеточных возбудителей.
Важным свойством макролидов является их проникновение и накопление в гранулоцитах, макрофагах и клетках тканей организма. Макролиды второго поколения, к которым относится кларитромицин, способны проникать в фагоцитирующие клетки (фибробласты, полиморфноядерные гранулоциты, макрофаги и др.), повышая фагоцитарную активность этих клеток. Таким образом, при миграции фагоцитирующих клеток в воспалительный очаг с ними поступают и антибиотики. Интересно, что при увеличении длительности терапии не меняется проникновение в фагоцитирующие клетки джозамицина, возрастает поступление кларитромицина и убывает поступление азитромицина. Между тем, при длительной терапии следует выбирать препараты, поступление которых в фагоцитирующие клетки не уменьшается. Поэтому для длительной терапии кларитромицин предпочтительнее азитромицина.
Эффективность макролидов при лечении инфекций дыхательных путей объясняется не только прямым антибактериальным действием, но и наличием у них противовоспалительных свойств. Противовоспалительные или, что более правильно, модулирующие воспаление эффекты макролидов при заболеваниях дыхательных путей многообразны: воздействие на секрецию цитокинов/ хемокинов; влияние на хемотаксис, трансэндотелиальную миграцию, фагоцитоз и дегрануляцию нейтрофилов, ускорение мукоцилиарного клиренса; снижение секреции слизи бокаловидными клетками.
Влияние макролидов на иммунный процесс
Основным объектом воздействия макролидов являются фагоцитирующие клетки. Это связано со способностью этих препаратов активно проникать внутрь фагоцитов, а также высвобождаться из них в ходе инфекционного процесса. Проникая в фагоцитирующие клетки, макролиды влияют на их функциональную активность, что проявляется широким спектром эффектов, основными среди которых являются тормозящее воздействие на продукцию кислородных радикалов и модуляция выработки провоспалительных и противовоспалительных цитокинов. В частности, воздействуя на полиморфноядерные нейтрофилы, макролиды ускоряют их апоптоз, снижают продукцию таких провоспалительных цитокинов, как интерлейкины IL6 и IL8 и фактор некроза опухоли α. С другой стороны, под действием макролидов усиливается синтез IL10, что, наряду с уменьшением продукции IL8, приводит к большей усвояемости данных антибиотиков моноцитами, что в целом способствует росту антибактериальной активности.
Макролиды оказывают также влияние на нефагоцитирующие клетки, которое может быть как прямым, так и опосредованным фагоцитами. Так, они защищают цилиарный эпителий дыхательных путей от повреждающего действия фагоцитирующих клеток. Макролиды обладают способностью и прямого воздействия на эпителиальные клетки, они модифицируют секреторную активность эпителия слизистых оболочек, а также нарушают адгезию патогенных микроорганизмов на поверхности эпителиальных клеток и, следовательно, процесс микробной колонизации слизистых оболочек. Снижение секреции под действием макролидов развивается вследствие блокады транспортных каналов для С1- и Н2О. Антибиотики данного семейства значительно ослабляют роль эозинофилов в воспалении, ускоряя их апоптоз и ограничивая продукцию этими клетками хемокинов и адгезивных молекул.
Доказано действие макролидов и на лимфоциты. Они угнетают пролиферацию Т-лимфоцитов, что связывали со способностью этих препаратов подавлять продукцию IL-2. Описана чувствительность к макролидам Т-хелперов 1-го типа, в то время как цитотоксические Т-клетки не реагировали на лечение данными препаратами. Установлено стимулирующее влияние антибиотиков данной группы на естественную киллерную активность клеток у здоровых людей.
Среди природных макролидов наиболее изученным с точки зрения влияния на иммунную систему является эритромицин. Установлено, что этот антибиотик может проникать в полиморфноядерные лейкоциты, изменяя их функциональную активность, повышая их подвижность. Действует эритромицин и на макрофагальные функции, в частности, отмечен его дозозависимый эффект в отношении продукции цитокинов альвеолярными макрофагами. В то же время способность эритромицина проникать и в фагоцитирующие, и в эпителиальные клетки вряд ли может быть признана высокой.
Среди других 14-членных макролидов, но уже полусинтетического происхождения, больше всего внимания в литературе уделяется противовоспалительным свойствам кларитромицина. Для него характерно статистически достоверное усиление фагоцитарных реакций и внутриклеточного киллинга. При этом названные эффекты кларитромицина носят отчетливый дозозависимый и зависимый от времени характер. В высоких дозах этот антибиотик утрачивал способность влиять на развитие адаптивных и естественных иммунных реакций, тогда как в умеренных дозах хорошо стимулировал выработку антител. Представляется интересным, что в первой фазе иммуномодулирующего действия (начало лечения) отмечалась стимуляция дегрануляции нейтрофилов и оксидативного взрыва, что оптимизирует функционирование защитных механизмов человека. По достижении первоначального терапевтического эффекта (эрадикации бактерий) отмечаются уменьшение концентрации цитокинов/ хемокинов и стимуляция апоптоза нейтрофилов, что приводит к уменьшению выраженности воспалительной реакции (вторая фаза действия препарата).
Макролиды в терапии аллергических заболеваний
Применение антибиотиков у больных с аллергическими заболеваниями, в частности при аллергическом рините и бронхиальной астме, является довольно серьезной проблемой. Это связано с аллергизирующими свойствами самих антибиотиков. Противовоспалительные свойства макролидов вкупе с низкой природной аллергенностью дают возможность их широкого использования при синуситах, развившихся на фоне аллергического ринита, а также при сопутствующей бронхиальной астме. В основе успеха терапии макролидами при риносинусите и сопутствующей бронхиальной астме лежат уже упомянутые выше механизмы: угнетение продукции провоспалительных цитокинов, активация секреции противоспалительного IL-10, уменьшение трансэндотелиальной миграции нейтрофилов, эозинофилов, моноцитов и т. д. При оценке эффективности лечения макролидами бронхиальной астмы и риносинуситов некоторые исследователи обращают особое внимание на воздействие этих препаратов на эозинофилы, в частности, на способность макролидов стимулировать апоптоз этих клеток, уменьшать продукцию ими хемокинов и молекул адгезии.
Наиболее оптимальной фармакодинамикой и фармакокинетикой среди антибиотиков-макролидов нового поколения обладает кларитромицин. Он оказывает антибактериальное (бактерицидное) действие, взаимодействуя с субъединицей рибосом бактерий 50S и подавляя синтез белка. Препарат эффективен в отношении многих аэробных, анаэробных, грамположительных и грамотрицательных микроорганизмов, в частности, S.pneumonae, S.pyogenes, H.influenzae, H.parainfluenzae, M.catarrhalis, Legionella pneumophila, Mycoplasma pneumoniae, Chlamydia pneumoniae. К препарату нечувствительны Enterobacteriaceae и Pseudomonas spp.
Именно у кларитромицина наблюдается наиболее высокая внутриклеточная концентрация, сохраняющаяся в течение оптимального времени. Таким образом, именно кларитромицин оказывается эффективным и против внутриклеточных, и внеклеточных возбудителей. Время выведения кларитромицина из тканей практически не отличается от времени выведения из плазмы крови.
В сравнительных исследованиях показано, что частота побочных явлений при применении кларитромицина была одинаковой по сравнению с азитромицином, рокситромицином, амоксициллином и меньшей, чем у эритромицина.
Все побочные эффекты относились к категории легких. Таким образом, макролиды - это антибиотики, характеризующиеся широким спектром антимикробного действия, сниженной индукцией лекарственной устойчивости у микроорганизмов, воздействием на ход иммунного процесса и течение воспалительных реакций в организме больного. При реализации этих эффектов у макролидов преобладают дозозависимая модуляция фагоцитарной активности и подавляющее действие на продукцию провоспалительных цитокинов. Все эти особенности комплексного воздействия макролидов на макроорганизм определяют область их клинического применения у больных с воспалительными заболеваниями дыхательных путей, в том числе больных с острой воспалительной патологией ОНП.
Исходя из вышесказанного, считаем возможным рекомендовать использование кларитромицина как препарата первого выбора у пациентов со среднетяжелой формой острого риносинусита в случаях возможной сенсибилизации к препаратам пенциллинового ряда или других ситуациях, в которых необходимо назначение макролидов.
Учитывая значительную роль обструкции естественных отверстий ОНП в патогенезе синусита, большое значение в его терапии приобретают сосудосуживающие препараты (деконгестанты): нафазолин, оксиметазолин, ксилометазолин, тетризолин, инданазолин и др. Применяемые в виде капель и аэрозолей, деконгестанты действуют на регуляцию тонуса кровеносных сосудов полости носа. Активируя адренергические рецепторы, они вызывают сокращение кавернозной ткани носовых раковин и, как следствие, расширение носовых ходов и улучшение носового дыхания. По механизму действия большинство топических деконгестантов являются α-адреномиметиками, причем они могут селективно действовать на α1- либо α2-рецепторы.
ТАБЛИЦА 4. ТОПИЧЕСКИЕ СОСУДОСУЖИВАЮЩИЕ ПРЕПАРАТЫ
Механизм действия Генерическое название Торговые названия α1-адреномиметики Фенилэфрин Вибрацил*, Адрианол α2-адреномиметики Оксиметазолин
Ксилометазолин
Нафазолин
ИнданазоламинАфрин,
Леконил,
Називин,
Назол,
Фазин
Галазолин,
Для нос,
Ксимелин,
Олинт,
Отривин
Нафтизин,
Саноринα+β-адреномиметики Способствующие выделению норадренали Тетризолин
Эфедрина гидрохлорид наФариал,
Тизин
Адреналина гидрохлорид* помимо фенилэфрина, в состав входит антигистаминный препарат диметинден.Различные деконгестанты отличаются по своим фармакодинамическим особенностям, выраженности и продолжительности действия и побочных эффектов. Все эти препараты при длительном применении вызывают развитие синдрома "рикошета". В меньшей степени это свойственно фенилэфрину который, обладая мягким вазоконстрикторным эффектом за счет агонизма к α1-адренорецепторам, не вызывает значительного уменьшения кровотока в слизистой оболочке носа. В то же время лечебный эффект фенилэфрина менее выражен и менее продолжителен. Данные риноманометрии показали, что ксилометазолин уменьшает сопротивление воздушному потоку в полости носа на 8 часов с его максимальным снижением на 33%, в то время как фенилэфрин -только на 0,5-2 часа с максимальным снижением носового сопротивления на 17%. Продолжительный эффект α2-адреномиметиков объясняется их замедленным выведением из полости носа вследствие уменьшения кровотока в слизистой оболочке.
Большинство исследований показало, что кратковременные курсы лечения топическими деконгестантами не приводят к функциональным и морфологическим изменениям в слизистой оболочке. Длительное (свыше 10 дней) использование этих лекарственных средств может вызывать выраженный отек в полости носа, назальную гиперреактивность, изменения гистологического строения (ремоделирование) слизистой оболочки, то есть развитие медикаментозного ринита.
Важную роль играет форма выпуска препарата. Обычные носовые капли практически невозможно дозировать, так как большая часть введенного раствора тут же стекает по дну полости носа в глотку. Сложно дозировать и те сосудосуживающие капли, которые пациент должен впрыскивать в нос из пластикового баллона, сжимая его пальцами. И в том, и в другом случае теряется желаемый лечебный эффект и возникает угроза передозировки препарата. В этом плане предпочтительнее выглядит назначение дозированных аэрозолей ксилометазолина. Начинать лечение всегда следует с более низких концентраций препарата, тем более что недавние исследования показали, что и 0,1%, и 0,05% растворы ксилометазолина обладают примерно одинаковым вазокон-стрикторным эффектом.
Короткие курсы лечения топическими деконгестантами продолжительностью не более 10 дней могут применяться для уменьшения заложенности носа и восстановления дренажа ОНП у больных острым РС. Деконгестанты следует с осторожностью назначать при наличии атрофических и субатрофических изменений слизистой оболочки, а также у детей младше 2 лет.
Топические кортикостероиды (мометазона фуроат, флутиказона дипропионат, будесонид)
Данные препараты сравнительно недавно вошли в основной арсенал средств для лечения острого РС. Целесообразность их использования при данном заболевании долго оспаривалось с учетом возможного "мнимого" иммуносупрессивного эффекта, присущего кортикостероидным препаратам. На клеточном уровне противовоспалительное действие кортикостероидов осуществляется следующими путями:
- уменьшением количества тучных клеток и базофилов, и, следовательно, выделяемых ими медиаторов воспаления в эпителии носа и ОНП;
- выраженным снижением количества эозинофилов и их продуктов в эпителии и собственном слое слизистой оболочки; кортикостероиды могут также воздействовать на процесс апоптоза, уменьшая срок жизни эозинофилов;
- снижением количества Т-клеток в эпителии и воздействием на их функции
- уменьшением продукции лейкотриенов в слизистой оболочке;
- ингибированием продукции IgE, в частности при аллергии к пыльце растений;
- ГКС не действуют на нейтрофилы и макрофаги, никак не изменяя иммунный ответ на бактериальную инфекцию.Кроме того, топические кортикостероиды уменьшают секрецию желез слизистой оболочки, экстравазацию плазмы и тканевой отек. Эти препараты также снижают чувствительность рецепторов слизистой оболочки носа к гистамину и механическим раздражителям, то есть в определенной степени воздействуют и на неспецифическую назальную гиперреактивность.
Целый ряд контролируемых исследований убедительно продемонстрировал, что топические кортикостероиды могут с успехом применяться как в качестве монотерапии (при легких формах острого РС), так и как адъювантное средство при системном лечении антибиотиками. Недавнее двойное слепое исследование на 981 пациенте показало, что при легких формах острого РС мометазон в дозе 400 мкг/сут в плане воздействия на основные симптомы этого заболевания оказался значительно более эффективным, чем плацебо, и даже более эффективным, чем амоксициллин (!). Еще два хорошо контролируемых исследования показали, что добавление топических кортикостероидов (мометазона и флутиказона) к стандартному курсу системной антибиотикотерапии (амоксициллин/клавуланат, цефуроксим) значительно быстрее по сравнению с плацебо облегчали симптомы острого РС и ускоряли выздоровление.
Теперь с позиций доказательной медицины мы можем с уверенностью говорить об эффективности топических кортикостероидов при остром РС и рекомендовать их к более широкому применению при данном заболевании, особенно при сопутствующем аллергическом рините. Следует заметить, что для получения желаемого эффекта кортикостероиды при остром РС следует назначать в удвоенной (по сравнению с традиционной) дозировке: для флутиказона и мометазона она составляет 400 мкг/сут
Мукоактивные препараты
Играют определенную роль в лечении острых РС. Все мукоактивные средства принято делить на три основные группы:
- муколитики, влияющие на реологические свойства (вязкость и эластичность) слизи, в частности, протеолитические ферменты, N-ацетилцистеин;
- мукокинетики, ускоряющие транспорт слизи;
- мукорегуляторы, уменьшающие образование слизи (карбоцистеин, глюкокортикостероиды, ипратропия бромид).Наиболее широко используемым мукоактивным препаратом является N-ацетилцистеин, который выпускается в виде таблеток и назального аэрозоля. Ацетилцистеин способен разрывать дисульфидные мостики в кислых мукополисахаридах и таким образом уменьшать вязкость слизи. За счет наличия SH-группы, способной вступать во взаимодействие с окислительными токсинами, ацетилцистеин обладает и антиоксидантной активностью. Несмотря на широкое эмпирическое использование, эффективность муколитиков в целом пока не считается подтвержденной с позиций современной медицины доказательств (EP3OS, редакция 2007 года).
В лечении острого РС применяются препараты растительного происхождения, которые обладают противовоспалительным и муколитическим действием. Классическим и наиболее известным представителем данной группы является синупрет. В его состав входят компоненты хорошо известных лекарственных растений: корень горечавки, трава вербены и щавеля, цветы первоцвета и бузины. Синупрет способен уменьшать выраженность отека слизистой оболочки полости носа и облегчать эвакуацию секрета из ОНП. Другим аспектом его лечебного эффекта является способность цветов первоцвета повышать активность реснитчатого эпителия и ускорять эвакуацию секрета из ОНП, то есть оказывать не только муколитическое, но и мукокинетическое действие.
Отдельные компоненты синупрета обладают иммуностимулирующей и противовирусной активностью. Известно, что он оказывает действие на иммунную систему, стимулируя высвобождение IL1, IL6 и простогландинов, а также изменяет соотношение CD4/CD8 в сторону увеличения количества Т-хелперов. Входящие в состав препарата цветы первоцвета и трава вербены предотвращают репликацию вирусов гриппа А, парагриппа, а также респираторно-синцитиального вируса. Важным моментом в действии синупрета является потенцирование действия антибиотиков. Контролируемые исследования показали, что при остром РС добавление синупрета к обычной антибиотикотерапии увеличивает эффективность последней примерно на 35%.
Иммуномодуляторы - бактериальные лизаты (бронхомунал, рибомунил, ИРС-19)
Наиболее часто используемым для лечения РС препаратом этой группы является ИРС-19 - дозированный аэрозоль для интраназального применения, содержащий лизаты бактерий - наиболее распространенных возбудителей респираторных инфекций. При лечении острого РС по одной дозе препарата впрыскивают в каждую половину носа 5 раз в день. Специфическое действие ИРС-19 связывают с увеличением синтеза секреторного IgA. После распыления в полости носа препарат захватывается макрофагами, проникает через слизистую оболочку и после контакта с дендритными клетками подслизистого слоя стимулирует продукцию антиген-специфических антител. Другими направлениями действия препарата являются увеличение содержания лизоцима, повышение функциональной активности фагоцитирующих клеток. Однако целый ряд аспектов применения ИРС-19 изучен недостаточно, не проводились контролируемые исследования эффективности препарата в отношении основных клинических проявлений острого РС. Лечение препаратом ИРС-19 начинают на ранней (вирусной) стадии РС, в этом случае своевременное формирование эффективного иммунного ответа может предотвратить развитие бактериального воспаления и таким образом сократить общую продолжительность заболевания. Наши исследования показали, что назначение ИРС-19 в профилактической дозировке после эпизода острого РС способствует уменьшению контаминации полости носа патогенными микроорганизмами и снижению количества рецидивов.
При легких формах острого РС, а также как дополнение к системной антибиотикотерапии могут использоваться топические антибактериальные препараты (фузафунгин, фрамицетин и др.), комбинированные препараты (полим иксин+неомицин+дексаметазон+фенилэфрин), средства, способствующие восстановлению оттока из пораженных пазух (экстракт цикламена), препараты с противовоспалительным действием (парацетамол, фенспирид). Применение антигистаминных препаратов при остром РС не требуется, оно считается обоснованным только при сопутствующем аллергическом рините.
Ирригационная терапия
Промывание полости носа изотоническим раствором стандартно (хотя и при отсутствии достаточной доказательной базы) используется в лечении самых различных заболеваний полости носа и ОНП. В последние годы в аптеках широко представлены фабричные препараты для промывания полости носа. Обычно их готовят на основе морской воды, стерилизуя ее, доводя содержание солей до изотонической концентрации и упаковывая в удобные для распыления или промывания полости носа флаконы (АкваЛОР, АкваМарис, Маример, Физиомер и др.). При РС нанесение на слизистую оболочку изотонического раствора способствует нормализации реологических свойств слизи и оказывает легкий деконгестивный эффект, улучшая носовое дыхание. Считается, что содержащиеся в морской воде соли и микроэлементы (Са, Ре, К, Mg, Си и другие) способствуют повышению двигательной активности ресничек, активизации репаративных процессов в клетках слизистой оболочки носа и нормализации функции ее желез. В связи с отсутствием в составе веществ, способных вызвать побочные эффекты, эти лекарственные средства не требуют четкого дозирования, и кратность их введения может широко варьироваться по потребности.
Пункции и зондирование околоносовых пазух
Эти процедуры позволяют промыть пораженную пазуху антисептическим раствором, удалить из нее патологический секрет ввести лекарственные средства. Наиболее распространена и легче выполнима пункция верхнечелюстной пазухи, она чаще всего и используется в лечении гайморита.
Пункцию верхнечелюстной пазухи производят через нижний носовой ход иглой Куликовского после анестезии слизистой оболочки 5% раствором лидокаина. Стенку верхнечелюстной пазухи прокалывают специальной иглой в области свода нижнего носового хода (там, где она тоньше всего). Содержимое пазухи получают путем аспирации в шприц или промывания, объем измеряют заполняя пазуху жидкостью, затем пазуху промывают изотоническим или дезинфицирующим раствором, при необходимости вводят лекарственные препараты (антибиотики, антисептики, протеолитические ферменты, кортикостероиды). Больного при этом лучше уложить на бок с тем, чтобы лекарственный раствор не эвакуировался через естественное соустье. В некоторых случаях пункция и промывание пораженной пазухи позволяют ликвидировать блокаду ее естественного соустья. Считают, что регулярное удаление экссудата при гнойном синусите защищает от протеолиза факторы местного иммунитета и в 2-3 раза повышает содержание иммуноглобулинов и комплемента в пораженной пазухе, стимулируя механизмы местной антибактериальной защиты.
Использование лечебной пункции верхнечелюстной пазухи должно быть строго обоснованным, и она должна выполняться только при наличии явного гнойного процесса в пазухе. Следует помнить, что эта, на первый взгляд, безопасная процедура связана с риском проникновения иглы в глазницу, мягкие ткани щеки, крылонебную ямку. Она может сопровождаться повреждением устья носослезного канала в нижнем носовом ходе, обильным кровотечением, воздушной эмболией при попытке продувания пазухи. С широким распространением антибиотикотерапии эффективность пункционного метода в лечении синусита стала все больше оспариваться, в США и многих странах Западной Европы этот метод был практически полностью оставлен и исключен из клинических рекомендаций. Мы тоже постепенно приходим к этой точке зрения. Проведенные нами сравнительные исследования показали, что при остром первичном неосложненном РС лечебные пункции верхнечелюстной пазухи не повышают эффективность стандартного 10-дневного курса эмпирической антибиотикотерапии (амоксициллин/клавуланат, моксифлоксацин). Согласно стандартам лечения, предложенным Минздравсоцразвития в 2004 году, пункция верхнечелюстной пазухи показана только 3 из 100 больных острым синуситом. Однако никто не отрицает, что пункция остается золотым стандартом в постановке микробиологического диагноза синусита, и что ее выполнение абсолютно необходимо при тяжелом бактериальном, нозокомиальном синусите, а также при угрозе внутричерепных и орбитальных осложнений.
Метод дренирования околоносовых пазух
Метод имеет определенные преимущества перед лечением повторными пункциями (зондированиями). Постоянный дренаж вводят в пазуху на пункционной игле, через ее просвет или на проводнике после произведенной пункции. Наличие катетера создает дополнительный путь для эвакуации секрета из пораженной пазухи, увеличивает воздухообмен, ликвидирует отрицательное давление при блокированном или работающем как клапан естественном соустье. Наложение постоянного дренажа избавляет врача от необходимости участвовать во всех лечебных мероприятиях, упрощает проведение сеансов принудительной аэрации (оксигенации), дает возможность медсестре проводить их несколько раз в сутки. Отношение к методу длительного дренирования ОНП должно быть таким же, как и к пункции: оно не показано при первичных неосложненных формах синусита, использующий этот метод врач должен помнить, что постоянный катетер в пазухе является инородным телом и создает возможность для занесения нозокомиальной микрофлоры в дренированную пазуху
Активное опорожнение околоносовых пазух и введение в них лекарственных препаратов может осуществляться также методом перемещения и при помощи синус-катетера ЯМИК.
Таким образом, арсенал методов лечения острого РС достаточно разнообразен. Основополагающими методами остаются системная антибиотикотерапия и топические деконгестанты, которые в зависимости от клинической ситуации могут быть дополнены другими средствами.
Март 2009 г.