Опубликовано в:
«CONSILIUM MEDICUM» »»
Аспекты использования мультикиназного ингибитора Нексаварa® при лечении ряда онкологических заболеваний. Обзор текущих клинических исследований
Член-кор. РАМН, проф. И.В.Поддубная
Зав. кафедрой онкологии Российской медицинской академии последипломного образования Минздравсоцразвития РФ, Москва
1. Нексавар (сорафениб) в настоящий момент успешно применяется у пациентов при гепатоцеллюлярной карциноме (ГЦК) и почечно-клеточном раке (ПКР). Однако, учитывая многокомпонентный механизм действия препарата, возможно применение его у пациентов с другими онкологическими заболеваниями. Перспективы применения Нексавара достаточно обширны. В настоящий момент проводятся доклинические испытания препарата у больных раком молочной железы (РМЖ), меланомой, немелкоклеточным раком легкого, острым миелобластным лейкозом.
1. Нексавар®: перспективы использования
2. В исследовании II фазы среди больных метастатическим раком щитовидной железы, 90% которых составляла дифференцированная форма, применение Нексавара позволило добиться увеличения выживаемости без прогрессирования (ВБП) до 18,4 мес и достичь высоких показателей контроля заболевания: частичной ремиссии достигли 23% больных, стабилизация наблюдалась у 54% пациентов. Несмотря на небольшое число пациентов, включенных в исследование, данные II фазы доказали необходимость продолжить исследования Нексавара при дифференцированном распространенном раке щитовидной железы.
2. Использование мультикиназных ингибиторов при лечении рака щитовидной железы (2008–2009 гг.) Анализ II фазы клинических исследований
Препарат Пациенты Число PFS, нес PR. % SD.% PD, % Нексавар®(Brose) метастатический рак 30 18,4 23 54 7 Сунитимиб (Cohen) Дифференцированный рак (74%):
метастатический рак (26%)51 - 17
Дифференци-
рованный74
Дифференци-
рованный9
Дифференци-
рованныйАкситиниб (Cohen) Папиллярный (50%); медуллярный (18%); фолликулярный/смешанный (25%/18%); анапластический(3%) 60 18,1 30 48 7 Мотесаниб (Sherman) Папиллярный (61%); фолликулярный/смешанный (34%) 93 10 14 67 8 Леналидомид (Ain) Папиллярный (50%); фолликулярный (17%); смешанный (17%) 21 - 39 50 11 Brose et at. J Clin Oncol 2009; 27 (Suppl.): Abstract 6002,
Cohen et et. J Clin Oncol 200B; 26 (iuppl,): Abstrgct 6025.
Cohen et al. J Clin Oncol 200B; 26: 4708-13.
She/men et el. N Engl J Med 2006; 359; 31-42.
Ain et el, J Clin Oncol 2008; 26 (suppl.): Abstract 6027.3. В настоящий момент проводятся различные по своему дизайну исследования Нексавара у больных РМЖ. Изучается применение Нексавара в качестве терапии как первой, так и второй линии, а также сочетание Нексавара с различными химиотерапевтическими препаратами. Наиболее крупное исследование Нексавара при метастатическом РМЖ (SOLTI) включало 229 пациенток с HER-2 негативными опухолями, резистентными к лечению Таксаном или Антрациклином. Пациентки были разделены на 2 группы (1:1): первые принимали капецитабин + плацебо, вторые получали капецитабин + Нексавар (400 мг 2 раза в день). По результатам данного исследования комбинация Нексавар + капецитабин продемонстрировала значительное улучшение ВБП у больных местнораспространенным или метастатическим РМЖ (6,1 мес против 4,1 мес). Самым частым побочным эффектом в группе капецитабин + Нексавар являлся ладонно-подошвенный синдром. Таким образом, результаты данного исследования продемонстрировали эффективность и относительную безопасность Нексавара в лечении распространенного РМЖ.
3. Использование Нексавара® при лечении метастатического РМЖ (2008–2009 гг.)
Анализ клинических исследований IIb фазы
Все исследования рандомизированные двойные слепые; среднее число пациентов 220 в каждом.
Исследование Пациенты Терапия Регион FM-B07-01 Первая линия Летрозол или доцетаксел ±сорафениб Европа (+Россия) NU07B1 Первая линия Паклитаксел ±сорафениб США AC01BQ7 Прогрессирование после лечения Бевацизумабом Сорафениб/гемцитабин против плацебо/гемцитабин США SOLI10701 Резистентные к лечению Таксаном или Антрациклином Сорафениб/капецитабин против плацебо/капецитабин Испания, Франция, Бразилия Perez После терапии ингибиторами ароматазы или химиотерапии Сорафениб/ингибиторы ароматазы против плацебо/ ингибиторы ароматазы США, Европа, Индия 4. Два исследования по изучению эффективности Нексавара при немелкоклеточном раке легкого в качестве монотерапии демонстрируют увеличение медианы ВБП и медианы общей выживаемости (ОВ) у таких больных. В исследовании с участием 342 пациентов стабилизация заболевания достигалась уже на 8-й неделе терапии. Оба исследования выявили хороший профиль безопасности препарата: токсические эффекты были предсказуемы и легко купировались. В исследовании по применению комбинации Нексавара с эрлотинибом удалось достичь медианы ВБП в 4,6 мес при небольшой частоте побочных эффектов. Сравнение применения данной комбинации с монотерапией эрлотинибом показало, что комбинация двух препаратов позволяет достичь несомненно более значительного эффекта. Эти данные предварительны, так как число включенных в исследования пациентов невелико, однако они позволяют говорить о перспективе сочетанного применения таргетных препаратов.
4. Использование Нексавара® при лечении немелкоклеточного рака легких (2008-2009 гг.)
Исследование Фаза Терапия Число Результаты Gatzemeier (2006) II Распространенный рак легкого Сорафениб 52 Медиана PFS 11.9 нед
Медиана ОB 29.3 нед
Ладонно-подошвенный синдром (37%) усталость(27%)E2501 Schiller и соавт. (2008) II Третья линия Сорафениб 342 Стабилизация заболевания на 8-й неделе
Улучшение PFS
Улучшение ОВ
Токсические эффекты были предсказуемы и легко купировалисьSmilH совт. (2009) II Первая линия Сорафениб +эрлотиниб 50 Медиана ТТР (медиана времени до прогрессирования) 4.6 мес
Анорексия (1), лихорадка (5). диарея (6), усталость (4), ладонно-подошвенный синдром (6), назорея (2)Spiegel и соавт. (2009) II 1-2 предш, химиотерапия Сорафениб +эрлотиниб Эрлотиниб 166 Медиана PFS 3.06 мес против 1,87 мес (HR=0,75; р=0.05)
Медиана 0В 8,05 мес против 5,98 мес (HR=0,73; p=0.06)Gatzemeier U et al. ASCO 2006; Abstract 7002; Scagliotti G et al, ELCC 2008; Abstract 6.
Schiller J atai. ASCO 2008; Abstract 8014; Smft EF et al. ASCO 2009; Abstract 8018; Spiegel D et al.
IASLC 2009; Abstract 7489.5. Нексавар в качестве монотерапии или в комбинации с бевацизумабом или гемцитабином использовался в различных исследованиях при распространенном, персистирующем или рецидивирующем раке яичников. Данные исследования по применению Нексавара в качестве монотерапии показали, что у пациентов с персистирующим или рецидивирующим раком яичников Нексавар позволил достичь увеличения ВБП до 6 мес. Таким образом, использование Нексавара во II и III фазах исследований при различных злокачественных новообразованиях доказывает его эффективность в стабилизации заболевания, увеличение времени ОВ, особенно при распространенном и метастатическом раке щитовидной железы, немелкоклеточном раке легких и РМЖ. Доказанная эффективность Нексавара и хороший профиль безопасности препарата являются основополагающими компонентами для продолжения исследований Нексавара при различных злокачественных новообразованиях.
5. Использование Нексавара® при лечении рака яичников (2008-2009 гг.)
Исследование/фаза Терапия Число Результаты/переносимость Matoi и соавт. [1]
(G0G 170F)II Сорафениб, монотерапия Перепетирующий или рецидивирующий рак 73 6 мес
PFS 20%PR 3%
SD 34%Лихорадка (12 пациентов),
пневмония (2 пациента)Azad и соавт, [2] I Сорафениб +бевацизумаб Распространенный солидный рак 13 Нет данных PR 46%
SD Зв%Самые частое осложнения: ладонно-подошвенный синдром, диарея Welch и соавт. [3] II Сорафениб + гемцитабин Рецидивирующий рак 43 ТТР 5,4 мес ОВ 13,3 меc PR 5% SD 60% Ладонно-подошвенный синдром (21%), усталость (16%), гипокалиемия (16%) Siu и соавт. [4] I Сорафениб + гемцитабин Распространненый солидный рак 6 Нет данных PR 33% SD 63% Тромбоцитопения (29%), лимфопения (21%), усталость (14%) 1, Metei е( el. J Clin Oncol 2008; 26 (suppl ): Abstract 5537.
2. Aiad el el. J Clin Олсо) 2005: 25: 3708-14
3. Wei№ el si. J Clin Oncol 2007: 25 tsuppl.l: Abstract 5519.
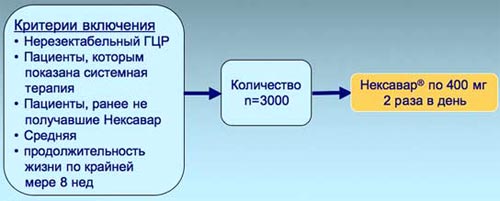
4. Slu el el. CUn Center Res 2006; 12.144-51.6. GIDEON - крупное пострегистрационное исследование по изучению применения Нексавара у пациентов с ГЦК. Главной целью данного исследования является оценка безопасности препарата Нексавар у пациентов при нерезектабельном гепатоцеллюлярном раке, являющихся кандидатами на системную терапию. Кроме того, исследование позволит оценить:
- эффективность лечения Нексаваром [по показателям ОВ, ВБП, частоты клинического ответа, стабилизации заболевания в соответствии с Критериями оценки ответа при солидных опухолях (RECIST)];
- продолжительность лечения препаратом;
- влияние сопутствующих заболеваний у данной группы больных;
- оптимальную модель врачебного поведения при лечении пациентов, страдающих нерезектабельным гепатоцеллюлярным раком.
6. Global Investigation of therapeutic DEcision in HCC and Of its treatmeNt with Nexavar® (GIDEON)* Проспективное, международное, многоцентровое, открытое, не интервенционное исследование Нексавара в лечении гепатоцеллюлярного рака (ГЦК)
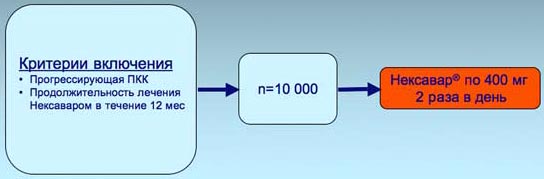
7. В исследовании PREDICT планируется включение 10000 пациентов с прогрессирующей ПКК. Продолжительность лечения Нексаваром составит 12 мес.
Целями исследования PREDICT являются:
- Всестороннее изучение пациентов с ПКК (демографические группы, история заболевания, инициирующие факторы заболевания)
- Подтверждение эффективности Нексавара у больных ПКК (исследование продолжительности лечения и динамики опухоли)
- Исследование профиля безопасности Нексавара и качества жизни больных ПКК (подбор дозировки Нексавара)
7. Исследование по изучению клинической эффективности препарата Нексавар у пациентов с почечно-клеточной карциномой – ПКК (PREDICT) Обзорное открытое мультицентровое когортное международное проспективное исследование
8. На настоящий момент в исследование PREDICT включено 1529 больных ПКК, из них 91% получали Нексавар в дозировке по 400 мг 2 раза в день. Среди побочных реакций в 22% отмечался ладонно-подошвенный синдром, диарея наблюдалась у 18%, сыпь – у 10%, алопеция – у 7%. Пациенты в 85% случаев перенесли нефрэктомию, имеют множественные висцеральные метастазы различной локализации. Получение новых данных по исследованию PREDICT позволит выработать четкие алгоритмы по назначению препарата Нексавар у пациентов с ПКК.
8. Предварительные результаты исследования PREDICT
Мужчины,n (%) 1104 (72) Средний возраст, лет 60.0 (18-88) Предшествующая нефрэктомия, n (%) 1306 (86) ECOG статус, n (%) 0 322(21) 1 768(50) 2 350(23) >2 85 (6) Число пациентов с метастазами, n (%) 1466 (96) в легкие 1066 (70) в кости 381 (25) в печень 324(21) Memorial Sloan Kettering Cancer Center Prognostic Risk, n (%) низкий 335(22) средний 541 (35) высокий 133 (9) DJagW, J.H.Ma. B.Korbenteld. M.Zemanoi/a, N.Leonhartsberger. K.Stauch, A.Bdekenhotf. J.Yu, B.Escudier
Citation: European Journal of Can car Supplements. September 2009: 7(2): 431
Материал предоставлен компанией ЗАО «БАЙЕР». Контактная информация:
ЗАО "БАЙЕР"
107113, Москва, 3-я Рыбинская ул., дом 18, строение 2.
Телефон: (495) 231-12-00
Факс: (495) 231-12-02
Компания ЗАО «БАЙЕР» заботится о высоком качестве своей продукции и поэтому заинтересована в получении любой информации по безопасности на продукцию компании в целях дальнейшей оценки и снижения риска возникновения нежелательных реакций у пациентов.
Если Вы хотите сообщить о нежелательном явлении или жалобе на качество продукции компании «ЗАО БАЙЕР», пожалуйста передайте информацию своему лечащему врачу, в регуляторные органы, или воспользуйтесь
| Июнь 2013 г. |