Опубликовано в:
«CONSILIUM MEDICUM» »»
Дифференцированный подход к лечению пациентов с метастатическим раком почки
Проф. В.Б.Матвеев
РОНЦ им. Н.Н.Блохина РАМН, Москва
1. Под понятием «таргетная терапия» подразумевается терапия препаратом, воздействующим на конкретную мишень в опухоли и имеющим минимальный эффект на организм в целом. Для таргетных препаратов характерно воздействие на определенные рецепторы, а наличие этих рецепторов в опухоли определяет возможность предсказания эффективности лечения. Идеальный таргетный препарат должен обладать минимальной токсичностью. Первым таргетным препаратом, который в декабре 2005 г. был зарегистрирован для применения у пациентов с метастатическим раком почки, стал Нексавар (сорафениб).
1. Понятие таргетной терапии
DEPARTMENT OF HEALTH & HUMAN SERVICES Public Health Service
Food and Drug Administration
Rockville, MD 20857
NDA 21-923 Bayer Pharmaceuticals Corporation
Attention: Aileen Ryan, M.Sc.
Director, Global Regulatory Affairs Therapeutic Area Oncology
400 Morgan Lane
West Haven, CT 06516Dear Ms. Ryan:
Please refer to your new drug application (NDA) dated July 6, 2005, received July 8, 2005, submitted under section 505(b) of the Federal Food, Drug, and Cosmetic Act for Nexavar (sorafenib) 200 mg tablets.
We acknowledge receipt of your submissions dated April 28, June 1 and 17, August 8, 19, 23, and 25, September 13, 16, and 23, October 7, 13, 18, 24, and 31, November 4 (2 submissions) and 8, and December 2, 5, 6, 15 and 19, 2005.
This new drug application provides for the use of Nexavar (sorafenib) tablets 200 mg for the treatment of patients with advanced renal cell carcinoma.
20 декабря 2005 г. Нексавар (сорафениб) одобрен FDA к применению у больных с распространенным раком почки
2. За почти 5 лет существования таргетной терапии появилось 5 препаратов, относящихся к данной группе. До их появления стандартом лечения метастатического рака почки считалась цитокиновая терапия, поэтому Нексавар в своем регистрационном исследовании использовался в качестве препарата второй линии. Данное исследование показало увеличение общей выживаемости (ОВ), а также выживаемости без прогрессирования (ВБП) почти в 2 раза при использовании Нексавара.
2. Препараты таргетной терапии в исследованиях III фазы
* Все больные в исследовании TARGET ранее получали лечение, 81-83% - цитокиновую терапию интерлейкином (IL-2) и интерфероном (IFN).
Дизайн исследования Линия терапии Эффективность Нексавар® против плацебо [1, 2] Против цитокиновой
терапииМедиана ВБП: 5.5 мес против 2.8 мес(p<0.001)
Медиана ОВ: 17.8 против 14.3 мес (p=0.0287)Сутент® против IFNα[3,4] 1-я линия Медиана ВБП: 11 мес против 5 мес(p<0.001)
Медиана ОВ: 26.4 против 20.0 мес (p=0.0362)Авастатин®+ IFNα против плацебо + IFNα [5] 1-я линия Медиана ВБП: 10.2 мес против 5.4 мес(p<0.0001) Авастатин®+ IFNα против IFNα [6] 1-я линия Медиана ВБП: 8.5 мес против 5.2 мес(p<0.0001) Торисел® против IFNα [7] 1-я линия у больных с плохим прогнозом Медиана ВБП: 5.5 мес против 3.1 мес(p<0.001)
Медиана ВБП: 10.9 мес против 7.3 мес(p<0.008)Эверолимус против плацебо [8] После терапии ТКI Медиана ВБП: 4.0 мес против 1.9 мес(p<0.0001)
1. Eacwtier B et el. N Engl J Med 2007; 356:125-34:
2 Bukomlii R el el. ASCO 2007; Chicago, IL. USA.
3 Metier RJ el al N Engl J Meid 2007, 356.- J15-M.
4. Figlin R el el. ASCO 2008; Chicago. IL, USA.
5. Escodisr B el el Leneel 2007:370; 2103-11.
6. Rini Bl at el. J Clin Oncol 2008, 26:5422-3.
7. Hudes G et al. N Engl J Med 2007:356: 2271-81.
8 Motzar RJ el al. Lancet 2008: 372: 449-563. Нексавар является мультикиназным ингибитором. Показано, что сорафениб подавляет многочисленные внутриклеточные киназы и киназы, расположенные на поверхности клетки, многие из которых задействованы в сигнальных системах опухолевой клетки, в процессах ангиогенеза и апоптоза. Мишенями действия сорафениба являются васкулярно-эндотелиальный фактор роста (VEGF), Raf-киназа и другие факторы. При светлоклеточном раке почки ключевую роль играет мутация гена VHL. Мутация этого гена приводит к накоплению фактора, индуцирующего гипоксию, что приводит к выбросу факторов роста и быстрому росту опухоли. Нексавар блокирует этот каскад реакций, благодаря чему подавляет рост опухоли при почечно-клеточном раке у человека.
3. Механизм действия Нексавара
ERK - extracellular signal-regulated kinase
GF(R) growiti factor (receptor);
HIF - hypoxia-inducible factor;
MEK - mitogen-activated protein kinase kinase
P- phosptiorylated: VEGF(R)-VEGF receptorАдаптировано из: Wilhelm SM
et al. Mol Cancer Thar 2008, 7: 3129-40.4. Если посмотреть на спектр действия всех препаратов, зарегистрированных для лечения метастатического рака почки, то видно, что количество мишеней у сорафениба значительно больше, чем у других препаратов. Сорафениб не только блокирует ангиогенез, но и стимулирует апоптоз в опухолевой клетке. Таким образом, потенциально можно рассчитывать, что сорафениб может быть более эффективным, чем другие препараты.
4. Мишени для таргетной терапии рака почки
Сорафениб Сунитиниб Акситиниб Темсиролимус
/ЭверолимусБевацизумаб C-Raf VEGFR2 VEGFR2 m-TOR VEGF B-Raf
wild typeVEGFR1 VEGFR1 B-Raf V599E
mutantVEGFR3 PDGFR hVEGFR2 PDGFRa/b mVEGFR2 KIT mVEGR3 FLT3 ITD mPDGFR-p FLT3 FLT3 RET C-KIT FGFR1 p38α 5. На сегодняшний момент ни один таргетный препарат не является универсальным и эффективным у всех больных раком почки. Поэтому индивидуальный подход к каждому больному является важнейшей составляющей правильной лечебной тактики. Факторами, которые необходимо учитывать при выборе препарата у конкретного пациента, являются: возраст, гистологическое строение опухоли, локализация и количество метастазов, наличие предшествующей терапии, желаемое качество жизни пациента, а также наличие сопутствующих заболеваний.
5. Факторы для выбора наиболее оптимального лечения почечно-клеточной карциномы Консенсус по выбору пациентов для лечения сорафенибом - На выбор метода лечения влияет много обстоятельств: необходимо учитывать все нижеперечисленные факторы:
ЗАБОЛЕВАНИЕ Статус MSKCC Хороший Умеренный Плохой No. локализация 0-1 2-3 >4 Локализация метастазов Лимфотические узлы Печень Легкие Кости Головной мозг Гистология Светлоклеточная форма Несветлоклеточная форма
Больной Возраст <65/70 (2) лет >65/70 (2) лет Статус 0 1 2 3 Сопутствующая
патологияГематологическая Контролируемая
гипертензияСердечно сосудистая < grade 2* > grade 2* >Заживление ран Диабет Усталость Щитов.
железаЦирроз Почки
ЛЕЧЕНИЕ Анамнез Naive Prior treatment Подходит на
цитокиныНе подходит
на цитокиныЦитокины в
анамнезеТаргетная терапия
в анамнезереальная цель Увеличение ОВ Уменьшение
опухолиСтабилизация Поддержка
качества
жизни1. Bellmunt J, etal. ESMO 2008; abstr 612P
2. EisenT, et al. J Natl Cancer Inst 2008;100:1454-636. Выбор тактики лечения в зависимости от характеристик болезни определяется по количеству очагов первичной опухоли, количеству и локализации метастазов, а также по гистологическому строению опухоли. Так, например, пациенты с метастазами в легкие имеют относительно неплохой прогноз, тогда медиана ВБП у больных с метастазами в головной мозг едва достигает 3 мес. Пациенты со светлоклеточным раком почки обычно имеют лучший прогноз, чем пациенты с несветлоклеточным раком.
6. Подходы к выбору терапии в зависимости от характеристики болезни
Заболевание Статус MSKCC Хороший Умеренный Плохой No. локализация 0-1 2-3 >4 Локализация метастазов Лимфотические узлы Печень Легкие Кости Головной мозг Гистология Светлоклеточная форма Несветлоклеточная форма 7. Как уже говорилось, до появления таргетных препаратов стандартом лечения являлась иммунотерапия, назначение которой было возможно только у больных с хорошим прогнозом по шкале MSKCC (Memorial Sloan-Kettering Cancer Center). Данная шкала оценивает несколько признаков, каждому из которых присваивается балл, по сумме которых можно судить о прогнозе для данного пациента. Только у пациентов с нормальным уровнем кальция, гемоглобина, лактатдегидрогеназы (ЛДГ), статусом по шкале Карновского более 70 можно было рассчитывать на эффект от проводимой иммунотерапии. У пациентов с промежуточным или плохим прогнозом иммунотерапия неэффективна.
7. Прогностическая шкала MSKCC (Memorial Sloan-Kettering Cancer Center)
- Интервал от диагноза до начала системной терапии <12 мес
- Уровень альбуминкорригированного кальция сыворотки >2,5 м моль/л
- Уровень гемоглобина менее нормы
- Уровень ЛДП более чем в 1,5 раза превышающий норму
- Статус по шкале Карновского <70
- Метастатическое поражение более 1-го органа
Хороший прогноз 0 признаков Промежуточный прогноз 1-2 признака Плохой прогноз >2 признаков Hudes G el at. N Engl J Med May 2007; 356: 2271-81.
8. Что же изменилось с появлением препаратов таргетной терапии? Регистрационное исследование сорафениба TARGET включало в себя 903 пациента, разделенных на 2 группы, одна из которых получала сорафениб, другая - плацебо (1:1). Сорафениб использовался в качестве терапии второй линии после иммунотерапии, исследование проводилось как среди больных с хорошим прогнозом (низкого риска), так и среди больных с промежуточным прогнозом. У всех больных также оценивался статус по шкале ECOG и число пораженных органов.
8. TARGET: характеристика больных
Характеристика Сорафениб,
n=451Плацебо,
n=452Возраст, лет
>7058(19-86)
n=11559(29-84)
n=788Мужчины, % 70 75 ECOG, % 0 48 47 1 49 52 2 2 1 MSKCC, прогностические группы риска, % Низкий 52 49 Промежуточный 48 51 Число пораженных органов, % 1-2 43 43 >2 57 57 Escudier В et al. N Engl J Med 2007; 356: 125-34.
9. Несмотря на то что в исследование TARGET, помимо больных с хорошим прогнозом, включены также и больные с промежуточным прогнозом, при применении сорафениба было получено достоверное увеличение общей выживаемости почти в 2 раза по сравнению с плацебо.
9. TARGET: общая выживаемость послеперекреста
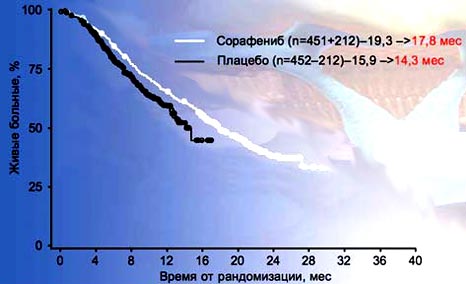
Приблизительное время начала перекрестного лечения - 30 июня 2005.
* Статистически значимо: O'Brien-Fleming пороговое значение для статистической значимости α=0,037.Bukowski RM etal. ASCO Annual Meeting; June 1-5, 2007; Chicago, IL.
10.В исследовании TARGET оценена эффективности Нексавара по сравнению с плацебо. На диаграмме показано, что и у пациентов с хорошим, и у пациентов с промежуточным прогнозом сорафениб доказал эффективность в отношении увеличения ВБП.
10. Нексавар обеспечил достоверное улучшение ВБП вне зависимости от группы риска MSKCC
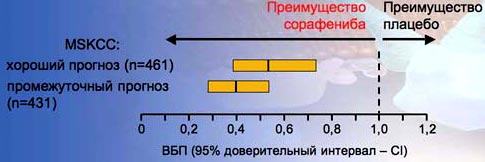
EscudierBet а/. W Engl J Med 2007; 356; 125-34.
11. В регистрационное исследование TARGET включены пациенты только со светлоклеточным раком почки без метастазов в головной мозг. Поэтому максимально полную информацию об эффективности и безопасности таргетных препаратов смогли обеспечить только исследования широкого доступа, куда было разрешено включать пациентов с неограниченным числом поражений, с метастазами в головной мозг, а также с несветлоклеточным, в том числе саркоматоидным раком почки. Такими исследованиями стали европейское исследование EU-ARCCS и американское исследование N Am ARCCS. По данным EU-ARCCS, эффективность Нексавара оставалась высокой во всех возрастных группах, у больных с тяжелым общесоматическим статусом, у пациентов с несветлоклеточными вариантами рака почки, включая саркоматоидный тип. Нескавар был эффективен при любой локализации метастазов. Хороший ответ на лечение отмечен у пациентов с мультиорганными метастазами и даже у больных с метастазами в головной мозг, среди которых суммарный ответ на лечение составил 60,7% при медиане 7,4 мес.
11. EU-ARCCS: Нексавар эффективен в различных подгруппах больных
* Общий ответ = CR+PR+SD>8 нед
Показатель Число вольных Общий ответ*. % Медиана ВБП, мес Возраст, лет <65 623 72,4 6.1 >65 408 73,5 7,8 ECOG PS 0 437 80.1 8.8 1 461 71,6 6.2 2 128 51.0 3.1 Гистологический вариант светлоклеточный 790 75.7 7.5 папиллярные черты 101 66,4 5,8 другие 103 61,2 4.9 саркоматоидный 46 67,4 4.3 Число пораженных органов 1 253 79.8 8.8 >2 774 70.7 6.2 Локализация метастазов легкие 748 73.0 6.8 печень 277 64.3 5.3 кости 363 69.2 6.0 головной мозг 28 60.7 7.4 Baск J er el. ECCO 2007. Barcelona, Spain.
12. Похожая тенденция отмечается и в американском исследовании широкого доступа N Am ARCCS, где Нексавар продемонстрировал эффективность у пациентов с метастазами в головной мозг (74%), пациентов старше 65 лет (84%), с папиллярным (81%) и хромофобным (94%) вариантами рака почки. Таким образом, были получены новые данные, показавшие эффективность сорафениба у значительно более широкой популяции пациентов.
12. N Am ARCCS: Нексавар эффективен в разных подгруппах больных
Ответ Всего [1] Больные, % метастазы в мозг
(n=50)возраст >65 лет [1]
(n=762)папиллярный
(n=118)хромофорный [2]
(n=18)Полный (ПР) <1 0 0 0 0 Частичный (ЧР) 4 4 3 3 6 Стабилизация (GT) 80 70 81 77 39 ПР + ЧР + СТ 84 74 84 81 94 Прогрессирование 16 26 16 20 6 1. KnoxJJetal. ASCO 200Г; Chicago, IL, USA.
2. Sladler WM el at. ASCO 2007; Chicago, IL, USA.13. Медиана ВБП пациентов с метастазами в головной мозг в среднем составляет около 3 мес. При терапии сорафенибом ВБП у таких пациентов достигает 7,4 мес при суммарном ответе на лечение 61 и 74% в исследованиях EU-ARCCS и N Am ARCCS соответственно. При сравнении эффективности сорафениба с сунитинибом - другим препаратом таргетного действия, изучавшимся для лечения пациентов с метастазами в головной мозг, общий ответ и ВБП при использовании сунитиниба оказались значительно ниже. Другие препараты из группы таргетных до настоящего момента не использовались у пациентов с метастазами в головной мозг
13. Эффективность Нексавара среди больных с метастазами в головной мозг
- Сорафениб
- EU-ARCCS (n=28) [1]
- ВБП: 7,4 мес
- Общий ответ 61%
- ARCCS (n=50) [2]
- Общий ответ; 74%
- Сунитиниб [3]
- Больные с бессимптомными метастазами (n=182)
- ВВП: 5,5 мес
- Общий ответ: 39,5%
- Темсиролимус бевацизумаб - нет данных
1. Beck J elal Oral presentation al ECCO 2007; Barcelona, Spain.
2, Henderson С et al J Clin Oncol 2007; 25 (June 20Suppl.); 18S (Abstract 15506).
3. Gore ME et al. Oral presentation at ASCO 2007; Chicago, 1L, USA.14. Вторая категория факторов, от которых зависит выбор терапии, - это факторы, связанные с самим пациентом. Прежде всего к ним относится возраст больного. Данный аспект существенно влияет на переносимость препарата, так как у пожилых пациентов имеется потенциально больший риск развития токсичности даже низкой степени. Помимо этого, у пациентов старшей возрастной группы часто имеется сопутствующая патология, в связи с чем такие больные принимают целый ряд лекарств, в той или иной степени влияющих на фармакокинетику назначаемых препаратов. Измененная фармакокинетика может увеличить токсичность или уменьшить эффективность противоопухолевой терапии. Наконец, пожилые пациенты могут меньше или больше реагировать на побочные эффекты, что может приводить к неадекватному проведению лечения или отказу от него.
14. Подходы к выбору терапии в зависимости от состояния здоровья пациента
Больной Возраст <65(1)/70(2) лет >65(1)/70(2) лет Статус 0 1 2 3 Сопутствующая
патологияГематологическая Контролируемая
гипертензияСердечно сосудистая < grade 2* > grade 2* Заживление ран Диабет Усталость Щитовидная
железаЦирроз Почки *NYHA criteria, including controlled arrhythmias.
15. В регистрационном исследовании TARGET Нексавар позволял увеличить ВБП почти в 2 раза как у пациентов моложе 70 лет, так и у пациентов старше 70 лет. Среди пациентов старше 70 лет медиана ВБП достигала 6,1 мес.
15. TARGET: Нексавар® увеличивал в 2 раза ВБП у больных >70 лет
Двукратное увеличение ВВП. Нексааар® против плацебо
- >70 лет=6,1 мес. HR=0,43; 95% CI: 0,26-0,69
- <70 лет=5,5 мес. HR=0,55; 95% CI: 0,47-0,66
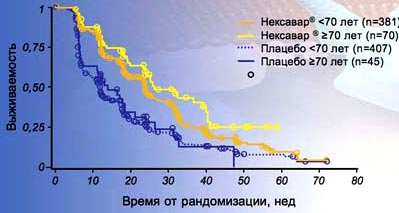
Eisen T el el. J Natl Cancer Inst 200в; WO; 1454-63.
Reproduced with permission from Oxford University Press.16. Среди частых побочных эффектов Нексавара отмечаются диарея, сыпь, слабость, ладонно-подошвенный синдром, повышение артериального давления, одышка. В исследовании TARGET при применении Нексавара чаще всего наблюдались диарея и кожные проявления. Побочные эффекты III—IV степени отмечали редко, частота их была сопоставима с группой плацебо.
16. TARGET: Нексавар® продемонстрировал благоприятный токсический профиль
Примечание. ЛПС - ладонно-подошвенный синдром.
Побочное явление Частота побочных явлений, % сорафениб (n=451) плацебо (n=451)+ любой степей III-IV степени любой степей III-IV степени Диарея 43 2 13 1 Сыпь/десквамация 40 1 16 <1 Слабость 37 5 28 4 ЛПС 30 6 7 - Гипертензия 17 4 2 <1 Отдышка 14 4 12 2 Снижение
гемоглобина8 3 7 4 Боль в костях 8 1 8 3 Опухолевая боль 6 3 5 2 Escudier В et а/. N Engl J Med 2007; 356; 125-34.
17. В исследовании TARGET проводилось сравнение частоты побочных эффектов у пациентов моложе и старше 70 лет. В обеих группах частота побочных эффектов была сравнима, различие между группами составляло в среднем 3-4%. Анорексия, ладонно-подошвенный синдром, зуд встречались в старшей возрастной группе даже реже, чем у пациентов моложе 70 лет.
17. TARGET: частота побочных эффектов одинакова в разных возрастных группах
ПЭ* (% больных)любой степени Возраст <70 лет
(n=381)Возраст >70 лет
(n=70)Различие между группами, % Слабость 36 39 3 Анорексия 14 10 4 Алопеция 26 30 4 ЛПС 31 23 5 Зуд 20 11 9 Сыпь/десквамация 39 44 5 Диареи 43 43 0 Тошнота 22 26 4 Гипертензия 18 10 8
частота у пациентов >70 лет
* Отмечены >10% больных. ПЭ - побочный эффект.ElsenTetal J Natl Cancer Inst 2006; 100: 1454-03
18. Оценка качества жизни пациентов проводилась на основании показателя времени до ухудшения статуса. При сравнении этого показателя у больных старше и моложе 70 лет оказалось, что при приеме Нексавара у пожилых пациентов показатель времени до ухудшения статуса даже лучше, чем у молодых пациентов (121 день против 90 дней). Таким образом, показатели качества жизни у больных молодого и пожилого возраста, получавших Нексавар, сопоставимы. Следовательно, Нексавар совершенно безопасно может применяться у данной категории пациентов.
18. Показатели качества жизни у больных молодого и пожилого возраста, получавших Нексавар
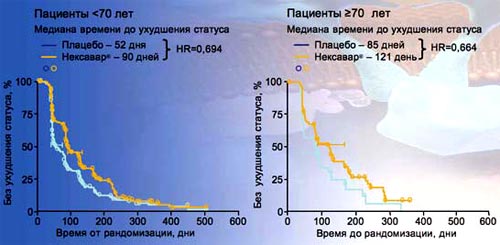
Ввел Tetel. J Nell Cancer Inst 2008; 100: 1454-63.
Reproduced with permission from Oxford University Press.19. Индивидуальный прогноз больного и как следствие эффективность выбранной терапии будут существенно зависеть от анамнеза пациента. Имеет большое значение, получал ли пациент предшествующую терапию, и если получал, то какую именно (иммунотерапию или таргетные препараты). Также при выборе терапии необходимо определить конкретную цель лечения у данного пациента: увеличение ОВ, уменьшение опухоли, стабилизация состояния или поддержание качества жизни.
19. Подходы к выбору терапии в зависимости от предшествующего лечения
- Предшествующая терапия
- Цель лечения
Лечение Анамнез Naive Prior treatment Подходит для
цитокинотерапииНе подходит
для цитокинотерапииранее цитокино терапия ранее таргетная терапия Реальная цель Увеличение ОВ Уменьшение
опухолиСтабилизация Поддержка
качества жизни20. Самым важным результатом исследования явился тот факт, что Нексавар подтвердил высокую эффективность при назначении в качестве первой линии терапии метастатического рака почки. Общий ответ на лечение у больных, получавших Нексавар в качестве первой линии терапии, был таким же высоким, как и у больных, получавших препарат в качестве второй линии, и составил 70,6%.
20. EU-ARCCS: Нексавар продемонстрировал эффективность в качестве первой и второй линии терапии
* Общий ответ = ОО + ЧО + СЗ >8 нед
Предшествующая терапия Число больных Общий ответ*, % Медиана ВБП,мес IFN-α и/или IL-2 Да 700 73,9 7,0 Нет 330 70.6 6,0
ОО - общий ответ: ЧО - частичный ответ, СЗ - стабилизация заболевания.Beck J et al. ECCO 2007; Barcelona, Spain.
21. Половина пациентов, включенных в исследование (935 из 1871 больных), получали Нексавар в качестве первой линии терапии. Больные, получавшие Нексавар в качестве первой и второй линии терапии, не отличались по числу метастазов и их локализации, соотношению гистологических вариантов рака почки и возрасту.
21. N Am ARCCS: характеристика больных
Характеристика Все Больные (n=2502) Первая линия (n=935) Две линии и более (n=936) Мужчины, % 69 69 69 Медиана возраста, лет 63 64 62 Медиана времени от установки диагноза, лет 1.4 (<1-34) 0.6 (<1-31) 2,2 (<1-34) Локализация метастазов, % легкие 69 66 72 кости 23 25 3 печень 24 21 27 лимфатические узлы 20 20 20 Число зон метастазирования, % 1 34 36 32 2 30 31 29 >3 34 30 30 Гистологический вариант. % светлоклеточный 79 78 79 папиллярный 7 6 8 Нефрактамия в анамнезе % 63 77 99 Отсутствие лечения % 50 0 100 Knox J et al. ASCO 2007; Chicago. IL, USA
22. Медиана ВБП у 224 больных, длительно получавших Нексавар в качестве первой линии терапии, составила 8,1 мес (35,1 нед) и была выше, чем в исследовании TARGET (возможно влияние фактора селекции больных), где все пациенты получали Нексавар в качестве второй линии терапии (24 нед). Это подтверждает эффективность Нексавара как препарата первой линии у больных метастатическим раком почки. Таким образом, препарат показал себя равноэффективным в качестве препарата первой и второй линии терапии.
22. Am ARCCS: ВБП у больных, получавших Нексавар в качестве первой линии терапии
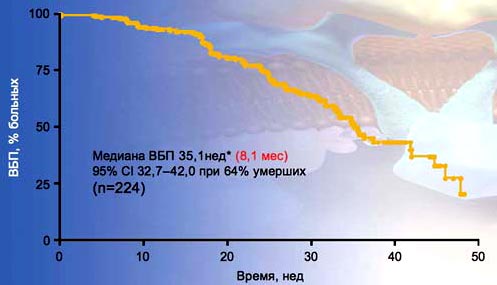
*Медиана выживаемости без прогрессирования у больных с несветлоклеточными вариантами RCC (n=23) - 37,4 нейRysnCWetal ASCO 2007; Chicago, IL, USA.
23. Исследованием последовательного применения различных таргетных препаратов ученые занимаются сравнительно недавно, поэтому имеются данные только небольших ретроспективных исследований. Дизайн одного из таких исследований приведен на рисунке. Исследование включало 90 пациентов, которые были разделены на две группы: 68 пациентов получали последовательно сорафениб, затем сунитиниб, 22 пациента получали таргетные препараты в обратной последовательности. Исследовалось 2 разные последовательности: сорафениб затем сунитиниб, сунитиниб затем сорафениб.
23. Последовательное применение сорафениба и сунитиниба
Ретроспективный анализ
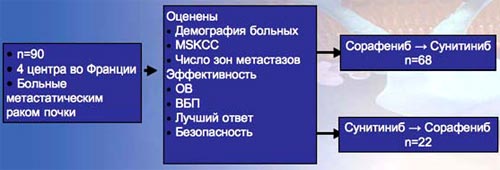
Adapted from Sablin MP et al. Presented at: A SCO Annual
Meeting; June 1-5, 2007; Chicago, IL24. Если оценить медиану ВБП, то она была несколько выше в группе, в которой препаратом первой линии назначался сорафениб. Достоверно лучшей была также переносимость последовательности сорафениб - сунитиниб, нежели обратной. Это привело к тому, что длительность приема таргетной терапии была значительно выше при первоначальном приеме сорафениба, затем сунитиниба.
24. Оценка эффективности лечения
Нексавар® -> Сутент лучше переносился, чем Сутент -> Нексавар®, в отношении частоты развития стоматита, анорексии. ЛПС и общего состояния
Результат Сорафениб -> сунитиниб (n=68) Сорафениб -> сунитиниб (n=22) сорафениб сунитиниб сунитиниб сорафениб Медиана ВБП, нед 26 25 22 17 Контроль над болезнью,% 82 66 77 64 Длительность терапии, нед 33 28 27 22 Ssblin MP el al. ASCO 2007:, Chicago, IL, USA.
25. Исследование Миннесотского университета показало достоверное различие во времени до прогрессирования между двумя последовательными режимами. Режим сорафениб - сунитиниб оказался значительно эффективнее, чем сунитиниб - сорафениб. У пациентов, находящихся на первом режиме терапии медиана времени до прогрессирования составила 78 нед, тогда как при первоначальном приеме сунитиниба она составила лишь 37 нед. Таким образом, последовательность сорафениб - сунитиниб может лучше переноситься и обеспечивать большую длительность терапии.
25. Исследование Миннесотского университета: достоверное различие во времени до прогрессирования между двумя последовательными режимами
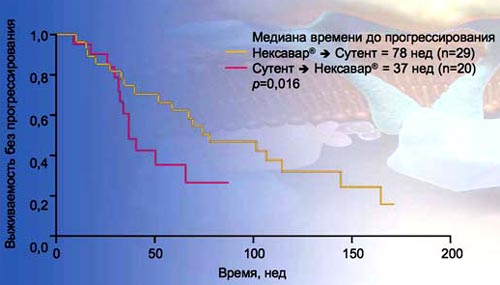
DudekAZetai. Cimcer 2009, 115:61-7.
Reproduced with permission from John Wiley & Sons, Inc.26. Еще одним препаратом из группы таргетных, который применялся в качестве терапии первой линии, был Авастин (бевацизумаб). Нексавар показал клинический эффект у больных, рефрактерных к Авастину (бевацизумаб) и Сутенту (сунитиниб). В исследовании N Am-ARCCS сорафениб в качестве второй линии у пациентов, рефрактерных к бевацизумабу, продемонстрировал суммарный ответ в 81%, что практически идентично его ответу в качестве первой линии таргетной терапии. Аналогичные данные были получены и в европейском исследовании. Последовательная терапия таргетными препаратами является способом преодоления резистентности, так как перекрестная резистентность между таргетными препаратами отсутствует. Таким образом, может быть получен дополнительный эффект от последовательного назначения таргетных препаратов.
26. N Am-ARCCS и EU-ARCCS: ответ на Нексавар у больных, получавших ранее иную таргетную терапию
N Am-ARCCS:
- Клинический ответ на лечение (ПР + ЧР + СТ) был получен у 159/197 (81%) пациентов, рефрактерных к бевацизумабу, что сопоставимо с общим ответом на лечение Нексаваром во всей группе пациентов (84%)
Drabkin НА et al. ASCO 2007; Chicago, IL, USA .
EU-ARCCS:
Общий ответ = ПР + ЧР + СТ >8 нед
Показатель Предшествующий Бевацизумаб (n=42) Предшествующий Сунитиниб (n=69) Общий ответ, % 72 62 Медиана выживаемости без прогрессирования, мес 5,0 4,1 Bеcк Jet al. ЕССО 2007; Barcelona, Spain.
27. Если суммировать все факторы, связанные с заболеванием, с больным и самим лечением, то можно определить показания к назначению сорафениба. Пациенты и хорошего, и промежуточного прогноза являются кандидатами для этой терапии. Гистологическое строение опухоли, а также возраст пациента не являются ограничениями для назначения сорафениба. Нексавар может применяться у пациентов со статусом до 2 по шкале ECOG. Лишь серьезная сердечнососудистая патология является противопоказанием для назначения препарата. Сорафениб был зарегистрирован в качестве второй линии терапии, но более поздние исследования показали, что он эффективен и в качестве первой линии терапии. Также терапия сорафенибом позволяет увеличить ОВ, достичь стабилизации, поддержать качество жизни пациента.
27. Консенсус о показаниях к назначению сорафениба
Уровень доказательности >>>>>
Низкий
Средний
Высокий
Заболевание Статус MSKCC Хороший Промежуточный Плохой No. локализаций 0-1 2-3 >4 Локализация МТС Лимфотические узлы Печень Легкие Кости Головной мозг Гистология Светлоклеточная форма Несветлоклеточная форма
Больной Возраст <65(1)/70(2) лет >65(1)/70(2) лет Статус 0 1 2 3 Сопутствующая
патологияГематологические Контролируемая
гипертензияСердечно-сосудистая <2* >2* Заживление ран Диабет Слабость Щитовидная
железаЦирроз Функция
почек
ЛЕЧЕНИЕ Анамнез Подходит на
цитокинотерапиюНе подходит
на цитокинотерапиюранее цитокинотерапия ранее таргетная терапия Реальная цель Увеличение ОВ Уменьшение
опухолиСтабилизация Поддержка
качества
жизни1. Betlmunt J et at. ESMO 2008: abstr 612P.
2. Eisen T et al. J Natl Cancer Inst 2008; 100: 1454-63.28. Нексавар высокоэффективен и безопасен при метастатическом раке почки в качестве как первой линии терапии, так и второй после назначения цитокиновых или таргетных препаратов. Нексавар продемонстрировал эффективность у больных со всеми гистологическими вариантами рака почки, с метастазами в головной мозг, получавших терапию другими таргетными препаратами, а также в подгруппе больных в возрасте более 65, которые составляют основную группу больных метастатическим раком почки. На сегодняшний день все ведущие организации, кроме Европейской ассоциации урологов, рекомендуют Нексавар в качестве первой или второй линии терапии.
28. Нексавар®. Показания к применению
Первая линия Вторая линия FDA Распространенный рак почки ЕМЕА При наличии противопоказаний к терапии IFN и IL-2 Прогрессирование на фоне терапии цитокинами EAU - Метастатический рак почки NCCN Для особо отобранной группы пациентов Прогрессирование на фоне терапии цитокинами и/или ингибиторами тирозинкиназ Россия Распространенный рак почки
Материал предоставлен компанией ЗАО «БАЙЕР». Контактная информация:
ЗАО "БАЙЕР"
107113, Москва, 3-я Рыбинская ул., дом 18, строение 2.
Телефон: (495) 231-12-00
Факс: (495) 231-12-02
Компания ЗАО «БАЙЕР» заботится о высоком качестве своей продукции и поэтому заинтересована в получении любой информации по безопасности на продукцию компании в целях дальнейшей оценки и снижения риска возникновения нежелательных реакций у пациентов.
Если Вы хотите сообщить о нежелательном явлении или жалобе на качество продукции компании «ЗАО БАЙЕР», пожалуйста передайте информацию своему лечащему врачу, в регуляторные органы, или воспользуйтесь
| Июнь 2013 г. |