Опубликовано в журнале:
Артериальная гипертензия, Том 18, № 4 / 2012, стр. 334-343Оценка антипролиферативной эффективности валсартана у больных ишемической болезнью сердца при реваскуляризации миокарда
(исследование ПРОЛИВ)М.З. Алугишвили, В.Ю. Козулин, Е.А. Усова, Л.В. Геворкова, Л.Б. Митрофанова, М.Л. Гордеев, А.В. Панов
ФГБУ «Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова» Минздравсоцразвития РФ, Санкт-Петербург, РоссияАлугишвили М.З. — кандидат медицинских наук, докторант; Козулин В.Ю. — кандидат медицинских наук, врач отделения рентген-эндоваскулярной хирургии; Усова Е.А. — кандидат медицинских наук, научный сотрудник научно-исследовательского отдела ишемической болезни сердца; Геворкова Л.В. — врач-кардиолог консультативно-диагностического центра; Митрофанова Л.Б. — доктор медицинских наук, заведующая научно-исследовательской лабораторией патоморфологии; Гордеев М.Л. — доктор медицинских наук, профессор, заведующий научно-исследовательским отделом хирургии сердца и сосудов; Панов А.В. — доктор медицинских наук, профессор, заведующий научно-исследовательским отделом ишемической болезни сердца.
Контактная информация: ФГБУ «Федеральный Центр сердца, крови и эндокринологии им. В.А. Алмазова» Минздравсоцразвития РФ, ул. Пархоменко, д. 15, Санкт-Петербург, Россия, 194156. Факс: 8 (812) 702–55–75. E-mail: Marianna-alugishvili@yandex (Алугишвили Марианна Захариевна).Резюме
Актуальность. Операция аортокоронарного шунтирования (АКШ) является на сегодняшний день наиболее широко распространенным методом хирургического лечения больных ишемической болезнью сердца (ИБС) с многососудистым поражением коронарного русла, вовлечением в стенозирующий процесс основного ствола левой коронарной артерии. При этом долгосрочный прогноз пациентов после выполненной операции АКШ определяется преимущественно работоспособностью сформированных венозных и артериальных аортокоронарных шунтов. Пролиферация интимы венозных шунтов сопровождается увеличением риска тромбоза шунта. Цель исследования — проанализировать антигипертензивную и антипролиферативную активность валсартана (Валз) в отношении интимы венозных трансплантатов у больных ИБС после операции АКШ. Материалы и методы. Исследована когорта из 60 пациентов с ИБС, перенесших операцию АКШ. Морфологические особенности большой подкожной вены (БПВ) изучались в образцах, полученных во время операции коронарного шунтирования. Антигипертензивная активность Валза оценивалась с помощью мониторирования артериального давления (АД). Результаты. Среднее снижение систолического АД в основной группе пациентов составило 26,8 мм рт. ст. (р < 0,01), в контрольной группе — 26,5 мм рт. ст. (р < 0,01); диастолического АД в основной группе — 13,6 мм рт. ст. (р < 0,01), в контрольной группе — 14,1 мм рт. ст. (р < 0,01). Морфометрические показатели венозных анастамозов в группе пациентов, получающих валсартан (основная группа), не отличались показателей больных, получающих периндоприл в контрольной группе. При иммуногистохимическом анализе по показателю Ki-67 обнаружена значительно более низкая пролиферативная активность клеток эндотелия (3,5 ± 0,02 против 4,1 ± 0,02 усл. ед.) и гладкомышечных клеток (4,38 ± 0,01 против 7,15 ± 0,05 усл. ед.) в группе пациентов, получавших валсартан. Выводы. Установлена высокая антигипертензивная эффективность и хорошая переносимость валсартана (Валз, Actavis Group, Исландия) в составе комплексной терапии больных ИБС и АГ при коронарном шунтировании. На фоне терапии валсартаном выявлено уменьшение пролиферативной активности интимы и гладкомышечных клеток венозных трансплантатов.
Ключевые слова: антигипертензивная терапия, валсартан, реваскуляризация миокарда, венозные шунты, аортокоронарное шунтирование.Evaluation of antiproliferative efficacy of valsartan in patients with coronary artery disease during myocardial revascularisation (the PROLI V study)
M.Z. Alugishvili, V.Y. Kozulin, Е.А. Usova, L.V. Gevorkova, L.B. Mitrofanova, М.L. Gоrdeev, А.V. Panov
Almazov Federal Heart, Blood and Endocrinology Centre, St Petersburg, RussiaCorresponding author: Almazov Federal Heart, Blood and Endocrinology Centre, 15 Parkhomenko, St Petersburg, Russia, 194156. Fax: 8 (812) 702–55–75. E-mail: Marianna-alugishvili@yandex (Marianna Z. Alugishvili, MD, PhD, the Doctoral Candidate).
Abstract
Background. Nowadays coronary artery bypass graft (CABG) surgery is the most widely used treatment option in patients with multivessel coronary artery disease (CAD) including left main artery lesion. The long-term prognosis of these patients is determined by the properties of the grafts. Objective. To investigate antihypertensive and antiproliferative activity of the angiotesin-converting enzyme inhibitor Valsartan (Valz, Actavis Group, Iceland). Design and methods. Sixty CAD patients who underwent CABG surgery, were enrolled. Antihypertensive effects of Valsartan were assessed by 24-hour blood pressure monitoring. Venous specimens were taken during CABG surgery. Morphological changes in saphenous veins were studied by microscopy, histochemistry and immunological methods. Results. Antihypertensive effects of valsartan and perindopril were comparable. The mean systolic and diastolic blood pressure did not differ in valsartan and perindopril groups. No changes between groups were found by morphological methods. Proliferative activity of endothelial cells was significantly lower in valsartan group. Conclusion. Valsartan in CAD patients after CABG surgery is an effective therapeutic approach regarding the prevention of the intimal hyperplasia of venous grafts.
Key words: antihypertensive therapy, valsartan, myocardial revascularization, venous grafts, coronary artery bypass graft surgery.Статья поступила в редакцию: 21.03.12. и принята к печати: 16.04.12.
Введение
Хирургическая реваскуляризация миокарда является наиболее радикальным методом лечения ишемической болезни сердца (ИБС). Число операций коронарного шунтирования (КШ) в РФ имеет тенденцию к неуклонному росту [1]. Операция КШ сопровождается устранением или уменьшением выраженности стенокардии, а в определенных ситуациях — увеличением продолжительности жизни больных [2, 3]. Однако реваскуляризация миокарда не избавляет пациента от ИБС. Окклюзирующие процессы в шунтах и прогрессирование атеросклероза в нативных коронарных сосудах после КШ определяют риск рецидива стенокардии, развития острых коронарных синдромов и фатальных исходов [4].
Возобновление клиники ИБС после успешно проведенной операции в большинстве случаев ассоциируется с изменениями венозных шунтов. Около 10 % шунтов из большой подкожной вены (БПВ) подвергаются окклюзии в первый месяц после операции, 10 % — в первый год, еще 25 % — в последующие 6 лет. Через 10 лет после операции только 45 % аутовенозных шунтов остаются проходимыми [5]. Характерная динамика патологических процессов в венозных шунтах после операции послужили основой для формирования понятия «болезни венозного шунта». Это состояние включает в себя три взаимосвязанных процесса: тромбоз, гиперплазию интимы («артериализацию») и атеросклеротическое поражение шунта. Они имеют очерченные временные рамки и представляют собой последовательную эволюцию изменений в венозном шунте после выполнения операции [6].
В настоящее время накапливается все больше данных, свидетельствующих о необходимости более широкого применения блокаторов ренин-ангиотензиновой системы (РАС) у больных ИБС при подготовке к КШ и после операции, включая пациентов с сохраненной сократительной способностью миокарда. Известно, что ангиотензин II (АТII) присутствует в местах атеросклеротического повреждения, в том числе в макрофагах атеросклеротических бляшек. Он является одним из важнейших модуляторов пролиферации клеток. Вследствие хирургической реваскуляризации миокарда на стенки венозных шунтов начинает воздействовать непривычно высокое давление, которое приводит к феномену up-регуляции пролиферативного эффекта АТII, что сопровождается увеличением восприимчивости сосудистой стенки к факторам роста и развитием гиперплазии интимы. Положительные эффекты ингибиторов ангиотензинпревращающего фермента (иАПФ) у больных после КШ в настоящее время связывают, в том числе, с их потенциальной способностью предупреждать вазоконстрикцию, прогрессирование атеросклероза в нативных сосудах, а также ограничивать гиперплазию интимы шунтов и усиливать ангиогенез. Использование иАПФ у экспериментальных животных, подвергшихся венозному шунтированию в каротидном бассейне, приводило к уменьшению гиперплазии интимы на 40 %. Следовательно, ограничивая гиперплазию интимы, иАПФ могут предупреждать раннюю окклюзию шунтов. Установлено, что активность АПФ в венозных шунтах в 3 раза выше, чем во внутренней грудной и лучевой артериях. С этих позиций протективный эффект иАПФ в отношении ранней окклюзии шунтов вследствие гиперплазии интимы касается преимущественно венозного материала.
Лишь в двух крупных исследованиях (НОРЕ и EUROPA) с применением иАПФ отмечено значимое снижение риска развития инфаркта миокарда и смертности от сердечнососудистых заболеваний при стабильной ИБС (в том числе, у больных после реваскуляризации миокарда) [7, 8]. Считается, что влияние иАПФ на атерогенез зависит от прочности их связи с АПФ и от способности проникать в ткани. Несмотря на общность механизмов действия различных препаратов этого класса по степени сродства к тканевой АПФ, липофильности, способности улучшать эндотелиальную функцию, замедлять клеточный апоптоз в сосудистой стенке, а также замедлять ремоделирование сердца и сосудов, различия между препаратами могут быть весьма существенны.
В то же время следует отметить, что группа исследователей под руководством доктора Antonio Miceli (Бристоль, Великобритания) проанализировала данные 10023 пациентов, подвергшихся КШ с апреля 1996 г. по май 2006 г. Проводилось сравнение результатов группы из 3052 пациентов, получавших до операции иАПФ, с результатами сопоставимой контрольной группы больных, не получавших иАПФ. Первичной конечной клинической точкой была смертность в течение 30 суток после вмешательства. Средняя смертность в двух группах составила 1 %. Однако у пациентов, получавших иАПФ, риск смертности был почти в два раза выше. Риск послеоперационной почечной дисфункции у них был выше на 36 %, мерцательной аритмии — на 34 %. В этой группе на 22 % чаще применялась инотропная поддержка. Комментируя полученные результаты, исследователи отмечают, что, несмотря на известные преимущества иАПФ, их использование непосредственно перед операцией нежелательно. Целесообразнее отменить прием иАПФ перед операцией и возобновить его уже после КШ [7].
Вторым классом, блокирующим активность РАС, являются сартаны (блокаторы рецепторов ангиотензина II, БРА). Известно, что превращение ангиотензина I в ангиотензин II под воздействием АПФ идет лишь в системном кровотоке, в то время как в тканях оно осуществляется под воздействием химаз. Поэтому эффекты РАС, приводящие к развитию патологических процессов (например, в стенке сосудов), не могут быть полностью нивелированы только путем применения иАПФ. Этим также может объясняться феномен «ускользания» эффекта при их длительном применении. Принципиальные различия иАПФ и БРА заключаются именно в механизме действия на этом этапе. Кроме того, фармакодинамические эффекты БРА связаны с их способностью блокировать ренин-ангиотензин-альдостероновую систему (РААС) на уровне ангиотензиновых рецепторов 1-го типа. Именно через активацию этих рецепторов по современным представлениям реализуется патологическое влияние высоких концентраций основного эффектора РААС ангиотензина II при сердечнососудистых заболеваниях, в том числе в отношении пролиферативных процессов. Следует подчеркнуть, что БРА обладают специфичным действием и блокируют только биологические эффекты АТII, не вмешиваясь в кининовую систему, что улучшает их переносимость.
Препаратом, эффективность которого доказана по всем общепризнанным и ряду дополнительных показаний к назначению БРА в крупных исследованиях, является валсартан. Он быстро всасывается из желудочно-кишечного тракта, максимальная концентрация в плазме крови достигается через 2–4 ч после приема внутрь; в эти же сроки проявляется антигипертензивный эффект препарата. Длительный период полувыведения (около 9 ч), а также прочная связь с АТ1-рецепторами (в 24 тыс. раз превышающая таковую к АТ2-рецепторам) обеспечивает 24-часовое поддержание эффекта, что позволяет принимать препарат 1 раз в сутки. Хорошо изучена и многократно доказана не только антигипертензивная эффективность валсартана, но и его способность улучшать сердечнососудистый прогноз у пациентов с артериальной гипертензией (VALUE) [8], сердечной недостаточностью (VALHeFT) [9], инфарктом миокарда (VALIANT) [10] и высоким риском сердечнососудистых осложнений (JIKEI HEART Study, KYOTO HEART Study) [11]. Таким образом, валсартан доказал свою эффективность на всех этапах сердечнососудистого континуума. На сегодняшний день валсартан занимает лидирующую позицию в лечении многих состояний и является самым назначаемым БРА во всем мире [12]. Применительно к улучшению прогноза после реваскуляризации миокарда важные результаты получены в исследованиях Val-PREST и VALVACE. Доказано, что терапия валсартаном уменьшает риск развития рестенозов и повторных вмешательств у пациентов, перенесших транслюминальную баллонную ангиопластику коронарных артерий [13, 14]. Оптимальным по соотношению «цена-качество» представителем валсартана на Российском рынке является препарат Валз (фармацевтическая компания Actavis Group, Исландия). Отличительной особенностью Валза является наличие всех трех зарегистрированных показаний, как и у оригинального валсартана: артериальная гипертензия, хроническая сердечная недостаточность и повышение выживаемости пациентов с острым инфарктом миокарда.
Таким образом, опосредованные через ангиотензин II пролиферативные процессы в сосудах и шунтах определяют потенциально высокую эффективность БРА в отношении ближайших и отдаленных исходов КШ за счет профилактики ранней окклюзии преимущественно венозных шунтов.
Цель настоящего исследования —оценка антигипертензивной эффективности препарата валсартана (Валз) и его антипролиферативного влияния на морфологическое состояние венозных аутотрансплантатов у пациентов с ИБС при операции КШ.Материалы и методы
В исследование включено 60 пациентов со стабильной формой ИБС (стенокардия напряжения II–V функционального класса, ФК). Средний возраст пациентов на момент исследования составил 53,4 ± 8,7 года. Всего включено 54 (90 %) мужчины и 6 (10 %) женщин. Продолжительность анамнеза ИБС до включения в исследование составила 4,1 ± 3,5 года. Стенокардия напряжения II ФК установлена у 12 больных (20 %), III ФК —у 39 (65 %), 9 (15 %) больных имели клинику стенокардии IV ФК. Инфаркт миокарда (ИМ) перенесли 25 % больных. У всех пациентов была диагностирована гипертоническая болезнь (включались пациенты только с 1-й степенью тяжести артериальной гипертензии, нелеченой или леченной нерегулярно), 39 пациентов (65 %) курили, 30 (50 %) имели избыточный вес, сахарный диабет типа 2 был диагностирован у 7 больных (11,6 %), у 45 (75 %) имела место дислипидемия. Средняя фракция выброса (ФВ) левого желудочка (ЛЖ) составила 56,8 ± 1,2 % (по методике Симпсона).
Все включенные в исследование пациенты получали терапию, включающую прием нитратов, дезагрегантов (с отменой за 5 дней до операции), b-блокаторов, статинов, диуретиков по показаниям. Антагонисты кальция назначались при непереносимости b-блокаторов.
Не включались в исследование больные с текущим инфарктом миокарда, острым нарушением мозгового кровообращения, нарушениями функции почек и печени, сердечной недостаточностью II–IV ФК и дисфункцией левого желудочка (ФВ < 40 %), сахарным диабетом тип 1, наличием в анамнезе указаний на непереносимость иАПФ.
В рамках проекта ПРОЛИВ (ПРОЛИферация вен и Валсартан) все 60 пациентов после компьютерной рандомизации были разделены на две равные группы по 30 больных: 1-я группа (основная) дополнительно к назначенной терапии в качестве антигипертензивного препарата получала валсартан; 2-я группа (контрольная) — иАПФ периндоприл. Дизайн исследования представлен на рисунке 1.Рисунок 1. Дизайн исследования ПРОЛИВ
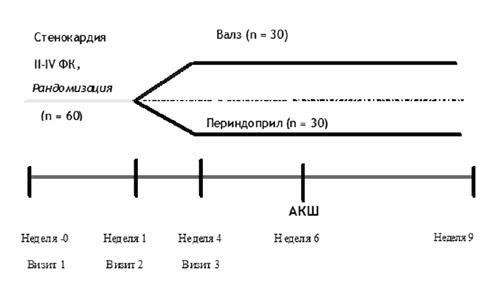
Примечание: АКШ — аортокоронарное шунтирование; ФК — функциональный класс.Продолжительность наблюдения составила 9 недель (табл. 1), в течение которых были проведены 4 визита. Во время первого визита — «визита отбора» — проводили физикальное обследование, определяли АД по методу Короткова, частоту сердечных сокращений (ЧСС), проводились исследования крови и мочи, регистрировалась электрокардиограмма (ЭКГ) в 12 стандартных отведениях. После периода «отмыва» (0–1 неделя) на 2-м визите осуществлялась рандомизация и назначение сравниваемых препаратов.
Доза валсартана составляла 80 мг, периндоприла — 5 мг. На этом этапе исследования повторно проводили физикальное исследование, контроль АД и ЧСС. Во время 3-го визита вновь определяли клинический статус пациента, измеряли АД, ЧСС, оценивали переносимость терапии, выполняли лабораторные анализы. После операции КШ терапия возобновлялась в ранние сроки в послеоперационном периоде (24–36 часов). Заключительный 4-й визит осуществлялся на 9-й неделе от начала лечения. На этом этапе исследования проводили физикальное обследование, полное лабораторное исследование, оценивали АД и ЧСС, регистрировали ЭКГ. Антигипертензивная терапия могла быть усилена по решению врача для достижения целевого уровня АД (АД < 130/80 мм рт. ст. как для пациентов очень высокого риска).
Оценка антигипертензивной эффективности проводилась по следующим параметрам:
- снижение от исходного уровня к концу наблюдения систолического (САД) и диастолического (ДАД) АД;
- доля пациентов, ответивших на проводимое лечение (cнижение ДАД как минимум на 5 мм рт. ст. или САД на 10 мм рт. ст.);
- доля пациентов, достигших целевого уровня АД (< 130/80 мм рт. ст.).
Оценка антипролиферативной эффективности проводилась на основании морфологического изучения особенности большой подкожной вены (БПВ) в образцах, полученных во время операции КШ. Сегменты, предназначенные для выделения рибонуклеиновой кислоты (РНК), отмывали в стерильном физиологическом растворе, погружали в раствор RNAJainer и хранили при температуре 4 °С. При проведении гистологического и иммуногистохимического исследования полученный интраоперационный материал фиксировали в 10%-м формалине, обезвоживали в спиртах восходящей плотности и заливали в парафин. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином по ван Гизону. Морфометрический анализ осуществлялся с помощью анализатора изображения Leica Scope.
Схема приготовления иммуногистохимических препаратов сводилась к следующим этапам: после депарафинизации парафиновых срезов проводилось блокирование активности эндогенной пероксидазы в 3%-м растворе перекиси водорода с последующим промыванием в дистиллированной воде. Восстановление активности антигенов путем кипячения в ЭДТА-буфере (pH 9,0) в водяной бане в течение 30 минут с последующим промыванием в Трисбуфере с Tween 20. Далее следовала инкубация с первичными антителами (18 часов, при 6 °С), затем инкубация с вторичными антителами Real Rabbit/Mouse (Dako), реакция с DAB, промывание в дистиллированной воде. Затем следовало докрашивание ядер гематоксилином, обезвоживание и заключение в среду Bio Mount. Использовались антитела к Ki-67-, Bcl-2 фирмы DAKO и антитело к TGF-beta фирмы Novocastra. Во всех препаратах подсчитывали число клеток с экспрессией антигенов при исследовании не менее 1000 клеток, за исключением эндотелия, число клеток которого не всегда достигало заданного.
Результаты исследования анализировались с помощью стандартных параметров описательной статистики для непрерывных количественных признаков: среднее, стандартное отклонение, медиана, минимальное и максимальное значения. Для оценки снижения риска появления основного и дополнительных регистрируемых клинических событий использовали модель Кокса. В двух группах больных сравнивали частоту развития острых состояний с доверительным интервалом 95%-й вероятности (ДИ = 95 %). В подгруппах больных с определенными клиническими характеристиками также проводили описательный анализ основного регистрируемого показателя. Во всех анализах
учитывали всех больных, получивших хотя бы одну дозу исследуемого препарата.Результаты
Анализ факторов риска и сопутствующих заболеваний в основной и контрольной группах пациентов установил, что их характер и частота встречаемости существенно не различались (табл. 1).
Таблица 1. Исходная характеристика пациентов , включенных в исследование
Основная группа (Валсартан, n = 30)
Контрольная группа (Периндоприл, n = 30)
Возраст, годы
54,3 ± 7,6
52,8 ± 9,0
Мужской пол, %
90,0
90,0
Курение, %
60,0
56,7
Отягощенная наследственность, %
66,7
70,0
ГБ, %
10,0
10,0
СД типа 2, %
6,7
5,0
ИМТ > 30 кг/м2, %
30,0
36,7
Перенесенный ИМ, %
26,7
30,0
Патология дыхательной системы в анамнезе, %
10,0
6,7
Патология ЖКТ в анамнезе, %
50,0
53,3
Патология мочеполовой системы в анамнезе, %
40,0
36,7
ОНМК в анамнезе, %
6,7
3,3
Предоперационная терапия
Бета-блокаторы, %
90,0
86,67
Антагонисты кальция, %
10,0
13,33
Нитраты, %
86,67
86,67
Диуретики, %
16,67
13,33
Статины, %
90,0
90,0
АСК (по возможности отменялась за 5 суток до оперативного лечения), %
90,0
93,33
Примечание: ГБ — гипертоническая болезнь; СД — сахарный диабет; ИМТ — индекс массы тела; ИМ — инфаркт миокарда; ЖКТ — желудочно-кишечный тракт; ОНМК — острое нарушение мозгового кровообращения; АСК — ацетилсалициловая кислота.
В таблице 2 представлены основные результаты изменения гемодинамических показателей в течение 9 недель применения валсартана и периндоприла.
Таблица 2 Основные показатели гемодинамики в течение исследования
Показатель |
Основная группа (Валсартан, n = 30) |
Контрольная группа (Периндоприл, n = 30) |
р |
САД визит 2, мм рт. ст. |
153,2 ± 1,16 |
152,1 ± 0,97 |
> 0,05 |
САД визит 4, мм рт. ст. |
126,4 ± 0,85 |
125,6 ± 1,14 |
> 0,05 |
ΔСАД визиты 2-4, мм рт. ст. |
26,8 (p < 0,01) |
26,5 (p < 0,01) |
|
ДАД визит 2, мм рт. ст. |
93,9 ± 0,78 |
94,0 ± 0,56 |
> 0,05 |
ДАД визит 4, мм рт. ст. |
80,3 ± 0,81 |
80,9 ± 1,23 |
> 0,05 |
ΔДАД визиты 2-4, мм рт. ст. |
13,6 (p < 0,01) |
14,1 (p < 0,01) |
|
ЧСС визит 2, уд/мин |
72,1 ± 0,64 |
71,7 ± 1,45 |
> 0,05 |
ЧСС визиты 4, уд/мин |
71,4 ± 0,87 |
70,8 ± 1,63 |
> 0,05 |
ΔЧСС визиты 2-4, уд/мин |
0,5 (p > 0,05) |
0,9 (p > 0,05) |
|
Ответ на терапию, %* |
96,7 |
96,7 |
> 0,05 |
Достижение целевого уровня АД (< 130/80 мм рт. ст.), % |
70,0 |
66,7 |
> 0,05 |
Примечание: САД/ДАД — систолическое/диастолическое артериальное давление; ЧСС — частота сердечных сокращений; * — cнижение ДАД как минимум на 5 мм рт. ст. или САД на 10 мм рт. ст.
Отмечено статистически значимое снижение САД и ДАД в каждой группе между вторым и четвертым визитами. Среднее снижение САД в основной группе пациентов составило 26,8 мм рт. ст. (р < 0,01), в контрольной группе — 26,5 мм рт. ст. (р < 0,01). Среднее снижение ДАД в основной группе пациентов составило 13,6 мм рт. ст. (р < 0,01), в контрольной группе — 14,1 мм рт. ст. (р < 0,01). При этом не было выявлено значимых различий динамики САД и ДАД между группами. Различия в уровне АД отсутствовали на каждом визите.
В обеих группах пациентов при применении терапии, основанной на блокаде РАС, отмечен хороший контроль АД. Целевой уровень АД < 130/80 мм рт. ст. был достигнут у 70 % пациентов основной и 66,7 % пациентов контрольной группы. Количество пациентов, ответивших на терапию в соответствии с заданными критериями в основной и контрольной группах, составило 96,7 %.
ЧСС в процессе лечения значимо не изменилась в обеих группах больных. Следует подчеркнуть, что подавляющее число пациентов принимало b-адреноблокаторы.
Пациенты и врачи одинаково высоко оценили эффективность валсартана в составе комбинированной терапии. За весь период наблюдения наблюдались следующие побочные явления: головная боль (1 пациент), головокружение у 1 пациента на фоне избыточного снижения АД (доза валсартана была снижена до 40 мг). В контрольной группе кашель (не требующий отмены препарата) был зарегистрирован у 1 пациента, и 1 пациент связывал с приемом периндоприла усталость. Последний прекратил терапию иАПФ после 4-го заключительного визита. Отсутствие значимого кашля на прием периндоприла в контрольной группе обьясняется тем, что исходно в исследование не включались пациенты с анамнестическими указаниями на непереносимость иАПФ.
Динамика лабораторных показателей на фоне применения валсартана представлена в таблице 3. Как видно из представленных данных, существенных отклонений от нормы по анализируемым показателям в ходе лечения валсартаном не зарегистрировано.
Таблица 3. Динамика лабораторных показателей в основной группе лечения валсартаном
Показатель |
Визит 1 |
Визит 4 |
Гемоглобин, г/л |
120,0 ± 1,2 |
119,9 ± 1,8 |
СОЭ, мм/ч |
8,4 ± 1,4 |
8,1 ± 1,5 |
Лейкоцитарная формула |
Без особенностей |
Без особенностей |
Креатинин, мкмоль/л |
58 ± 5,8 |
62 ± 6,3 |
АЛТ, Ед/л |
23 ± 4,2 |
25 ± 3,4 |
АСТ, Ед/л |
21 ± 5,9 |
24 ± 2,3 |
Общий анализ мочи |
Без значимых изменений |
Без значимых изменений |
Примечание: СОЭ — скорость оседания эритроцитов; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза.
Морфологические особенности венозных трансплантатов у больных ИБС при коронарном шунтировании в основной и контрольной группах
По данным коронароангиографии, поражение двух артерий имело место у 35 % (21 человек), трех — у 50 % (30 человек). Поражение основного ствола левой коронарной артерии в сочетании с поражением других коронарных артерий выявлено у 6 из 60 (10 %) больных.
Венозные кондуиты использовались в качестве материала для шунтирования различных коронарных бассейнов у всех исследованных больных. Наиболее часто венозные шунты применялись при реваскуляризации огибающей артерии и правой коронарной артерии, в то время как для лечения поражений передней межжелудочковой артерии (ПМЖА) в основном использовалась внутренняя грудная артерия. Кроме поражений собственно ПМЖА, венозные трансплантаты часто использовались для шунтирования ее крупных диагональных ветвей вместе с аутоартериальными шунтами. Всего было использовано 120 венозных аортокоронарных шунта: один венозный шунт у 18 больных (30 %), два венозных шунта — у 24 пациента (40 %) и три венозных шунта использованы в 18 случаях (30 %). В 91,7 % случаев была выполнена полная реваскуляризация, в 8,3 % — неполная. Полной считали случаи, когда шунтировали все артерии с диаметром более 1 мм и стенозом более 60 %.
Результаты морфологического исследования образцов вен пациентов основной и контрольной групп представлены в таблице 4.
Таблица 4Морфологические характеристики венозных анастомозов в основной и контрольной группах
|
Основная группа (Валсартан, n = 30) |
Контрольная группа (Периндоприл, n = 30) |
р |
||
Показатель |
абс. |
% |
абс. |
% |
|
Гиперплазия интимы |
29 |
96,7 |
28 |
93,5 |
> 0,05 |
Степень гиперплазии интимы |
13 |
44,8 |
13 |
46,4 |
> 0,05 |
Наличие продольных ГМК в интиме |
16 |
53,3 |
17 |
56,7 |
> 0,05 |
Дистрофия интимы |
29 |
96,7 |
28 |
93,5 |
> 0,05 |
Число слоев ГМК в медии До 9 10–19 Более 20 |
10,31 ± 3,66 |
43,3 |
7,85 ± 2,65 |
46,7 |
> 0,05 |
Продольные пучки ГМК в адвентиции |
21 |
70 |
22 |
73,3 |
> 0,05 |
Примечание: ГМК — гладкомышечные клетки.
Гиперплазия интимы образцов вен в основной группе наблюдения пациентов, получающих валсартан, наблюдалась в 93,5 % случаев, среди них циркулярная гиперплазия интимы наблюдалась в 46,4 % случаев, очаговая гиперплазия — в 53,6 % случаев. При анализе степени выраженности гиперплазии интимы получены следующие данные: гиперплазия интимы до 25 % толщины медии составила 46,4 %, до 50 % толщины медии — 21,5 %, до 75 % толщины медии — 10,7 % , 75 % и более — 21,4 % случаев.
Дистрофия гладкомышечных клеток (ГМК) установлена в 93,5 % венозных кондуитов, признаки спазма — в 60 % вен. В 46 % случаев выявлена дистрофия и десквамация эндотелия, в 80 % случаев — пролиферация эндотелия vasa vasorum.
У половины обследованных вен количество слоев ГМК составило 10–19, в остальных случаях — до 9. У 56,7 % мышечный каркас вен был усилен наличием продольных слоев ГМК в интиме, а у 70 % — в адвентиции. Морфометрическое исследование показало, что средняя толщина интимы вен составила 0,13 ± 0,11 мм, медии вен — 0,22 ± 0,08 мм.
Признаков атеросклеротического поражения сосудов не было выявлено ни в одном случае. Воспалительная инфильтрация медии была диагностирована в 20 % случаев, лимфоцитарно-макрофагальная инфильтрация адвентиции — в 30 % случаев. Хронический флебит был выявлен у 20 % пациентов, флебосклероз — в 35 % случаев.
Морфометрические показатели венозных анастамозов в группе пациентов, получающих валсартан (основная группа), не отличались от показателей больных, получающих периндоприл (табл. 4).
Вместе с тем при проведении иммуногистохимического анализа по показателю Ki-67 обнаружена значительно более низкая пролиферативная активность как клеток эндотелия (3,5 ± 0,02 и 4,1 ± 0,02 усл. ед. соответственно), так и ГМК (4,38 ± 0,01 и 7,15 ± 0,05 усл. ед. соответственно) в группе пациентов, получавших валсартан. Высокий уровень экспрессии Вcl-2 в эндотелиоцитах и ГМК соответствовал высокому уровню TGF. При этом показатели TGF-b и Вcl-2 не различались в группах пациентов, получавших валсартан и периндоприл (табл. 5).
Таблица 5. Уровень экспрессии KI-67, TGF-B И Bcl-2 в эндотелиоцитах и гладкомышечных клетках венозных трансплантатов пациентов в основной и контрольной группах пациентов
Ki-67
(%) |
Bcl-2
(%) |
TGF-b
(%) |
||||
|
Э | ГМК | Э | ГМК | Э | ГМК |
Основная группа (Валсартан, n = 30) |
3,5 ± 0,02* | 4,38 ± 0,01* | 20,46 ± 0,03 | 25,33 ± 0,05 | 48,4 ± 0,03 | 52,8 ± 0,03 |
Контрольная группа (Периндоприл, n = 30) |
4,1 ± 0,02 | 7,15 ± 0,05 | 23,47 ± 0,01 | 26,16 ± 0,04 | 48,8 ± 0,02 |
51,36 ± 0,01 |
Примечание: ГМК — гладкомышечные клетки; Э — эндотелиоциты; * — p < 0,05.
Таким образом, применение валсартана (Валз) сопровождается достоверным снижением пролиферативной активности эндотелиоцитов и ГМК БПВ. Именно пролиферативные процессы в интиме и медии венозного шунта во многом определяют его «артериализацию», развитие «болезни венозного шунта» с последующим формированием стенозов и окклюзий после КШ. Отсутствие значимых различий морфометрических показателей в образцах венозных шунтов на фоне применения препарата класса БРА (валсартана) и иАПФ (периндоприла), вероятно, обусловлено коротким сроком наблюдения.
Заключение
В проведенном нами исследовании у 60 пациентов с ИБС и выполненной операцией прямой реваскуляризации миокарда с помощью КШ оценивалась антигипертензивная эффективность препарата валсартана (Валз, Actavis Group, Исландия) и его антипролиферативное влияние на морфологическое состояние венозных аутотрансплантатов. В обеих группах пациентов при применении терапии, основанной на блокаде РАС, отмечен хороший контроль АД. Целевой уровень АД < 130/80 мм рт. ст. был достигнут у 70 % пациентов основной и у 66,7 % пациентов контрольной группы. Количество пациентов, ответивших на терапию в соответствии с заданными критериями в основной и контрольной группе, составило 96,7 %.
Результаты проведенного исследования показали высокую антигипертензивную эффективность и очень хорошую переносимость валсартана в составе комплексной терапии больных ИБС и АГ 1-й степени тяжести при коронарном шунтировании. На фоне терапии валсартаном выявлено уменьшение пролиферативной активности интимы и ГМК
венозных трансплантатов, что позволяет предполагать перспективность применения препарата для улучшения отдаленных исходов оперативного лечения. Таким образом, использование валсартана (Валза) в комплексном лечении пациентов с ИБС на этапе подготовки к КШ и в раннем послеоперационном периоде не только позволило достичь целевого уровня АД у больных АГ, но и значительно улучшило прогноз после реваскуляризации миокарда.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литературы
| Декабрь 2012 г. |