ОСОБЕННОСТИ ПРИМЕНЕНИЯ И ЭФФЕКТИВНОСТЬ N-АЦЕТИЛЦИСТЕИНА ПРИ РЕСПИРАТОРНОЙ ПАТОЛОГИИ У ДЕТЕЙ
О. Симонова, доктор медицинских наук, профессор,
Научный центр здоровья детей РАМН, МоскваСочетание прямого муколитического действия N-ацетилцистеина (NAC) и всех его лекарственных форм с антиоксидантным и антитоксическим свойствами объясняет его высокую эффективность при респираторной патологии у детей, сопровождающейся увеличением вязкости бронхиального секрета и слизи. Рассматриваются показания, противопоказания и особенности приема NAC у детей.
Ключевые слова: N-ацетилцистеин, респираторная патология, вязкость бронхиального секрета, мукостаз, лечение, дети.
Традиционно для облегчения откашливания или при так называемом влажном кашле, который сопровождается трудноотделяемой, вязкой мокротой, принято использовать муколитические средства. Но современный рынок подобных лекарственных препаратов переполнен, и порой весьма затруднительно выбрать наиболее эффективное средство, особенно для детей.
Долгое время в терапии кашля применялись лекарства, которые усиливают откашливание — отхаркивающие препараты или секретомоторные средства. По механизму действия все секретомоторные лекарственные средства делятся на 2 группы:
- препараты алтея, истода, термопсиса и других лекарственных трав, терпингидрат, ликорин, эфирные масла; они оказывают слабое раздражающее действие, что приводит к усиленному образованию слизи в бронхах, но при этом также стимулируются и слюнные железы;
- натрия, калия йодид, аммония хлорид и ряд других солевых препаратов; они выделяются слизистой оболочкой бронхов, стимулируя бронхиальную секрецию, и частично разжижают мокроту [9].
Однако существуют ограничения, особенно у детей, для применения подобных препаратов: повышенный рвотный рефлекс, непереносимость йода, аллергические реакции, необходимость частого приема микстур и др. [9, 13].
Многочисленные научные исследования показывают, что именно реологические свойства мокроты (вязкость, эластичность и адгезия, т.е. липкость) определяют возможность ее свободного отделения. Поэтому большое значение в лечении состояний, сопровождающихся образованием вязкой мокроты, отводится лекарственным средствам, известным как муколитики или бронхосекретолитические препараты [5, 6, 9].
Важно понимать, что по механизму действия муколитики не являются средством воздействия на основное патогенетическое звено болезни — воспалительную реакцию, а влияют лишь на симптомы заболевания, т.е. относятся к симптоматической терапии [2, 22].
Обычно выделяют 3 группы муколитических препаратов в зависимости от химической формулы действующего начала: N-ацетилцистеин и его производные; амброксола гидрохлорид и его производные; карбоцистеин и его производные [5, 9].
Есть еще один муколитик — фермент, который был специально создан для больных муковисцидозом, — дорназа альфа (пульмозим); это рекомбинантная человеческая ДНКаза [7, 11]. Хорошим муколитическим эффектом обладают также обычные физиологический (0,9% NaCl) или гипертонический (от 3—6 до 20% NaСl) растворы в виде ингаляций через небулайзер. Умеренную муколитическую активность продемонстрировал унитиол (относится к группе тиолов: 2,3-димеркаптопропансульфонат), используемый также в виде ингаляций. Протеолитические ферменты (например, хемотрипсин и др.) в качестве муколитиков сегодня не используются в связи с возможным повреждением легочного матрикса и высоким риском серьезных побочных эффектов — таких, как аллергические реакции, кровохарканье или бронхоспазм [5, 8, 9].
Известно, что в ответ на инфекционный или неинфекционный чужеродный материал, попавший на слизистую оболочку верхних и(или) нижних дыхательный путей, развивается первая защитная реакция слизистой оболочки со стороны мукоцилиарного клиренса в виде гиперсекреции слизи, изменения ее физико-химических свойств, скорости движения ресничек и др., направленная на удаление повреждающего агента [5, 15, 19].
Повреждающими факторами, которые существенно изменяют строение и функции слизистой оболочки дыхательных путей и мукоцилиарного клиренса, могут быть не только различные вирусы при острых респираторных вирусных инфекциях, бактерии, грибы, но также различные аллергены, табачный дым, пыль и т.д. Вследствие ринофарингеальных воспалительных процессов развивается катаральный средний отит, при котором всегда повышается секреция сложных трубчато-альвеолярных желез евстахиевой трубы [11, 18]. Признаками хронического бронхита являются гиперплазия и гипертрофия бронхиальных желез, а также гиперплазия бокаловидных клеток [1].
Образующаяся мокрота состоит из бронхиального секрета и слюны (схема 1) [4]. В чистом виде бронхиальный секрет (идеальный материал для исследования) можно получить только при бронхоскопии или при откашливании мокроты во время дренажа. Это — довольно сложный комплекс, который состоит из секрета бронхиальных желез и бокаловидных клеток, поверхностного эпителия, продуктов метапроцессанарушаетсяболизма клеток, альвеолярного сурфактанта и тканевого транссудата.
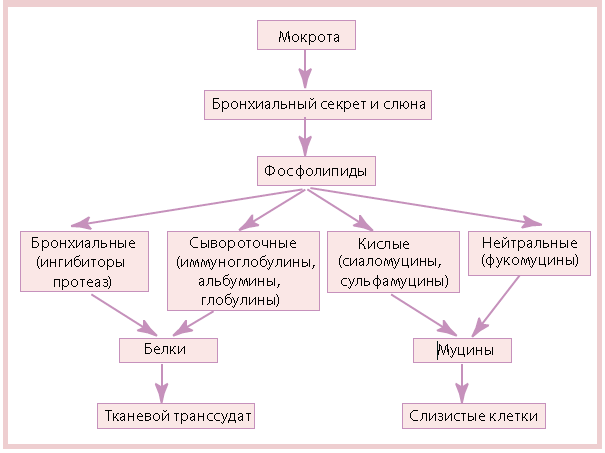
По физико-химической структуре бронхиальный секрет представляет собой многокомпонентный коллоидный раствор, включающий 2 фазы: золь и гель. Золь — жидкая, растворимая фаза; представляет собой глубокий слой толщиной 2—4 мкм, непосредственно прилежащий к слизистой оболочке; в нем плавают и сокращаются реснички, энергия которых передается на него без задержки. В состав золя входят электролиты, сывороточные компоненты, местносекретируемые белки, биологически активные вещества, ферменты и их ингибиторы. Золь продуцируется в респираторной зоне (альвеолах и дыхательных бронхиолах), где он участвует в очищении воздуха, так как обладает умеренными адгезивными свойствами. По мере дальнейшего продвижения секрета к нему присоединяется содержимое бокаловидных клеток и серомукоидных желез, формирующих гель.
Гель — нерастворимая, вязкоэластическая фаза — представляет собой верхний, наружный слой бронхиального секрета толщиной 2 мкм, расположенный над ресничками. Гель состоит из гликопротеинов; последние формируют фибриллярную структуру, представляющую собой широкую ячеистую сеть, элементы которой содержат водородные связи. Гель способен перемещаться только после повышения минимального напряжения сдвига (предела текучести), т.е. когда разрываются связанные между собой ригидные цепи. Соотношение фаз геля и золя определяется активностью серозных и слизистых желез. Преобладающая активность серозных подслизистых желез приводит к образованию большого количества секрета с низким содержанием гликопротеинов — бронхорее. В противоположность этому гиперплазия слизеобразующих клеток с возрастанием их функциональной активности, наблюдаемая, например, при хроническом бронхите, бронхиальной астме и т.д., характеризуется повышением содержания гликопротеинов, фракции геля и, соответственно, увеличением вязкости бронхиального секрета.
До определенного момента гиперпродукция слизи носит защитный характер, но в дальнейшем изменяется не только количество бронхиального секрета, но и его качество. Секретообразующие элементы воспаленной слизистой начинают продуцировать вязкую слизь с увеличенным содержанием гликопротеинов. Это, в свою очередь, приводит к росту фракции геля (она начинает преобладать над другой фракцией — золем) и, соответственно, к повышению вязкоэластических свойств бронхиального секрета. Развитию гипер- и дискринии способствует также значительное увеличение как количества, так и площади распространения бокаловидных клеток (вплоть до терминальных бронхиол). Существенно изменяется качественный состав секрета: снижается содержание секреторного иммуноглобулина А, интерферона, лактоферрина, лизоцима — основных компонентов местного иммунитета, обладающих противовирусной и противомикробной активностью [1] .
В результате ухудшения реологических свойств бронхиального секрета нарушается подвижность ресничек мерцательного эпителия, что блокирует их очистительную функцию: скорость движения бронхиального секрета замедляется или совсем прекращается. Вязкий бронхиальный секрет становится хорошей питательной средой для размножения различных микроорганизмов (в том числе вирусов, бактерий, грибов). Это приводит к усугублению воспалительного процесса, нарастанию бронхиальной обструкции, формированию оксидативного стресса [5, 12, 16, 19].
Таким образом, изложенное выше подчеркивает необходимость применения для лечения подобных состояний препаратов, которые улучшают или облегчают отделение патологически измененного бронхиального секрета, предотвращают мукостаз и улучшают мукоцилиарный клиренс [20]. С облегчением отделения секрета устраняется и один из важных факторов обратимой бронхиальной обструкции, а также уменьшается вероятность микробной колонизации дыхательных путей. Это достигается в значительной степени благодаря применению муколитических/ мукорегуляторных препаратов [3, 5, 9, 10] .
Причины кашля и его клинические проявления у детей отличаются от таковых у взрослых. У ребенка кашель от незаметного покашливания, практически не влияющего на самочувствие и поведение больного, варьирует до сильного мучительного, сопровождающегося рвотой, беспокойством, болевым синдромом, нарушающим сон, самочувствие и поведение. Поэтому вопрос выбора муколитического средства особенно актуален для педиатров [3, 10, 21].
При острых или хронических воспалительных заболеваниях дыхательных путей увеличивается как число бокаловидных клеток, так и площадь их распространения [5]. Соотношение реснитчатых и бокаловидных клеток достигает 5:1 (в норме — 10:1). Особенно это нарушенное соотношение проявляется в терминальных бронхиолах, что еще больше утяжеляет течение заболевания.
При этом не только увеличиваются объем и вязкость мокроты, но снижается ее эластичность из-за роста активности протеолитических ферментов бактериального происхождения и нейтрофильной эластазы лейкоцитов. Отмечается также функциональная неполноценность секреторного α1-ингибитора протеиназ, которая также снижает эластические свойства мокроты.
Таким образом, мукоцилиарный клиренс нарушается при различных заболеваниях дыхательных путей вследствие изменений физико-химического состава мокроты и дисбаланса в работе реснитчатого эпителия. Поэтому важно использовать препарат, который нормализует состав секрета и регулирует работу секреторной клетки.
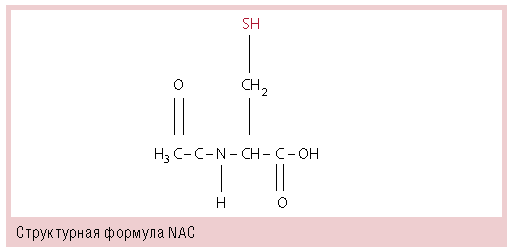
С этой целью применяются неферментные муколитики, основу которых составляет химическое вещество N-ацетилцистеин (NAC) — производное L-цистеина (см. рисунок). NAC успешно используется на практике более 30 лет, причем не только как муколитическое средство для лечения заболеваний респираторной системы; описаны свойства NAC как активного антиоксидантного (дополнительная защита органов дыхания от повреждающего воздействия свободных радикалов, эндо- и экзотоксинов, образующихся при воспалительных заболеваниях респираторного тракта) и антитоксического (применяется в военном деле и при отравлении парацетамолом, альдегидами и другими фенолами) препарата.
Из всех мукоактивных препаратов только NAC является прямым муколитиком, так как в его структуре содержится свободная сульфгидрильная группа, которая и разрушает дисульфидные связи между молекулами кислых мукополисахаридов и гликопротеидов, изменяя структуру мокроты [5, 9]. Бронхиальный секрет становится более жидким. Активность препарата сохраняется при любом виде мокроты — слизистой, слизисто-гнойной, гнойной. Это особенно важно при бактериальных инфекциях, когда необходимо быстро уменьшить вязкость мокроты с гнойными включениями, чтобы эвакуировать ее из дыхательных путей и предотвратить распространение инфекции.
Большое терапевтическое значение имеет свойство NAC усиливать двигательную активность ресничек цилиарного эпителия за счет снижения вязкости мокроты и увеличивать секрецию альвеолярного сурфактанта альвеолоцитами.
Прямое антиоксидантное свойство NAC связано с тем, что его тиольные группы соединяются электрофильными группами свободных радикалов. Непрямое действие NAC как предшественника глютатиона заключается в усилении активности глютатион-S-трансферазы и других ферментов.
Фармакокинетика NAC. Препарат при пероральном приеме быстро всасывается и довольно быстро метаболизируется в печени. При прохождении через печень NAC дезацетилируется с образованием цистеина. Биодоступность достаточно низкая — 10%.
Безопасность NAC доказана, так как его действующее вещество — натуральное, хотя и химически синтезированное соединение, является производным природной аминокислоты.
Максимальная концентрация в плазме достигается через 1—3 ч. Действие начинается через 30—90 мин после введения и сохраняется 2—4 ч. Это всегда нужно учитывать при планировании таких процедур, как дыхательная гимнастика и дренаж бронхиального дерева, ингаляции, а также иметь в виду двигательную активность пациента, в том числе период отдыха и сна.
Связывание с белками плазмы составляет около 50%. Препарат способен проникать через плацентарный барьер; его можно обнаружить в околоплодной жидкости. Указанные свойства ограничивают его применение при беременности. Выводится препарат в основном почками, в неизмененном виде — через кишечник.
Исходя из фармакологических свойств препарата его назначают при различных заболеваниях органов дыхания, которые сопровождаются вязкой, трудноотделяемой мокротой. Успешно NAC применяется при острых состояниях: ОРВИ, бронхиты, бронхиолиты, пневмонии, осложнения в виде ателектазов. При хронических бронхолегочных процессах на фоне врожденной и наследственной патологии органов дыхания, таких как муковисцидоз, синдром Зиверта— Картагенера, бронхоэктазы, пороки развития бронхов, иммунодефицитные состояния, цилиарная дискинезия, NAC входит в состав базисной терапии как муколитик. У больных бронхиальной астмой препарат та же имеет свои показания к применению в случае развития осложнений. Фтизиатры широко используют NAC при активном респираторном компоненте заболевания. Кроме того, препарат успешно применяется при ЛОР-патологии (отиты, синуситы, риниты) [14].
NAC имеет также ряд противопоказаний: прежде всего это гиперчувствительность к ацетилцистеину, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, кровохарканье, легочное кровотечение или риск его возникновения, беременность, кормление грудью.
С осторожностью следует применять препарат при варикозном расширении вен пищевода, бронхиальной астме, заболеваниях надпочечников, печеночной и(или) почечной недостаточности.
В редких случаях наблюдаются головная боль, воспаление слизистой оболочки рта (стоматит), шум в ушах; крайне редко - понос, рвота, изжога и тошнота, что возможно в случае передозировки. В единичных случаях наблюдаются аллергические реакции - такие, как спазмы дыхательных путей (бронхоспазм; в частности у пациентов с гиперреактивностью бронхов при бронхиальной астме или ингаляционном введении через небулайзер), а также падение артериального давления, увеличение частоты сердечных сокращений (тахикардия), кожная сыпь, зуд и крапивница.
Несмотря на то, что препарат известен давно и успешно применяется, на практике часто допускаются ошибки. При работе с препаратом необходимо пользоваться стеклянной посудой и избегать контакта с металлами, резиной, кислородом, легко окисляющимися веществами из-за активности сульфгидрильной группы молекулы ацетилцистеина, которая может быстро вступать в различные химические реакции, снижая эффективность препарата.
Обычно суточную дозу препарата рассчитывают по 10—20 мг на 1 кг веса больного или по возрасту:
- для взрослых и подростков старше 14 лет: 2—3 раза в день по 200 мг ацетилцистеина (по 400—600 мг в день);
- детям в возрасте от 6 до 14 лет: 3 раза в день по 100 мг ацетилцистеина или 2 раза в день по 200 мг ацетилцистеина (300—400 мг в день);
- детям в возрасте от 2 до 5 лет: 2—3 раза в день по 100 мг ацетилцистеина (200—300 мг в день),
- дети в возрасте от 1 года до 2 лет: 2—3 раза в день по 50 мг ацетилцистеина (100—150 мг в день).
Ацетилцистеин разрешен для новорожденных и детей до 1 года жизни, однако применяют его исключительно по жизненным показаниям под строгим врачебным контролем из-за того, что у детей данного возраста не всегда можно эффективно провести дренаж.
Рекомендуемую дозу (10 мг на 1 кг веса в день) в обычной педиатрической практике изменять нельзя. Исключение составляют больные муковисцидозом.
При муковисцидозе NAC назначается из расчета 30 и более мг на кг веса больного в день, чтобы добиться полного муколитического эффекта.
Случаи передозировки в педиатрической практике описаны, как случаи гиперсекреции у детей грудного возраста. Побочные действия, угрожающие жизни и здоровью, не описаны. В случае передозировки (диспепсические расстройства) назначают симптоматическую терапию.
Очень важно соблюдать режим приема NAC последний прием не позже 18 часов, чтобы успеть после наступления муколитического эффекта (через 30—45 мин) перед сном провести эффективный дренаж бронхиального дерева. Прием NAC непосредственно перед сном, что очень часто назначается докторами и выполняется родителями, является серьезной тактической ошибкой, так как при дренажном положении (лежа в постели) после приема NAC начинается активное отхождение мокроты, появляется кашель, ночь проходит в беспокойстве, что усиливает физические и психологические страдания больного.
Поэтому важно также через 30 мин или через 1 ч после приема NAC организовать дренаж бронхиального дерева, откашляться, сделать дыхательную гимнастику; это также является активной терапией подобных состояний [17]. Особую осторожность следует соблюдать при использовании NAC у маленьких детей, так как муколитический эффект достигается быстро и легко; после этого необходимо тщательно провести дренаж и освободить легкие от разжиженной мокроты, что у малышей организовать довольно трудно.
Все эти тактические ошибки создают миф о «заболачивании» легких при использовании NAC. Поэтому необходимо соизмерять дозировку препарата и возраст больного, подробно объяснить родителям, в чем заключается действие препарата, какие эффекты возможны и, главное, почему необходим дренаж легких после приема NAC и как его проводить.
До недавнего времени препараты ацетилцистеина были представлены только в форме шипучих таблеток и гранул для приготовления раствора, что не совсем подходило для лечения детей младшего возраста, а потому ограничивало применение этих высокоэффективных муколитиков в педиатрической практике. Сегодня на рынке лекарств появилась новая, широко востребованная в педиатрической практике лекарственная форма ацетилцистеина — препарат АЦЦ (компания «Сандоз») в гранулах для приготовления сиропа (в 5 мл сиропа 100 мг ацетилцистеина); она легко дозируется, особенно для детей младше 2 лет. Данная лекарственная форма не содержит сахара и спирта, имеет приятные органолептические свойства, охотно принимается детьми. Флакона, как правило, хватает на 1 полный курс лечения.
Следует помнить, что при применении препаратов на основе ацетилцистеина дополнительный прием жидкости усиливает их муколитический эффект.
При внезапных кратковременных простудных заболеваниях длительность приема обычно составляет 5—10 дней. При хроническом бронхите и муковисцидозе препарат следует принимать более длительное время (с целью профилактики инфекций; под врачебным контролем).
Ацетилцистеин является активным веществом, и поэтому очень важно знать, как он взаимодействует с другими лекарственными средствами. Например, препарат усиливает действие бронхолитиков (на практике такое сочетание встречается довольно часто). Одновременный прием ацетилцистеина и глицеролтринитрата (нитроглицерин) может привести к усилению сосудорасширяющего и разжижающего кровь эффектов глицеролтринитрата.
Частой ошибкой является одновременное применение ацетилцистеина и противокашлевых средств. Поскольку из-за подавления кашлевого рефлекса может возникнуть опасный застой слизи, подобных комбинаций следует избегать.
Антибиотики рекомендуется принимать не ранее чем через 2 ч после приема внутрь ацетилцистеина, чтобы не уменьшать их всасывание.
Терапия с использованием секретолитических и секретомоторных средств всегда носит патогенетический характер, но достигаемый эффект существенно зависит от сопутствующих факторов; в целом анализ эффективности муколитического средства затрудняет именно необходимость учитывать большое число указанных факторов.
В качестве критериев эффективности терапии отхаркивающими средствами на практике обычно выступают:
- динамика кашлевого дренажа — продуктивность кашля, временной интервал, в течение которого сухой кашель трансформировался в продуктивный;
- динамика аускультативных изменений в легких;
- частота бактериальных осложнений;
- продолжительность периода болезни, при котором сохраняется обструкция на одном из участков респираторного тракта.
Таким образом, муколитический препарат прямого типа действия, включающий различные лекарственные формы NAC, сочетая в себе дополнительно антиоксидантное и антитоксическое свойства, является эффективным и безопасным средством терапии острых и хронических заболеваний верхних и нижних дыхательных путей, которые сопровождаются образованием вязкой слизи. NAC нормализует реологические свойства бронхиального секрета, облегчает отделение мокроты, предотвращает мукостаз и улучшает мукоцилиарный клиренс, уменьшает симптомы интоксикации. Различные лекарственные формы препарата позволяют успешно применять его как у детей, в том числе младшего возраста, так и у взрослых.
Литература
- Белоусов Ю.Б., Омельяновский В.В. Клиническая фармакология болезней органов дыхания / Справ. рук-во. - М., 1996. С. 144-147.
- Бронхиты у детей / Пособие для врачей / Под ред. В.К.. Таточенко. - М., 2004. - 89 с.
- Критерии диагностики и принципы лечения рецидивирующих и хронических заболеваний легких у детей / Пособие для врачей. - В.К.. Таточенко, И.К.. Волков, С.В. Рачинский и др. - М., МЗ РФ и НЦЗД РАМН, 2001. - 23 с.
- Маев И.В., Бусарова Г.А. Муколитические средства в хронической обструктивной болезни легких//Леч. врач.-2003; 1.
- Мукоактивная терапия / Под ред. А.Г. Чучалина, А.С. Белевского. - М.: Атмосфера, 2006. -127 с.
- Нурмухамедов Р.Х. Простуда // Consilium provisorum.-2001; 1 (1): 15-18.
- Практическая пульмонология детского возраста (справочник) / Под ред. В.К. Таточенко. - М., 2000. - С. 26-29, 57-62,183-192.
- Рачинский С.В. и соавт. Бронхиты у детей. - Л.: Медицина, 1978. - 211 с.
- Российский национальный педиатрический формуляр / Под ред. А.А. Баранова. - М.: ГЭОТАР-Медиа, 2009. - 912 с.
- Самсыгина Г.А.. Лечение кашля у детей (лекция) // Журн. Педиатрия им. Г.Н. Сперанского. - 2004; 3.
- Симонова О.И. Дорназа альфа: три клинических эффекта // Педиатрич. фармакол. - 2008; 5 (2). С. 26-32.
- Синопальников А.И., Клячкина И.Л. Место муколитических препаратов в комплексной терапии болезней органов дыхания // Рос. мед. вести, 1997; 2 (4): 9-18.
- Сорока Н.Д. Муколитическая терапия затяжных вариантов течения заболеваний органов дыхания у детей // Вопр. соврем. педиатрии. - 2008; 7 (4): 111-115.
- Таточенко В.К. и др. Острые заболевания органов дыхания у детей. - М.: Медицина, 1981. - 206 с.
- Федосеев Г.Б., Емельянов А.В., Тимчик В.Г. Отхаркивающие препараты как средства для лечения обструктивных заболеваний легких // Новые Санкт-Петербургские врачебные ведомости. -1997; 21.
- Хронические обструктивные болезни легких / Федеральная программа. -М., 1999:15-36.
- Хрущев С.В., Симонова О.И. Физическая культура детей с заболеваниями органов дыхания. Уч. пособ. - М.: Медицина. 2006. - 304 с.
- Чучалин А.Г. Клинические рекомендации по хронической обструктивной болезни легких. - М., 2001.
- Шмелев Е.И. Патогенез воспаления при хронических обструктивных болезнях легких. - В кн.: Хронические обструктивные болезни легких / Под ред. А.Г. Чучалина. -М., 1998:82-92.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: NHLBI/WHO Workshop. 2001:19.
- Korppi, M., Laurikainen, K., et al. Antitussives in the treatment of acute transient cough in children //Acta Paediatrica Scandinavica. -1991; 80: 969-971.
- Kupczyk M., Kuna P.. Mucolytics in acute and chronic respiratory tract disorders. II. Use for treatment and antioxidant properties // Pol Merkuriusz Lek, 2002, Mar. 12 (69): 248-52.
| Февраль 2010 г. |