Опубликовано в журнале:
«Фарматека», 2010, № 12, с. 55-61Вегетативная невропатия при сахарном диабете: клинические проявления, диагностика и лечение
А.Н. Баринов1, М.В. Новосадова2
1Первый Московский государственный университет им И.М. Сеченова, Москва
2OOO “Адирион”Рассматривается проблема периферических невропатий, причиной которых могут быть разнообразные этиологические факторы. Самой частой причиной вегетативной невропатии (ВН) является сахарный диабет, при этом инвалидизация и летальные исходы у больных диабетом в основном обусловлены кардиоваскулярными осложнениями ВН. Представлены клиническая характеристика кардиоавскулярной ВН, методы диагностики и принципы терапии вегетативной дисфункции. Лечение ВН представляет собой сложную медико-социальную проблему, требующую максимального участия в процессе лечения самого пациента, а также создания окружающими необходимых условий для реабилитации на фоне проводимой патогенетической (тиоктовая кислота) и симптоматической (минералкортикоиды, симпатомиметики) терапии. Ключевые слова: вегетативная невропатия, сахарный диабет, кардиоваскулярная вегетативная невропатия, тиоктовая кислота
The article is dedicated to the problem of autonomic neuropathy, which may be caused by variety of etiological factors. The most common cause of autonomic neuropathy (AN) is diabetes mellitus, and disability and death in diabetic patients are mainly due to cardiovascular complications of AN. The clinical characteristics of cardiovascular AN, methods of diagnosis and principles of treatment of autonomic dysfunction are presented. The treatment of AN is a complex medico-social problem that requires maximum participation of the patient in the treatment, as well as the creation of necessary conditions for rehabilitation against the background of the pathogenetic (tioctic acid) and symptomatic (mineralocorticoides, sympathomimetics) therapy. Key words: autonomic neuropathy, diabetes mellitus, cardiovascular autonomic neuropathy, tioctic acid
Большинство периферических полиневропатий сопровождается клиническими или субклиническами признаками дисфункции вегетативной нервной системы (ВНС). Наиболее часто поражение ВНС развивается при невропатиях “малых волокон”, когда преимущественно поражаются тонкие, плохо миелинизированные А-дельта нервные волокна и немиелинизированные С-волокна [16]. ВНС регулирует функцию висцеральных органов, гладкой мускулатуры сосудистой стенки, эндокринных и экзокринных желез, иммунной системы и трофику мягких тканей. Симптомы ее поражения включают сердечно-сосудистые, желудочно-кишечные, мочеполовые и терморегуляторные расстройства, а также трофические нарушения, псевдопарезы и дизрегуляцию зрачка.
Различают следующие периферические вегетативные невропатии:
- диабетическую;
- амилоидную;
- синдром Гийена–Барре;
- острые и подострые автономные невропатии;
- аутоиммунные и паранеопластические невропатии: анти-Hu-антитела (1-й тип анти-нейрональных нуклеаоных антител, ANNA-1); антитела к клеткам Пуркинье 2-го типа (PCA-2); CRMP-5 (Collapsin response mediator protein 5); нейрональные антитела к никотиновым и ацетилхолиновым рецепторам; антитела к кальциевым каналам P/Q-типа; антитела к ацетилхолиновым рецепторам;
- паранеопластические невропатии, связанные с заболеваниями соединительной ткани (болезнь Шегрена, системная красная волчанка, ревматоидный артрит, смешанные заболевания соединительной ткани);
- наследственные невропатии: наследственные сенсорно-вегетативные невропатии, болезнь Фабри, невропатия индейцев Навахо, болезнь Танжера, множественная эндокринная неоплазия (тип 2b);
- невропатии при инфекциях (болезнь Чага, ВИЧ-инфекция, ботулизм, лепра, дифтерия): токсические невропатии (органические растворители, акриламид, соли тяжелых металлов, вакор, винкристин, цисплатин, паклитаксел, доксорубицин, цитозин арабинозид, амиодарон, пентамидин, препараты золота, подофиллин, токсины морских гадов).
Сахарный диабет (СД) является самой частой причиной вегетативной невропатии (ВН) [2–6]. При этом в популяции больных СД типа 1 достоверная ВН выявляется у 8,5 %, а вероятная –у 16,8 % больных; при СД типа 2 – у 12,2 и 22,1 % больных соответственно [9]. Показано, что факторами риска развития ВН являются длительное течение СД, плохой контроль уровня гликемии и мужской пол [5, 15, 19, 25]. Кардиоваскулярные осложнения ВН являются одними из главных причин инвалидизации и летальных исходов у больных СД. Наличие у больных СД признаков ВН увеличивает риск развития диабетической стопы и связанных с ней осложнений [13]. С момента появления клинической симптоматики ВН ожидаемая смертность среди больных СД в течение следующих 5 лет составляет 50 %.
Экспериментально подтвержденные связи между предрасположенностью к летальным аритмиям и признаками повышенной симпатической или пониженной парасимпатической активности стимулировали развитие исследований количественных показателей вегетативной активности для ранней диагностики ВН. В настоящее время выявлена существенная взаимосвязь между состоянием ВНС и смертностью от сердечно-сосудистых заболеваний, включая внезапную смерть [20, 23, 24, 27].
Клинические проявления кардиоваскулярной ВН
Основными клиническими проявлениями кардиоваскулярной ВН являются постоянная умеренная тахикардия и фиксированный пульс, ортостатическая гипотензия, безболевая ишемия и инфаркт миокарда, снижение циркадных влияний на вегетативную функцию, повышение риска возникновения сердечных аритмий вследствие увеличения симпатических влияний, диабетическая кардиомиопатия и нарушение функции миокарда, осложнения при анестезии и операции в виде неожиданной остановки дыхания и сердцебиения [2, 11, 26, 28]. Развитие тахикардии в начале заболевания связано с поражением блуждающего нерва при относительном преобладании активности симпатического отдела ВНС [22]. По мере прогрессирования ВН снижается активность и симпатического отдела, что может сопровождаться исчезновением тахикардии. На этой стадии отмечается отсутствие тахикардии, а в ответ на функциональные пробы и эмоциональный стресс выявляется т. н. денервированное сердце.
Безболевая ишемия или безболевой инфаркт миокарда регистрируются в 45–65 % случаев ВН по сравнению с 4 % у пациентов с СД без признаков ВН. Отсутствие характерных клинических признаков нарастающей ишемии является фактором риска формирования инфаркта миокарда и внезапной смерти. Механизм развития безболевой ишемии комплексный. В основе его лежит дисфункция кардиальных афферентных нервных волокон и измененный порог болевой чувствительности. Показано, что кардиальная форма ВН является четким прогностическим критерием безболевой ишемии миокарда [27]. Наличие кардиоваскулярной ВН является прогностически неблагоприятным признаком для развития терморегуляторных и сосудомоторных нарушений [29], мочеполовых расстройств [30] и других осложнений СД, например диабетической ретинопатии [10].
Методы диагностики вегетативной дисфункции
Ввиду высокой медико-социальной значимости кардиоваскулярной ВН выявление вегетативной дисфункции является одной из наиболее приоритетных задач современной диабетологии. Существует ряд опросников [7, 17] вегетативной дисфункции (см. таблицу), но все они являются субъективными, поэтому данные, полученные при использовании опросников, носят ориентировочный характер и не могут использоваться для верификации диагноза ВН.
Таблица Шкала невропатических симптомов и изменений
Симптом Да/нет Степень тяжести (+), (++), (+++) Изменения симптома (без, лучше, хуже), изменения (+), (++), (+++), (-), (--), (---) Вегетативные (автономные) симптомы 1) предобморочное или обморочное состояние при вставании или долгом стоянии, которое не связано с приемом сосудорасширяющих препаратов или психологическими стрессами (например, видом крови) 2) повторяющаяся тошнота с рвотой непереваренной пищей, особенно по утрам, не связанная с желудочно-кишечными заболеваниями 3) персистирующая диарея, особенно ночью, не связанная с заболеваниями кишечника 4) потеря контроля над мочевым пузырем, не связанная с гинекологическими проблемами у женщин или заболеваниями предстательной железы у мужчин 5) потеря контроля над прямой кишкой, не связанная с ее заболеваниями 6) отсутствие эрекции, не связанное с приемом лекарств или операцией на предстательной железе 7) отсутствие эякуляции, не связанное с приемом лекарств или операцией на предстательной железе 8) сухость глаз, не связанная с лекарственными препаратами или глазными болезнями 9) сухость во рту, не связанная с приемом лекарств или заболеваниями полости рта Шкала представляет собой заполняемую врачом анкету, в которой каждый симптом оценивается по ряду характеристик:
- Наличие конкретного симптома – в анкете на этот вопрос отвечают однозначно “да” или “нет”, зачеркивая соответствующий квадрат.
- Степень выраженности симптома – исследователь определяет степень выраженности симптома у данного больного: (+) – симптом слабо выражен; (++) – умеренная степень выраженности; (+++) – значительная выраженность симптома.
- Изменения симптома – исследователь определяет динамику симптома как улучшение: (+) – незначительное; (++) – умеренное; (+++) – значительное); ухудшение: (-) – незначительное; (--) – умеренное; (---) – значительное или без изменений.
Для более точной диагностики этого заболевания применяются инструментальные методы исследования. Наиболее характерными признаками кардиоваскулярной ВН на ЭКГ являются: дисперсия интервала ST, удлинение интервала QT, инверсия положительного зубца Т, псевдокоронарный подъем сегмента ST [18]. Однако эти изменения ЭКГ появляются на поздних стадиях заболевания, когда терапия ВН уже малоэффективна.
Для проведения начальной диагностики ВН наиболее широкое распространение получил метод пяти стандартных тестов по Ewing D.J. [14, 19]. Этот метод удовлетворяет как клиническим, так и научным требованиям [25]:
- Изменение частоты сердечных сокращений (ЧСС) при медленном глубоком дыхании (6 в минуту). Наблюдаемые в норме ускорение ЧСС на вдохе и урежение на выдохе исчезают по мере прогрессирования недостаточности парасимпатической иннервации сердца. Разница между минимальной и максимальной ЧСС в 10 ударов и менее (норма >15) свидетельствует о нарушении парасимпатической иннервации сердца.
- Тест Вальсальвы. При повышении внутрилегочного давления (пациент натуживается при дыхании в мундштук, соединенный с манометром, с целью поддержания давления в спирометре на уровне 40 мм рт. ст. в течение 10–15 секунд) в норме ЧСС увеличивается с последующей компенсаторной брадикардией. При нарушении парасимпатической регуляции сердечной деятельности этот феномен выпадает. Величина отношения максимального RR-интервала в первые 20 секунд после пробы к минимальному интервалу RR во время пробы менее 1,2 свидетельствует о наличии у больного ВН.
- Тест Шелонга (ортостатическая проба). Пациент спокойно лежит на спине в течение 10 минут, после чего измеряется артериальное давление (АД). Затем пациент встает, и АД измеряется на 2-й, 4-й, 6-й, 8-й и 10-й минутах. Снижение АД на 30 мм рт. ст. и более считается патологическим и свидетельствует о ВН с нарушением симпатической иннервации (норма < 10 мм рт. ст.).
- Тест 30 : 15. Тест основан на учащении ЧСС при вставании с максимальным значением к 15-му удару с последующим урежением ритма с минимальным значением к 30-му удару. Отношение 15-го RR-интервала к 30-му с момента начала вставания при ортопробе ниже 1,0 является диагностическим критерием ВН (норма > 1,04).
- Проба с изометрической нагрузкой. При сжатии динамометра в течение 3 минут до трети максимальной силы руки отмечается подъем диастолического АД. Повышение диастолического АД менее чем на 10 мм рт. ст. говорит о ВН с недостаточной симпатической иннервацией (норма > 16 мм рт. ст.).
Использование данных тестов считается достаточным для выявления раннего, субклинического поражения ВНС, в связи с чем они более десятилетия используются как “золотой стандарт” для диагностики ВН [21].
Ввиду недостаточной чувствительности и специфичности вышеуказанных методик (нормальные показатели вышеуказанных тестов значительно варьируются в зависимости от возраста, пола и индекса массы тела испытуемых) может использоваться усовершенствованный вариант диагностики ВН – количественное вегетативное тестирование (КВТ). В основе КВТ лежит методика регистрации и оценки высокочастотных дыхательных колебаний сердечного ритма, предложенная Wheeler and Watkins [33]. Обследуемый лежит спокойно, проводится фоновая запись ЭКГ. Затем по команде пациент дышит глубоко и регулярно с частотой шесть раз в минуту (5 секунд вдох и 5 секунд выдох). КВТ представляет собой исследование вариабельности ритма сердца, выполняемое синхронно с глубоким дыханием частотой 6 дыхательных циклов в минуту. При такой частоте дыхания в наибольшей степени стимулируется блуждающий нерв, поэтому проба используется для оценки реактивности парасимпатического отдела ВНС. При данном варианте проведения пробы оценивается разница между максимальной и минимальной ЧСС во время дыхательного цикла или экспираторно-инспираторное отношение.
У здоровых людей интервал времени от начала цикла одного сердечного сокращения до начала другого не является одинаковым, он постоянно меняется. Первым это обнаружил Haller в 1760 г. Периодические составляющие вариабельности ритма сердца, выделенные на основании кратковременных записей в состоянии покоя, представлены высокочастотными, низкочастотными и очень низкочастотными колебаниями, как правило имеющими периодичность в 0,2–0,4, 0,04–0,15 и 0,003–0,040 Гц соответственно. Для их обнаружения наиболее оптимальной является процедура спектрального анализа ритма сердца с использованием преобразования Фурье. Низкочастотные колебания связаны с активностью постганглионарных симпатических волокон и отражают модуляцию сердечного ритма симпатической нервной системой. Генез очень низкочастотных колебаний до сих пор неясен и, вероятнее всего, связан с влиянием надсегментарных (в первую очередь гипоталамических) центров вегетативной регуляции. Высокочастотные колебания сопряжены с дыханием и отражают преимущественно влияние парасимпатической системы на сердечную мышцу. Именно эти высокочастотные колебания и подвергаются анализу в процессе КВТ.
Проведение КВТ имеет ряд методологических особенностей. Существует линейная связь между изменчивостью сердечного ритма и объемом легких: величина экспираторно-инспираторного отношения возрастает с увеличением глубины дыхания. Однако не следует требовать слишком больших усилий от обследуемого, т. к. это может привести к активации не парасимпатического, а симпатического отдела ВНС. С ростом частоты дыхания экспираторно-инспираторное отношение падает (включаются симпатические модулирующие влияния). Резонансной в системе сердце–легкие является частота дыхания 5–6 циклов в минуту.
Проявления ВН затрагивают оба эфферентных звена ВНС – симпатические и парасимпатические нервные волокна, однако с учетом более раннего и более значимого поражения парасимпатических нервных волокон при СД количественную оценку состояния ВНС при диабетической ВН целесообразно проводить именно по низкочастотному компоненту вариабельности сердечного ритма. Обладая высокой чувствительностью и селективностью, методика КВТ позволяет диагностировать ВН уже на доклиническом этапе и количественно (в перцентилях) определять степень вегетативного дефицита, что особенно важно для контроля эффективности лечения [22]. КВТ может использоваться для раннего выявления дисфункции тонких волокон при ВН наряду с такими ультрасовременными методами диагностики, как конфокальная микроскопия [31].
Принципы лечения ВН
Несмотря на огромные достижения в понимании патогенеза и развитии методов диагностики поражения периферических нервов, проблема лечения ВН остается в центре внимания клиницистов и фармакологов. До настоящего времени не разработано метода лечения, который стал бы “золотым стандартом” терапии ВН [32].
Базисная терапия ВН при СД кардинально не отличается от терапии сенсомоторной диабетической полиневропатии. На первом месте по значимости стоит компенсация СД. Гипергликемия запускает каскад метаболических и сосудистых нарушений, вызывающих развитие сенсомоторной диабетической невропатии и ВН. В связи с этим первоочередной задачей должно быть снижение уровня сахара до величин, близких к норме [15]. Однако даже жесткий контроль уровня гликемии не всегда гарантирует отсутствие осложнений СД со стороны нервной системы [15, 32].
При гипергликемии множество процессов (оксидативный стресс, усиленное образование конечных продуктов избыточного гликирования белков; активация перекисного окисления липидов, индуцибельной NO-синтазы) приводит к избыточному образованию свободных радикалов – молекул, обладающих повышенной реагентной способностью. Свободные радикалы нарушают целостность клеточных структур, в первую очередь эндотелия, вызывая эндоневральную гипоксию и приводя к развитию невропатии при диабете. Активность собственной антиоксидантной системы организма (“ловушки” свободных радикалов – супероксиддисмутаза, каталаза, глутатион и др.) при диабете снижается, что обусловливает необходимость применения экзогенных антиоксидантов для преодоления окислительного стресса. Первое место среди антиоксидантов и вообще препаратов, использующихся для патогенетического лечения диабетической невропатии, сегодня занимает α-липоевая (тиоктовая) кислота – естественный липофильный антиоксидант. Оптимальным в начале лечения считается внутривенное капельное введение тиоктовой кислоты (600 мг на 200 мл физиологического раствора) в течение 15 дней с последующим приемом 600 мг препарата в виде таблеток один раз в сутки за 30–40 минут до еды в течение 3 месяцев [1, 8, 12, 35].
К сожалению, необходимость многократного внутривенного введения препарата снижает приверженность пациентов лечению, поэтому появление представителя нового поколения тиоктовой кислоты – Тиоктацида БВ (быстрого всасывания) – дало возможность повысить комплаентность терапии. Улучшение фармакокинетики препарата (через 20 минут достигается пик в плазме крови) и снижение коэффициента вариабельности (рис. 1) уровня тиоктовой кислоты в плазме крови (с 59 до 22 % по сравнению с первым поколением Тиоктацида) позволяют заменить внутривенное введение препарата таблетированной формой Тиоктацида БВ в случаях умеренной вегетативной невропатии без выраженного синдрома мальабсорбции. Причем дозировка Тиоктацида БВ сохраняется прежней – 600 мг в сутки. Таким образом, с помощью БВ-формы становится возможным преодолеть резистентность к лечению полиневропатий Тиоктацидом в случаях, связанных с недостаточной абсорбцией препарата [36]. Вышеуказанные данные не могут быть экстраполированы на другие (генерические) аналоги тиоктовой кислоты, т. к. их эффективность не была подтверждена двойными слепыми рандомизированными плацебо-контролируемыми исследованиями по стандартам GCP, а главное – генерики тиоктовой кислоты до сих пор создаются с применением старых технологий, не предусматривающих БВ-форм таблетированных препаратов.
Рис. 1. Сравнение таблетированной формы 1 и 2 поколения - эффект оптимизации фармакокинетики
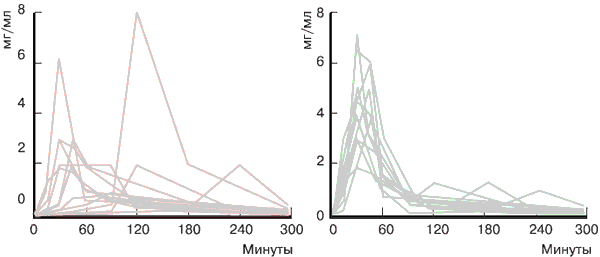
а) уровень тиоктовой кислоты в плазме крови здоровых добровольцев, при приеме 600 мгТиоктацида 1 поколения, произведенного по старой технологии. Коэффициент вариабельности уровня тиоктовой кислоты в плазме крови составляет 59 %.
б) уровень тиоктовой кислоты в плазме крови здоровых добровольцев, при приеме 600 мгТиоктацида БВ. Коэффициент вариабельности уровня тиоктовой кислоты в плазме крови составляет 22 %, пик в плазме крови достигается через 20 минутСобственный опыт
Наш собственный опыт включает динамическое наблюдение за 120 пациентами с СД типов 1 и 2 и периферической сенсомоторной невропатией на предмет наличия и оценки степени выраженности кардиоваскулярной ВН. КВТ проводилась с помощью прибора CASE IV в рамках исследования SYDNEY I [1, 12]. У 41 пациента была выявлена выраженная вегетативная кардиоваскулярная ВН с результатами 0–1 перцентиль, у 5 – умеренная ВН с результатами от 2 до 5 перцентилей. Таким образом, представленность кардиоваскулярной ВН в группе пациентов с диагностированной периферической полиневропатией оказалась достаточно высокой – более 34 %. Такая высокая распространенность ВН в исследуемой группе с неравномерным распределением в сторону более тяжелого течения может объясняться строгими критериями включения пациентов в исследование (выраженные нейрофизиологические изменения по данным электронейромиографии или КВТ).
В дальнейшем пациенты были рандомизированы в 2 группы и в течение 3 недель получали курс лечения либо Тиоктацидом в дозе 600 мг, либо плацебо внутривенно капельно в ходе двойного слепого рандомизированного клинического исследования SYDNEY I [1, 12]. Двадцать два пациента группы выраженной невропатии получали плацебо и 19 – Тиоктацид. Из пяти человек с умеренной кардио-васкулярной ВН один пациент был в группе плацебо и четыре – в группе Тиоктацида. Повторное КВТ проведено через 4 недели после первого теста. В группе с выраженной кардиоваску-лярной ВН наблюдались следующие результаты: из 19 больных, получавших Тиоктацид, улучшение выявлено у 5 (26,3 %), причем у 2 пациентов параметры КВТ изменились до нормальных показателей. Из 22 больных, находившихся в группе плацебо, улучшение выявлено у 2 (9 %) человек. В группе пациентов, получавших Тиоктацид, не наблюдалось отрицательной динамики показателей КВТ за 4 недели, в то время как в группе плацебо ухудшение параметров было выявлено у 3 пациентов.
В группе умеренной ВН (5 человек) у 1 пациента, получавшего плацебо, никаких изменений выявлено не было, в то время как у 2 из 4 больных, получавших Тиоктацид, наблюдалась положительная динамика с нормализацией показателей количественного тестирования.
Таким образом, результаты проведенного обследования продемонстрировали улучшение параметров вариабельности сердечного ритма на фоне проведения инфузионной терапии Тиоктацидом в дозе 600 мг/сут в течение 15 дней, что объективно свидетельствует об уменьшении выраженности кардиоваскулярной ВН.
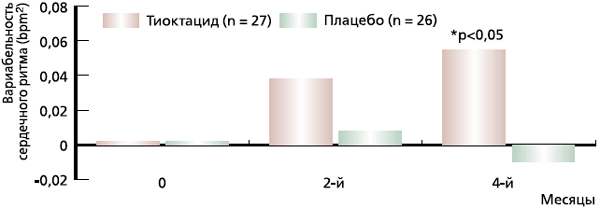
Наши результаты коррелируют с таковыми рандомизированного плацебо-контролируемого исследования DEKAN (рис. 2), в котором было продемонстрировано улучшение вариабельности сердечного ритма у пациентов с ВН при СД типа 2 на фоне лечения Тиоктацидом в таблетированной форме в дозе 800 мг/сут в течение 4 месяцев [34].
Рис. 2. Изменение вариабельности сердечного ритма у больных диабетической вегетативной невропатией в динамике на фоне приема 800 мг/сутТиоктацида или плацебо в ходе двойного слепого рандомизированного плацебо-контролируемого исследования DEKAN
Наиболее сложной задачей терапии ВН является симптоматическое лечение ортостатической гипотензии, встречающейся у 1,0–3,4 % больных СД. Для симптоматической терапии этого состояния используют минералокортикоиды (флудрокортизон в дозе 0,1–1,0 мг/сут). К препаратам второго ряда, применяемым в качестве дополнительной терапии ВН при неэффективности флудрокортизона или в качестве монотерапии при невозможности его применения, относят симпатомиметики (эфедрин, фенилпропаноламин, фенилэфрин, метилфенидат, декстроамфетамин, тирамин, мидодрин, клонидин, иохимбина гидрохлорид, DL-дегидроксифенилсерин). Синтетические аналоги вазопрессина (десмопрессин, лизин-вазопрессин), Эритропоэтин (эпоэтин бета), кофеин и ингибиторы циклооксигеназы (индометацин, флурбипрофен, ибупрофен, напроксен) относят к дополнительным препаратам, не используемым в качестве монотерапии [2].
Существуют нефармакологические методы лечения этого состояния:
- медленное, постепенное изменение положения тела;
- избегание напряжения, натуживания и изометрических упражнений;
- использование компенсаторных физических упражнений;
- отмена антигипертензивных лекарственных средств;
- сон на кровати с приподнятым головным концом;
- диета с высоким содержанием натрия (поваренной соли);
- специально разработанные комбинезоны, сдавливающие нижнюю часть тела.
Заключение
Таким образом, лечение ВН представляет собой сложную медикосоциальную проблему, требующую максимального участия в процессе лечения самого пациента, а также создание окружающими необходимых условий для реабилитации на фоне проводимой патогенетической (тиоктовая кислота – Тиоктацид) и симптоматической (минералкортикоиды, симпатомиметики) терапии.
ЛИТЕРАТУРА
1. Аметов А.С., Строков И.А., Баринов А.Н., и др: Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. № 11(88). C. 69–73.
2. Баринов А.Н., Строков И.А. Диабетическая невропатия // Неврологический журнал. 2000. Т 5. № 5. С. 47–55.
3. Котов С.В., Калинин А.П., Рудакова И.Г. Диабетическая невропатия. М., 2000. С. 71.
4. Прихожан В.М. Нарушения иннервации внутренних органов при сахарном диабете // Сов. Медицина 1978. № 6. С. 99–104.
5. Прихожан В.М. Особенности развития диабетической невропатии в зависимости от пола больных сахарным диабетом // Пробл. эндокринологии. 1977. Т. 23. № 5. С. 11–6.
6. Прихожан В.М. Поражение нервной системы при сахарном диабете. М., 1981. С. 296.
7. Строков И.А., Баринов А.Н., Новосадо-ва М.В., Яхно Н.Н. Клинические методы оценки тяжести диабетической полиневропатии // Неврологический журнал. 2000. Т 5. № 5. С. 14–9.
8. Строков И.А., Манухина Е.Б., Бахтина Л.Ю. и соавт. Состояние эндогенных протекторных систем у больных с инсулинзависимым сахарным диабетом с полиневропатией: эффект антиоксидантной терапии // Бюллетень экспериментальной биологии и медицины. 2000. Т 130. № 10. С. 437-41.
9. Табеева Г.Р., Азимова Ю.Э. Антиоксидантная терапия диабетической полинейропатии // Фарматека 2010. № 7(201). C. 48-52.
10. Anan F. Diabetic retinopathy is associated with insulin resistance and cardiovascular autonomic dysfunction in type 2 diabetic patients. Hypertens Res 2009;32(4):299-05.
11. Collado Marquez S. Diabetic autonomic neuropathy diagnosed in primary care in patients with type 2 diabetes. Aten Primaria 2008;40(10):511-15.
12. Dyck PJ, Ametov AS, Barinov AN, et al: The sensory symptoms of diabetic polyneuropathy are improved with a-lipoic acid. Diabetes Care 2003;26(3):770-76.
13. Elliott J. Large-fiber dysfunction in diabetic peripheral neuropathy is predicted by cardiovascular risk factors. Diabetes Care 2009;32(10):1896-900.
14. Ewing DJ, Martin CN, Young RJ, Clarke BF. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care 1985;8:491-98.
15. Factors in development of diabetic neuropathy. Baseline analysis of neuropathy in feasibility phase of Diabetic Control and Complications Trial (DCCT). Diabetes. 1988;37:476–81.
16. Freeman R. Autonomic Peripheral Neuropathy. Neurol Clin. 2007;25(1):277–301.
17. Grant. JA, O’Brien P, Dyck PJ. Neuropathy test and normative results. Diabetic Neuropathy. Philadelphia. 1999:123–34.
18. Javorka M. Recurrences in heart rate dynamics are changed in patients with diabetes mellitus. Clin Physiol Funct Imaging. 2008; 28(5):326–31.
19. Lacigov AS. Could we predict asymptomatic cardiovascular autonomic neuropathy in type 1 diabetic patients attending out-patients clinics? Wien Klin Wochenschr 2007;119(9–10): 303–08.
20. Lacigova S. Influence of cardiovascular auto-nomic neuropathy on atherogenesis and heart function in patients with type 1 diabetes. Diabetes Res Clin Pract 2009;83(1):26–31.
21. Lambrecht R. Evaluation of a brief cardiovascular autonomic screen. Auton Neurosci 2007;131(1–2):102–06.
22. Low PA, Walsh JC, Huang CY, et al. The sympathetic nervous system in diabetic neuropathy: a clinical and pathological study. Brain 1975;98:341–56.
23. Maser RE, Mitchell BD, Vinik AI, et al. The association between cardiovascular auto-nomic neuropathy and mortality in individuals with diabetes: a meta-analysis. Diabetes Care 2003;26(6):1895–901.
24. Maser RE, Pfeifer MA, Dorman JS, et al. Diabetic autonomic neuropathy and cardiovascular risk: Pittsburgh Epidemiology of Diabetes Complications Study III. Arch Intern Med 1990;150:1218–22.
25. Ninkovic AV. Cardiovascular autonomous dysfunction in diabetics: the influence of disease duration, glycoregulation degree and diabetes type. 2008;136(9–10):488–93.
26. Rabbone I. Early cardiovascular autonomic dysfunction, beta cell function and insulin resistance in obese adolescents. Acta Biomed 2009;80(1):29–35.
27. Rathmann W, Ziegler D, Jahnke M, et al. Mortality in diabetic patients with cardiovascular autonomic neuropathy. Diabet Med 1993;10(9):820–24.
28. Schmid H. Cardiovascular impact of the auto-nomic neuropathy of diabetes mellitus. Arq Bras Endocrinol Metabol 2007;51(2):232–43.
29. Sun PC. Thermoregulatory sudomotor dysfunction and diabetic neuropathy develop in parallel in at-risk feet. Diabet Med 2008; 25(4):413–18.
30. Szabo L. Urinary flow disturbance as an early sign of autonomic neuropathy in diabetic children and adolescents. Neurourol Urodyn 2007;26(2):218–21.
31. Tavakoli M. Corneal confocal microscopy: a novel means to detect nerve fibre damage in idiopathic small fibre neuropathy. Exp Neurol 2010;223(1):245–50.
32. Tesfaye S. Advances in the management of diabetic peripheral neuropathy. Curr Opin Support Palliat Care 2009;3(2):136–43.
33. Wheeler T, Watkins PJ. Cardiac denervation in diabetes. Br Med J 1973;4:584–86.
34. Ziegler D. Effects of treatment with the anti-oxidant alfa-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. Diabetes Care 1997;20(3):369–73.
35. Ziegler D, Ametov AS, Barinov AN, et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care 2007;29:2365–70.
| Апрель 2011 г. |