Опубликовано в журнале:
Фарматека №9-2006г.ЭФФЕКТИВНОСТЬ ИНФУЗИОННОЙ И ТАБЛЕТИРОВАННОЙ ФОРМ АЛЬФА-ЛИПОЕВОЙ КИСЛОТЫ В ЛЕЧЕНИИ ДИАБЕТИЧЕСКОЙ ПОЛИНЕВРОПАТИИ
И.А. Строков, К.И. Строков, Т.В. Солуянова
Кафедра нервных болезней ММА имени И.М. Сеченова, Москва
Кафедра эндокринологии и диабетологии РМАПО, Москва
В обзоре на основании результатов многочисленных клинических исследований рассматриваются возможности внутривенного и перорального применения α-липоевой кислоты (АЛК; Тиоктацида) для лечения диабетической полиневропатии (ДПН). Мета-анализ результатов исследований ALADIN, ALADIN III, SYDNEY и NATHAN II показал, что при ДПН внутривенное введение АЛК (600 мг/сут) в течение 3 недель (14 инфузий) вполне безопасно и приводит к значительному улучшению в отношении позитивной невропатической симптоматики и неврологического дефицита. Данные об эффективности при ДПН таблеток АЛК (длительными курсами или после внутривенного введения препарата) не столь однозначны, и вопрос о целесообразности их использования дискутируется, хотя при пероральном применении АЛК в течение 2 лет было отмечено некоторое улучшение клинической картины полиневропатии. Остается актуальным и вопрос о возможности лечения ДПН короткими курсами таблеток АЛК. Имеются данные о том, что прием 1800 мг АЛК, формы быстрого высвобождения, в течение 3 недель не уступает по эффективности внутривенному введению препарата. Появление новой таблетированной лекарственной формы Тиоктацида БВ (быстрого высвобождения) позволяет обеспечить предсказуемость фармакокинетики препарата и большую биодоступность, чем при применении обычных таблеток АЛК, и имеет лучшие перспективы в лечении пациентов с ДПН. Альфа-липоевая кислота (АЛК, тиоктовая кислота) – естественный коэнзим митохондриального мультиэнзимного комплекса, катализирующего окислительное декарбоксилирование α-кетокислот, таких как пируват и α-кетоглюторат [1]. АЛК является также мощным липо-фильным антиоксидантом, что определяет возможность ее терапевтического использования [2]. АЛК представляет собой рацемическую смесь R(+) и S(-) изомеров, плохо растворяющихся в воде и хорошо – в липофильных растворителях. Вводимая в организм АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, в частности, за счет действия в качестве ловушки основного свободного радикала, формирующего поздние осложнения сахарного диабета (СД), – супероксида [2]. Дигидролипоевая кислота не используется в качестве лекарственного препарата, т. к. при хранении легко окисляется.
АЛК используется для лечения отравлений металлами и грибами, неалкогольного и алкогольного стеатогепатита, алкогольной полиневропатии [3, 4], однако наиболее широко и успешно препарат применяется в терапии диабетической полиневропатии (ДПН) [5].
Экспериментальные исследования на крысах со стрептозотоциновым и наследственным СД показали, что АЛК уменьшает перикисное окисление липидов, увеличивает активность супероксиддисмутазы, улучшает эндоневральный кровоток и скорость распространения возбуждения (СРВ) в седалищном нерве, увеличивает утилизацию глюкозы в кардиомиоцитах, ингибирует развитие катаракты, предотвращает поражение гломерулярного аппарата почек [6–10]. В клинических исследованиях с применением АЛК у больных СД отмечены улучшение состояния системы микроциркуляции, эндотелийзависимых реакций сосудистой стенки, фильтрационной функции почек и утилизации глюкозы, уменьшение перекисного окисления ли-пидов и активации фактора транскрипции NF-κB, нормализация содержания оксида азота и стресс-белков [11–14].
Клиническая фармакокинетика АЛК (при внутривенном введении и при приеме внутрь, отдельно для R(+)-АЛК и S(-)-АЛК, на пустой желудок и после еды) была детально изучена в работах Hermann R. и соавт. у здоровых добровольцев и больных СД [15]. Фармакокинетические характеристики АЛК при внутривенном введении не отличались у здоровых людей и больных СД, и имелась линейная зависимость между концентрацией АЛК в плазме и дозой вводимого внутривенно препарата в границах 200–1200 мг. При приеме таблеток у больных СД концентрация АЛК оказалась выше на 30–40 %, чем у здоровых лиц, что объясняют задержкой опорожнения желудка из-за автономной гастроинтестинальной невропатии. Это предположение имеет основание, но исследование больных СД с нормальной и сниженной скоростью опорожнения желудка не показало значительной разницы между ними в концентрации АЛК. В этой связи необходимы дополнительные исследования для ответа на вопрос о причинах различия фармако-кинетики обычной формы таблетированной АЛК у здоровых лиц и больных СД. При приеме этой таблетированной формы линейная зависимость концентрации АЛК в плазме от дозы препарата находилась в границах 50–600 мг. Прием таблеток АЛК натощак, за 30 минут до еды, существенно увеличивал достигаемую концентрацию препарата в плазме и ускорял время достижения пика концентрации по сравнению с приемом таблеток после еды. Как при внутривенном введении, так и при приеме таблеток через 24 часа в плазме не остается АЛК, но она депонируется в тканях, в т. ч. в периферических нервах. Ввиду всего изложенного понятно, почему ранее, до появления новой таблетированной формы АЛК быстрого высвобождения (Тиоктацид БВ), таблетки АЛК использовались только для поддерживающей терапии.
Клиническое применение АЛК для лечения ДПН началось в 1950-е гг., и до 1980 г. применялись дозы от 30 до 300 мг (как внутривенно, так и перорально) для оценки влияния на боль, рефлексы, вибрационную чувствительность и СРВ. C 1988 по 1995 г. дозы АЛК в проводимых исследованиях были увеличены до 400–600 мг [16]. Полученные результаты были противоречивы, а для сравнения использовались группы больных, получавших витамины группы В. Создавалось впечатление, что эффективно только внутривенное введение АЛК. Кроме того, различались сроки лечения, а критерии оценки эффекта АЛК были недостаточно четко определены, что затрудняло мета-анализ этих исследований.
Первым исследованием эффективности внутривенного введения АЛК, выполненным с соблюдением требований доказательной медицины (рандомизированное двойное слепое плацебо-контролируемое), можно считать проведенное в Германии исследование Alpha-Lipoic Acid in Diabetic Neuropathy (ALADIN) [17], выполненное с применением оригинального препарата АЛК Тиоктацид (трометамоловая соль АЛК). У 328 амбулаторных пациентов СД типа 2 была проведена оценка эффективности и безопасности внутривенного введения АЛК (Тиоктацид 600 T). Больные были разделены на четыре группы: получавших АЛК в дозе 100, 600 или 1200 мг и группу плацебо (14 инфузий в течение 3 недель). Основным критерием оценки ДПН служила шкала TSS (Total Symptom Score), которая позволяла оценивать интенсивность и частоту в течение последних 24 часов основных позитивных невропатических симптомов, таких как стреляющая боль, жжение, онемение и парестезии [18]. В качестве дополнительных критериев использовали опросник Hamburg Pain Adjective List (HPAL) для оценки болевого синдрома и результаты осмотра больного врачом с подсчетом Neuropathy Disability Score (NDS) для оценки негативной невропатической симптоматики в отношении рефлексов и чувствительности различных модальностей. Счет TSS при использовании АЛК в дозах 600 и 1200 мг достоверно снижался через 3 недели по сравнению с группой, получавшей 100 мг препарата или плацебо (р < 0,002). Показатель HPAL достоверно снижался через 3 недели при введении 600 и 1200 мг по сравнению с плацебо (p < 0,01). NDS значительно, но не достоверно уменьшался только в группе больных, получавших 1200 мг АЛК, по сравнению с плацебо. Побочные эффекты (головная боль, тошнота, рвота) чаще отмечались при дозировке 1200 мг (32,6 %), чем при дозировке 600 мг (19,8 %) и введении плацебо (20,7 %).
Исследование ALADIN позволило сделать несколько важных выводов. Во-первых, были предложены адекватные критерии оценки ДПН, которые использовались в дальнейших работах, особенно это относится к принятию TSS как основного показателя эффективности АЛК. Во-вторых, была показана дозозависимая эффективность АЛК, причем доза 600 мг признана оптимальной терапевтической, т. к. доза 1200 мг не увеличивала эффективности лечения и сопровождалась большим числом гастроинтестинальных побочных эффектов. В-третьих, в плацебо-контролируемом исследовании были доказаны эффективность и безопасность лечения ДПН внутривенным введением трометамоловой соли АЛК (Тиоктацид 600 Т).
В проведенном в Германии исследовании ALADIN III у двух амбулаторных групп больных СД типа 2 (167 и 174 пациентов соответственно) на первой стадии применялось внутривенное введение 600 мг АЛК (Тиоктацид 600 T) или плацебо в течение 3 недель [19]. Однако различие между группой больных, получавших АЛК, и группой плацебо было менее значительным (p = 0,033). Возможно, это было связано с большим количеством медицинских центров, принимавших участие в исследовании (70 центров), что сопровождалось техническими ошибками при определении TSS. Значительно большая эффективность плацебо в этом исследовании по сравнению с ALADIN подтверждает такую возможность. В этом исследовании для анализа динамики силы мышц, рефлексов и порогов чувствительности была использована шкала Neuropathy Impairment Score (NIS), более подробная, чем шкала NDS. Баллы по шкале NIS снижались через 3 недели лечения внутривенным введением АЛК достоверно более значительно, чем в группе, получавшей плацебо (p = 0,02). Исследование ALADIN III подтвердило уменьшение позитивной невропатической симптоматики и показало возможность уменьшения неврологического дефицита у больных СД типа 2 с ДПН.
Рандомизированное двойное слепое контролируемое исследование SYDNEY проводилось в России с той же целью, что и исследование ALADIN, но имело целый ряд особенностей дизайна [20, 21]. Обследовали с тестированием TSS (ежедневно) и NIS (до и после лечения) 120 больных СД типа 1 и СД типа 2 с симптомной полиневропатией, которые были разделены на две группы. Пациенты первой группы получали внутривенно АЛК (Тиоктацид 600 T) в дозе 600 мг, второй – внутривенно плацебо (0,04 мг рибофлавина) в течение 3 недель.
Особенности исследования:
госпитализация больных на месяц, что обеспечивало постоянный контроль гликемии, соблюдение диеты, стандартные физические нагрузки и таким образом хороший контроль СД; высокий исходный уровень баллов по шкале TSS (не менее 7,5), тогда как в предыдущих исследованиях исходный уровень был от пяти баллов, что обеспечивало гораздо больший возможный диапазон изменений TSS; предварительное обучение эндокринологов и неврологов, принимавших участие в исследовании, что обеспечивало стандартную оценку TSS и NIS в процессе лечения, причем тестирование в одно и то же время дня в ходе всего исследования проводил один врач-невролог; в течение первой недели пациенты обеих групп получали плацебо (период отмывки); за этот период счет баллов по шкале TSS не должен был снижаться более чем на 3 балла или достигать величины меньшей чем 5 баллов, что позволило исключить плацебо-респондеров. Из дополнительных показателей оценивали электромиографические (ЭМГ) показатели, пороги вибрационной, болевой и температурной чувствительности и вариабельность сердечного ритма при глубоком дыхании с использованием аппарата CASE IV в начале и по окончании исследования. Среднее значение баллов по шкале TSS уменьшилось на 5,72 ± 1,53 в группе, получавшей АЛК, и лишь на 1,82 ± 1,92 в группе плацебо (p < 0,001). Достоверное различие между группами по среднему количество баллов шкалы TSS появилось только на четвертой неделе лечения. Анализ динамики баллов по каждому отдельному симптому (боль, жжение, онемение, парестезии) в процессе лечения показал достоверное уменьшение выраженности всех симптомов на четвертой неделе в группе, получавшей АЛК, по сравнению с плацебо-группой (p < 0,001). Счет баллов по шкале NISLL уменьшился на 2,70 ± 3,37 в группе, получавшей АЛК, и только на 1,20 ± 4,14 балла в группе плацебо (p < 0,05). Из ЭМГ-показате-лей отмечено достоверное улучшение (уменьшение) только дистальной латенции при стимуляции n. suralis (p < 0,05). Изучение эффективности амбулаторного трехнедельного внутривенного введения АЛК больным СД (n = 241) в сравнении с внутривенным введением плацебо (n = 236) с тестированием шкал TSS и NIS в 33 диабетологических центрах США, Канады и Европы было выполнено также в исследовании Neurological Assessment of Thioctic Acid II (NATHAN II Study) [22]. Стандартные метод и сроки введения АЛК (Тиоктацид 600 Т) в четырех исследованиях (ALADIN, ALADIN III, SYDNEY, NATHAN II) позволили провести мета-анализ полученных в них результатов, сравнив данные 716 больных ДПН, получавших АЛК, и 542 пациентов, получавших плацебо [23]. Выявлен достоверно лучший эффект АЛК (Тиоктацида) на TSS в сравнении с плацебо (p < 0,05). Снижение TSS более чем на 50 % было отмечено у 52,7 % больных, получавших АЛК, и у 36,9 % пациентов в группе плацебо (p < 0,05). Среди отдельных симптомов шкалы TSS в наибольшей степени при лечении АЛК уменьшалось жжение. Мета-анализ динамики NIS проводился только для трех исследований, т. к. в ALADIN шкала NIS не использовалась. В отношении отдельных симптомов NIS достоверная разница была отмечена в отношении болевой и тактильной чувствительности и ахилловых рефлексов. Различий в побочных эффектах лечения между группами не наблюдалось.
Результаты мета-анализа свидетельствуют, что при ДПН внутривенное введение АЛК (Тиоктацид 600 Т) в течение 3 недель (14 инфузий) безопасно и приводит к значительному улучшению в отношении позитивной невропатической симптоматики и неврологического дефицита.
Первое заслуживающее внимания определение эффективности таблеток АЛК относится к 1988 г., когда было проведено двойное слепое исследование влияния перорального приема 600 мг АЛК в течение 84 дней у 35 больных СД с оценкой неврологического статуса и ЭМГ-показателей [24]. Не было отмечено позитивного эффекта по сравнению с группой больных СД, получавших витамины группы В. Это не позволяет считать дизайн исследования адекватным, т. к. в настоящее время известно, что тиамин, активируя транскетолазу, может патогенетически влиять на течение ДПН [27]. Дальнейшие направления исследований эффективности таблеток АЛК при ДПН можно разделить на три группы:
изучение эффекта непродолжительного приема таблеток АЛК (недели–месяцы); изучение эффекта таблеток АЛК (в течение нескольких месяцев), принимаемых после внутривенного введения препарата в течение 3 недель; изучение эффекта длительного (годы) приема таблеток АЛК на течение ДПН. В Oral Pilot (ORPIL) Study изучали эффективность приема в течение 3 недель таблеток АЛК 600 мг (Тиоктацид), назначаемых 3 раза в день (суммарная дневная доза 1800 мг) аналогичной группе из 12 больных СД 2 типа с ДПН, в сравнении с эффектом плацебо в аналогичной группе из 12 пациентов [22]. TSS в достоверно большей степени уменьшался в группе АЛК (p = 0,021). HPAL изменялся в обеих группах без достоверных различий. NDS достоверно уменьшался в группе АЛК по сравнению с группой плацебо (p = 0,025). Различий в частоте побочных эффектов между группами не отмечалось. Основным недостатком работы можно считать небольшое число обследованных больных, что затрудняет статистическую обработку. В исследовании Deutsche Kardiale Autonome Neuropathie (DEKAN) у 73 больных СД типа 2 с нарушением вариабельности сердечного ритма использовали для лечения либо АЛК (Тиоктацид) в таблетках (200 мг 4 раза в день, суммарная доза 800 мг), либо плацебо в течение 4 месяцев. Выявлено достоверное увеличение вариабельности сердечного ритма в группе АЛК по сравнению с группой плацебо (p < 0,05). Частота побочных эффектов в группах достоверно не различалась.
В исследовании, проведенном в России, показано, что после окончания 3-недельного внутривенного введения АЛК (Тиоктацид 600 Т) в течение первого месяца наблюдается дальнейшее улучшение состояния, причем эффект лечения существенно уменьшается только через 6 месяцев [25].
Целесообразность длительного приема таблеток АЛК с целью лечения и замедления прогрессирования ДПН изучалась в исследовании ALADIN II [22]. Таблетки АЛК (Тиоктацид) получали в течение 2 лет две группы больных СД типа 1 и СД типа 2: одна группа (n = 18) получала АЛК в дозе 600 мг 2 раза в день, вторая (n = 27) – в дозе 600 мг 1 раз в день. Третья группа (n = 20) получала таблетки плацебо. Исследование показало увеличение СРВ по чувствительному нерву (n. suralis) по сравнению с плацебо для обеих групп, получавших АЛК. Потенциал действия n. suralis достоверно увеличился только в группе больных, получавших 600 мг АЛК (p < 0,05), а СРВ по двигательному n. tibialis достоверно возросло по сравнению с плацебо только в группе больных, получавших 1200 мг АЛК. Не отмечено различий между группами через 2 года по баллам NDS. В этом году должны быть опубликованы данные исследования NATHAN I, в котором изучали динамику NIS и семи электрофизиологических тестов у больных ДПН при лечении таблетками АЛК (Тиоктацид) в течение 4 лет для решения вопроса о возможности использовать АЛК с целью предотвращения или замедления прогрессирования ДПН.
Вопрос об эффективности лечения ДПН короткими курсами таблеток АЛК остается актуальным. Имеются данные о том, что прием 1800 мг АЛК в течение 3 недель не уступает по эффективности внутривенному введению препарата (Тиоктацид 600 Т) [26, 27].
Особые надежды в отношении возможности неинвазивной терапии только таблетированной формой АЛК связывают с Тиоктацидом БВ (быстрого высвобождения), который имеет ряд преимуществ перед обычной формой АЛК. Тиоктацид БВ обладает предсказуемой фармакокинетикой, обеспечивая необходимую терапевтическую концентрацию действующего вещества в тканях, и имеет более высокую биодоступность, чем таблетки АЛК предыдущего поколения (см. рисунок).
Рис. Концентрация в крови двух форм тиоктовой кислоты у здоровых добровольцев [21,22]
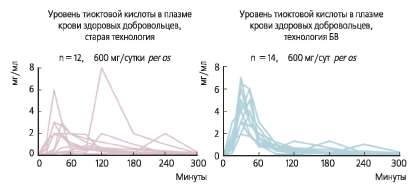
Основным недостатком обычных форм АЛК была высокая вариабельность времени достижения максимальной концентрации АЛК в плазме (59 %) даже у одного и того же пациента, в результате чего у отдельных больных уровень препарата в плазме и тканях может быть ниже терапевтического. Таблетированная форма Тиоктацида БВ благодаря более быстрой и выраженной абсорбции имеет межиндивидуальную вариабельность всего 22 %, что иллюстрирует рисунок. Прием таблеток Тиоктацида БВ через 20–30 минут после еды обеспечивает надежное повышение концентрации АЛК в крови у всех пациентов, что не может быть гарантировано при приеме обычных пероральных форм АЛК.
В 2005 г. проведено исследование SYDNEY II, в котором изучалась эффективность 3-недельного лечения ДПН у больных СД типа 1 и 2 Тиоктацидом БВ. Исследование проводилось в нескольких эндокринологических и неврологических центрах России и Израиля. Больные были разделены на четыре группы: первая группа получала 600 мг АЛК в день, вторая – 1200, третья – 1800 и четвертая – таблетки плацебо. Результаты этого исследования, которые должны быть опубликованы в 2006 г., позволят ответить на многие вопросы дальнейших перспектив перорального лечения ДПН АЛК быстрого высвобождения (Тиоктацид БВ).
ЛИТЕРАТУРА
1. Reed LJ. Multienzyme complex. Acc Chem Res 1974;7:40–46.
2. Packer L, Witt EH, Tritschler H. Alfa-lipoic acid as a biological antioxidant. Free Radic Biol Med 1995;19:227–50.
3. Яковенко Э.П., Яковенко А.В., Григорьев П.Я. и др. Роль альфа-липоевой кислоты в терапии метаболических заболеваний печени // Фарматека. 2005. № 3. С. 25–29.
4. Скляр И.А., Воробьева О.В., Шаряпова Р.Б. и др. Тиоктацид в лечении алкогольной полиневропатии // Лечение нервных болезней. 2001. Т. 2. № 2. С. 39–41.
5. Ziegler D, Reljanovic M, Mehnert H, et al. α-Lipoic acid in the treatment of diabetic polyneuropathy in Germany: Current evidence from clinical trials. Exp. Clin. Endocrinol Diabetes 1999;107:421.
6. Nagamatsu M, Nickander KK, Schmelzer JD, et al. Lipoic acid improves nerve blood flow, reduces oxidative stress and improves distal nerve conduction in experimental diabetic neuropathy. Diabetes Care 1995;18:1160–67.
7. Stevens MJ, Obrosova I, Cao X, et al. Effect of DL-alpha-lipoic acid on peripheral nerve conduction, blood flow, energy metabolism and oxidative stress in experimental diabetic neuropathy. Diabetes 2000;49:1006–15.
8. Ramrath S, Tritchler HJ, Eckel J. Stimulation of cardiac glucose transport by thioctic acid and insulin. Horm Metab Res 1999;31:632–35.
9. Borenshtein D, Ofri R, Werman M, et al. Cataract development in diabetic sand rats treated with alpha-lipoic acid and its gamma-linolenic acid conjugate. Diabetes Metab Res Rev 2001; 17:44–50.
10. Melhem MF, Craven PA, Liachenko J, et al. Alpha-lipoic acid attenuates hyperglycemia and prevents glomerular mesangial matrix expansion in diabetes. J Am Soc Nephrol 2002;13:108–16.
11. Haak ES, Usadel KH, Kohleisen M, et al. The effect of α-lipoic acid on the neurovascular reflex arc in patients with diabetic neuropathy assessed by capillary microscopy. Microvasc Res 1999;58:28–34.
12. Borcea V, Nourooz-Zadeh J, Wolff SP, et al. Alpha-lipoic acid decreases oxidative stress in patients with diabetes mellitus. Free Radic Biol Med 1999;22:1495–500.
13. Строков И.А., Манухина Е.Б., Бахтина Л.Ю. и др. Состояние эндогенных протекторных систем у больных инсулинзависимым сахарным диабетом с полинейропатией: эффект антиоксидантной терапии // Бюллетень экспериментальной биологии и медицины. 2000. Т. 130. № 10. С. 437–41.
14. Hofmann MA, Bierhaus A, Zumbach MS, et al. Insufficient glycemic control increases nuclear factor-κB binding activity in peripheral blood mononuclear cells isolated from patients with type I diabetes. Diabetes Care 1998;21:1310–16.
15. Hermann R, Niebch G. Human pharmacokinetics of α-lipoic acid. In: Fuchs J, Packer L, Zimmer G (Eds). Lipoic Acid in health and disease. Marcel Dekker Inc N-Y 1997, p. 337–60.
16. Biewenga GP, Haenen GRM, Bast A. The role of lipoic acid in the treatment of diabetic polyn-europathy. Drug Met Rev 1997;29:1025–54.
17. Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant α-lipoic acid. A 3-week multicentre randomized controlled trial (ALA-DIN Study). Diabetologia 1995;38:1425–33.
18. Строков И.А., Баринов А.Н., Новосадова М.В. и др. Клинические методы оценки тяжести диабетической полиневропатии // Неврологический журнал. 2000. № 5. С. 14–19.
19. Ziegler D, Reljanovic M, Mehnert H, et al. α-Lipoic acid in the treatment of diabetic polyneuropathy in germany: current evidence from clinical trials. Exp Clin Endocrinol Diabetes 1999; 107:421–30.
20. Ametov AS, Barinov A, Dyck PJ, et al. The sensory symptoms of diabetic polyneuropathy are improved with α-lipoic acid. Diabetes Care 2003;26(3):770–76.
21. Аметов А.С., Строков И.А., Баринов А.Н. и др. Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. № 11 (88). С. 69–73.
22. Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant α-lipoic acid: a meta-analysis. Diab-eric Medicine 2004;21:114–21.
23. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy. Treat Endocrinol 2004;3:1–17.
24. Jorg J, Metz F, Scharafinski H. Zur medikamentosen Behandlung der diabetischen polyneuro-pathie mit der α-liponsaure oder vitamin B-Pra-paraten. Nervenarzt 1988;9:36–44.
25. Strokov IA, Novosadova MV, Lavrova IN, et al. The prolonged clinical effect of tioctic acid in symptomatic distal diabetic polyneuropathy. Abstr of the 14th Annual Scientific Meeting of the DFSG and NEURODIAB, Regensburg, Germany, 2004, p. 195.
26. Komelyagina EU, Volkov AK, Antsiferov MB. The comparison of intravenous and oral treatment of symptomatic polyneuropatty with α-lipoic acid. The pilot study (2004).
27. Галстян Г., Удовиченко О., Анциферов М. Тиоктацид в лечении диабетической полинейропатии // Врач. 2000. № 1.
28. Brownlee M. Biochemistry and molecular cell biology of diabetic complications. Nature 2001; 414:813–20.
| Сентябрь 2007 г. |