Динамика ключевых медиаторов инсулинорезистентности у больных сахарным диабетом 2 типа при применении метформина ( ®)
М.И. Балаболкин, И.И. Дедов, Н.П. Гончаров, Е.М. Клебанова, Г.Г. Мамаева, В.М. Креминская, Г.С. Колесникова
ГУ Эндокринологический научный центр (дир. - акад. РАН и РАМН И.И. Дедов) РАМН, Москва,
кафедра эндокринологии и диабетологии (зав. проф. М.И. Балаболкин) ММ А им. И.Н. СеченоваОсновная роль в патогенезе сахарного диабета типа 2 (СД 2) отводится инсулиновой резистентности, которая выявляется у родственников I степени родства больных за много лет до манифестации СД 2. Исследованиями последних лет четко показано, что инсулиновая резистентность является первичной. Для поддержания в этих условиях углеводного обмена в пределах нормы необходима повышенная функция островкового аппарата поджелудочной железы, что сопровождается периферической гиперинсулинемией. От функциональной способности β-клеток зависит время развития нарушенной толерантности к глюкозе, а затем и клинических признаков СД 2 [1].
Более чем у 90% больных, страдающих СД 2, на момент манифестации заболевания имеется избыточная масса тела, что сопровождается прямой корреляцией между ее наличием и степенью выраженности инсулиновой резистентности [2]. Лечение СД 2 комплексное и предусматривает назначение соответствующей диетотерапии, физической активности, проведение обучения больного и самоконтроля углеводного обмена, медикаментозной терапии, а также профилактика и лечение сосудистых осложнений диабета. Медикаментозная терапия СД включает применение секретогенов (препараты сульфонилмочевины или производные аминокислот), бигуанидов, глитазонов, ингибиторов α-глюкозидаз. Одним из побочных явлений применения пероральных сахароснижающих препаратов является их влияние на прибавку массы тела, что крайне нежелательно, так как увеличение массы тела способствует дальнейшему прогрессированию инсулиновой резистентности. Из перечисленных препаратов лишь бигуаниды и ингибиторы а-глюкозидаз не способствуют дальнейшему повышению массы тела. Учитывая, что более чем 90% больных СД 2 имеют избыточную массу тела, бигуаниды являются препаратами выбора для лечения таких больных.
Бигуаниды почти 50 лет применяются для лечения СД 2 и механизм их сахароснижающего действия отличается от секретогенов. Они не изменяют секрецию инсулина и не оказывают биологического сахароснижающего эффекта при его отсутствии. В присутствии инсулина бигуаниды, из которых в настоящее время применяется только метформин, увеличивают периферическую утилизацию глюкозы, уменьшают глюконеогенез, повышают утилизацию глюкозы кишечником, что проявляется снижением уровня глюкозы в крови, оттекающей от кишечника; а также снижают повышенное содержание инсулина в сыворотке крови у больных, страдающих ожирением и СД 2. С учетом указанного механизма действия метформина правильнее говорить не о его гипогликемическом, а об антигипергликемическом влиянии. Кроме того, метформин оказывает умеренное влияние на снижение содержания липидов в сыворотке крови (ХС, ТГ, ХС ЛПНП и ЛПОНП, а также способствует повышению уровня ХС ЛПВП), уменьшает инсулинорезистентность, что проявляется снижением уровня инсулина в крови. Терапия метформином сопровождается умеренным снижением массы за счет уменьшения количества жировой ткани. Отмечено положительное влияние на состояние сердечно-сосудистой системы: повышение фибринолиза, снижение уровня ингибитора 1 типа активатора плазминогена, пролиферации гладких мышечных клеток в сосудистой стенке in vitro и скорости атерогенеза у животных.
Инсулинорезистентность скелетных мышц (in vitro исследования биоптатов мышц) у больных СД или ожирением объясняется уменьшением количества глкжозных транспортеров, а повышение утилизации глюкозы, наблюдаемое под воздействием метформина, обусловлено увеличением количества глюкозных транспортеров в клетках-мишенях. Клеточные механизмы действия метформина, сопровождающиеся повышением утилизации глюкозы, опосредуются через его влияние на транслокацию глюкозных транспортеров из внутриклеточного пула на плазматическую мембрану клетки, что и сопровождается стимуляцией поглощения глюкозы мышцами при отсутствии влияния на транспорт аминокислот.
Жировая ткань является эндокринным органом и секретирует значительное количество гормонов, многие из которых прямо или опосредованно влияют на инсулиновую резистентность и, естественно, на эффективность проводимой терапии, что имеет прямое влияние на развитие и скорость прогрессирования сосудистых осложнений СД.
Учитывая влияние метформина на инсулиновую резистентность и жировой обмен, можно предположить, что некоторые эффекты его действия могут быть следствием изменения секреции гормонов жировой ткани и, в частности, лептина, который секретируется в жировой ткани и участвует в регуляции энергетического баланса в организме через соответствующие рецепторы, локализованные в гипоталамической области. Содержание лептина в крови пропорционально количеству жира в организме [1]. Помимо гормонального регулятора массы тела и использования энергии, лептин прямо или опосредованно участвует в контроле гематопоеза, количества жировой ткани в организме, репродукции, функции иммунной системы и ангиогенеза [2].
α-ФНО является цитокином и его ген экспрессируется как в иммунных, так и в неиммунных клетках, включая эндотелиоциты, фибробласты и адипоциты. Установлено, что высвобождение α-ФНО из клеток жировой ткани такое же, как и его высвобождение из моноцитов или макрофагов [3]. Повышение экспрессии гена α-ФНО в адипоцитах животных и при ожирении у человека сопровождается повышением степени выраженности инсулиновой резистентности, что позволило считать, что этот цитокин является одним из ключевых медиаторов ее развития. Это антиинсулиновое действие α-ФНО является следствием его влияния на снижение экспрессии ГЛЮТ-4 и ингибирования тирозинкиназы рецепторов к инсулину в клетках и тканях-мишенях [4].
В связи с изложенным целью нашего исследования явилось изучение влияния формина (метформина) не только на состояние углеводного, но и липидного обмена, динамику содержания лептина, его растворимого рецептора и α-фактора некроза опухолей (α-ФНО) в сыворотке крови у больных СД 2.
Объем и методы исследования
Проведено открытое неконтролируемое нерандомизированное исследование по изучению эффективности и безопасности препарата метформин (Формин Плива) фирмы «Плива Хрватска д.о.о.».
В исследование включались больные СД 2 в возрасте от 20 до 65 лет с длительностью заболевания от 1 мес до 15 лет, у которых содержание глюкозы в сыворотке крови натощак составляло не более 11 ммоль/л, а уровень гликозилированного гемоглобина в крови — не более 10%.
Критериями исключения являлись наличие сердечной и легочной недостаточности, нарушение функции почек и печени, беременность, острые респираторные, хирургические и другие заболевания, протекающие с температурой. Общий анализ крови и мочи проводили через каждый месяц наблюдения, а биохимический анализ крови, включая содержание общего ХС, ТГ, ХС ЛПНП и ЛПОНП и ХС ЛПВП, мочевины, креатинина, печеночных ферментов, проводили на 1-ми 4-м визитах.
Лечение формином проводилось в течение не менее 12 нед. и изучалось при этом его влияние на состояние углеводного и липидного обмена у больных СД 2.
Обследовано 262 больных (мужчин 71 и женщин 191, соответственно 27,1 и 72,9%) СД 2 в возрасте от 20 до 65 лет, в основном (74,5%) в возрасте 40-59 лет.
Из общего числа обследованных у 26 больных на фоне терапии формином изучалось содержание лептина, растворимого рецептора к лептину и α-ФНО.
Содержание глюкозы в плазме крови (биохимический анализатор «ХИТАЧИ 912» ROCHE) и HbAlc (аппарат Diastat «Bio-Rad») определяли в лаборатории биохимии ЭНЦ РАМН (зав. — А.В. Ильин) традиционными методами с использованием указанной аппаратуры.
Уровень лептина и растворимого рецептора к лептину в сыворотке крови определяли в лаборатории гормональных исследований ЭНЦ РАМН (зав. — проф. Н.П.Гончаров) с использованием стандартных наборов фирмы DSL (США) для определения с использованием иммуноферментного анализа, а содержание α-фактора некроза опухолей (α-ФНО) — с помощью стандартных наборов фирмы «Biosource» (Бельгия) также для определения с использованием иммуноферментного анализа (ИФА).
Клиническая характеристика больных представлена в табл. 1.
До включения в настоящее исследование больные СД находились на различной терапии, в том числе 10 обследованных (3,8%) — на диетотерапии, 155 (59,2%) — на терапии препаратами сульфонилмочевины и 97 больных (37%) получали лечение глюкобаем, глиформином, сиофором, новонормом или комбинированную терапию. После обследования больные были переведены на терапию формином в суточной дозе от 1000 до 1400 мг.
Таблица 1
Клиническая характеристика больных и частота осложнений СД
Ретинопатия
68 больных (26%)
Нефрология
13 больных (5%)
Нейропатия
112 больных (42.7%)
ИБС
55 больных (21%)
Другие заболевания
125 больных (47.7%)
Артериальная гипертензия
96 больных (36.6%)
Ангиопатия нижних конечностей
16 больных (6.1%)
Другие сердечно-сосудистые заболевания
35 больных (13.4%)
114 больных (43.5%) не имели сосудистых осложнений,
у 148 больных (56.5%) выявлены сосудистые осложнения.Результаты исследования и их обсуждение
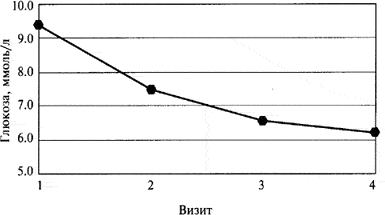
На фоне лечения формином у больных отмечалось улучшение углеводного обмена, которое сопровождалось статистически достоверным снижением гликемии натощак (первый визит 9,33±0,2 ммоль/л; второй визит — 7,37±0,09; третий визит — 6,66±0,08 и четвертый визит - 6,45±0,08; р<0,0001) и уровнем гликогемоглобина в крови (с 8,78±0,09 до 7,25±0,07%; р<0,0001). Компенсация углеводного обмена у больных также сопровождалась статистически достоверным уменьшением индекса массы тела с 34,02±0,33 кг/м2 (первый визит) до 32,73±0,33 кг/м2 (четвертый визит; р<0,0001).
Данные о содержании гликогемоглобина и гликемии у обследованных больных в период лечения представлены на рис. 1 и 2.
Рис.1.
Кумулятивные распределения уровня гликогемоглобина (НbА1с) в крови до и через 3 мес от начала лечения.
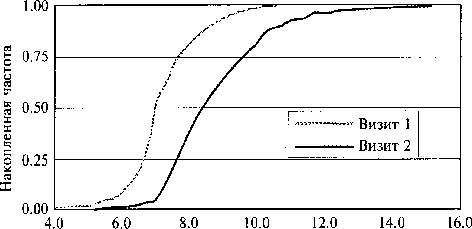
Рис. 2.
Динамика изменения содержания глюкозы в крови во время лечения.
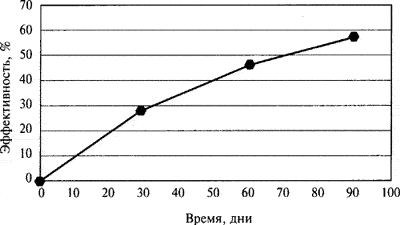
Следует подчеркнуть, что динамика эффективности лечения формином, оцениваемая по жестким критериям, а именно уровню снижения глюкозы ниже 6,5 ммоль/л, составила 60% (рис. 3).
Рис. 3.
Динамика эффективности лечения по уровню глюкозы натощак (<6,5 ммоль/л).
Под влиянием лечения формином содержание общего холестерина и ХС ЛПНП снизилось, а уровень ХС ЛПВП повысился, но изменения концентрации липидов на фоне лечения формином оказались статистически недостоверными.
Кроме того, у 26 больных на фоне терапии формином изучалось содержание лептина, растворимого рецептора к лептину и α-ФНО (табл. 2).
Проведенное нами исследование показало, что терапия формином сопровождается снижением гликемии в среднем на 2,5-3 ммоль/л; уменьшением уровня гликозилированного гемоглобина в крови на 1,53%. Общая эффективность лечения по уровню глюкозы в крови 6,5 ммоль/л составила 60%. Формин хорошо переносится больными и обладает высокой безопасностью. Наряду с этим у больных на фоне лечения формином наблюдается недостоверное снижение содержания лептина, растворимого рецептора к лептину и статистически достоверное снижение α-ФНО в сыворотке крови больных. Можно предположить, что улучшение компенсации углеводного обмена на фоне терапии формином является не только прямым его влиянием на улучшение поглощения глюкозы периферическими тканями, но и за счет уменьшения секреции гормонов жировой ткани, в частности, α-ФНО.
Таблица 2
Содержание глюкозы, гликозилированного гемоглобина, лептина, растворимого рецептора к лептину и а-ФИО в сыворотке крови на фоне лечения формином
Показатель
Исходно
Через 3 мес лечения
Р
Глюкоза, ммоль/л
10,0*2,88
7,99*1,97
<0,05
НbА1с,%
9,02*2,09
7,24*1,02
<0,05
ХС ЛПНП, моль/л
3,76*0,71
3,43*0,59
>0,05
ХС ЛПВП, моль/л
1,05*0,19
1,35*0,28
>0,05
Лептин, нг/мл
32,72*2,75
30,0*3,47
>0,05
Рецептор к лептину,нг/мл
55,46*22,68
47,0*18,75
>0,05
а-ФНО, пг/мл
47,75*2,98
24,34*3,15
<0,05
Метформин снижает гипергликемию при СД посредством ингибирования скорости образования глюкозы печенью. При этом одни исследователи считают, что этот эффект метформин оказывает путем снижения скорости глюконеогенеза [5], а другие — через снижение скорости гликогенолиза в печени [6]. С целью уточнения механизма действия метформина на скорость образования глюкозы печенью было проведено неординарное исследование R. S. Hundal и соавт. [7], в котором было четко показано, что метформин снижает скорость образования глюкозы через снижение глюконеогенеза. Авторы применили три высокочувствительных метода, где скорость образования глюкозы определялась с помощью [6,6-2Н2]глюкозы, количество гликогена и гликогенолиз — с помощью 13С-ядерной магнито-резонансной спектроскопии, а глюконеогенез — по 2Н2О. У больных СД 2 скорость образования глюкозы печенью была в 2 раза, а глюконеогенеза в 3 раза выше по сравнению с группой контроля. Терапия метформином в течение 3 мес. приводила к снижению образования глюкозы на 25%, а глюконеогенеза - на 36%. У обследованных нами больных терапия метформином также в течение 3 мес. приводила к достоверному снижению уровней гликогемоглобину и глюкозы в крови.
Таким образом, проведенные исследования показывают, что формин обладает выраженным антигипергликемическим эффектом, способствует улучшению компенсации углеводного обмена, что сопровождается статистически достоверным снижением гликемии и уровня гликозилированного гемоглобина в сыворотке крови. Наряду с этим на фоне терапии формином отмечается снижение уровня холестерина ЛПНП и повышение содержания холестерина ЛПВП, при практически неизмененных показателях содержания общего холестерина в сыворотке крови. Кроме того, лечение формином способствует статистически достоверному снижению содержания а-ФНО и умеренному понижению уровня лептина и его растворимого рецептора в сыворотке крови.
Литература
1. Балаболкин М.И., Диабетология, Медицина, 2000, с. 671
2. Балаболкин М.И., Клебанова Е.М., Креминская В.М., Влияние метформина на показатели перекисного окисления липидов у больных сахарным диабетом 2 типа // Клин, фармакол. и терапия - 2001 -№4-С. 89-90
3. Sewter С. P., Digby J. E., Blows F. et ol., Regulation of tumor necrosis factor-alpha release from human adipose tissue in vitro // J Endocrinol -1999-Vol. 163-P. 33-38
4. Rosen E.D., Spiegelman B.M., Tumor necrosis factor as a mediator of insulin resistance of obesity // Curr Opin Endocrinol Metab - 1999 -Vol.6-P. 170-176
5. Stumvoll M, Nurjhan N, Perriello G, Metabolic effects of metformin in non-insulin-dependent diabetes // N Engl J Med. - 1995. - Vol. 333. - P. 550-554)
6. Cusi K., Consoli A., DeFronzo R. A., Metabolic effects of metformin on glucose and lactate metabolism in noninsulin-dependent diabetes mellitus // J Clin Endocrinol Metab - 1996 - Vol. 81 - P. 3059-4067
7. Hundal R.S., Krssak M., Dufour S. et al., Mechanism by which metformin reduces glucose production in type 2 diabetes // Diabetes - 2000 - Vol. 49 - P. 2063-2069Формин (метформин) -
| Июль 2005 г. |