Опубликовано в:
«ВРАЧ» »» 5/2012
Сегментарные механизмы формирования мышечного спазма, спастичности и хронизации боли
А. Баринов, кандидат медицинских наук
Первый МГМУ им. И.М. Сеченова
Обсуждаются вопросы взаимосвязи патогенеза боли и мышечного спазма, роль дефицита ГАМК в развитии спондилогенных болевых синдромов.
Предлагается патогенетически обоснованный подход к лечению хронической боли и мышечно-тонических синдромов.Ключевые слова: γ-ригидность, порочный круг «боль-спазм-боль», ГАМК-рецепторы, Баклосан.
Segmental mechanisms of muscle spasm, spasticity, and pain chronification
A. Barinov, MD
I.M. Sechenov First Moscow State Medical UniversityMuscle tension in nociceptive pain syndromes is common in clinical practice and is a defensive reflex on the one hand and a pathological mechanism of pain chronification on the other.
Key words: spasticity, GABA receptors, Baclosan, muscle tone, nociceptive afferentation.
Одним из главных двигательных расстройств является спастичность - повышение мышечного тонуса, возникающее в результате поражения кортикоспинальных путей. Спастичность выражается в сопротивлении пассивному движению, зависящему от его скорости, и связана с растормаживанием тонических сегментарных рефлексов растяжения, афферентная часть дуги которых начинается от проприорецепторов мышц (аннулоспиральных окончаний мышечных веретен и органов растяжения Гольджи) и, проходя по хорошо миелинизированным А-ß-волокнам (афференты Iа) в задние рога спинного мозга, моносинаптически возбуждает гомонимные и синергичные α-мотонейроны передних рогов спинного мозга; в результате возникает сокращение скелетных мышц (экстрафузальных волокон). Этот рефлекс появляется в ответ на растяжение мышечных волокон и служит механизмом обратной связи для поддержания длины мышц (рис. 1).
Рис. 1. Сегментарный рефлекс растяжения
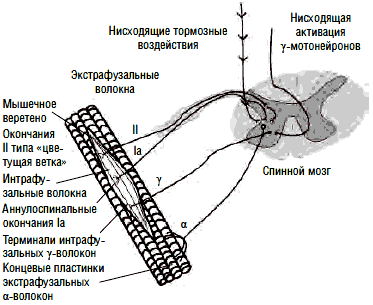
Экстрафузальные мышечные волокна в покое имеют неизменную длину. Сегментарный рефлекс растяжения поддерживает эту длину постоянной - как только мышца растягивается, растягиваются и мышечные веретена - рецепторы растяжения, держащие под контролем длину мышцы. Аннулоспиральные нервные окончания (рис. 2) немедленно отвечают на растяжение мышцы афферентацией по быстропроводящим Iа-волокнам в α-мотонейроны спинного мозга, а оттуда через быстропроводящие эфферентные α1-волокна импульс идет к экстрафузальной мускулатуре, в результате мышца сокращается и ее первоначальная длина восстанавливается. Любое растяжение мышцы незамедлительно запускает в действие этот механизм регуляции длины.
Большие α-мотонейроны переднего рога сопровождаются более мелкими γ-мотонейронами. γ-Мотонейроны находятся под контролем нисходящих путей оральных отделов ЦНС в составе пирамидного, ретикулоспинального и вестибулоспинального трактов. Тонкие немиелинизированные γ-волокна идут от γ1-мотонейронов к интрафузальным (фузимоторным) мышечным волокнам. Последние значительно тоньше обычных (экстрафузальных) мышечных волокон и образуют мышечные веретена. Импульсы, производимые γ1-мотонейронами, приводят к сокращению интрафузальных мышечных волокон в районах обоих полюсов веретена, тем самым вызывая натяжение его экваториальной части. Это изменение тотчас регистрируется аннулоспиральными окончаниями, и их потенциалы действия, идущие по быстропроводящим Iа-волокнам в α-мотонейроны, увеличивают тонус мышцы (рис. 3).
Нисходящая пирамидная активация α1-мотонейронов приводит к произвольному сокращению мышцы. Сегментарная активация α1-мотонейронов афферентацией из аннулоспиральных окончаний мышечных веретен приводит к непроизвольному сокращению соответствующей мышцы. Активность мышечных веретен произвольно и непроизвольно контролируется нисходящими центральными влияниями, регулирующими активность сегментарных γ1-мотонейронов, которые исходят из облегчающих и супрессорных зон мозга. Нисходящая супрасегментарная активация γ1-мотонейронов обусловливает сокращение интрафузальных мышечных волокон, что вызывает снижение порога возбудимости рецепторов растяжения: даже малое напряжение мышцы влечет активацию рецепторов растяжения с последующей рефлекторной активацией α1-мотонейронов и непроизвольным сокращением мышцы.
Электрическая стимуляция облегчающих зон мозга у декортицированных животных увеличивает ригидность. Стимуляция супрессорных зон вызывает противоположный эффект. Облегчающие зоны могут оказывать активирующее действие на спинной мозг по таким нисходящим путям, как вестибулоспинальный и руброспинальный тракты, или опосредованно - через нисходящую эфферентную импульсацию от латеральной ретикулярной формации, т.е. через латеральный ретикулоспинальный тракт. Латеральная ретикулярная формация - это образование, похожее по форме на карандаш, простирающееся через продолговатый мозг вверх до таламуса. Ретикулярная формация имеет связи с большинством сенсорных систем. Ее эфферентные сигналы направляются вверх к полушариям мозга по восходящим путям и вниз к спинальным мотонейронам по нисходящим путям, где они служат главным источником растормаживания мотонейронов, особенно γ-мотонейронов. Клетки латеральной ретикулярной формации находятся в состоянии постоянной активности. Как следствие этого, она является источником непрерывного облегчения сегментарных тонических рефлексов.
В отличие от облегчающих зон все супрессорные зоны головного мозга действуют не прямо на спинной мозг, а опосредованно - через нейроны медиальной ретикулярной формации. Медиальная и латеральная ретикулярные формации не похожи друг на друга ни анатомически, ни функционально. Медиальная ретикулярная формация представляет собой группу рассеянных по стволу мозга скоплений нервных клеток; она проецируется на спинной мозг как главный источник супраспинального торможения сегментарных мотонейронов и является общим конечным путем супрессорных зон мозга. Нейроны медиальной ретикулярной формации в отличие от латеральных ретикулярных нейронов не обладают фоновой активностью. Они запускаются и управляются импульсами от супрессорных зон головного мозга и только благодаря этому способны оказывать тормозное действие на сегментарные γ-мотонейроны, обеспечивающие регуляцию длины мышцы и мышечного тонуса (рис. 3; 4).
При повреждении супрессорных зон медиальные ретикулярные нейроны не функционируют и мотонейроны спинного мозга «освобождаются» от торможения, навязанного в норме супрессорными зонами. Это устранение нисходящего торможения приводит к дисбалансу управляющей системы, когда эффект облегчающих импульсов больше не компенсируется конкурирующими тормозными воздействиями. Следствием этой несбалансированности становится ригидность. Выключение одной из супрессорных зон вызывает временную ригидность; устранение 2 и более зон - длительную. Последняя проявляется в виде триады двигательных симптомов, которые позволяют определить наличие спастичности:
Таким образом, мышечный тонус может регулироваться непосредственно головным мозгом как произвольно, так и непроизвольно, однако существует и дублирующая регуляторная система на сегментарном уровне (рис. 4-6) и эта регуляция важна для нормального осуществления каждого произвольного движения. Эфферентное воздействие γ-мотонейронов делает произвольные движения более плавными, «настраивает» в соответствии с решаемой задачей.
- гиперактивность фазных рефлексов на растяжение;
- гиперактивность тонических рефлексов на растяжение;
- клонусы.
В нормальной двигательной деятельности активность α- и γ-мотонейронов сопряжена. Импульсы, нисходящие от центров головного мозга по независимым параллельным путям (пирамидному и ретикулоспинальному и др.), возбуждают α- и γ-мотонейроны в соответствующих пропорциях и в норме продуцируют плавные координированные движения. При повреждении кортикоспинального тракта этот баланс изменяется, что может привести к гиперактивности γ-мотонейронов и, соответственно, к активации мышечных веретен. В итоге возбуждаются гомонимные и синергичные α-мотонейроны и возникает гипертонус или спастичность скелетных мышц. Спастичность, которая уменьшается или уничтожается разрывом γ-веретенной петли, известна как γ-ригидность. Большинство клинических случаев спастичности имеет значительный γ-компонент.
Понятия «спастичность» и «ригидность» - не синонимы. Ригидность может возникать вследствие поражения как пирамидной, так и экстрапирамидной систем, а спастичность - всегда признак пирамидной недостаточности.
Основной симптом спастичности - увеличение (по сравнению с нормой) сопротивления мышц растяжению. Величина сопротивления зависит от скорости движения. У пациентов со спастичностью может наблюдаться клинический феномен - медленно производимое пассивное движение не приводит к сопротивлению, в то время как при быстром пассивном движении сопротивление четко ощущается в начале движения (симптом «складного ножа»). В ригидных же мышцах напряжение присутствует всегда - как в исходном состоянии, так и при их растяжении. Проявлением спастичности в этом случае будет слишком быстрое (по сравнению с нормой) сокращение напряженных мышц при увеличении скорости растяжения.Рис. 2. Аннулоспиральное нервное окончание мышечного веретена
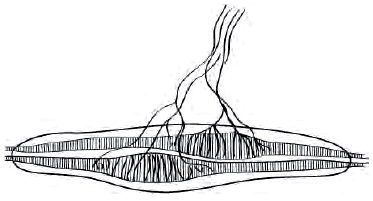
Рис. 3. Круг обратной связи при поддержании длины мышцы
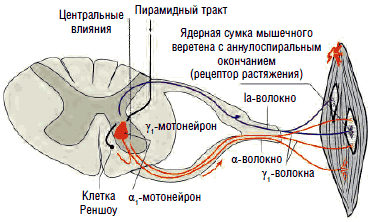
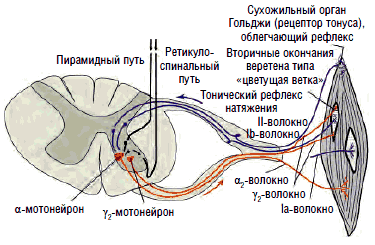
Рис. 4. Кольцо обратной связи для поддержания тонуса мышцы
Несмотря на широкое распространение γ-ригидности, не всякая спастичность опосредуется исключительно через γ-веретенную петлю. Изолированное поражение пирамидного тракта, например, при временной ишемии спинного мозга может «освобождать» от супрасегментарного тормозного контроля вместо γ-мотонейронов только α-мотонейроны. При этих условиях именно последние становятся местом патологической гиперактивности, и разрыв (при дорсальной ризотомии на уровне соответствующих сегментов) или ингибирование (например, агонистами γ-аминомасляной кислоты - ГАМК, рис. 7) γ-веретенной петли не будет приводить к уменьшению спастичности. Спастичность, сохраняющаяся при разрыве γ-петли, обозначается как α-ригидность. Ригидность мышц с выраженными симптомами спастичности обозначается как γ-ригидность, а спинальная ригидность без спастики называется α-ригидностью. В большинстве случаев спинальная ригидность, если она не является чистой α-ригидностью, носит смешанный характер.
При рутинном клиническом исследовании спастичность имеет следующие черты:
В рутинной клинической практике, помимо повышения тонуса мышц конечностей, связанного с пирамидной недостаточностью, особого внимания заслуживает повышение тонуса паравертебральной и перикраниальной мускулатуры при хронических спондилогенных болевых синдромах, а также околосуставных мышц при патологии суставов. Именно поэтому целесообразно более подробно рассмотреть вопросы контроля тонуса мышц. Сегментарный контроль тонуса мышцы осуществляется системой, в которой измерительными устройствами являются сухожильные органы Гольджи - рецепторы тонуса мышц (рис. 8).
- рефлекс на растяжение мышц, который в норме скрыт, становится очевидным;
- пороги вызывания сухожильных рефлексов снижаются;
- ответ мышцы при ударе по сухожилию возрастает. Может быть вызван клонус;
- на удар по сухожилию одной мышцы отвечает не только она, но и соседние;
- тонические рефлексы на растяжение (т.е. сопротивление пассивному передвижению конечности) тоже усиливаются.
Эти органы ответственны за напряжение гомонимных мышц, вызванное как сознательным, так и рефлекторным сокращением. Они посылают тормозящие импульсы, которые передаются по быстропроводящим Ib-волокнам через вставочные нейроны на α2-мотонейроны. Основной задачей рецепторов Гольджи являются измерение степени напряжения мышц на основании поступающих в них сигналов и поддержание мышечного тонуса в физиологических пределах - в состоянии готовности к сокращению или расслаблению (см. рис. 4).
Многие мышечные веретена имеют, помимо первичных (аннулоспиральных рецепторов растяжения), еще и вторичные окончания, известные под названием «цветущая ветка». Эти окончания реагируют на изменение тонуса, их афферентация проводится к мотонейронам, контролирующим мышцы (агонисты и антагонисты) по тонким волокнам II типа, связанным со вставочными нейронами, образующими собственную нейрональную систему спинного мозга (см. рис. 5), способную осуществлять реципрокное воздействие.
Рис. 5. Сегментарный контроль возбудимости мотонейронов
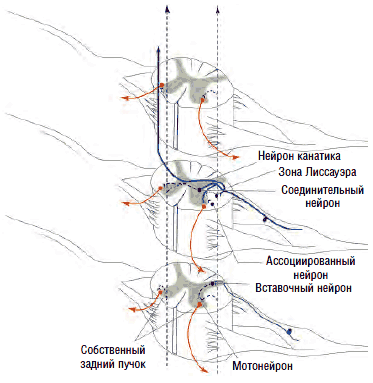
Рис. 6. Моносинаптический рефлекс и полисинаптическое тормозное воздействие на мышцы-антагонисты
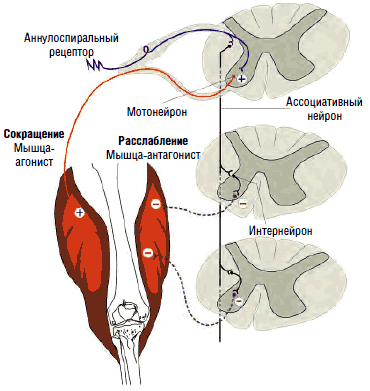
Так, при активации мышц-сгибателей происходит синхронное подавление активности соответствующих антагонистов - мышц-разгибателей. Вставочные нейроны передают на мотонейроны, отвечающие за сокращение мышц-антагонистов, тормозящие импульсы, что обеспечивает их реципрокное расслабление в момент сокращения агонистов (см. рис. 6). В противном случае сокращение агонистов приводило бы к мгновенному последующему сокращению антагонистов, что сделало бы любое движение невозможным или, по крайней мере, затруднительным. Собственно, это и наблюдается при спинальной ригидности.
Напряжение мышц при болевых синдромах является, с одной стороны, защитным рефлексом, а с другой - патологическим механизмом хронизации боли. Известно, что мышечно-тонические синдромы при длительном течении приводят к патологическим изменениям в спазмированной мышце - образованию локальных участков фиброза («курковых» или «триггерных» зон), служащих основой хронического миофасциального болевого синдрома. Возникновение защитных сгибательных рефлексов (рис. 9) связывают с патологически усиленной афферентной ноцицептивной импульсацией, которая приводит к дисбалансу возбуждающих и тормозных влияний на мотонейроны. Процесс может развиваться в пределах спинального сегментарного уровня, но возможно вовлечение и других иерархических супрасегментарных уровней, но только низшего порядка. Возникает вопрос: каким образом сенсорная афферентация вызывает дизрегуляцию мышечного тонуса с преобладанием возбуждающих влияний на мотонейроны и является ли возбуждение тонического защитного рефлекса патофизиологической основой мышечно-тонического синдрома?
Традиционные представления о порочном круге «боль - спазм - боль» в последнее время подвергаются критическому переосмыслению. Показано, что механизм защитного сгибательного рефлекса работает лишь при острой боли и непродолжительное время. Более того, экспериментальные исследования на здоровых добровольцах с использованием игольчатой электромиографии не подтвердили наличия мышечной гиперактивности в ответ на продолжительную болевую стимуляцию. Это может свидетельствовать о более сложном механизме возникновения патологического мышечного спазма, чем простое «переключение» ноцицептивной афферентации на γ-мотонейроны заинтересованного сегмента. Связь повышения тонуса и электромиографической активности паравертебральной мускулатуры с эмоционально-личностными изменениями (повышенный уровень тревоги и катастрофизации), зафиксированная у пациентов с хроническими спондилогенными болевыми синдромами, является отражением супрасегментарных процессов, приводящих к растормаживанию лимбикоретикулоспинальных активирующих воздействий на γ-мотонейроны передних рогов спинного мозга. В формировании стойкого гипертонуса мышц (мышечно-тонического синдрома) при острых и хронических болевых синдромах большое значение придается недостаточности тормозных кортико-лимбических и лимбико-ретикулярных влияний и общему дефициту ГАМК - нейротрансмиттера, осуществляющего тормозное действие как на супрасегментарном, так и на сегментарном уровне, которое опосредуется вставочными интернейронами через рецепторы ГАМК-А и ГАМК-B на постсинаптических мембранах γ-мотонейронов переднего рога (см. рис. 7).
Рис. 7. Торможение возбудимости γ2-мотонейронов переднего рога, обеспечивающих поддержание постоянного тонуса мышц за счет натяжения интрафузальных волокон мышечных веретен
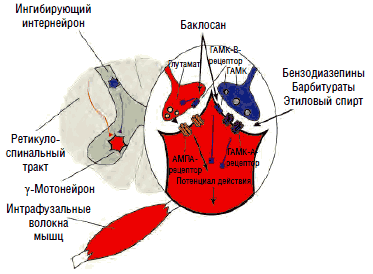
Рис. 8. Сухожильный орган Гольджи – рецептор напряжения мышцы
Рис. 9. Полисинаптический защитный флексорный рефлекс
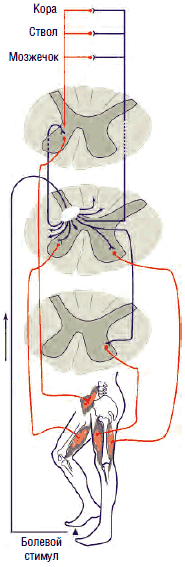
Механизм действия ГАМК на пре- и постсинаптические мембраны зависит от типа взаимодействующих рецепторов. ГАМК-А-рецепторы представляют собой регулируемые ионотропные каналы, селективно пропускающие ионы хлора внутрь клетки. Они участвуют в подавлении быстрых (<100 мс) потенциалов действия нейрона за счет повышения проницаемости мембран для ионов хлора, повышения разницы электрических потенциалов мембран внутри и вне клетки (гиперполяризуют мембраны), препятствуя возникновению потенциала действия нейрона, что приводит к снижению возбудимости нервных клеток, в частности, γ-мотонейронов передних рогов (это обусловливает миорелаксирующее действие ГАМК и агонистов), или ноцицепторов второго и третьего порядков (обезболивающее действие), а также лимбической системы (транквилизирующее действие).
Рис. 10. Различия ГАМК-А- и ГАМК-В-рецепторов
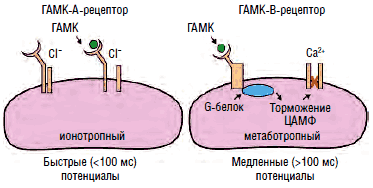
Рис. 11. Строение канала хлора
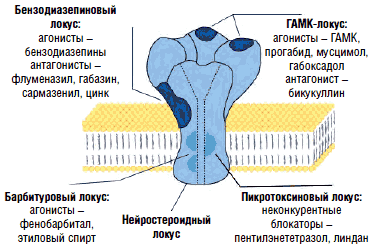
Рис. 12. Регуляция активности ноцицепторов задних рогов
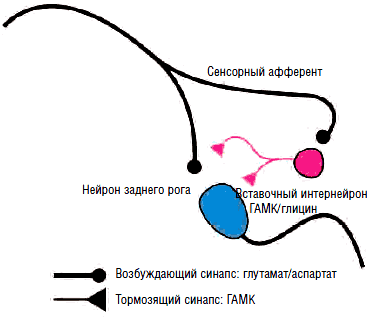
В отличие от ионотропных ГАМК-А-рецепторов ГАМК-B-рецепторы являются метаботропными, т.е. оказывают не прямое, а опосредованное действие на ионные каналы посредством активации G-белка, ингибирующего фермент аденилилциклазу, что приводит к торможению выделения внутриклеточного мессенджера циклического аденозинмонофосфата (ЦАМФ) и снижению фосфорилирования кальциевых каналов, их закрытию, подавлению входа кальция в клетку и снижению возбудимости нейронов за счет гиперполяризации мембраны в конце потенциала действия. Таким образом, метаботропные ГАМК-В-рецепторы подавляют медленные (>100 мс) мембранные потенциалы. Кроме того, ГАМК-В-рецепторы обладают способностью открывать калиевые каналы, что также приводит к гиперполяризации нейрона и подавлению развития потенциала действия и высвобождения нейротрансмиттеров на пресинаптических мембранах. Селективными агонистами ГАМК-В-рецепторов являются баклофен, фенибут, γ-гидроксибутират, лезогаберан. Антагонистами - саклофен и факлофен. Наиболее часто в клинической практике для торможения активности γ-мотонейронов при лечении спастичности и мышечно-тонических синдромов применяется производное хлорфенилмасляной кислоты баклофен (Баклосан), являющийся структурным аналогом ГАМК.
Агонистами ГАМК-А-рецепторов являются бензодиазепины, этиловый спирт и барбитураты, нейростероиды (прегненолон, дигидроэпиандростерон, синтезируемые глиальными клетками периферической и центральной нервной системы) и пентилэнететразол, соединяющиеся с соответствующими сайтами субъединиц канала хлора и модулирующие его активность (рис. 11). Ранее выделялся 3-й тип рецепторов - ГАМК-С, который также является каналом хлора, не чувствительным, однако, к перечисленным агонистам. В настоящее время предлагается рассматривать его как особый подтип ГАМК-А-рецептора, состоящего из 3 изоформ ρ-субъединиц, обладающих аффинитетом к цисамино-кротоновой кислоте, помимо ГАМК. Существует множество изоформ α-, β-, δ-, ε-, π-, θ- и ρ-субъединиц канала хлора, определяющих чувствительность канала к тем или иным агонистам. Каждый канал состоит из 5 субъединиц, комбинация которых и определяет аффинитет той или иной группы нейронов к воздействию различных ГАМК-агонистов и антагонистов.
Таким образом, посредством ионотропных хлорных каналов либо метаботропных кальциевых каналов ГАМК оказывает тормозное воздействие в различных отделах центральной нервной системы. И не последнюю роль в подавлении мышечного спазма играют сегментарные ГАМКергические влияния на уровне заднего рога. В задних рогах спинного мозга среди многочисленной группы нейромедиаторов, нейрогормонов и нейромодуляторов, опосредующих проведение ноцицептивных сигналов, наиболее важная роль в активации последних отводится возбуждающим аминокислотам, а также субстанции Р, нейрокинину А и кокальцигенину. Возбуждающие аминокислоты (глутамат, аспартат) содержатся более чем в 1/2 нейронов спинномозговых ганглиев и высвобождаются из их центральных пресинаптических терминалей в задних рогах спинного мозга под действием афферентных ноцицептивных импульсов. Возбуждающие аминокислоты взаимодействуют с несколькими подтипами глутаматных рецепторов. Это прежде всего N-метил-D-аспартат (NMDA)-рецепторы, α-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота (AMPA)-рецепторы, а также метаботропные глутаматные рецепторы (mGluR). Считается, что реализация физиологических реакций, в том числе болевых (например, защитный рефлекс отдергивания), при выделении глутамата опосредуется через AMPA-рецепторы, в то время как NMDA-рецепторы обеспечивают развитие длительной гиперактивности (сенситизации) ноцицептивных нейронов, формы нейрональной пластичности, лежащей в основе развития патологической боли. Нейропластичность по своей сути является процессом образования новых межнейронных взаимодействий (сродни процессу обучения). Их формирование осуществляется с помощью синаптических и несинаптических механизмов. В условиях недостаточности торможения ГАМКергическими интернейронами (рис. 12) облегчаются синаптические межнейронные взаимодействия, происходят активация ранее неактивных синапсов и объединение близлежащих гиперактивных нейронов в единую сеть с самоподдерживающейся активностью. Дизрегуляционные процессы затрагивают не только первичное ноцицептивное реле в задних рогах спинного мозга, но и распространяются на вышележащие структуры системы болевой чувствительности. Контроль проведения ноцицептивных импульсов в ЦНС со стороны антиноцицептивных структур головного мозга при неврогенных болевых синдромах становится неэффективным. В этих условиях снижается обезболивающий потенциал центральных анальгетиков, поэтому для лечения таких болевых синдромов необходимы средства, обеспечивающие подавление патологической активности в периферических ноцицепторах и гипервозбудимых нейронах ЦНС.
Сегментарное подавление возбудимости осуществляется за счет выделения тормозных аминокислот (ГАМК и глицина), а также нейропептида энкефалина. В пресинаптическом торможении участвуют опиоидные рецепторы, ГАМК-А- и ГАМК-В-рецепторы, а в постсинаптическом торможении - оба ГАМК-рецептора и глициновые рецепторы. Активируются тормозные интернейроны афферентацией по быстропроводящим А-ß-волокнам (суставно-мышечной, тактильной и вибрационной чувствительности), осуществляя «окружающее торможение» нейронов широкого динамического спектра в задних рогах спинного мозга. Этот процесс описан Р. Мелзаком и П. Уоллом как «воротный контроль» боли. Утрата сегментарных тормозных влияний при повреждении соматосенсорных афферентов или дефицит тормозных медиаторов (ГАМК, глицин) при глутаматиндуцированном апоптозе тормозных интернейронов на фоне длительной интенсивной ноцицептивной афферентации приводит к развитию центральной сенситизации ноцицепторов задних рогов спинного мозга, а также супрасегментарных ноцицептивных структур. Подобные процессы на уровне передних рогов спинного мозга и ретикулоспинального тракта приводят к «растормаживанию» γ-мотонейронов с развитием стойкого спазма заинтересованных мышечных групп, что можно рассматривать, как аналог центральной сенситизации.
В итоге возможности ГАМКергических препаратов, в частности Баклосана, воздействующего на процессы сегментарной и супрасегментарной патологической гиперактивности, в терапии самых разнообразных форм болевого синдрома достаточно обширны. Однако для их успешной реализации необходимо помнить о строго индивидуальной дозировке данного препарата, разработке персональных дозовых схем и курсов его назначения для каждого конкретного больного в зависимости от клинического ответа и переносимости лечения. Именно максимальная индивидуализация терапии является наиболее действенным путем профилактики возможного развития побочных эффектов. Баклосан представлен в виде таблеток по 10 и 25 мг, наличие 2 дозовых форм позволяет эффективно комбинировать различные дозовые схемы и курсы, способствует индивидуализации терапии и, в итоге, повышает комплаенс в процессе лечения. Необходимо отметить, что Баклосан, хотя и не является препаратом последнего поколения, тем не менее, еще не раскрыл все свои возможности. Доказана эффективность данного препарата в лечении некоторых форм невропатической боли (тригеминальная невралгия), головных болей (головная боль напряжения с вовлечением перикраниальной мускулатуры), абстинентных синдромов в наркологии. Дальнейшее изучение его механизмов действия и клинической эффективности, внедрение новых лекарственных форм будут способствовать расширению сферы применения Баклосана в неврологической практике.
Список использованной литературы
- Алексеев В.В., Баринов А.Н. и др. Боль. - Рук-во для врачей и студентов. -Под ред. Н.Н. Яхно / М.: МедПресс. - 2009; 302 с.
- Игонькина С.И. Роль ГАМКергического торможения в механизмах центральной невропатической боли // Рос. журн. боли. - 2012; 1: 18-9.
- Разумов Д.В., Подчуфарова Е.В. Невроортопедическая и электрофизиологическая характеристика паравертебральных мышц при хронических скелетно-мышечных болевых синдромах пояснично-крестцовой локализации // Боль. - 2009; 3: 66-7.
- Разумов Д.В., Подчуфарова Е.В. Роль болевого поведения в формировании инвалидизации у пациентов с хронической болью в спине // Рос. мед. журн. - 2010; 3: 11-8.
- Arendt-Nielsen L., Graven-Nielsen T. Muscle Pain: Sensory Implications and Interaction With Motor Control // Clin. J. Pain. - 2008; 24 (4): 32-40.
- Barnard E., Skolnick P., Olsen R. et al. Sub-types of α-aminobutyric acidA receptors: classification on the basis of sub-unit structure and receptor function. Int. Union Pharmacol. XV // Pharmacol. Rev. - 1998; 50: 291-313.
- Froestl W. Chemistry and Pharmacology of GABAB Receptor Ligands. GABAReceptor Pharmacology - A Tribute to Norman Bowery // Adv. Pharmacol. -2010; 58: 19-62.
- Graven-Nielsen T., Jansson Y., Segerdahl M. et al. Experimental pain by ischaemic contractions compared with pain by intramuscular infusions of adenosine and hypertonic saline // Eur .J. Pain. - 2003; 7: 93-102.
- Johansson H., Sojka P. Pathophysiological mechanisms involved in genesis and spread of muscular tension in occupational muscle pain and in chronic musculoskeletal pain syndromes: a hypothesis // Med. Hypotheses. - 1991; 35: 196-203.
- Oppenheim W. Selective posterior rhizotomy for spastic cerebral palsy: a review // Clin. Orthop. Relat. Res. - 1990; 20: 253-61.
- Svensson P., Graven-Nielsen T., Matre D. et al. Experimental muscle pain does not cause long-lasting increases in resting electromyographic activity // Muscle Nerve. - 1998; 21: 1382-9.
- Veiersted K., Westgaard R., Andersen P. Electromyographic evaluation of muscular work pattern as a predictor of trapezius myalgia // Scand. J. Environ Health. - 1993; 19: 284-90.
| Июнь 2012 г. |