Купить в Мегаватте быстро и очень просто (812)333-00-89. |
Опубликовано в:
Информационный бюллетеньЛАБОРАТОРНАЯ ДИАГНОСТИКА ГЕПАТИТА С
(Серологические маркеры и методы их выявления)М.И.Михайлов, Институт эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, Москва
При постановке диагноза "гепатит С" необходимо учитывать следующие наиболее важные факторы:
показатели активности "печеночных" ферментов;
наличие или отсутствие маркеров инфицирования вирусом гепатита С (ВГС) и другими гепатотропными вирусами;
данные эпидемиологического анамнеза;
результаты клинического осмотра пациента. Только комплексный учет данных факторов позволяет с высокой степенью надежности диагностировать это заболевание. Лабораторный работник должен предоставить объективную информацию о выявленном спектре вирусных антигенов и антител, а также РНК ВГС, позволяющую клиницисту, сотруднику службы переливания крови и врачу-эпидемиологу решать стоящие перед ними задачи. Чаще всего это:
выявление лиц с наличием ВГС для снижения уровня посттрансфузионного гепатита С;
постановка диагноза и разграничение острого и хронического гепатита С;
прогноз заболевания;
назначение, оценка и прогноз эффективности проводимой терапии;
изучение широты распространения ВГС в популяции и различных группах населения.
При этом основными направлениями работ, выполняемых лабораторными сотрудниками, являются:
разработка и выбор наиболее информативных методов выявления маркеров инфицирования ВГС;
определение критериев объективной оценки полученных результатов;
разработка оптимальных алгоритмов проведения лабораторных исследований;
внедрение системы повышения качества выявления маркеров инфицирования ВГС. Основой лабораторной диагностики гепатита С служат знания о ВГС, его репликации, информация о динамике появления и исчезновения маркеров инфицирования, а также современные иммунохимические и молекулярно-биологические методы детекции антигенов, антител и нуклеиновых кислот.
ВИРУС ГЕПАТИТА С. ВГС впервые был идентифицирован в 1988 году, когда группа исследователей во главе с М. Houghton и Choo Q.L, применив новые молекулярнобиологические методы исследования, клонировала и секвинировала геном вируса [I]. Частица вируса гепатита С имеет сферическую форму со средним диаметром около 50 нм [2,3]. Попытки визуального обнаружения и изучения строения вируса гепатита С предпринимались с момента открытия вируса, однако до сих пор отсутствуют хорошо документированные результаты этих исследований, что, возможно, связано с трудностями накопления вирусных частиц в необходимых количествах.
ВГСединственный член рода Hepacivirus в семействе Flaviviridae, в которое входят такие вирусы, как вирус диареи быков и лихорадки свиней (род Pestivirus) и вирус желтой лихорадки, вирус дэнге и GB-вирусы: GBV-A, GBV-B и GBV-C/HGV (род Flavivi-rus). Схема строения вируса гепатита С может быть представлена следующим образом (схема № 1). Нуклеокапсид содержит РНК вируса гепатита С. Сверху нуклеокапсид покрыт липидной оболочкой с утопленными в ней оболочечными белками, кодированными РНК ВГС. Геном вируса представлен однонитевой линейной молекулой РНК положительной полярности, протяженностью около 9600 нуклеотидов. Организация генома ВГС подобна другим флавивирусам. В нем выделяют две зоны, кодирующие структурные и неструктурные (функциональные) белки. Гены, кодирующие структурные белки, расположены у 5' области генома вируса, а неструктурные у 3' области. Ген ВГС имеет одну открытую рамку считывания (ОРС), единый полипептид (приблизительно в 3000 аминокислот), который под действием вирусных и клеточных протеаз нарезается на структурные и неструктурные белки.
Рис. 1. Структурные элементы HCV

К структурным белкам относят белки, кодированные Core, El и Е2 зонами РНК ВГС. Выявлено три формы С-белка ВГС: полноразмерная (р21) с молекулярной массой - 21 kD, усеченная (р19) и форма (р16), обнаруженная в ядрышках инфицированных гепатоцитов. На своей поверхности С-белок несет различные высококонсервативные В-клеточные эпитопы, существование которых чрезвычайно важно для выявления антител к ВГС в процессе лабораторной диагностики гепатита С.
Зоны РНК ВГС - Е1 и Е2 кодируют белки с молекулярной массой 31 и 70 kD . Эти белки имеют несколько участков N-гликозилирования; в Е1 белке определено до 6 таких участков, а в Е2 - 11. В участке Е2 заключена информация о небольшом белке - р7, который в структуре вируса не обнаружен.
Обозначение регионов, расположенных ближе к 3'- концу РНК ВГС - как зон, несущих информацию о неструктурных белках вируса, указывает на то, что эти белки не являются структурными компонентами вирусной частицы. В неструктурной зоне РНК ВГС выделяют участки, обозначенные как: NS2, NS3, NS4A, NS4B, NS5A и NS5B. Большинство из белков, кодированных неструктурными зонами РНК ВГС, необходимы для репликации вируса.
Сравнительный анализ нуклеотидных последовательностей РНК изолятов ВГС, полученных в различных регионах мира и даже в процессе заболевания от одного и того же пациента, выявил основную особенность этого вируса - высокую гетерогенность РНК. Положение о значительной генетической вариабельности РНК ВГС легло в основу теорий, объясняющих: длительное (иногда пожизненное) носительство вируса, частое развитие хронического заболевания, трудности в терапии и создании эффективных вакцинных препаратов. Наиболее значительные отличия последовательностей РНК ВГС сосредоточены в N-концевой части региона Е2, которую обозначают - "гипервариабельный регион" (HVR) [4].
В настоящее время определено 6 основных генотипов и свыше 100 субтипов ВГС. Генотипы 1а, 1в, 2а, 2в, 2с и За составляют более 90% HCV-изолятов, полученных в Северной и Южной Америке, Европе, России, Китае, Японии и Австралии/Новой Зеландии [5]. Генотипы 4, 5а и 6 соответственно регистрируются в Центральной и Южной Африке, Юго-Восточной Азии. В России и странах СНГ зарегистрировано преобладание генотипа 16 (не менее 68,9%) [6,7]. Считается, что пациенты, инфицированные генотипом 1 (особенно 1в), отвечают хуже на лечение по сравнению с пациентами, инфицированными другими генотипами вируса.
У больного ВГС циркулирует как популяция частиц вируса, у которых геномы отличаются друг от друга на 1-2% (квазиспецифичности) в результате мутаций, накапливающихся во время инфекции и/или попавших в организм пациента при заражении. Эти мутантные формы могут способствовать более активной репликации или могут помогать вирусу уклоняться от иммунного ответа организма и потенциально влиять на исход острой инфекции, различия в течении заболевания и ответе на интерферонотерапию [8].
ОПРЕДЕЛЕНИЕ АНТИ-ВГС. После открытия вируса ВГС и определения его роли в развитии посттрансфузионного гепатита - "ни А, ни В" перед исследователями стояла задача разработать методы, способные выявлять лиц с ВГС и пригодные для диагностики острого и хронического гепатита С. Было установлено, что антигены ВГС циркулируют в чрезвычайно низких концентрациях, и очевидно, что методический уровень конца 80-х годов XX века, применяемый для детекции вирусных антигенов, был явно недостаточен.
В 1989 году группа исследователей фирмы "Chiron Corporation" под руководством Q-L.Choo осуществила клонирование РНК ВГС и получила иммунореактивные олигопептиды, вступающие в реакцию с антителами, циркулирующими в крови больных хроническим гепатитом "ни А, ни В". Эти олигопептиды стали основой диагностических препаратов для выявления антител к ВГС. Это определило быстрый прогресс в разработке и промышленном выпуске диагностических препаратов. Основным методом, применяемым для детекции анти-ВГС, стал твердофазный иммуноферментный анализ, как метод, отвечающий требованиям практического здравоохранения -т.е. обладающий высокой чувствительностью, специфичностью и простотой проведения.
Учитывая, что ВГС персистирует в крови больных острым и хроническим гепатитом С одновременно с анти-ВГС, внимание разработчиков диагностических препаратов концентрировалось на создании тест-систем для детекции антител, обеспечивающих максимально полное выявление носителей вируса и максимально ранние сроки диагностики острой инфекции. Многообразие антигенов и антигенных детерминант, кодированных структурной и неструктурной зоной РНК ВГС, определило направление в конструировании диагностических препаратов выбором и аранжировкой олигопептидов, применяемых для их создания. За время, прошедшее с момента открытия ВГС, созданы диагностические системы трех поколений ( таблица 1).
Таблица 1
Диагностические препараты для выявления анти-ВГС [9]
Поколение
Применяемые пептиды,
зоны РНК ВГС, в которых
они кодированы% выявления носителей
ВГСВремя первого
выявления
анти-ВГС от
начала желтухиПервое
5-1-1 NS3
С100-3 NS470-80 %
30-90 дней
Второе
С22-3 Core
С200 NS3 и NS4
СЗЗс NS3
С 100-3 NS492-95 %
20-25 дней
Третье
С22-3 Core
С200 NS3 и NS4
СЗЗс NS3
Пептид NS597%
7-10 дней
Введение дополнительных пептидов, прежде всего с22-3 (Core), в диагностические препараты 2-го и 3-го поколения позволило решить главную задачу, то есть увеличить чувствительность, специфичность и, самое главное, выявляемость анти-ВГС . Благодаря диагностикумам 3-го поколения удается выявлять до 97% носителей ВГС. Вместе с тем, определенную дискуссию вызвало решение о введении в диагностикум пептида, кодированного NS5 регионом РНК ВГС. По мнению некоторых исследователей, присутствие этого пептида не имеет принципиального значения для улучшения качества диагностического препарата. [10,11]. Однако антитела к NS5 могут быть выявлены в более ранние сроки инфекции, что улучшает качество лабораторной диагностики острого гепатита С. [12].
В настоящее время во всем мире, в том числе и в России, применяются диагностические препараты 3-го поколения. Пептиды, применяемые в диагностических препаратах, получены при помощи рекомбинантной технологии (например, диагностикумы фирм: "Диагностические препараты", г. Нижний Новгород; "Вектор" г. Новосибирск; "Roche"; "Abbott" и др.), или синтетической (000 МЦ "Авиценна" г. Санкт-Петербург; "Organon" и др.). Диагностикумы, в которых одновременно использованы оба вида пептидов, получили обозначения, как препараты 4-го поколения. По своим характеристикам эти препараты не обладают значимыми различиями. Сравнительные испытания, регулярно проводимые МЗ России, продемонстрировали сопоставимую чувствительность диагностических препаратов отечественных и зарубежных производителей.
Установлено, что применение диагностикумов 3-го поколения для выявления анти-ВГС среди иммунокомпетентного населения (например, доноров крови) оценивается в 98,8-100%. В то же время среди иммунокомпрометированных лиц, например, таких как пациенты после трансплантации почки, костного мозга или лица, инфицированные ВИЧ, этот показатель значительно ниже - 50 - 95% [12]. S.George с соавт. [13] продемонстрировали, что у 8,4% больных ВИЧ-инфекцией регистрируются ложно-негативные результаты выявления анти-ВГС. Причем у таких пациентов в процессе наблюдения может регистрироваться серореверсионный эффект, т.е. регистрация позитивного результата после серонегативного анти-ВГС периода [14].
Одна из наиболее важных проблем при проведении исследований на наличие анти-ВГС - ложнопозитивные результаты. Их появление может быть связано с неспецифическим взаимодействием компонентов реакции, возможными перекрестными реакциями с другими вирусными антигенами и многими другими факторами. Уровень ложно-позитивных результатов при выявлении анти-ВГС с различными диагностическими препаратами может достигать 10-20% [15,16]. Повышенный уровень таких результатов отмечен среди больных онкологическими и аутоиммунными заболеваниями, лиц с иммунодефицитными состояниями и больных сифилисом [16,17]. Существование ложнопозитивных результатов ставит перед лабораторным работником задачу их разграничения с истинным выявлением анти-ВГС. Для решения этой задачи служит обнаружение в образце сыворотки крови РНК ВГС. Однако отрицательный результат обнаружения РНК ВГС не позволяет говорить о наличии ложнопозитивного выявления анти-ВГС. Необходимо учитывать, что анти-ВГС могут изолированно циркулировать в крови пациента, который выздоровел после острого гепатита С (10-15%) или у которого произошла элиминация РНК ВГС в результате проводимой терапии.
КОНФИРМАЦИОННЫЕ (SUPPLEMENTAL) ТЕСТЫ. Для разграничения ложнопозитивных образцов и образцов, действительно содержащих антитела к ВГС, разработаны дополнительные (Supplemental) тесты. Наиболее часто в этих тестах используется принцип иммуноблота [например - тест RIBA ("Ortho-Clinical Diagnostics"); "LiaTek HCV" (Organon Teknika)], когда на нитроцеллюлозной мембране адсорбируются в виде отдельных полос антигены, кодированные различными зонами РНК ВГС. Анти-ВГС взаимодействуют с адсорбированными антигенами с помощью меченных ферментом антител против Ig G человека с последующей их детекцией при помощи субстратного комплекса. Помимо иммуноблота в качестве дополнительных тестов также используют диагностические препараты для выявления анти-ВГС против конкретных антигенов, кодированных различными зонами РНК ВГС ["Спектр 4" ("Имбио", г. Нижний Новгород; РекомбиБест АНТИ-ВГС-СПЕКТР" - ЗАО "Вектор Бест", г. Новосибирск; ИФА- Анти-НСУ-Спектр, НПО "Диагностические системы", г. Нижний Новгород].
Разработка и внедрение этих тестов идет параллельно с внедрением скрининговых тестов для выявления анти-ВГС, повторяя принцип расширяющегося спектра использованных пептидов в каждом последующем поколении диагностических препаратов. Так, диагностикум RIBA-III отличается от предыдущего поколения добавлением пептида, кодированного зоной NS5. Принципы, позволяющие подтвердить позитивный результат выявления анти-ВГС, прежде всего включают: возможность (в некоторых случаях) получения более четких результатов ферментативной реакции при взаимодействии с отдельными пептидами, а также применение в диагностикуме расширенного спектра пептидов, которые не используются в скрининговых тестах. Только введение новых пептидов позволяет повысить диагностическую ценность подтверждающих тестов.
Трактовка полученных результатов, например в таком тесте, как RIBA-III, включает три возможных ответа : позитивный, негативный и неопределенный результат. Последний из них выдается в случае отсутствия четких показаний (согласно инструкции, прилагаемой к диагностическому набору), позволяющих определенно судить о наличии или отсутствии анти-ВГС в исследуемом образце. Соотношение спектра регистрируемых ответов при проведении подтверждающих тестов колеблется в зависимости от характеристик групп пациентов, у которых первично выявлены анти-ВГС [18]. По данным J.M. Pawlotsky с соавт. [19], в половине случаев результатов, трактуемых как "неопределенные", удается обнаружить РНК ВГС. На наш взгляд, правомочность ответа - "неопределенный результат выявления анти-ВГС", выдаваемого лабораторным работником клиницисту, очевидна не только при проведении подтверждающего теста, но и рутинном исследовании на наличие анти-ВГС. Необходимость такой трактовки полученных результатов является отражением современного состояния лабораторной диагностики гепатита С.
ОПРЕДЕЛЕНИЕ IgM АНТИ- ВГС. В настоящее время созданы и промышленно выпускаются диагностические наборы для выявления IgM анти-ВГС фирмами: "Вектор Бест"; "Диагностические системы"; "Имбио", "Abbott" и др. На этапе конструирования диагностических наборов были созданы наборы для ИФА, основой которых являлись пептиды, кодированные различными регионами РНК ВГС [20] . Выбор был остановлен на пептиде, кодированном Core регионом РНК ВГС и выявлении антител к нему класса IgM. Так же как и при использовании тестов для выявления анти-ВГС (IgG), при исследовании IgM анти-ВГС могут быть зарегистрированы ложнопозитивные результаты. По данным Stevensona D.L. с соавт. [21], до 70% больных с хроническим гепатитам С с наличием IgM анти-ВГС одновременно имели повышенный уровень ревматоидного фактора, который способствует появлению ложнопозитивных результатов. Вместе с тем, по мнению Pawlotsky J.M., наличие ревматоидного фактора не влияет на качество выявления IgM анти-ВГС [22].
ОПРЕДЕЛЕНИЕ АНТИГЕНОВ ВГС. Возможность определения антигенов ВГС привлекала внимание исследователей сразу же после открытия вируса. Принципиальная возможность их тестирования была продемонстрирована К. Krawczynski с соавторами [23], которые иммуногистохимически обнаружили в печеночной ткани антигены ВГС, доказав специфичность иммунофлюоресцентного свечения. Применение поли- и моноклональных антител к различным антигенам ВГС установило наличие ВГС core Ag, антигенов, кодированных NS3 и NS4 зонами РНК ВГС, в ядре и цитоплазме гепатоцитов, у 60-90% больных хроническим ГС [24].Однако дальнейшие исследования продемонстрировали, что антигены ВГС удается обнаружить менее чем в 5% печеночных клеток.
Первые диагностические тест-системы ("Ortho Antibody to Core Antigen (Murine Monoclonal) EL1SA Test System" и "Imucheck F-HCV Ag Core Kokusai") для выявления антигена ВГС появились на рынке иммунобиологических препаратов в 1999 году. В качестве цели детекции был избран Core антиген ВГС, который определяют при помощи твердофазного варианта ИФА, сконструированного на основе моноклональных антител. Первые исследования по применению этих тестов определили их высокую чувствительность, специфичность, и перспективность применения, прежде всего, в службе переливания крови [25,26]. Установлены:
возможность определения Core Ag ВГС в сыворотке или плазме крови;
специфичность выявления Core Ag ВГС;
наличие лиц с циркулирующим антигеном в крови серонегативных по анти-ВГС;
частое (90,3%) обнаружение Core Ag ВГС в сыворотках крови с наличием анти-ВГС и РНК ВГС [25];
прямая корреляция между концентрацией РНК ВГС и выявлением Core Ag ВГС [25];
сокращения фазы "окна" - от момента инфицирования до первого позитивного результата выявления анти-ВГС . Определено, что Core Ag ВГС удается выявлять в 83% случаев (n=24) на следующий день после первого обнаружения РНК ВГС [26] и задолго (в среднем 26 дней) до появления анти-ВГС [27]. МЕТОДЫ ОБНАРУЖЕНИЯ РНК ВГС. Современный этап лабораторной диагностики гепатита С можно охарактеризовать как этап начала широкого применения молекулярно - биологических методов выявления РНК ВГС. Подавляющее большинство методов выявления нуклеиновых кислот было апробировано для выявления РНК ВГС. Принципам конструирования диагностических препаратов и их применению для детекции вирусных ДНК или РНК посвящено значительное количество литературных обзоров, опубликованных как в отечественных [28], так и зарубежных изданиях [29]. Все эти методы можно разделить на две группы, в основе которых лежит применение принципов гибридизации без амплификации избранного участка нуклеиновой кислоты или с их амплификацией, что позволяет значительно повысить разрешающую способность метода.
Метод гибридизации основан на соединении меченных гибридизационных зондов (генноинженерные или синтетические молекулярные структуры, содержащие в себе нуклеотидные последовательности, комплементарные избранным участкам РНК). Учет результатов осуществляют по интенсивности сигнала, поступающего от метки в составе образовавшегося комплекса.
При гепатите С этот метод выявления РНК ВГС прежде всего нашел применение для ее идентификации непосредственно в гепатоцитах, в тестах обозначаемых - in situ hibidization [30]. Возможность непосредственной детекции РНК ВГС в ткани позволила обнаружить ее в мононуклеарных клетках крови, клетках слюнных желез и других тканях организма больного гепатитом С [31,32].
Метод гибридизации, применяемый для детекции РНК ВГС, позволяет продемонстрировать наличие негативных (репликативных) цепей РНК ВГС, что свидетельствует об активной репликации вируса [33].
Метод полимеразнной цепной реакции - в настоящее время наиболее широко применяемый методический прием, лежащий в основе практически всех молекулярно-биологических методов детекции РНК ВГС. Причем определение РНК ВГС возможно как в качественном, так и количественном варианте, что особенно важно для назначения, мониторинга и оценки эффективности применяемой терапии.
В качестве основных вариантов метода можно выделить:
полимеразную цепную реакцию (ПЦР);
лигазную цепную реакцию;
NASBA;
ТМА (Реакция транскрипционно опосредованной амплификации, Transcrip-tion-mediated amplification). Полимеразная цепная реакция - широко применяемый как в России, так и за рубежом метод детекции РНК ВГС. В его основе лежит многоцикловой процесс, напоминающий естественную репликацию нуклеиновой кислоты, причем каждый цикл состоит из последовательных этапов.
Из исследуемого материала (сыворотка или плазма крови, печеночный биоптат) выделяется РНК ВГС. Учитывая, что нуклеиновая кислота ВГС представлена РНК, а для амплификации необходима молекула кДНК, при помощи фермента - обратной транскриптазы, происходит образование однонитевых молекул кДНК ВГС. На следующем этапе к определенному участку каждой из цепей кДНК ВГС присоединяются т.н. праймеры - короткие олигонуклеотиды, комплементарные известным нуклеотидным последовательностям. Сравнение первичной структуры 5'UTR области генома различных изолятов ВГС выявило их незначительную изменчивость (между генотипами, гомология нуклеотидов - 92-98%, а внутри генотипа 98-99%). Это сделало предпочтительным выбор праймеров из этой зоны РНК ВГС и их применение в диагностических тест-системах, выпускаемых у нас в стране и за рубежом.
Далее, при помощи фермента ДНК- зависимой ДНК полимеразы происходит синтез новых участков ДНК. В настоящее время в качестве источника этого фермента чаще всего используют бактерии Thermophilus termus (Tth-полимераза) или Thermophilus aquaticus (Taq-полимераза). Обладая термостабильностью в присутствии ионов марганца и магния, этот фермент может быть одновременно использован для синтеза комплементарных одноцепочечных молекул кДНК ВГС и амплификации избранных участков кДНК. На завершающем этапе одного цикла реакции, при помощи ДНК полимеразы происходит синтез новых цепей комплементарных кДНК ВГС. Многократное повторение циклов реакции приводит к накоплению фрагментов кДНК ВГС, которые возможно зарегистрировать при помощи электрофореза в полиакриламидном геле с последующей визуальной детекцией или же с применением гибридизации с олигонуклеотидными зондами, что увеличивает чувствительность и специфичность применяемых диагностических препаратов. Применение праймеров, меченных ферментами, позволяет проводить учет результатов ПЦР при помощи иммуноферментного анализа.
Постоянная цель, стоящая перед исследователями, конструирующими диагностические системы для выявления РНК ВГС, - повышение чувствительности и специфичности. Этой цели служит вариант ПЦР, обозначенный - "гнездовой ПЦР" (nested PCR) [34]. Отличительной особенностью этого метода от "классического" является одновременное использование двух пар праймеров, одна из которых комплементарно связывается с внутренним участком ампликона, полученного после первого раунда амплификации. Вместе с тем считается, что при этом варианте ПЦР более высок риск контаминации образцов, что может привести к ложноположительным результатам [35] .
Острая потребность в определении РНК ВГС и сложности, связанные с крупномасштабным производством высокочувствительных и специфичных диагностических наборов для ПЦР диагностики, определили широкое применение препаратов, изготовленных в научных лабораториях. Сравнение этих тест-систем, так называемых - "домашних" тестов ("in house tests"), продемонстрировало их высокую вариабельность по чувствительности и специфичности, а также отсутствие воспроизводимости результатов между лабораториями и сериями диагностических препаратов. Так, при проведении первого Европейского цикла "внешнего" контроля качества оценки выявления РНК ВГС (1996 г.) из 136 лабораторий только 22 (16%) смогли абсолютно правильно определить наличие или отсутствие вирусной РНК в предоставленных контрольных образцах [36]. Подобный результат отмечен и в нашей стране, во время проведения аналогичной работы в рамках Федеральной системы внешнего контроля качества (2001 г.), когда из 14 участвующих лабораторий лишь 3 (21,4%) смогли правильно решить поставленную задачу [37].
Причины появления ложнонегативных и ложнопозитивных результатов выявления РНК ВГС разнообразны. При ложноотрицательных результатах:
- потеря или разрушение РНК ВГС в ходе подготовки к реакции клинического материала;
- наличие в образце ингибиторов, влияющих на различные компоненты ПЦР. Эти ингибиторы представлены различными химическими или белковыми субстанциями. Например: наличие в спермальной жидкости ингибиторов обратной транскриптазы не позволяло обнаружить РНК ВГС и говорить о возможности реализации полового пути передачи гепатита С [38]; наличие гепаприна [39]; высокий уровень криоглобулинов в сыворотке крови [40];
- несоблюдение теплового режима хранения и транспортировки клинического материала. При ложнопозитивных результатах:
- контаминация между пробами (при обработке образцов и/или работе с реакционной смесью), в том числе и контаминацией позитивным контрольным образцом;
- контаминация продуктами предшествующий амплификации (ампликонами), которые могут загрязнять исследуемые образцы и растворы через аэрозоли или лабораторное оборудование.Массовое внедрение ПЦР диагностики по определению РНК ВГС поставило перед органами практического здравоохранения задачи перехода на новый уровень проведения лабораторных исследований. Выделение изолированных зон для осуществления основных этапов ПЦР (для подготовки проб; проведения амплификации; для учета полученных результатов); отдельный комплект для каждого этапа реакции лабораторной одежды, автоматических пипеток; существование стандартных диагностических наборов и самое главное — наличие высококвалифицированных лабораторных сотрудников позволяет снизить уровень появления ложных результатов.
Первый стандартизированный набор для определения РНК ВГС ("AmplicorTM HCV", "Roche Diagnostic Systems") изготовлен в 1993 году. За прошедшие годы наборы для выявления РНК ВГС прошли эволюцию, основной целью которой стало повышение их чувствительности и специфичности. При конструировании "Amplicor TM HCV" использовано несколько оригинальных методических приемов, позволяющих выявлять 100 и выше копий РНК ВГС в мл., а также бороться с возможными случаями контаминации образцов и растворов, применяемых в наборе. Использование фермента - амперазы и дезиксиуридинтрифосфата (dUTP) позволяет разрушать в первом цикле амплификации предшествующие апликоны, которыми могла произойти контаминация. Разрушение амперазы в конце первого цикла амплификации (при +55 С) не позволяет ферменту разрушать ампликоны, избранные в качестве мишени. Принципиальным новшеством стало введение внутреннего контроля. Смысл этого новшества заключается во введении в каждый исследуемый образец последовательности, подобной амплифицируемому участку РНК ВГС, которая в дальнейшем выявляется с помощью соответствующих праймеров в реакции амплификации в аналогичном режиме. Отсутствие позитивной реакции при выявлении внутреннего контроля свидетельствует о наличии ложнонегативного результата реакции на наличие РНК ВГС в исследуемом образце. Диагностикумом следующего поколения стал препарат, обозначенный - "HCV Amplicor 2,0", при использовании обладающий пределом чувствительностью 50 молекул РНК ВГС.
Систему выявления РНК ВГС при помощи наборов фирмы "Roche" нельзя рассматривать в отрыве от их приборного обеспечения, определяющего высокое качество тестирования. Разработчики метода стремились к полной автоматизации всех этапов реакции. Воплощением этой идеи стала система "COBASAmpliPrepTM", позволяющая полностью автоматизировать процесс выделения РНК ВГС, амплификации и детекции, тем самым уменьшить риск получения ложнопозитивных и ложнонегативных результатов, сохранив при этом высокую чувствительность и специфичность [41].
Лигазная цепная реакция выявления РНК BГC.(LCR). Метод основан на способности фермента "ДНК- зависимой ДНК-лигазы" сшивать (лигировать) разрывы фосфодиэфирной связи в ДНК в присутствии АТФ и ионов Mg 2+. Так же как и при проведении "классической" ПЦР для выявления РНК ВГС, первый этап LCR - обратная транскрипция с получением кДНК ВГС. Далее ДНК-лигаза осуществляет связывание двух пар праймеров (комплементарных 5' некодированной зоне РНК ВГС), которые в дальнейшем амплифицируются. Детекция продуктов амплификации LCR осуществляется при помощи учета реакции антиген-антитело. Каждый из двух прайеров метится различным гаптеном. Первый из них захватывается антителами, адсорбированными на микрочастицах. После процедуры промывания при помощи второй пары антител, меченных флуоресцентной меткой, происходит их избирательное взаимодействие с гаптеном в амплификационном продукте с последующим проведением субстратной реакции и учетом на флюориметре.
Чувствительность этого метода составляет около 200 копий РНК ВГС в мл, что позволяет его использовать для решения различных клинико-диагностических задач [42]. В настоящее время диагностические наборы выявления РНК ВГС, основанные на LCR, изготовлены фирмой "Abbott".
Nucleic Acids Seaquencence Amplification - NASBA -метод детекции РНК ВГС основан на одновременном действии трех ферментов: обратной транскриптазы вируса миелобластомы птиц, РНК-азы Н и РНК-полимеразы Т7 [43.]. В отличие от RT PCR на первом этапе не проводится обратная транскрипция РНК ВГС. При помощи использованных ферментов удается получить более 10(9) копий участка кДНК ВГС в течение 90 минут [44]. Возможность проведения реакции при небольших температурах (+41 С) значительно упрощает работу и позволяет отказаться от оборудования, обеспечивающего циклические изменения высоких температур. Учет результатов реакции осуществляется при помощи электрохемилюминесценции. Несмотря на то, что по своей чувствительности NASBA близка к RT PCR, метод широко не используется для выявления РНК ВГС. В настоящее время проводится разработка варианта метода, сочетающего принципы проведения NASBA и "Real-time RT PCR".
Метод транскрипционно опосредованной амплификации (Transcription-mediated amplification - ТМА) отличается от ПЦР и LCR прежде всего тем, что непосредственно амплифицируются фрагменты РНК ВГС , а не кДНК ВГС. На начальном этапе реакции к РНК ВГС присоединяется праймер (№1) и с помощью фермента (обратной транскриптазы) синтезируется копия молекулы мишени - кДНК. Обратная транскриптаза, обладая также активностью РНКазы-Н, разрушает вирусную РНК в гибриде РНК-кДНК. Далее к молекуле кДНК присоединяется второй праймер с последующей достройкой двухцепочечной ДНК при помощи обратной транскриптазы. При помощи другого фермента -РНК-полимеразы происходит транскрипция РНК с кДНК, что приводит к образованию от 100 до 1000 копий ампликона РНК ВГС в одном цикле реакции. К этим РНК-апликонам присоединяется праймер № 2 с дальнейшим синтезом кДНК-копий и разрушением молекулы РНК. Присоединение праймера №1 на кДНК с последующей достройкой двухцепочечной ДНК запускает следующий цикл амплификации. Учет результатов реакции осуществляют на люменометре, так как образовавшиеся РНК-ампликоны специфически взаимодействуют с ДНК-зондами, меченными хемилюминафорами.
В качестве преимуществ ТМА-метода при выявление РНК ВГС отмечают:
проведение реакции при более низких температурах по сравнению с ПЦР;
образование большего числа ампликонов в одном цикле реакции, что уменьшает время, необходимое для получения конечного результата (30-40 минут), и повышает чувствительность реакции (50 копий /мл.) [45].
снижение риска контаминации, так как РНК менее устойчива, чем ДНК. Сравнительные исследования по детекции РНК ВГС при помощи ТМА и другими методами продемонстрировали высокий уровень совпадений результатов [45].
Сочетание принципов гибридизации и амплификации лежит в основе метода выявления РНК ВГС, обозначенного как "Метод гибридизации с использованием разветвленных зондов или Branched DNA assay (bDNA) [46]. В отличие от ПЦР в данном тесте осуществляется амплификация не молекул кДНК ВГС, а сигнала. Реакция проводится в 96 луночных планшетах, на которых адсорбированы фрагменты РНК ВГС из 5' нетранслируемой зоны и core-гена РНК ВГС. За счет последующего связывания с синтетической молекулой разветвленной ДНК и гибридизацией с пробой, меченной щелочной фосфотазой с усилителем и последующей ферментативной реакцией достигается резкое увеличение полученного сигнала. В настоящее время на диагностическом рынке появились диагностикумы третьего поколения (Вауег 3.0 Hepati-tis С Virus RNA Quantitation by bRNА), обладающие чувствительностью, позволяющей выявлять 520 IU/ml (2500 копий РНК ВГС).
КОЛИЧЕСТВЕННОЕ ВЫЯВЛЕНИЕ РНК ВГС. Для оценки концентрации РНК ВГС применяют количественный вариант ПЦР. Первоначально концентрацию РНК ВГС пытались охарактеризовать порядковыми величинами, например"+","++" и т.д., визуально отражающими интенсивность полос, полученных при электрофорезе продуктов амплификации, или же методом конечных разведений, т.е по наличию позитивного результата в конечной точке титрования. Трудности стандартизации всех этапов ПЦР не позволяют объективно оценить концентрацию РНК ВГС, что приводит к существенным ошибкам трактовки полученных результатов.
В настоящее время результаты исследования выражают в количественных единицах: количество копий РНК ВГС, содержащихся в 1 мл., в абсолютном или логарифметическом выражении (log 10). Исходя из того, что концентрация обнаруженной РНК ВГС отражает количество вирусных частиц, данный показатель обозначают как "вирусный эквивалент (eq)", с добавлением приставки k (килограмм, тысяча) или М (миллион). Еще одним способом выражения количества вирусных частиц являются их весовые эквиваленты. Например, в граммах или пикограммах (1 pg соответствует приблизительно 1 миллиону eq). Разнообразие применяемых величин создает трудности трактовки результатов, полученных в различных лабораториях. Поэтому комитет экспертов ВОЗ по биологической стандартизации изготовил "международный стандартный образец", содержащий РНК ВГС (лиофильновысушенная сыворотка крови, содержащая РНК ВГС 1-го генотипа), концентрация которой выражена в международных единицах (IU/mL) [47]. Специальные коэффициенты позволяют пересчитывать полученные показатели концентрации в международные единицы.
Для определения концентрации РНК ВГС применяют практически все варианты ПЦР. При этом к диагностическим препаратам предъявляется ряд специфических требований, важнейшим из которых является строгая линейность результатов, т.е. увеличение сигнала регистрируемой реакции при увеличении концентрации РНК ВГС в исследуемом образце. Применение внутренних стандартов с различным содержанием РНК ВГС позволяет избежать многих методических ошибок, которые могут отразиться на конечном результате реакции [28]. Чувствительность применяемых диагностикумов (Amplicor HCV Monitor v2.0; LCx HCV RNA Quantitative Assay) позволяет выявлять РНК ВГС, начиная с 50 копий в мл [48,49], что особенно важно для прогнозирования эффективности избранной противовирусной терапии.
ПЦР в реальном времени ("Real-time RT PCR") -один из наиболее перспективных вариантов количественного метода выявления РНК ВГС. Метод и его аппаратное обеспечение совместно разработаны специалистами фирм "Roche" и "Percin Elmer". Принцип метода заключается в способности гидролизовать последовательности кДНК в направлении 5'---- 3'. В реакции применяется специальный зонд, меченный двумя флюоресцентными красителями, имеющими близкие максимумы поглощения и флюоресценции. При наличии продуктов амплификации Tag-полимераза расщепляет зонд, что приводит к предотвращению переноса энергии от одной молекулы красителя к другой, и тем самым предотвращает выход кванта света. Специальный прибор осуществляет учет реакции и математическое моделирование кинетики флюоресценции на каждом этапе реакции, что позволяет получить информацию об исходной концентрации РНК ВГС.
Отличительной особенностью "ПЦР в реальном времени" считают возможность получать информацию о наличии РНК ВГС непосредственно в процессе реакции, что позволяет уменьшить время анализа в сочетании с высокой чувствительностью и линейностью получаемых результатов [50]. По данным Татьяны Яшиной с соавторами, данный метод позволяет выявлять от 200 копий РНК ВГС в мл. [51].
МЕТОДЫ ГЕНОТИПИРОВАНИЯ РНК ВГС. Определение принадлежности ВГС к определенному генотипу и субтипу нашло свое применение для решения не только чисто научных, но и практических вопросов. Например: поиск источника инфекции во время вспышек гепатита С или прогнозирование эффективности применяемой терапии.
"Золотой стандарт" генотипирования ВГС - непосредственное определение первичной структуры РНК ВГС с его последующим филогенетическим анализом [52], что позволяет четко охарактеризовать данный изолят вируса. Получить эту информацию возможно при использовании следующих вариантов секвенирования:
прямого;
на основе стандартного клонирования;
секвенирования продуктов ПЦР реакции (Limited-sequencing).
Несмотря на точность получаемого результата, метод непосредственного секвенирования не используется в практическом здравоохранении из-за технических сложностей проведения исследования и высокой стоимости работ. Вместе с тем наличие информации о первичной структуре РНК ВГС является референтным методом генотипирования, а наличие приборов для автоматического секвинирования упрощает получение результата.В настоящее время в большинстве случаев для генотипирования РНК ВГС применяются методы, основанные на использовании ПЦР с типоспецифическими праймерами. Впервые генотипирование РНК ВГС проведено Н. Okamoto с соавторами в 1992 году при помощи RT-ПЦР [53], включающего два этапа амплификации. Первый из них проводился с универсальными, для всех генотипов ВГС, праймерами, второй со смесью типоспецифических праймеров с получением специфических продуктов амплификации различной длины. О наличии того или иного генотипа судили по размеру амплифицированного продукта. В качестве праймеров используются типоспецифические зонды, информация о которых расположена в 5'UTR, Core или NS5 - областях РНКВГС[54].
Гибридизация амплифицированных продуктов с адсорбированными геноспецифическими зондами (из 5'-нетранслируемой зоны РНК ВГС), адсорбированными на нитроцеллюлозной мембране, лежит в основе теста - обозначенного "INNO-LiPA HCV, INNO-GENETICS" [55]. Первоначально с помощью этого теста удавалось типировать генотипы: la; lb; 2a; 2b;3a; 3Ь; 4 и 5а. В дальнейшем тест-системы 2-го поколения "INNO-LiPA HCV II , INNOGENETICS" позволяют различать все 6 генотипов и дополнительно 2с; 2d; 2i; 3с; 4a-h; 6а и 10а. [56]
Методический арсенал определения генотипов ВГС не ограничивается вышеперечисленными способами и включает в себя разнообразные методы:
генотипирование на основе анализа профилей рестрикции амплифицированных продуктов (RFLP). Продукты амплификации фрагментов РНК ВГС (5'UTR - область или NS5 область РНК ВГС) расщепляются рестриктазами. Образовавшиеся фрагменты различаются по длине в зависимости от имеющихся внутри них сайтов рестрикции, по которым идет расщепление. Результаты электрофореза и их сравнение позволяют идентифицировать генотип ВГС в исследуемом образце [57]. Сравнение результатов генотипирования методом ПЦР- RFLP с данными секвинирования продемонстрировало высокий уровень совпадения результатов - 95% [58]. генотипирование на основе метода SSCP (оценки конформационного полиморфизма одноцепочечных фрагментов ДНК). В качестве объекта исследования выбран 5'-нетранслируемый регион РНК ВГС, который обладает минимальным набором нуклеотидных вариаций, отличающих генотипы друг от друга. Этот факт определяет возможность применить общие праймеры при генотипировании [59]. СЕРОТИПИРОВАНИЕ Анти-ВГС стало возможным благодаря исследованиям P.Simmonds с соавторами, установившим наличие антител, направленных к генотипспецифичным эпитопам, информация о которых кодирована NS4 зоной РНК ВГС [60]. При помощи диагностикума для ИФА, сконструированного на основе синтетических пептидов, удалось разграничить случаи гепатита С, вызванные вирусами 1, 2 и 3 генотипа (89% совпадения с результатами генотипирования). Разработка тестсистем с использованием синтетических и рекомбинантных антигенов, кодированных NS4 и Core зонами РНК ВГС, позволила расширить перечень типируемых вариантов вируса, а также судить о наличии подтипов (1а, lb, 2a, 2Ь, За, и 4а) [61,62]. В настоящее время осуществляется коммерческий выпуск диагностических препаратов для проведения серотипирования как в плашечном варианте проведения ИФА - "Мurех НС 1-6 Serotyping Assay, Murex Diagnostics", так и в варианте "иммуноблот" - RIBA HCV Serotyping Assay, Chiron Diagnostics. Сравнительные данные результатов серотипирования и генотипирования РНК ВГС продемонстрировали высокий уровень совпадения результатов, достигая 95% [62].
Серотипирование анти- ВГС по сравнению с генотипированием РНК ВГС обладает такими преимуществами, как простота проведения реакции и более низкая стоимость. Вместе с тем, этот метод ни в коем случае не может заменить генотипирование. Результаты серотипирования анти-ВГС свидетельствуют о типовой принадлежности анти-ВГС при текущей или ранее перенесенной инфекции. В некоторых случаях (наиболее часто у больных гемофилией) регистрируется одновременное выявление анти-ВГС различных подтипов, что может свидетельствовать о множественном инфицировании различными субтипами и генотипами ВГС [63]. Кроме того, у пациентов с гепатитом С на фоне выраженного иммунодефицитного состояния РНК могут быть единственным маркером, что делает невозможным проведение серотипирования.
ВЫЯВЛЕНИЕ и ТРАКТОВКА РЕЗУЛЬТАТОВ ТЕСТИРОВАНИЯ СЕРОЛОГИЧЕСКИХ МАРКЕРОВ ВГС-ИНФЕКЦИИ. Наличие широкого спектра серологических маркеров текущей или предшествующей ВГС инфекции, а также современная методологическая база позволяют решить многие задачи лабораторной диагностики и профилактики гепатита С. В таблице № 2 представлены серологические маркеры ВГС инфекции и наиболее важные направления их тестирования.
Таблица 2
Диагностическая значимость маркеров текущей или предшествующей ВГС инфекции
Маркер
Скрининг
в службе
кровиПодтвер-
ждение
результата
+ анти-ВГСДиагнос-
тика
заболева-
нияМонито-
ринг
леченияПрогноз
эффектив-
ности
леченияЭпидеми-
ологические
исследова-
нияАнти-ВГС
+
+
+
Спектр
Анти-ВГС
+
+
+
+
IgM
Анти-ВГС
+
+
+
+
Core Ag ВГС
+
+
+
+
+
+
РНК ВГС
+
+
+
+
+
РНК ВГС
Количество
+
+
Генотип ВГС
+
+
Серотип ВГС
+
+
Одной из главных задач лабораторной диагностики гепатита С является постановка диагноза и разграничение острого от хронического гепатита С при помощи выявления серологических маркеров инфицирования. Так же как и при других острых вирусных гепатитах, серологические маркеры инфицирования ВГС последовательно появляются и исчезают по ходу инфекции и процесса выздоровления (Рисунок 2).
РНК ВГС удается обнаружить на 7 - 21-й день после инфицирования ВГС, а анти-ВГС на 20 - 150-й день (в среднем 50-й день) [64]. Спектр анти-ВГС может различаться в зависимости от периода острого гепатита. Считается, что первыми удается определить антитела, кодированные Core и NS5 зоной РНК ВГС. Анти-ВГС к белкам, кодированным NS4 зоной, в острую фазу гепатита С отсутствуют [65]. Сравнительное изучение уровня концентраций анти-ВГС, спектра анти-ВГС и РНК ВГС у больных острым и хроническим гепатитом продемонстрировало некоторые различия [66]. На наш взгляд, эти различия могут быть связаны с индивидуальными особенностями инфекционного процесса, что снижает их диагностическую ценность.
Рис. 2. Острый гепатит С
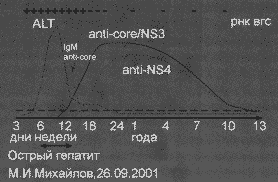
По аналогии с лабораторной диагностикой гепатита А и В ожидали, что определение антител к ВГС класса IgM будут иметь столь же большое диагностическое значение как IgM анти-ВГА и IgM анти-НВс. Однако данные тестирования сывороток крови больных острым и хроническим гепатитом С на наличие IgM анти-ВГС указывают на частое их выявление среди этих больных - 50-93% и 50-70% соответственно [67,68], эти результаты свидетельствуют, что обнаружение IgM анти-ВГС не может быть использовано как маркер острой ВГС инфекции.
Отсутствие маркера, претендующего на роль "золотого" стандарта острого гепатита С, определяет необходимость комплексной оценки полученных результатов, основанных на динамическом наблюдении за пациентом.
Не менее важное направление использования высокочувствительных методов тестирования РНК ВГС - снижение риска развития посттрансфузионного гепатита С. Необходимость таких работ определяется наличием фазы "окна", т.е. временем между первым обнаружением РНК ВГС и появлением анти-ВГС , а также существованием доноров крови (больных хроническим гепатитом С), у которых имеются РНК ВГС при отсутствии анти-ВГС. Современная система контроля донорской крови на наличие ВГС включает только тестирование анти-ВГС, риск заражения гепатитом С сохраняется. Исходя из этого правомерна постановка вопроса о тестировании крови на наличие РНК ВГС современными методами (методы NAT - "nucleic acid amplification test"). Фактор, ограничивающий эту работу, - высокая цена исследований. Для сокращения затрат рекомендуется тестирование пулов сывороток крови (от 8 до 96 образцов) с последующим поиском позитивного образца в случае выявления РНК ВГС в пуле сывороток. Учитывая фактор разведения искомой РНК ВГС при пулировании сывороток крови, принципиальным становится вопрос о применении наиболее чувствительных методов детекции. Считается, что использование диагностических наборов для NAT - с чувствительностью 50-100 IU/mL позволяет значительно уменьшить риск посттрансфузионного гепатита С.
Несомненно, перечень вопросов, которые можно решить при тестировании всего спектра маркеров ВГС-инфекции, не исчерпывается этими двумя направлениями. Наличие современных методов тестирования в совокупности со знанием их возможностей открывает широкие перспективы научных и прикладных работ по гепатиту С.
Литература:
1 .Choo QL, Kuo G, Weiner AJ, et al. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 1989Apr21;244(4902):359-62.
2.Yuasa T, Ishikawa G, Manabe S, et al. The particle size of hepatitis С virus estimated by fil-tration through microporous regenerated cellulose fibre. J Gen Virol 1991 Aug;72 ( Pt 8):2021-4
3. Prince AM, Huima-Byron T, Parker TS, Levine DM. Visualization of hepatitis С virions and putative defective interfering particles isolated from low-density lipoproteins. J Viral Hepatl996Jan;3(l):ll-7.
4. Kato N, Ootsuyama Y, Tanaka T, et al.. Marked sequence diversity in the putative envelope proteins of hepatitis С viruses. Vims Res 1992 Feb;22(2):107-23.
5. Bukh J., The hepatitis С virus. American Association for the Study of Liver Diseases Post-graduate Course 2000, Update on Viral Hepatitis, October 27-28, 2000, Dallas, Texas. P. 102-111.
6. Львов Д.К., Миширо С., Селиванов Н.А. и др. Распространение генотипов вируса гепатита С, циркулирующих на территориях Северо-Западной и Центральной частей России.// Вопросы вирусологии, 1995, N6, с.251-253.
7. Кузин С.Н., Лисицина Е.В., Самохвалов Е.И и др. Распространение гепатита С и отдельных генотипов вируса гепатита С в регионе с умеренной активностью эпидемического процесса. // Вопросы вирусологии, 1999, N2, с.79-82.
8. Bukh J., Miller R.H., Purcell R.H. Genetic heterogeneity of hepatitis С virus: quasispecies and genotypes. Semin Liver Dis 1995 Feb;15(l):41-63.
9. Gretch D.R., Diagnostic test for hepatitis C,< Hepatology, 1997,Sep;26;Suppll;43-47S.
10. Barrera J.M., Francis B.,Ercilla G. Et al., Improved detection of anti-HCV in post-transfusion hepatitis by a third-generation ELISA, Vox Sang 1995; 69: 15-18
11. Huber K.R. Sebesta С. Bauer К. Detection of common hepatitis С virus subtypes with a third-generation enzyme immunoassay. Hepatology 1996, 24; 471-473.]
12. Pawlotsky J.M. Diagnostic tests for hepatitis C. Journal of Hepatology, Suppl. 1, Vol 31,1999,71-79.
13. Georg S., Klinzman D., Schmidt W.N. et al. Antibody negative HCV infection in HIV-positive individuals. Antiviral Therapy., 2000; 5 (Suppl. 1), 10th International, Symposium on Viral Hepatitis and Liver Disease: p. 70. 14 Busch. M. P., Laycock M. E., Mohr В., et al. Failure of Serologic Assays for Diagnosis of Hepatitis В and C Virus Infections in Patients with Advanced HIV. 8th Conference "Retroviruses and Opportunistic Infections", Chicago, Feb.4-8., 2000, p. 235.
15. Schroter M, Feucht HH, Schafer P, et al. Definition of false-positive reactions in screening for hepatitis C virus antibodies. J Clin Microbiol 1999 Jan;37(l):233-4
16. Hernandez-Aguado I, Bolumar F, Moreno R, et al.,False-positive tests for syphilis associated with human immunodeficiency virus and hepatitis В virus infection among intravenous drug abusers. Valencian Study Group on HIV Epidemiology. EurJ Clin Microbiol Infect Dis 1998 Nov;17(ll):784-7
17. Sonmez E, Ozerol IH, Senol M, et al.. False-positive reaction between syphilis and hepatitis C infection. Isr J Med Sci 1997Nov;33(ll):724-7
18. de Medina M, Hill M, Sullivan НО, et al. Detection of anti-hepatitis С vims antibodies in patients undergoing dialysis by utilizing a hepatitis С virus 3.0 assay: correlation with hepatitis С vims RNA. J. Lab Clin Med 1998 Jul;132(l):73-5
19. Pawlotsky JM, Bastie A, Pellet C, et al., Significance of indeterminate third-generation hepatitis С vims recombinant immunoblot assay. J Clin Microbiol 1996 Jan;34(l):80-3
20. Chen PJ, Hwang LH, Chang LY et al, Immunoglobulin M antibodies against hepatitis С vims antigens: significance and applications. Gastroenterol Jpn 1993 May;28 Suppi 5:67-70 21.Stevenson DL, Harris AG, Neal KR, Irving WL.The presence ofrheumatoid factor in sera from anti-HCV positive blood donors interferes with the detection ofHCV-specific IgM. Trent HCV Study Group. J Hepatol 1996 Nov;25(5):621-6
22. Pawlotsky JM, Remire J, Darthuy F, Is the detection of anti-hepatitis С vims core IgM influ-enced by the presence of serum rheumatoid factor. J Med Virol 1995 Jan;45(l):68-70
23. Krawczynski K, Beach MJ, Bradley DW, et al., Hepatitis С vims antigen in hepatocytes: immunomorphologic detection and identification. Gastroenterology 1992 Aug;103(2):622-9
24. Gonzalez-Peralta RP, Fang JW, Davis GL, et al.,Optimization for the detection of hepatitis С vims antigens in the liver. J Hepatol 1994 Jan;20(l):143-7
25. Komatsu F, Takasaki K. Determination of serum hepatitis С vims (HCV) core protein using a novel approach for quantitative evaluation of HCV viraemia in anti-HCV-positive patients. Liver 1999 Oct;19(5):375-80
26. Aoyagi K, lida K, Ohue C, et al., Performance of a conventional enzyme immunoassay for hepatitis C vims core antigen in the early phases of hepatitis C infection. Clin Lab 2001:47(3-4):119-27
27. Peterson J, Green G, lida K, et al., Detection of hepatitis C core antigen in the antibody negative 'window' phase of hepatitis C infection. Vox Sang 2000;78(2):80-5
28. Момыналиев K.T, Говорун В.М.. Перспективы применения методов ДНК-диагностики в лабораторной службе. Клиническая лабораторная диагностика, 2000, № 4., с.25-32.
29. SchifFER, de Medina M, Kahn RS. New perspectives in the diagnosis of hepatitis C. Semin Liver Dis 1999;19 Suppl 1:3-15
30. Negro F, Pacchioni D, Shimizu Y, et al.,Detection ofintrahepatic replication of hepatitis C virus RNA by in situ hybridization and comparison with histopathology Proc Nati Acad Sci USA,1992,Mar,15;89(6):2247-51
31. Moldvay J, Deny P, Pol S, et al.Detection of hepatitis C vims RNA in peripheral blood mononuclear cells of infected patients by in situ hybridization. Blood 1994 Jan 1;83(1):269-73
32.Arrieta JJ, Rodriguez-Inigo E, Ortiz-Movilla N, et al., In situ detection of hepatitis C vims RNA in salivary glands. Am J Pathol 2001 Jan;158(l):259-64
33. Nouri Aria KT, Sallie R, Sangar D, et al.,Detection of genomic and intermediate replicative strands of hepatitis C vims in liver tissue by in situ hybridization. J Clin Invest ,1993 May; 91(5):2226-34
34.Garson JA, Tedder RS, Briggs M, et al.. Detection of hepatitis C viral sequences in blood do-nations by "nested" polymerase chain reaction and prediction ofinfectivity. Lancet 1990 Junl6;335(8703):1419-22
35.Roth W.K. and Zeuzem S. Serological and molecular diagnosis of hepatitis C vims infection. In book- Hepatitis C 1997: Essays and expert opinions on its natural history, epidemiology, di-agnosis and terapy Abbott Diagnostics Division, 1997, 77-85
36. Damen M, Cuypers HT, Zaaijer HL, et al. International collaborative study on the second EUROHEP HCV-RNA reference panel. J Virol Methods 1996 Apr 26;58(1-2): 175-85
37.Исаева О.В.,ГущинА.Е., Малышев B.C. и др. Федеральная система внешнего контроля качества выявления HBsAg, анти-ВГС и РНК ВГС: 1996-2001 годы. Тезисы докладов IV Российской научно-практической конференции, "Гепатит В,С и D - проблемы диагностики, лечения и профилактики", Москва, 2001 г., 151-153.
38. Lemez-Ville M, Kunstmann JM, De Almeida M, et al. Detection of hepatitis C vims in the semen of infected men. Lancet,2000,1 ;356(9223):42-3.
39. Cuypers HT, Bresters D, Winkel IN, et al.. Storage conditions of blood samples and primer selection affect the yield of cDNA polymerase chain reaction products of hepatitis C vims. : J Clin Microbiol 1992 Dec;30(12):3220-4.
40. Vanthiel D.H., Polymerase Chain-Reaction for the detection of HCV- RNA - cryoglobuline-mia as a cause for false-negative results. Italian Journal of Gastroenterology and Hepatology, 1997, Jun; 29(3):273-274.
41. EstebanJ.I.,Martell M., Nitscho H., et al. Automated sample extraction for quantitative HCV RNA testing: towards full automation of viral load testing. J of Hepatology, V 34, Suppl. № 1, April 2001, , Abstract of the 36th Annual Miting of the European Association for the Study of the liver. P. 130.
42. Leckie G., Abravaya K., Lampinen et al Sensitive quantition of hepatitis C vims RNA using an Abbott LCx assay. . Antiviral Therapy, 2000; 5 (Suppl. 1), 10th International, Symposium on Viral Hepatitis and Liver Disease: C. 6.
43.Sillekens P., KokW., Van Gemen B. et al. Specific detection of HCV-RNA using NASBA as a diagnostic tool. In Groupe francaise d'etudes moleculaires des hepatitis (GEMHEP), ed. Hepatitis C vims: new diagnostic tools. Paris: John Libbey Eurotext., 1994, 71-82
44.Tsumoka M., Fujii T. Rapid and specific detection of RNA base sequence using fluorescence polarization. Nucleic Acids Symp Ser 1999; (42): 239-240
45. Sarrazin ,G. Teuber, R.Kokka et al.,Detection of Residual Hepatitis C Virus RNA by Tran-scription-Mediated Amplification in Patients With Complete Virologic Response According to Polymerase Chain Reaction-Based Assays. Hepatology, 2000 , 32, № 4, р.818-823.
46. Alter H.J., Sanchez-Pescador R., Urdea M.S., et al Evaluation of branched DNA signal amplification for the detection of hepatitis C vims RNA. J Viral Hepat 1995;2(3):121-32
47. Saldanha J, Leiie N, Heath A. Establishment of the first international standard for nucleic acid amplification technology (NAT) assays for HCV RNA. WHO Collaborative Study Group.Vox Sang, 1999;76(3): 149-58
48.Castro FJ, Sauleda S, Esteban JI, et al. Evaluation of hepatitis C vims RNA RT/PCR qualitative and quantitative second generation assays. J Virol Methods 2001 Jan;91(l):51-8
49.Pawlotsky J.M., JilgW.ZanettiA.R. et al. Multi-center evaluation of the LCx HCV RNA quantitative assay. J.of Hepatology, Vol.34, №1, April 2001, Abstract of the 36th Annual Miting of the European Association for the Study of the liver. P. 128.
50.Germi R., Crance J.M., Garin D. et. Real-teme RT-PCR quantification: a new method to study hepatitis C vims adsortion on vero cells. Vol.34, №1, April 2001, Abstract of the 36th An-nual Miting of the European Association for the Study of the liver. P. 117.
51.YashinaT, MamV, Golberg E., SevallJ.S., Real-teme RT-PCR for quantitative detection of hepatitis C viral RNA. . Antiviral Therapy, 2000; 5 (Suppl. 1), 10th International, Symposium on Viral Hepatitis and Liver Disease: Abstract C004.
52.Simmonds P, Holmes EC, Cha ТА et al. Classification of hepatitis C vims into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region. J Gen Virol 1993Nov;74(Ptll):2391-9.
53. Okamoto H, Sugiyama Y, Okada S, et al.Typing hepatitis C vims by polymerase chain reac-tion with type-specific primers: application to clinical surveys and tracing infectious sources. J Gen Virol 1992 Mar;73 ( Pt 3):673-9
54.Chayama K Genotyping Hepatitis C Vims by type-specific primers for PCR based on NS5 region. Hepatitis C Protocols, Edited by Johnson Yiu-Nam Lau, MD, Humana Press, 1998, p.165-173
55. Stuyver, L., Rossau, R., Wyseur, A., Duhamel, M., Vanderborght, В., Van Heuverswyn, H., and Maertens, G. (1993) Typing of hepatitis C virus isolates and characterization of new sub-types using a line probe assay. J. Gen Virol. 74,1093-1102.
56. Maertens G., Stuyever L. HCV Genotyping by the Line Probe Assay INNO-LiPA HCV II. Hepatitis С Protocols, Edited by Johnson Yiu-Nam Lau, MD, Humana Press, 1998, p.183-198
57. F Davidson, P Simmonds, JC Ferguson, et al., Survey of major genotypes and subtypes of hepatitis С virus using RFLP of sequences amplified from the 5' non-coding region J Gen Virol 1995 76: 1197-1204.
58. Thiers V, Jaffredo F, Tuveri R, et al.. Development of a simple restriction fragment length polymorphism (RFLP) based assay for HCV genotyping and comparative analysis with geno-typing and serotyping tests. J Virol Methods 1997 Apr;65(l):9-17
59. Ильина Е.Н., Гущин А.Е., Говорун В.М. Новые перспективы генодиагностики в установлении диагноза и мониторинге вирусных гепатитов В и С. Сборник тезисов докладов 3-й Всероссийской научно-практической конференции "Генодиагностика в современной медицине", Москва, 2000, стр.216-218.
60.Simmonds P., Rose K.A., Graham S., et al., Mapping of serotype-specific, immunodominant epitopes in the NS-4 region of hepatitis С virus (HCV): use of type-specific peptides to serologi-cally differentiate infections with HCV types 1, 2, and 3. J Clin Microbiol 1993;31:1493-1503.
61.Мукомолов С.Л., Колобов А.А., Плотникова В.А. с соавт. Использование метода серотипирования для определения генотипов вируса гепатита С, циркулирующих в Санкт-Петербурге. Тезисы международного Фальк симпозиума № 92, СПб, с.266.
62.Schroter M., Feucht H., Schafer P., et al., Serological Determination of Hepatitis C Virus Subtypes la, Ib, 2a, 2b, За, and 4a by a Recombinant Immunoblot Assay. Journal of Clinical Microbiology, 1999, Vol. 37, No. 8, p. 2576-2580
63.Toyoda H, Fukuda Y, Hayakawa T, et al., Presence of multiple genotype-specific antibodies in patients with persistent infection with hepatitis С virus (HCV) of a single genotype: evidence for transient or occult superinfection with HCV of different genotypes. Am J Gastroenterol 1999 Aug;94(8):2230-6
64.0rland J.R.,Wright T.L. and Cooper S. Acute hepatitis C. Hepatology, Vol. 33. № 2, p.321-327.
65.Афанасьев А.Ю.,Зубов С.В., Жданов Ю.Е., Кривопускова А. В. ИФА-диагностика в разграничении гепатита С острого и хронического течения. Росс. журн. гастроэнтер., колопрокт., 1995, 5, № 3, прилож. 1, стр.12.
66.Саринсон С.Н. Особенности патогенеза и течения гепатита С. Оптимальные сроки лечения интерфероном. Вирусные гепатиты, 1998, №1 (2), стр. 3-8.
67.Chau KH, Dawson GJ, Mushahwar IK, et al., IgM-antibody response to hepatitis C virus an-tigens in acute and chronic post-transfusion non-A, non-B hepatitis. J Virol Methods 1991 Dec;35(3):343-52
68.Quiroga JA, Campillo ML, Catillo I, et al. IgM antibody to hepatitis C virus in acute and chronic hepatitis C. Hepatology 1991Jul;14(l):38-43
| Март 2003 г. |