ИНСУЛИННЕЗАВИСИМЫЙ САХАРНЫЙ ДИАБЕТ:
ОСНОВЫ ПАТОГЕНЕЗА И ТЕРАПИИА.С.Аметов
А.М.Грановская-Цветкова
Н.С.КазейРоссийская Медицинская Академия Минздрава РФ
Москва -1995
ПРЕДИСЛОВИЕ
Сахарный диабет - одна из серьезнейших проблем, масштабы которой продолжают увеличиваться и, которая касается людей всех возрастов и всех стран.
Сахарный диабет занимает третье место среди непосредственных причин смерти после сердечнососудистых и онкологических заболевании, поэтому решение многих вопросов, связанных с проблемой этого заболевания, поставлено во многих странах на уровень государственных задач.
В настоящее время во всем мире накоплены доказательства того, что эффективный контроль диабета может свести до минимума или предотвратить многие из связанных с ним осложнений.
Важнейшую роль в управлении сахарным диабетом, наряду с лекарственным обеспечением играет команда, состоящая из хорошо обученного медицинского персонала (врач, медицинская сестра, специалист по диетотерапии, специалист-психолог) и пациент, хорошо обученный и мотивированный на достижение поставленных целей.
Данное руководство разработано для профессионального обучения врачей - терапевтов, эндокринологов, диабетологов и является плодом международного сотрудничества Минздрава России, Европейского Бюро ВОЗ и фирмы Ново-Нордиск. Мы посчитали, что объединение усилий позволит получить наиболее значимые результаты, что полностью соответствует задачам, определенным Сант-Винцентской Декларацией и, конечно, соответствует основным направлениям Национальной Программы по борьбе с сахарным диабетом.
Главный диабетолог МЗМП РФ
профессор А.С.АметовПАТОГЕНЕЗ ИНСУЛИННЕЗАВИСИМОГО САХАРНОГО ДИАБЕТА
Важные исследования и их результаты, полученные за последние 10 лет, значительным образом повысили качество жизни многих больных сахарным диабетом. Однако, наряду с дальнейшим улучшением метаболического контроля, по-прежнему насущной остается задача постижения фундаментальных основ болезни, определение риска и понимание причин развития осложнений.
Инсулиннезависимый сахарный диабет (ИНСД) или сахарный диабет II типа представляет собой группу гетерогенных нарушений углеводного обмена. И это объясняет, в первую очередь, отсутствие единой общепринятой теории патогенеза данного заболевания, хотя современные достижения в понимании патофизиологии ИНСД и его многочисленных осложнений привели к выдающимся переменам в управлении этим распространенным заболеванием. Благодаря вкладу мировой биологической науки, уточнены многие аспекты патогенеза ИНСД и найдены некоторые пути нормализации обменных процессов при этом заболевании.
Генетическая основа инсулиннезависимого сахарного диабета. В настоящее время генетическая основа ИНСД не вызывает сомнении. Причем, следует отметить, что генетические детерминанты при ИНСД носят еще более важный характер, чем при сахарном диабете 1 типа. Подтверждением генетической основы ИНСД служит факт, что у однояицевых близнецов ИНСД развивается почти всегда (95- 100%) у обоих. В то же время генетический дефект, определяющий развитие ИНСД, до конца не расшифрован. С позиций сегодняшнего дня рассматриваются два варианта. Первый: два независимых гена вовлечены в патогенез ИНСД, один отвечает за нарушение секреции инсулина, второй вызывает развитие инсулинорезистентности. Рассматривается также вариант наличия общего дефекта в системе узнавания глюкозы В-клетками или периферическими тканями, в результате чего имеет место или снижение транспорта глюкозы, или снижение глюкозо-стимулированного ответа В- клеток.
Риск развития сахарного диабета II типа возрастает от 2 до 6 раз при наличии диабета у родителей или ближайших родственников.
Взаимосвязь инсулиннезависимого сахарного диабета и ожирения. Риск развития ИНСД увеличивается в два раза при ожирении 1 степени, в 5 раз при средней степени ожирения и более, чем в 10 раз при ожирении III степени. Причем, абдоминальное распределение жира более тесно связано с развитием метаболических нарушении (включая гиперинсулинемию, гипертензию, гипертриглицеридемию, резистентность к инсулину и сахарный диабет II типа), чем периферическое или распределение жира в типичных частях тела.
Гипотеза "дефицитного" фенотипа. В последние годы особый интерес вызывает гипотеза "дефицитного" фенотипа. Суть этой гипотезы заключается в том, что недостаточное питание в период внутриутробного развития или ранний постнатальный период является одной из основных причин замедленного развития эндокринной функции поджелудочной железы и предрасположенности к ИНСД.
Может показаться сомнительным, что явления, развивающиеся в первые два года существования ребенка, способны вызвать изменения эндокринных функции к 50- 70 годам жизни. Однако, следует отметить, что оплодотворенная яйцеклетка развивается в полноценный плод, проходя 42 цикла деления клеток, в то время как после рождения и в течение всей нашей жизни происходит лишь 5 дальнейших циклов деления. Причем, число делений клеток варьирует в различных тканях. У полноценного новорожденного имеется в наличии полный набор нейронов мозга, клубочков почек и лишь 50% набора бета-клеток поджелудочной железы взрослого. Поэтому влияние различных вредных факторов может отразиться на морфологии и функции бета-клеток с увеличением возраста.
"Истощение" поджелудочной железы. По мнению одного из ведущих экспертов в области патогенеза ИНСД Р. А. де Фронзо, инсулиннезависимый сахарный диабет возникает как следствие нарушения баланса между чувствительностью к инсулину и инсулиновой секрецией. Многочисленные исследования, посвященные этому вопросу, показали, что самым ранним признаком ИНСД является нарушение способности организма реагировать на инсулин. До тех пор, пока поджелудочная железа способна увеличивать секрецию инсулина, чтобы преодолеть инсулиновую резистентность, толерантность к глюкозе остается в норме. Однако, с течением времени бета-клетки утрачивают способность поддерживать достаточный уровень инсулиновой секреции, относительная инсулинопения приводит к нарушению толерантности к глюкозе и, постепенно, к явному сахарному диабету. Причина "истощения" поджелудочной железы до конца не изучена, так же как причина потери первой фазы в секреции инсулина при ИНСД.
Механизмы развития гипергликемии.
Хорошо известно о существовании двух основных источников поступления глюкозы в кровь:В свою очередь инсулин регулирует уровень глюкозы посредством двух механизмов. Во-первых, инсулин вызывает снижение продукции глюкозы печенью и повышение синтеза гликогена, во-вторых, повышает транспорт и метаболизм глюкозы в периферических тканях, в частности, в жировых и мышечных клетках.
- натощак глюкоза непосредственно продуцируется печенью,
- после еды глюкоза всасывается из пищи в кишечнике.
Кроме того, продукция глюкозы печенью контролируется глюкагоном и катехоламинами, которые стимулируют выброс глюкозы печенью и, следовательно, выступают как антагонисты действия инсулина.
Аналогично действию инсулина в данном случаем выступает глюкоза, которая по принципу внутренней обратной связи сама по себе подавляет продукцию глюкозы печенью.
Таким образом, зная основные источники поступления глюкозы в кровь и основные механизмы регулирования гликемии, можно заключить, что нарушение гомеостаза глюкозы при ИНСД возможно в результате патологии как минимум на трех различных уровнях:
Все перечисленные факторы в той или иной степени участвуют в патогенезе ИНСД. Какой из них лидирует? Общего мнения по этому вопросу нет, несмотря на огромный накопленный исследовательский материал.
- поджелудочная железа, где может произойти нарушение механизма распознавания глюкозы и вследствие этого нарушение секреции инсулина;
- периферические ткани, где клетки могут стать резистентными к инсулину, что приведет к недостаточному транспорту и метаболизму глюкозы;
- печень, где повышается продукция глюкозы, вызванная нарушением нормального механизма (обратная связь) ее подавления инсулином или глюкозой, либо, напротив, обусловленная избыточной стимуляцией глюкагоном или катехоламинами.
Причины нарушения секреции инсулина:
1) снижение массы бета-клеток поджелудочной железы,
2) дисфункция бета-клеток при их неизменном количестве,
3) сочетание снижения массы бета-клеток с их дисфункцией.Этиология потери массы бета-клеток при ИНСД до конца неизвестна. Исследования с использованием аутопсии показали уменьшение размеров островков Лангерганса и массы бета-клеток на 40-60 % от нормы. Рассматривая различные причины потери массы В-клеток и нарушения их функции, необходимо остановиться на феномене "глюкозотоксичности". Показано, что хроническая гипергликемия сама по себе может вызывать структурные нарушения островков и снижение секреции инсулина, одновременно гипергликемия уменьшает способность инсулина стимулировать захват глюкозы периферическими тканями. Не случайно, один из выдающихся диабетологов современности доктор Гарольд Рифкин предложил включить термин "глюкозотоксичность" в повседневный словарь врача-диабетолога.
В течение последних лет определенное внимание ученых-диабетологов было привлечено к работам, в которых отмечены изменения в морфологии бета-клеток, включая фиброз островков и накопление в них амилоида. Относительно недавно обнаружено, что амилоид состоит из специфического белка амилина, структуру которого составляют 37 аминокислот. В исследованиях in vitro показано, что амилин уменьшает захват глюкозы и подавляет секрецию инсулина изолированными бета-клетками. Выдвинута гипотеза, что в связи с первичным дефектом на уровне бета-клеток при ИНСД, характеризующимся нарушением превращения проинсулина в инсулин, амилин (участник этого процесса в норме) откладывается в бета-клетках и снижает в дальнейшем секрецию инсулина.
Одним из самых противоречивых разделов патогенеза ИНСД является вопрос о секреции инсулина при этом заболевании. В отличие от здоровых людей, у которых введение глюкозы вызывает транзиторное повышение гликемии и инсулинемии, у больных ИНСД базальные уровени инсулина чаще бывают в пределах нормы или повышены, а глюкозо-стимулированный выброс инсулина нарушен. Ниже, в таблице приводится анализ 32 публикации, касающихся базальнои секреции инсулина и реакции В-клеток на нагрузку глюкозой. Большинство исследователей отмечает, что при ИНСД имеет место потеря, так называемой, первой фазы секреции инсулина в ответ на внутривенную стимуляцию глюкозой.
Инсулиновый ответ на нагрузку глюкозой у больных ИНСД без ожирения (анализ 32 публикаций)
Уровень инсулина натощак Инсулиновый ответ на нагрузку глюкозой ранний поздний общий Сниженный 0 21 13 16 Нормальный 27 6 12 11 Повышенный 5 5 7 5
Несмотря на то, что ранний ответ инсулина "теряется", когда уровень глюкозы в плазме превышает 6,33 - 6,66 ммоль/л, базальные концентрации инсулина нормальны или даже повышены, отражая, таким образом, увеличение скорости секреции инсулина в ответ на повышение глюкозы натощак. При уровнях гликемии натощак 6,66 - 9,99 ммоль/л общий инсулиновый ответ может быть в норме, повышен или снижен, но обычно обратно пропорционален базальной гипергликемии. При уровнях глюкозы в плазме 9,99- 16,65 ммоль/л обе (ранняя и поздняя) фазы секреции инсулина становятся выраженно ослабленными.Итак, абсолютная реакция на глюкозу при ИНСД очень различна - от чрезмерно повышенной, особенно у больных с избыточным весом, до значительно сниженной у пациентов с тяжелой формой заболевания. Оценка продукции и секреции инсулина может проводиться лишь при сопоставлении уровней инсулинемии и гликемии. При значительно повышенных уровнях глюкозы становится ясно, что выброс инсулина в ответ на стимуляцию глюкозой при ИНСД фактически сильно нарушен.
В этой связи было выдвинуто предположение, что снижение реакции бета-клеток на глюкозу является первичным нарушением при этой патологии. Любой фактор, например ожирение, который повышает требования к бета-клеткам, может потенциально вызвать нарушение толерантности к глюкозе и сахарный диабет в основном за счет прогрессирующего нарушения выброса инсулина.
Существует мнение, что снижение реакции инсулина на глюкозу - это ранний, возможно генетический, маркер ИНСД. Причем, секреторный ответ бета-клеток на аргинин, глюкагон и катехоламины, как правило, в пределах нормы, что свидетельствует о селективном изменении при ИНСД глюкозочувствительного механизма.
Радиоиммунологический анализ иммунореактивного инсулина. Несмотря на чрезвычайную популярность радиоиммунологического анализа иммунореактивного инсулина, существует мнение, что современные методы иммунохимического определения уровня инсулина не позволяют получить полную картину секреции гормона, тогда как его истинный уровень достоверно снижен.
Считается , что радиоиммунологический анализ инсулина определяет сумму всех инсулино- и проинсулиноподобных молекул в плазме.
Снижение активности инсулина на периферии и в печени. Это одна из последних концепций, лежащих в основе патогенеза ИНСД. Она заключается в том, что, наряду со снижением секреции, происходит снижение активности инсулина на периферии и в печени. У больных с умеренной гипергликемией основной дефект заключается в снижении чувствительности к инсулину на уровне периферических тканей, главным образом в мышцах. При значительной гипергликемии натощак дополнительным фактором является повышенная продукция глюкозы печенью.
Инсулинорезистентность. Далеко не все ученые-диабетологи разделяют мнение, что снижение функциональной активности бета-клеток в отношении секреции инсулина является основной отличительной чертой ИНСД, многие из них считают, что в патогенезе этого заболевания главную роль играет резистентность периферических тканей к действию инсулина. Известно, что у части больных сахарным диабетом II типа нормальные базальные уровни инсулина не оказывают влияние на содержание глюкозы в крови, а в некоторых случаях даже повышенные уровни инсулина не могут нормализовать гликемию. Этот феномен называют инсулинорезистентностью.
Известно, что основными органами-мишенями для действия инсулина являются печень, мышечная и жировая ткань. Первый этап на пути действия инсулина на клетку заключается в связывании его со специфическими молекулами, расположенными на наружной поверхности мембраны клетки, называемыми рецепторами. Активированный инсулином рецептор включает цепь внутриклеточных процессов, типичных для реакции инсулина (запуск тирозин-киназной активности, усиление процессов фосфорилирования).
Клетка может стать резистентной на двух уровнях: на уровне рецептора к инсулину и на уровне послерецепторных путей. Кроме того, инсулинорезистентность может быть обусловлена продукцией измененной молекулы инсулина, с одной стороны, и феноменом неполной конверсии проинсулина в инсулин, с другой.
В основе продукции дефектной молекулы инсулина лежит мутация структурального гена инсулина, и в данном случае речь идет всего лишь об одном нарушении последовательности аминокислот в молекуле инсулина. В позиции 24 В-цепи вместо фенилаланина присутствует лейцин, что приводит к снижению биологической активности, при нормальном уровне иммунореактивного инсулина.
В результате дефекта структурального гена проинсулина превращение его в инсулин реализуется в неполной мере. Образуется избыток проинсулина, обладающего более низкой биологической активностью, чем инсулин. Проинсулин имеет выраженную перекрестную реакцию с инсулином, и при радиоиммунологическом анализе инсулина создается впечатление об его избытке.
Рассматривая феномен инсулинорезистентности при ИНСД, следует также обратить внимание на группу с названием - антагонисты инсулина в циркуляции крови. В эту группу следует включить: 1)контринсулярные гормоны; 2)антитела к инсулину; 3)антитела к рецепторам инсулина.
Применительно к контррегуляторным гормонам следует отметить, что перечень их хорошо известен (гормон роста, кортизол, тиреоидные гормоны, тиреотропин, плацентарный лактоген, пролактин, АКТГ, глюкагон, катехоламины), а механизм их контринсулярного действия достаточно изучен, хотя есть еще целый ряд вопросов, нуждающихся в уточнении. В первую очередь речь идет об инсулинорезистентности, вызывающей нарушение контроля за продукцией глюкозы печенью. При ИНСД снижение продукции глюкозы печенью не происходит, что ведет к гипергликемии. Нарушение механизмов регуляции продукции глюкозы в печени может находиться на разных уровнях:
В существовании инсулиновой резистентности при ИНСД играют роль как рецепторные, так и пострецепторные дефекты. В последние годы в литературе появилось значительное количество данных о структуре и функциях инсулинового рецептора, а также механизмах его взаимодействия с инсулином. Фосфорилирование/дефосфорилирование ключевых внутриклеточных протеинов является важным сигнальным механизмом, который соединяет инсулиновое связывание и внутриклеточное действие инсулина. Инсулиновый рецептор представляет собой сложный гликопротеин, состоящий из двух альфа-субъединиц и двух бета-субъединиц, соединенных дисульфидными связями. Альфа-субъединица инсулинового рецептора располагается вне клетки и содержит домен инсулинового связывания, бета-субъединица направлена внутрь и представляет собой трансмембранный протеин. Фосфорилирование бета-субъединицы инсулинового рецептора с последующей активацией тирозинкиназы является важным вторым посредником действия гормона. У лиц, не страдающих сахарным диабетом, активность тирозинкиназы возрастает в линейной пропорции к уровню глюкозы в диапазоне физиологической концентрации инсулина в плазме, в то время, как у больных ИНСД и у лиц с избыточным весом активность тирозинкиназы снижена на 50% и более.
- недостаточое подавление инсулином продукции глюкозы, отражающее роль печени в общей инсулинорезистентности;
- резистентность к физиологическому подавляющему влиянию глюкозы вследствие длительной гипергликемии;
- абсолютное или относительное повышение активности контррегуляторных гормонов.
Уместно напомнить о теории запасных рецепторов, согласно которой в данную единицу времени в процессе взаимодействия инсулина с рецептором участвуют лишь 10% рецепторов, остальные 90% находятся в "свободном" состоянии. Причем, какой из рецепторов в данное время взаимодействует с инсулином - статистическая случайность.
Значительное количество исследований продемонстрировало, что связывание инсулина с моноцитами и адипоцитами у больных ИНСД снижается в среднем до 30%. Снижение связывания инсулина возникает в результате уменьшения числа инсулиновых рецепторов, в то же время, сила притяжения инсулина не меняется. Кроме снижения числа инсулиновых рецепторов на поверхности клетки, возможны различные дефекты в интернализации рецепторов. Однако, следует осторожно оценивать эти явления. Есть факты, указывающие на то, что снижение связывания инсулина с рецептором не может в полной мере объяснить дефект действия гормона при ИНСД. В частности, уменьшение числа рецепторов к инсулину обнаружено только у 2/3 больных ИНСД, особенно у пациентов со значительной гипергликемией натощак.
Необходимо отметить, что у лиц с нарушением толерантности к глюкозе, скорее всего, существует лишь незначительный дефект связывания инсулина с рецептором, при этом у больных ИНСД с умеренной и тяжелой гипергликемией натощак развитие инсулинорезистентности обусловлено дефектом послерецепторного действия инсулина.
Таким образом, снижение количества рецепторов к инсулину играет определенную роль, но не является единственным фактором, способствующим развитию инсулинорезистентности.
В периферических тканях захват глюкозы снижается более, чем на 55%. В основе этого нарушения, с одной стороны, лежат процессы, в результате которых уменьшается число рецепторов к инсулину, с другой стороны, уменьшается число транспортеров глюкозы - белков, расположенных на внутренней поверхности клеточных мембран и обеспечивающих транспорт глюкозы внутрь клетки.
В настоящее время выделяют 2 класса транспортеров глюкозы - GluT:
1 - Na+ - котранспортеры, осуществляющие перенос глюкозы против градиента концентрации путем сопряжения захвата Na+ и захвата глюкозы.
II - облегченные транспортеры, осуществляющие перенос глюкозы путем усиления механизмов пассивного транспорта.За последние пять лет транспортеры глюкозы являлись предметом интенсивных исследований. Удалось расшифровать последовательность их ДНК, определить функцию. Было описано 5 транспортеров глюкозы с четким распределением их на уровне различных органов и тканей. В частности, GluT.1 и GluT.3 отвечают за основной, или учредительный, захват глюкозы, GluT.2 - транспорт глюкозы к гепатоциту и, частично, к эпителиальным клеткам тонкого кишечника и почек, GluT.4 - отвечает за инсулинстимулированныи захват глюкозы мышечной и жировой тканью, GluT.5 - межклеточный транспорт к эпителиальным клеткам.
Активность транспорта глюкозы при ИНСД широко изучалась, во многих исследованиях было показано, что в адипоцитах и в мышцах она падает.
Таким образом, при инсулинорезистентных состояниях максимально стимулированная активность транспорта глюкозы снижена. Эта резистентность связана с очевидным снижением транспортеров глюкозы в мышечной и жировой тканях и снижением транслокации транспортеров в ответ на инсулин.
Несмотря на наличие компенсаторной гиперинсулинемии натощак, в постабсорбционном состоянии выход печеночной глюкозы остается неизменным или увеличенным, в то время, как эффективность усвоения глюкозы тканями снижается. Продукция глюкозы печенью возрастает вследствие усиления глюконеогенеза. В мышечной ткани нарушение действия инсулина связано с изменением активности инсулинового рецептора тирозинкиназы, снижением транспорта глюкозы и уменьшением синтеза гликогена. На ранней стадии ИНСД основной дефект заключается в неспособности инсулина стимулировать усвоение глюкозы и отложение ее в виде гликогена.
Другие потенциальные механизмы, позволяющие объяснить невосприимчивость к инсулину, включают усиление окисления липидов, изменения в плотности капилляров скелетных мышц, нарушение транспорта инсулина через сосудистый эндотелий, увеличение уровня амилина, а также токсичность глюкозы.
КЛИНИКА И ДИАГНОСТИКА ИНСД
Как правило, ИНСД развивается у лиц старше 40 лет. Начало заболевания в большинстве случаев постепенное. За исключением редких случаев гипергликемических гиперосмолярных состояний, неосложненный сахарный диабет второго типа не проявляется классическими симптомами и не диагностируется в течение длительного времени. Выявление нарушения толерантности к глюкозе происходит либо случайно при рутинном скрининге, либо в ходе диспансерного обследования пациентов с заболеваниями, часто сочетающимися с ИНСД. При сборе анамнеза, ретроспективно выявляются первые симптомы заболевания: полидипсия, полиурия, потеря в весе, повышенная утомляемость, сниженная толерантность к физическим нагрузкам, повышенный аппетит, судороги в мышцах, транзиторные нарушения рефракции, подверженность инфекционным заболеваниям (кожи, мочевыводящих путей), зуд, сенсорные нарушения, снижение либидо и импотенция.
Гетерогенность ИНСД определяет характер дебюта заболевания:
Диагностика сахарного диабета.
- гипергликемия, повышенный уровень свободных жирных кислот в сыворотке крови - 100 %,
- ожирение - 80 %,
- гиперинсулинемия натощак - 80 %,
- эссенциальная гипертония - 50 %,
- дислипидемия (повышение триглицеридов, снижение ХС ЛПВП) - 50 %,
- сердечно-сосудистые заболевания - 30 %,
- диабетическая ретинопатия, нейропатия - 15 %,
- нефропатия - 5 %.
Угрожаемыми в плане развития ИНСД являются:
1) больные с вышеперечисленными симптомами,
2) пациенты с высокой степенью риска развития сахарного диабета - лица, у которых один из родителей болен диабетом; второй из близнецов, если один болен диабетом; матери, дети которых имели вес при рождении более 4500 г или врожденный порок развития; женщины, имеющие в анамнезе самопроизвольные аборты,
3) пациенты, имеющие заболевания, которые часто ассоциируются с диабетом (ожирение, артериальная гипертензия, поликистоз яичников),
4) пациенты с панкреатитом, гипертиреозом, акромегалией, феохромоцитомой, синдромом Кушинга,
5) пациенты, длительно получающие диабетогенную терапию (синтетические эстрогены, диуретики, кортикостероиды).Если при обследовании уровень глюкозы в крови натощак превышает (или равен) 140 мг% (7,8 ммоль/л) при двухкратном измерении, диагностируется сахарный диабет. В противном случае требуется проведение перорального теста на толерантность к глюкозе. По рекомендациям Всемирной организации здравоохранения, методика проведения глюкозо-толерантного теста следующая: утром натощак, после исследования гликемии, пациент принимает внутрь 75 г глюкозы, затем через 1 час и 2 часа после нагрузки исследуют капиллярную кровь на содержание глюкозы.
Классификация результатов орального теста на толерантность к глюкозе по рекомендациям ВОЗ (данные должны быть подтверждены двумя последовательными анализами)
УПРАВЛЕНИЕ ИНСУЛИННЕЗАВИСИМЫМ САХАРНЫМ ДИАБЕТОМ
Диагноз Гликемия натощак через 2 часа после нагрузки 75 г глюкозы Сахарный диабет 140 мг%
(7,8 ммоль/л)200 мг%
(11,1 ммоль/л)Нарушение толерантности к глюкозе 140 мг%
(7,8 ммоль/л)140 мг%, но не >200 мг%
(7,8-11 ммоль/л)Отсутствие диабета 100 мг%
(5,5- 5,7 ммоль/л)140 мг%
(7,8 ммоль/л)Главные задачи:
1. Добиться хорошего метаболического и биохимического контроля.
2. Предупредить развитие сосудистых осложнений.Способы решения:
диетотерапия,
физические упражнения,
медикаментозное лечение.Цели терапии ИНСД
В зависимости от возраста:
1) у пациентов молодого и среднего возраста - облегчение симптомов сахарного диабета и улучшение отдаленного прогноза,
2) у пожилых (пациенты старше 65 лет) - облегчение симптомов заболевания.По критериям, предложенным Европейской Группой по Формированию Политики в области ИНСД :
Показатель Уровень компенсации хороший удовлетворительный плохой Гликемия (ммоль/л) натощак 4,4 - 6,7 < 7,8 > 7,8 через 1 час после еды 4,4 - 8,9 < 10,0 > 10,0 Глюкозурия (%) 0 < 0,5 > 0,5 HbA1с (%) < 7 7 - 8 > 8 Общий холестерин (ммоль/л) < 5,2 5,2 - 6,5 > 6,5 Триглицериды (ммоль/л) < 1,7 1,7 - 2,2 > 2,2 ЛПВП (ммоль/л) > 1,1 0,9 - 1,1 < 0,9 Индекс массы тела (кг/кв.м) муж. < 25
жен. < 24< 27
< 26> 27
> 26АД (мм рт. ст.) < 140/90 < 160/95 > 160/95
Долгосрочное управление диабетом включает внимательное отношение к питанию, расходу энергии и медикаментозному лечению. Успех терапии зависит от того, насколько пациент вовлечен в программу лечения. Мотивация и поведение больного являются критическими факторами при составлении терапевтического плана.ДИЕТОТЕРАПИЯ ИНСД
Основные цели диетотерапии:
Современные рекомендации по диетотерапии ИНСД основываются на следующих фундаментальных правилах:
- предотвращение постпрандиальной гипергликемии,
- снижение избыточной массы тела,
- коррекция сопутствующей дислипидемии,
- снижение риска поздних осложнений,
- обеспечение необходимыми питательными веществами, витаминами и микроэлементами.
1) сокращение потребления калорий,
2) дробное питание (5- 6 раз в день),
3) исключение из рациона питания моно- и дисахаридов,
4) ограничение потребления насыщенных жиров,
5) снижение потребления холестерина (менее 300 г в день),
6) употребление продуктов с высоким содержанием пищевых волокон,
7) сокращение приема алкоголя (менее 30 г в день).Калорийность пищи расчитывается в зависимости от массы тела и характера энергетических затрат. Больным ИНСД рекомендуется назначать диету с калорийностью 20 - 25 ккал на килограмм реальной массы тела. При наличии ожирения суточный калораж снижается соответственно проценту избытка массы тела до 15 - 17 ккал на килограмм (1100- 1200 ккал. в сутки).
Показатели зависимости суточной потребности организма в энергии от массы тела (при абсолютном покое).
Тип сложения Отклонение массы тела от идеальной Дневная потребность в энергии (ккал/кг) Худой
Нормальный
Ожирение I- II ст.
Ожирение III ст.дефицит м.т.- 5% и более
избыток м.т. 5-10%
избыток м.т. 11 - 39%
избыток м.т.более 50%25
20
17
15
При расчете суточного калоража необходимо учитывать характер трудовой деятельности пациента.Расчет суточного калоража с учетом энергетических затрат на трудовую деятельность.
* суточный калораж в состоянии абсолютного покоя
Характер трудовой деятельности Общее количество энергии (ккал) Очень легкая
Легкая
Средне-тяжелая
Тяжелая
Очень тяжелаяА*+1/6 А
А+1/З А
А+ 1/2 А
А+2/3 А
А + АСостав дневного калоража должен быть следующим:
углеводы 50%, белки 15-20%, жиры 30-35%. Диета больного ИНСД всегда должна оказывать положительное влияние на липидный метаболизм. Основные принципы гиполипидемической диеты по рекомендациям Европейского Общества по Атеросклерозу представлены ниже:
Рекомендации Осневные источники 1. Снижение потребления жира Масло, маргарин, цельное молоко, сметана, мороженое, твердые и мягкие сыры, жирное мясо. II. Снижение потребления насыщенных жиров Свинина, утиное мясо, сосиски и колбасы, паштеты, сливки, кокосовые орехи. III. Повышенное употребление пищи с высоким содержанием белка и низким - насыщенных жирных кислот Рыба, цыплята, мясо индейки, дичь, телятина. IV. Увеличение потребления сложных углеводов, клетчатки из круп, фруктов и овощей. Все виды свежих и замороженных овощей, фруктов, все сорта зерновых, рис. V. Незначительное увеличение содержания простых ненасыщенных и полиненасыщенных жирных кислот. Подсолнечное, соевое, оливковое, рапсовое масла. VI. Сниженное потребление холестерина. Мозг, почки, язык, яица (не более 1-2 желтков в неделю), печень (не более двух раз в месяц).
Распределение жира в рационе должно быть следующим:
1/3 - насыщенные жиры (жиры животного происхождения)
1/3 - простые ненасыщенные жирные кислоты (растительные масла)
1/3 - полиненасыщенные жирные кислоты (растительные масла, рыба).Целесообразно включить в рацион питания продукты, богатые пищевыми волокнами (18-25 г в сутки), так как при этом улучшается утилизация углеводов тканями, уменьшается абсорбция глюкозы в кишечнике, значительно снижается гликемия и глюкозурия. Для контроля адекватности диетотерапии рекомендуется использовать систему подсчета "углеводных единиц", применение которой позволяет строго контролировать количество получаемых больным углеводов и облегчит самоконтроль.
Существует мнение, что снижение калоража в диете за счет сокращения насыщенных жиров может положительно влиять на липидный и липопротеиновый профиль, даже при отсутствии потери в весе у лиц без диабета. Сведения о роли таких изменений в диетотерапии у пациентов с ИНСД противоречивы. Противоречие касается вопроса - за счет каких продуктов должно сокращаться потребление насыщенных жиров: углеводов, моно- или полиненасыщенных жиров. По мнению известного диабетолога H.E. Lebovitz, лишь 5 - 8% пациентов с ИНСД могут контролировать гликемию сочетанием диеты и физической нагрузки, остальные 92% пациентов нуждаются в назначении сульфаниламидных препаратов.
ФИЗИЧЕСКИЕ НАГРУЗКИ В ЛЕЧЕНИИ ИНСД
ОПРЕДЕЛЯЮТСЯ
- вид
- интенсивность
- длительность
- частота
- расход энергии
возрастом, исходной физической активностью и общим состоянием пациента.Больным ИНСД рекомендуются ежедневные, однотипные, дозированные, адекватные физические нагрузки с учетом состояния сердечно- сосудистой системы, уровня артериального давления и толерантности к ним. Чем выше исходное артериальное давление, тем ниже переносимость физической нагрузки у пациентов с ИНСД.
Известно, что физические нагрузки снижают гликемию при исходной концентрации глюкозы в крови не более 14 ммоль/л, вызывают ее рост и усиливают кетогенез при гликемии более 14 ммоль/л в момент начала упражнений. Проведение физических нагрузок требует тщательного контроля гликемии до, во время и после нагрузки, а у пациентов с сопутствующими сердечно-сосудистыми заболеваниями - также контроля ЭКГ.
Влияние физических нагрузок на метаболизм, гормональную регуляцию и систему циркуляции.
Метаболизм и свертывающая система крови.
Гормональная регуляция
- повышение толерантности к глюкозе
- снижение уровня триглицеридов
- повышение уровня холестерина ЛПВП
- повышение фибринолитической активности крови
- снижение вязкости крови и агрегации тромбоцитов
- снижение уровня фибриногена
Система циркуляции
- снижение инсулинорезистентности и гиперинсулинемии
- снижение гормонов стресса
- повышение уровня эндорфинов
- повышение тестостерона
Наиболее предпочтительными физическими нагрузками у больных ИНСД являются ходьба, плавание, гребля, езда на велосипеде, лыжные прогулки. Для пожилых людей достаточно 30- 45 мин. ежедневной ходьбы.
- повышение эффективности сердечного выброса
- повышение электрической стабильности миокарда
- снижение потребления кислорода сердечной мышцей
- понижение артериального давления
- улучшение кровообращения в мышцах
Изменение образа жизни при ИНСД предполагает соблюдение диеты, режима физических нагрузок и уменьшение стресса.
УМЕНЬШЕНИЕ СТРЕССА:
Лечение ИНСД пероральными сахароснижающими препаратами
- изменение обстановки
- изменение представлений
- релаксация
Медикаментозное лечение должно быть назначено пациенту с ИНСД в том случае, если не удается достичь хорошего или удовлетворительного уровня гликемического контроля сочетанием диеты и физических нагрузок.
Пероральные сахароснижающие препараты или инсулин?
Фармакологическая альтернатива зависит от следующих факторов:Ингибиторы альфа-глюкозидазы.
- тяжесть заболевания (степень гипергликемии, наличие или отсутствие ее клинических симптомов),
- состояние больного (наличие или отсутствие сопутствующих заболеваний),
- предпочтение больного (если он хорошо информирован в отношении применения, ожидаемого терапевтического и возможных побочных эффектов, как пероральных препаратов, так и инсулина),
- мотивация больного,
- возраст и вес пациента.
Новые терапевтические возможности появились с открытием ингибиторов альфа-глюкозидазы, замедляющих всасывание углеводов в тонкой кишке. Псевдотетрасахарид акарбоза - глюкобай ("Байер", Германия) - эффективный ингибитор альфа-глюкозидазы, замедляет всасывание глюкозы в тонкой кишке, предупреждает значительное постпрандиальное повышение гликемии и гиперинсулинемию.Показания к терапии акарбозой при ИНСД:
Режим дозирования. Лечение начинают с дозы 0,05 г три раза в сутки. Далее, при необходимости, дозу можно повысить до 0,1 г , затем до 0,2 г три раза в сутки. Средняя доза акарбозы составляет 0,3 г. Увеличение дозы препарата рекомендуется производить с интервалом 1 - 2 недели. Таблетки следует принимать не разжевывая, с небольшим количеством жидкости, непосредственно перед едой.
- неудовлетворительный гликемический контроль на фоне диеты,
- "неудача" на ПСМ у пациентов с достаточным уровнем секреции инсулина,
- неудовлетворительный контроль при лечении метформином,
- гипертриглицеридемия у больных с хорошим контролем гликемии на диете,
- выраженная постпрандиальная гипергликемия на фоне инсулинотерапии,
- сокращение дозы инсулина у инсулинпотребных больных.
Акарбоза особенно эффективна в плане монотерапии у больных ИНСД с низким уровнем глюкозы крови натощак и высокой постпрандиальнои гликемией. Клинические исследования показали снижение уровня гликемии натощак на 10%, после еды - на 20- 30%, уровень гликозилированного гемоглобина на 0,6 - 2,5% через 12- 24 нед. лечения. Наш опыт применения акарбозы у пациентов с сахарным диабетом показал достоверное снижение постпрандиальной гликемии с 216, 5 +/- 4,4 до 158,7 +/- 3,9 мг%, гликозилированного гемоглобина с 10,12 +/- 0,20 до 7,95 +/- 0,16 %, уровня холестерина - на 9,8% от исходного и триглицеридов - на 13,3%.
Важным терапевтическим эффектом акарбозы является снижение постпрандиальной гиперинсулинемии и уровня триглицеридов в крови. Значение его велико, поскольку насыщенные триглицеридами липопротеины у больных ИНСД усугубляют инсулинорезистентность и являются независимым фактором риска развития атеросклероза.
Преимуществом препарата является отсутствие гипогликемических реакций, что особенно важно у пациентов пожилого возраста.
Побочные эффекты акарбозы:
Основным противопоказанием к применению акарбозы являются заболевания желудочно-кишечного тракта. Кроме того, препарат не рекомендуется пациентам с гастропарезом вследствие автономной диабетической нейропатии.
- вздутие живота,
- диарея,
- повышение активности трансаминаз,
- снижение сывороточного железа.
Производные сульфонилмочевины и акарбоза. При неудовлетворительном гликемическом контроле на фоне терапии сульфаниламидными препаратами наиболее часто применяется сочетание максимальной дозы глибенкламида и акарбозы в дозе 0,3 г в сутки. Акарбоза не меняет фармакокинетику глибенкламида. Сочетание ПСМ/акарбоза позволяет снизить среднесуточный уровень гликемии на 10- 20%, уровень HbA1c на 1- 2%.
Инсулин и акарбоза. У инсулинпотребных больных ИНСД было убедительно показано улучшение гликемического контроля и сокращение дозы экзогенного инсулина на фоне комбинированной терапии инсулин/акарбоза. Ингибиторы альфа-глюкозидазы особенно эффективны в случаях, когда постпрандиальная гипергликемия не контролируется моноинсулинотерапией.
Препараты сульфонилмочевины.
Основными показаниями к назначению сахароснижающих препаратов сульфонилмочевины (ПСМ) являются :
1) отсутствие компенсации углеводного обмена у пациентов с вновь выявленным ИНСД на фоне диетотерапии и рациональных физических нагрузок;
2) ИНСД у лиц с нормальной или избыточной массой тела в тех случаях, когда компенсация углеводного обмена была достигнута при назначении инсулина в дозе не более 20- 30 ед. в сутки.Характеристики, положенные в основу выбора ПСМ:
Условия, которые необходимо знать, чтобы правильно использовать препараты СМ:
- внутренняя антидиабетическая сила,
- скорость начала действия,
- продолжительность действия,
- метаболизм и экскреция,
- положительные и отрицательные побочные эффекты,
- возраст и психическое состояние больного.
1. ПСМ не эффективны у больных со значительной или полной потерей массы В- клеток.
2. По причинам, до сих пор не ясным, у части больных ИНСД ПСМ не проявляют свое антидиабетическое действие.
3. ПСМ не заменяют диетотерапию, а дополняют ее. Лечение ими неэффективно, если игнорируется диета.НАЧАЛО ТЕРАПИИ ПРЕПАРАТАМИ СУЛЬФОНИЛМОЧЕВИНЫ
1/3 - великолепный эффект
1/3 - хороший эффект
1/3 - неудовлетворительный эффектПосле 5 лет терапии около 50% больных из 1 и 2 подгрупп все еще имеют хороший ответ на прием препаратов СМ.
Противопоказания к назначению ПСМ:
1) инсулинзависимый сахарный диабет, панкреатический диабет,
2) беременность и лактация,
3) кетоацидоз, прекома, гиперосмолярная кома,
4) декомпенсация на фоне инфекционных заболеваний,
5) повышенная чувствительность к сульфаниламидам,
6) предрасположенность к тяжелым гипогликемиям у больных с выраженной патологией печени и почек,
7) крупные оперативные вмешательства.Относительными противопоказаниями являются церебральный атеросклероз, деменция, алкоголизм.
Механизм действия ПСМ. Производные сульфонилмочевины оказывают сахаропонижающий эффект за счет панкреатического и внепанкреатического действия.
I. Вероятно связанное с антидиабетическим действием.
- Панкреатическое действие заключается в стимуляции высвобождения инсулина из бета-клетки и усилении его синтеза, восстановлении количества и чувствительности рецепторов бета-клетки к глюкозе. Сульфаниламиды оказывают свои инсулинотропный эффект посредством закрытия АТФ-зависимых калиевых каналов, что в свою очередь приводит к деполяризации клеток, поступлению ионов кальция в В- клетку и усилению секреции инсулина. Сульфаниламиды связываются с рецептороподобными структурами на В-клетке. Связывающая способность различных производных сульфонилмочевины определяет их инсулинстимулирующую активность.
- Экстрапанкреатическое действие
1. Потенцирование стимуляции опосредованного инсулином транспорта глюкозы в скелетных мышцах и жировой ткани.
2. Потенциирование инсулинопосредованного транслокационного транспорта.
3. Потенциирование инсулинопосредованной активации синтеза гликогена.
4. Потенциирование инсулинопосредованного печеночного липогенеза.II. Возможно связанное с антидиабетическим действием.
1. Прямое влияние на печень.
а) повышение фруктозо-2,6 дифосфата,
б) стимуляция гликолиза,
в) подавление глюконеогенеза.
2. Прямое действие на скелетные мышцы.
а) повышение транспорта аминокислот,
б) повышение фруктозо-2,6-дифосфата.
3. Подавление инсулиназы.III. Маловероятно связанное с антидиабетическим действием.
1. Прямое действие на жировую ткань.
а), активация 3'-5'АМФ диэстеразы и подавление липолиза.
2. Прямое действие на миокард.
а) увеличение сократимости и насыщения кислородом, повышение гликогенолиза,
б) уменьшение гликолиза, снижение активности фосфофруктокиназы.
3. Повышение синтеза и секреции активатора плазминогена в эндотелиальных клетках.Фармакокинетика сульфаниламидов. Препараты сульфонилмочевины относятся к слабым кислотам. Они интенсивно связываются с белками (более 90%), метаболизируются печенью и выводятся почками или кишечником. Существуют выраженные различия во всасывании, метаболизме и элиминации между различными представителями этой группы препаратов (таб. 1).
Таблица 1.
Фармакокинетика производных сульфонилмочевины.Препараты, изменяющие действие ПСМ.
Препарат Период полужизни (час.) Длительность действия (час.) Суточная доза (мг) Активные метаболиты Хлорпропамид 24-48 24-72 100-500 + Толбутамид 3-28 6-10 500-3000 - Толазамид 4-7 16-24 100-1000 + Гликлазид 6-15 10-15 40-320 - Глипизид 1-5 14-16 2,5-20 - Глибурид 2-4 20-24 2,5-20 -/+
1. Усиливающие гипогликемическую активность ПСМ, посредством изменения их фармакокинетики:II. Имеющие собственную гипогликемическую активность:
- клофибрат,
- салицилаты,
- некоторые сульфаниламидные препараты.
III. Антагонисты СМ.
- салицилаты,
- гуанитидин,
- ингибиторы МАО,
- бета-блокаторы,
- алкоголь.
1. Укорачивающие период полужизни, ускоряя метаболизм:2. Имеющие внутреннюю гипергликемическую активность:
- хроническое употребление алкоголя,
- рифампицин,
Характеристика сахароснижающих сульфаниламидных препаратов. В лечебной практике применяют гипогликемизирующие препараты сульфонилмочевины I и II генерации. Препараты I генерации обладают большим количеством побочных эффектов, тогда как сульфаниламиды II генерации оказывают более выраженный гипогликемический эффект в минимальных дозах, вызывают меньше осложнений. Этим объясняется преимущественное использование этих препаратов в клинической практике. Сравнительная характеристика препаратов представлена в таблице 2. Определяющим критерием в подборе дозы для всех пероральных сахароснижающих препаратов является уровень гликемии, главным образом - натощак и через 2 часа после еды. Для более эффективного снижения постпрандиальной гликемии препараты сульфонилмочевины рекомендуется принимать за 30 мин. до приема пищи. Большинство препаратов традиционно назначаются два раза в день. Длительность действия зависит не только от периода полувыведения, но и от назначаемой дозы - чем больше лекарственного вещества дается в одной дозе, тем длительнее период падения его концентрации в плазме, и тем продолжительнее его действие.
- диуретики (тиазиды, фуросемид),
- эпинефрин,
- эстрогены,
- глюкагон,
- глюкокортикоиды,
- индометацин,
- изоланид,
- никотиновая кислота,
- фенитоин,
- Л- тироксин.
Таблица 2.
Характеристика сульфаниламидных препаратов.
Название
междун.Название
коммер.Содержание препарата
в 1 таб. (г)Высшая суточная доза (г) Длительность действия (час.) 1 2 3 4 5 Препараты первой генерации Толбутамид бутамид
орабет
ориназа0,5 2,0 6-10 Карбутамид букарбан
оранил
мидозол
диаборал0,2 2,0 6-12 Толазамид толиназе
норглицин0,1; 0,25; 0,5 1,0 16-24 Хлорпропамид диабинез
диабеторал0,1; 0,25 0,5 24-60 Препараты второй генерации Глибенкламид манинил
даонил
эуглюкон
глюкобене0,001; 0,005 0,02 20-24 Глипизид глибинез
минидиаб0,005 0,02 8-12 Гликлазид диабетон
диамикрон
предиан0,08 0,32 8-10 Гликвидон глюренорм
беглинор0,03 0,075 8
Обычно сульфаниламидные сахароснижающие препараты хорошо переносятся, частота побочных эффектов низкая. Кожные реакции неспецифичны и редкие. Гематологические осложнения, такие как тромбоцитопения, агранулоцитоз и гемолитическая анемия, были описаны в основном при приеме хлорпропамида и толбутамида. Нарушение печеночных функциональных тестов, желтуха могут возникать во время лечения любым из производных сульфонилмочевины.ПОБОЧНЫЕ ЭФФЕКТЫ И ТОКСИЧНОСТЬ ПСМ
Толбутамид - бутамид, орабет.
- гипогликемия
- кожная реакция (сыпь, эритема, зуд)
- желудочно- кишечные расстройства (анорексия, тошнота)
- нарушение состава крови (агранулоцитоз, тромбоцитопения)
- дисульфирам- подобная реакция (антабус)
- гипонатриемия
- гепатотоксичность (холестатическая желтуха)
Фармакологическое действие. Гипогликемизирующий эффект оказывает при приеме внутрь за счет стимуляции секреции инсулина В-клетками поджелудочной железы и повышения чувствительности периферических тканей к инсулину. Внепанкреатическое действие направлено на подавление глюконеогенеза в печени и липолиза в жировой ткани. Сахаропонижающее действие проявляется через 1,5 ч., достигает максимума через 3-4 ч., продолжительность эффективного действия 6-10 часов. На 95% связывается с белками плазмы, метаболизируется в печени. Метаболиты обладают слабой гипогликемическои активностью. Экскреция осуществляется почками.
Применение. Начальная суточная доза обычно составляет 1-1,5 г. в зависимости от уровня глюкозы крови. Лечебный эффект препарата проявляется не ранее первых 10-14 дней от начала лечения и при отсутствии эффекта проводимой терапии доза может быть доведена до 2 г. в сутки не ранее, чем через 2 недели от начала лечения. Дальнейшее увеличение дозы свыше 2 г (максимально допустимая) к нарастанию эффекта не приводит. При устранении глюкозурии и нормализации глюкозы крови доза может быть уменьшена на 0,25 - 0,5 г. в вечерний прием.
При отсутствии компенсации углеводного обмена в течение 4 недель лечения максимальными дозами показано назначение сульфаниламидных препаратов II генерации, или, в сочетании сахарного диабета и ожирения - комбинация толбутамида с бигуанидами.
Карбутамид - букарбан, оранил.
Фармакологическое действие. Оказывает гипогликемизирующее действие при приеме внутрь, стимулируя выделение эндогенного инсулина В-клетками островкового аппарата поджелудочной железы и повышая чувствительность периферических тканей к инсулину. Наличие аминогруппы в молекуле препарата обуславливает более мощное, чем у бутамида инсулинотропное действие. Сахароснижающий эффект проявляется через час после приема, достигает максимума через 5 ч., продолжается до 12 часов.
Применение. Начальная доза 0,25 г. 2 раза в сутки. Суточная доза карбутамида в начале лечения не должна превышать 0,75 г. В этом случае рекомендуется прием 0,5 г. препарата перед завтраком и 0,25 перед ужином. При недостаточной эффективности дальнейшее увеличение дозы до 1,5 г. в сутки (1,0 г утром и 0,5 г вечером) может быть рекомендовано не ранее, чем через 10 дней от начала лечения, что обусловлено длительностью ответных метаболических преобразовании в организме при приеме карбутамида. Максимальная доза не должна превышать 2 г в сутки. Недостаточная компенсация углеводного обмена при использовании максимальной дозы препарата в течение 4 недель является показанием для назначения сульфаниламидных препаратов II генерации.
Толазамид - толиназе.
Фармакологическое действие. Гипогликемизирующий эффект обусловлен стимуляцией секреции инсулина В-клетками. Оказывает внепанкреатическое действие, повышая чувствительность периферических тканей к инсулину, угнетая глюконеогенез в печени и липолиз в жировой ткани. Быстро абсорбируется в тонкой кишке, достигая максимального гипогликемизирующего действия через 3-4 часа. Пик концентрации сохраняется в течение 7 часов, длительность действия - до 16 часов. Оказывает слабый диуретический эффект.
Применение. Начальная доза не должна превышать 0,25 г. в сутки. Кратность приема - 2 раза в сутки. Вследствие быстрого и выраженного гипогликемизирующего эффекта толазамида его лечебное действие проявляется уже на первой неделе лечения и дальнейшая коррекция дозы может быть произведена через 7 дней от начала лечения при обязательном контроле гликемии и глюкозурии. Максимальная суточная доза 1,0 г. В сравнении с толбутамидом и карбутамидом обладает большим гипогликемизирующим эффектом, при замене препаратов 1,0 г карбутамида и/или толбутамида соответствуют 0,25 толазамида.
Хлорпропамид - апотекс, диабинез, диабеторал.
Фармакологическое действие. Несмотря на длительный период полураспада (до 35 часов), всасывается относительно быстро. Обладает наибольшей длительностью действия - до 60 часов. Подвергается интенсивному печеночному метаболизму, основные метаболиты обладают гипогликемической активностью и выделяются почками. Концентрация в плазме зависит в большей степени от элиминации почками, чем от всасывания. Начало сахароснижающего действия отмечается через 2 часа после приема, достигает максимума через 4-6 часов.
Дополнительный эффект хлорпропамида -потенцирование действия антидиуретического гормона, что может сопровождаться задержкой жидкости.
Применение. Подбор дозы производится индивидуально. Начальная суточная доза не должна превышать 0,25 г, прием однократный, во время завтрака. При выраженной гипергликемии и глюкозурии, неэффективности предшествующей терапии др. сульфаниламидами, возможно назначение 0,5 г в сутки, также однократно, во время завтрака.
Для пациентов старше 65 лет начальная доза составляет 0,1 г в сутки, максимальная до 0,25 г в день в связи с замедлением экскреции с мочой. Контроль гликемии и глюкозурии проводят через 3-5 дней от начала лечения. В случае недостаточного метаболического эффекта доза может быть увеличена до 0,5 г в сутки.
Во избежание кумуляции препарата, во всех ситуациях достижения компенсации углеводного обмена, дозу хлорпропамида рекомендуется уменьшить на 0,1 г в сутки, под контролем гликемии. Потенцирующее влияние на действие антидиуретического гормона делает возможным использование хлорпропамида в лечении несахарного диабета. Возможно его назначение при рефрактерности к действию адиурекрина и при непереносимости других препаратов гипофиза. Доза при отсутствии нарушений углеводного обмена не должна превышать 0,1 г в сутки.
Во всех случаях длительного применения препарата (более 5 лет) развивается снижение чувствительности к его действию.
Глибенкламид - даонил, манинил, эуглюкон, глюкобене, глюкоред, антибет.
Фармакологическое действие. Обладает выраженным панкреатическим и внепанкреатическим действием. Гипогликемизирующий эффект оказывает вследствие стимуляции синтеза инсулина - усиления его секреции из инсулинсодержащих гранул бета-клетки и повышения чувствительности бета-клеток к глюкозе, повышает количество и чувствительность рецепторов к инсулину, а также степень связывания инсулина с глюкозой и клетками-мишенями. Глибенкламид хорошо всасывается из желудочно-кишечного тракта. Начало сахароснижающего эффекта отмечается через 40 минут после приема, пик концентрации достигается через 2 и сохраняется в течение 6 часов, продолжительность действия 10-12 часов. Способность связываться с белками плазмы пролонгирует действие препарата, но короткий период полувыведения - до 5 часов, обуславливает его малую токсичность. Метаболизируется в печени, выводится с желчью и мочой в виде неактивных метаболитов.
Вышеперечисленные особенности действия глибенкламида, определяют его как препарат выбора в лечении сахарного диабета II типа. Начальная доза составляет 5 мг утром или по 0,25 мг утром и вечером. Контроль показателей углеводного обмена - через 5-7 дней и при необходимости - увеличение дозы на 0,25-0,5 мг в неделю до максимальной (20 мг).Следует отметить, что доза более 15мг в сутки не увеличивает гипогликемизирующий эффект. Кратность приема 1-2 раза в день и зависит от суточной дозы: при эффективности метаболического контроля на фоне 5 мг/сутки - прием 1 раз утром; доза в 10 мг может быть распределена равномерно в 2 приема на утро и вечер; при необходимости использования 15 мг в сутки рекомендуется употребление 10 мг утром и 5 мг вечером; при использовании максимально допустимой суточной дозы 20 мг, она распределяется на 2 приема.
При отсутствии компенсации в течение 4-6 недель возможна комбинированная терапия с производными сульфонилмочевины II генерации другой группы, бигуанидом или инсулинотерапией.
Глипизид - глибенез, минидиаб.
Фармакологическое действие. Препарат обладает панкреатическим и экстрапанкреатическим действием. Сахароснижающий эффект оказывает за счет стимуляции выделения инсулина и повышения чувствительности В-клеток поджелудочной железы к глюкозе. На внепанкреатическом уровне улучшает пострецепторное действие инсулина в клетках печени и мышечной ткани. Обладает небольшим гиполипидемическим действием, улучшает фибринолитическую активность и подавляет агрегацию тромбоцитов. Быстро всасывается в кишечнике, обеспечивая начало сахаропонижающего действия через 30 минут после приема. Максимальная концентрация отмечается через 1,5 часа, продолжительность действия 8-10 часов. Препарат быстро выводится с мочой в виде практически неактивных метаболитов.
Начальная доза для больных с впервые выявленным сахарным диабетом не должна превышать 7,5 мг в 2-3 приема. Дальнейшее увеличение дозы производится под контролем гликемии через 5-7 дней. Максимальная разовая доза 10 мг, суточная - 20 мг. Имеются сообщения о возможности применения 30 мг в сутки без проявления побочных эффектов, однако такое увеличение дозы не сопровождается увеличением сахаропонижающего действия.
Глипизид может быть использован в комбинации с другими производными сульфонилмочевины.
Глюренорм - гликвидон.
Фармакологическое действие. Обладает панкреатическим и внепанкреатическим эффектом. По механизму гипогликемизирующего действия близок к гликлазиду и способен стимулировать 1 фазу секреции инсулина. Особенностями данного препарата являются быстрое и непродолжительное действие, преимущественное выведение через кишечник (95%), что позволяет использовать его при лечении больных ИНСД с поражением почек. Всасывается быстро, начало гипогликемизирующего действия через 40 мин., пик концентрации - через 2 часа, период полувыведения - 1,5 часа. Продолжительность активного действия - 6-8 часов. Как и другие сахаропонижающие сульфаниламиды II генерации, положительно влияет на рецепторы инсулина и усиливает его пострецепторное взаимодействие в клетках, стимулируя утилизацию глюкозы в печени, мышцах и подавляя липолиз.
Начальная доза составляет 30 мг 1-2 раза в день. При отсутствии эффекта дозу увеличивают через 5-7 дней до максимальной, которая составляет 120 мг. Препарат принимают за 30-60 мин. до еды, кратность приема 2 раза при дозе 60 мг, при использовании больших доз - 3 раза в течение дня.
Может применяться у пациентов пожилого возраста в связи с невысокой частотой вызываемых гипогликемий. Глюренорм не повреждает мембраны диализаторов и может использоваться у больных, подвергающихся хроническому гемодиализу.
Мы оценивали влияние препарата на липидный и углеводный метаболизм у 25 больных с впервые выявленным ИНСД. На фоне терапии глюренормом отмечалось улучшение секреторной функции В-клеток поджелудочной железы. Наиболее выраженным этот эффект препарата был на 12 неделе лечения: в ответ на пищевой стимул секреция С-пептида достигла контрольного значения - 211% в сравнении с 245% в группе здоровых. На 120 мин. пищевого нагрузочного теста отмечалась стойкая гиперинсулинемия, что свидетельствовло о сохраняющейся периферической инсулинорезистентности.
Гипохолестеринемический эффект терапии глюренормом проявился уже на 6 неделе исследования: уровень холестерина снизился до контрольных значении, в большей степени за счет ХС ЛПОНП (снижение этого показателя составило 30% от исходного). Необходимо отметить, что у пациентов с исходно более низким уровнем холестерина (менее 250 мг/дл) отмечалось повышение соотношения ХС ЛПВП/ХС - ХС ЛПВП с 0,25 до 0,40, что свидетельствовало об улучшении системы транспорта холестерина на фоне терапии глюренормом (таб.3). Влияние препарата на апобелковый состав было непостоянным: снизившись к 6 неделе терапии на 20%, уровень атерогенного апопротеина В достиг исходного значения к 12 неделе.
Таблица 3.
Динамика липидного и апобелкового профиля у больных с впервые выявленным ИНСД, леченных глюренормом, в группе с исходным ХС<250 мг/дл.
Исследуемые
показатели
этапы
исследованияХС
мг/длТГ
мг/длХС
ЛПВП
мг/длХС
ЛПОНП
мг/длХС
ЛПНП
мг/длАпо А 1
мг/длАпо В
мг/длАпо В/
Апо А 1ХС
ЛПНП/
ХС ЛПВПХС
ЛПВП/
Апо А 11. через 3 нед.
диетотерапии13,1
100%146,3+/-
27,9
100%47,0+/-
5,5
100%29,3+/-
5,6
100%141,2+/-
5,0
100%136,8+/-
16,9
100%105,8+/-
19,7
100%0,8+/-
0,2
100%3,2+/-0,5 100%
0,3+/-0,001 100%
2. через 6 нед.
лечения194,0+/-
16,7
89%99,2+/-
15,7
68%45,4+/-
5,2
97%19,8+/-
3,2
68%128,8+/-
15,4
91%138,4+/-
13,9
101%86,0+/-
13,9
81%0,6+/-
0,1
75%3,0+/-0,5 94%
0,3+/-0,02 100%
3. через 12
нед. лечения180,0+/-
22,6
83%108,3+/-
49,9
74%52,3+/-
4,8
111%21,7+/-
10,0
74%106,0+/-
5,5
Р<0,01
1-3
75%156,3+/-
15,0
114%56,7+/-
17,4
54%0,4+/-
0,2
50%2,1+/-0,3 66%
0,3+/-0,01 100%
практически
здоровые лица205,4+/-
0,3100,7+/-
0,550,9+/-
0,120,1+/-
0,3134,4+/-
0,3143,0+/-
4,0117,0+/-
3,00,8+/-
0,12,6+/-0,2 0,3+/-0,01 P<0,001
к-3P<0,01
к-3
Влияние глюренорма на уровень триглицеридов в плазме было отмечено у больных с концентрацией холестерина более 250 мг/дл - этот показатель к 12 неделе терапии достиг контрольных значении (таб.4).Таблица 4.
Динамика липидного и апобелкового профиля у больных с впервые выявленным ИНСД, леченных глюренормом, в группе с исходным ХС>250 мг/дл.Диабетон - гликлазид, медоклазид, предиан, диамикрон.
Исследуемые
показатели
этапы
исследованияХС
мг/длТГ
мг/длХС
ЛПВП
мг/длХС
ЛПОНП
мг/длХС
ЛПНП
мг/длАпо А 1
мг/длАпо В
мг/длАпо В/
Апо А 1ХС
ЛПНП/
ХС ЛПВПХС
ЛПВП/
Апо А 11. через 3 нед.
диетотерапии273,2+/-
20,7
100%206,5+/-
13,7
100%38,7+/-
3,4
100%41,3+/-
2,2
100%193,2+/-
25,6
100%137,8+/-
6,8
100%126,0+/-
12,1
100%0,9+/-
0,1
100%5,1+/-0,7 100%
0,3+/-0,02 100%
2. через 6 нед.
лечения227,3+/-
11,9
83%120,7+/-
33,1
58%41,7+/-
2,9
108%23,9+/-
6,6
58%161,7+/-
13,2
84%131,8+/-
4,2
96%100,0+/-
16,5
79%0,8+/-
0,1
89%3,9+/-0,2 76%
0,3+/-0,02 100%
3. через 12
нед. лечения239,7+/-
7,7
88%145,0+/-
42,1
70%44,3+/-
4,4
114%28,9+/-
8,5
70%166,3+/-
11,8
86%141,5+/-
7,4
103%131,2+/-
11,6
104%0,9+/-
0,1
100%3,9+/-0,4 76%
0,3+/-0,02 100%
практически
здоровые лица205,4+/-
0,3100,7+/-
0,550,9+/-
0,120,1+/-
0,3134,4+/-
0,3143,0+/-
4,0117,0+/-
3,00,8+/-
0,12,6+/-0,2 0,3+/-0,01 P<0,05
1-к
P<0,01
3-кP<0,001
1-кP<0,01
1-к
P<0,05
2-кP<0,001
1-кP<0,05
1-кP<0,01
1-к
P<0,01
2-к
P<0,05
3-кФармакологическое действие. Как и другие производные сульфонилмочевины II генерации, диабетон обладает панкреатическим и экстрапанкреатическим воздействием, однако, механизм его влиянии имеет ряд особенностей. Диабетон восстанавливает ранний пик секреции инсулина. Ранняя фаза секреции инсулина играет важную роль в повышении готовности органов-мишеней для инсулина во второй фазе инсулиносекреции. Последнее приводит к уменьшению общего количества инсулина, необходимого для утилизации глюкозы и позволяет избежать гиперинсулинемию, вызванную длительной стимуляцией В-клеток. Диабетон повышает эффективность действия инсулина, снижая инсулинорезистентность, повышает утилизацию и накопление глюкозы в мышцах и снижает печеночный синтез глюкозы.
Гликлазид может улучшать инсулинопосредованную утилизацию глюкозы, улучшая действие инсулина на гликоген-синтетазу скелетных мышц.Как показали исследования, проведенные в нашей клинике (Н.Л. Винницкая, 1995), диабетон, наряду с активным гипогликемизирующим эффектом, обладает выраженным положительным влиянием на липидный и апобелковый спектр плазмы. Применение препарата в средней дозе 160 мг в сутки в течение шести недель у больных с впервые выявленным ИНСД привело к достоверному снижению уровня холестерина, ХС ЛПОНП (на 15 и 30% соответственно, р<0,05 ). Уровень атерогенного аполипопротеина В снизился на фоне лечения на 20% от исходного. Достоверное снижение показателя загруженности ЛПВП холестерином (соотношение ХС ЛПВП/Апо А1) свидетельствовало о положительных сдвигах в соотношении липопротеидов, транспортирущих холестерин. Гипотриглицеридемический эффект диабетона (уровень триглицеридов достоверно снизился к шестой неделе терапии на 50% от исходного), по-видимому, был обусловлен улучшением чувствительности к инсулину на уровне жировой ткани, снижением липолиза и доступа НЭЖК в печень как основного субстрата для синтеза триглицеридов.
Вторым отличительным эффектом диабетона является воздействие на тромбоциты и фибринолиз. Тормозя агрегацию и адгезию тромбоцитов и эритроцитов, он восстанавливает процесс физиологического пристеночного фибринолиза, предотвращает развитие микротромбозов и повышенную реакцию сосудов на адреналин при микроангиопатиях.
Начало сахаропонижающего действия отмечается через 40-60 мин. после приема и его максимум достигается через 2 часа. Продолжительность действия до 12 часов. В большинстве случаев достаточно двух таблеток в сутки (160 мг). При необходимости доза может быть увеличена под контролем гликемии до 320 мг в сутки (максимально допустимая доза). При необходимости использования 240 мг препарата в течение дня, большую дозу - 2 таблетки принимают утром.
Диабетон может быть использован в комбинации с другими сульфаниламидными сахаропонижающими препаратами для профилактики и лечения гемореологических нарушений.
Резистентность к сульфаниламидным препаратам.
ПЕРВИЧНАЯ И ВТОРИЧНАЯ НЕУДАЧА:
- уровень глюкозы остается повышенным через 30 дней от начала лечения
- "первичная неудача"
- отмечается после временного успеха, хотя бы в течение одного месяца первоначального хорошего ответа на ПСМ
- "вторичная неудача"
Инсулинорезистентность с течением ИНСД у многих пациентов достигает критического уровня. Даже терапия максимальными дозами сульфаниламидов при оптимальном диетическом режиме и адекватных физических нагрузках, не эффективна. Этот феномен называется "вторичной неудачей" пероральной терапии, и 5-10% всех пациентов с ИНСД проходят эту фазу заболевания ежегодно. Частота неудачи достигает максимума через 12-15 лет от начала заболевания. Вследствие уменьшения анаболического эффекта инсулина, неудовлетворительного метаболического контроля, выраженной глюкозурии и снижения утилизации глюкозы тканями, вес тела снижается до нормального или субнормального у большинства этих пациентов.
В то время как "первичный отказ" на сульфаниламидные препараты обычно связан с ошибочным применением их при ИЗСД, причины "вторичной неудачи" менее понятны. Неизвестно и то, является ли "вторичная неудача" обязательным феноменом, развивающимся у всех пациентов с ИНСД.
"ВТОРИЧНАЯ НЕУДАЧА" НА ПСМ равивается у 5 - 10% больных в год
Что лежит в основе?Причины неудачи, связанные с пациентом:
- прогрессирование заболевания?
- снижение ответа на терапию?
- ожирение?
Причины неудачи, связанные с терапией:
- переедание и прибавка в весе,
- снижение физической активности,
- стресс,
- интеркуррентные заболевания,
- плохой контакт врача с больным.
Причины неудачи, связанные с заболеванием:
- неадекватность дозы ПСМ,
- снижение чувствительности к ПСМ в связи с длительным их приемом,
- нарушение абсорбции препарата в связи с гипергликемией,
- неудачное сочетание с другими препаратами.
Основными детерминантами потери ответа на терапию, по-видимому, являются факторы, связанные с самим ИНСД. Снижение функции -клетки чаще всего встречается у женщин с аутоиммунными нарушениями, у которых отмечается высокая частота наличия органоспецифических антител. Функция -клеток при ИНСД нарушается значительно медленнее, чем при классическом ИЗСД. По-видимому, в основе феномена "вторичной неудачи" лежат причины, не связанные с нарушением функции -клетки. В исследовании Groop et аl. 43% всех причин "вторичной неудачи" у больных ИНСД были обусловлены печеночной и периферической инсулинорезистентностью, лишь 13% - нарушением функции -клетки, в 44% случаев причина плохого ответа на сульфаниламиды осталась невыясненной. Таким образом, на современном уровне знаний инсулинорезистентность остается основной причиной развития "вторичной неудачи" у больных ИНСД. В поддержку этой гипотезы свидетельствует факт усугубления инсулинорезистентности с течением заболевания. Также высказано предположение, что хронический прием сульфаниламидных препаратов может вызвать к ним резистентность. Однако, отмена хронической сульфаниламидной терапии обычно сопровождается выраженным нарушением гликемического контроля, подтверждая, что препарат все еще оказывает свой сахароснижающий эффект. Гипергликемия per se может также вносить свои вклад в развитие "вторичной неудачи". Всасывание сульфаниламидных препаратов нарушается при наличии гипергликемии. Кроме того, гипергликемия, усугубляя инсулинорезистентность, может отрицательно влиять на эффективность лечения, образуя порочный круг.
- дальнейшее уменьшение массы В- клеток,
- увеличение инсулинорезистентности.
Следующие основные факторы определяют наличие "вторичной неудачи" у пациентов с ИНСД:
1. Удовлетворительный контроль на фоне диеты и ПССП в течение минимум 4-х лет после установления диагноза.
2. Уровень гликемии натощак при повторных определениях превышает 10-11 ммоль/л, постпрандиальной - 13-15 ммоль/л.
3. Отсутствие эффекта от приема максимальной дозы сахароснижающих препаратов на фоне субкалорийной диеты, оптимального режима физических нагрузок и исключения других причин неудовлетворительного метаболического контроля.
4. Отсутствие аутоантител к островковым клеткам поджелудочной железы и инсулину, или их непостоянное наличие.
5. Базальная концентрация С-пептида больше 0,3 нмоль/л; интегрированный уровень С-пептида в ходе перорального глюкозотолерантного теста - больше 3,3 нмоль/л, суточная экскреция С-пептида с мочой - больше 6,6 нмоль/л.Известно, что у некоторых пациентов с ИНСД, имеющих аутоантитела к островковым клеткам или к инсулину, в течении нескольких лет (от 1 до 4-х лет) медленно развивается инсулинозависимость, что, по-видимому, связано с аутоиммунным поражением островковых клеток поджелудочной железы. Приведенные выше характеристики позволяют провести дифференциальную диагностику между "вторичной неудачей" у пациентов с ИНСД и медленно прогрессирующим ИЗСД. Специфические иммунологические и генетические маркеры являются показателями высокого риска наличия медленно прогрессирующего ИЗСД у пациентов с ранее установленным диагнозом ИНСД. Наиболее же доступными показателями для установления диагноза является длительность периода терапии сахароснижающими препаратами до возникновения "вторичного отказа" к ним и уровень секреции С-пептида.
Бигуаниды
Показания:
1. Ожирение у больных ИНСД.
2. Отсутствие эффекта монотерапии ПСМ.
3. Перспектива комбинированного лечения с ПСМ.ХАРАКТЕРИСТИКА БИГУАНИДОВ
В последние годы в нашей стране и за рубежом значительно сократилось применение бигуанидов у пациентов с ИНСД в связи с частыми случаями лактацидоза. Наиболее опасными с этой точки зрения являются производные фенилэтилбигуанидов (фенформин, диботин) и бутилбигуанидов (адебит, буформин, силубин). Метформин -производное диметилбигуанидов - наиболее безопасный и часто применяемый препарат этой группы. Он используется в лечении больных ИНСД уже более 30 лет в Европе и Канаде, и в настоящее время отменен запрет на его применение в США. По своей эффективности и безопасности препарат сравним с сульфаниламидами. Сообщения о случаях лактацидоза на фоне приема метформина крайне редки и составляют 0-0,084 случаев на 1000 пациентов в год. Угроза этого состояния может повышаться у пациентов с гипоксическими состояниями, почечной и печеночной недостаточностью, сердечной недостаточностью, и у лиц, злоупотребляющих алкоголем. In vitro исследования показали, что метформин не влиял на аэробную утилизацию глюкозы мозгом, почками и кожей. В то же время, тонкий кишечник, аккумулирующий наиболее высокие концентрации препарата по сравнению с другими тканями, является важным участником стимулированной метформином утилизации глюкозы. Тонкий кишечник - основной источник избыточного образования лактата в связи с повышением анаэробного гликолиза, и при повышении продукции глюкозы печенью, продукция лактата может повышаться. Механизм действия метформина не связан с повышением концентрации инсулина. Уровень инсулина в базальном состоянии и в течение дня не меняется, или незначительно снижается на фоне терапии метформином, как у больных ИНСД с избытком веса, так и без ожирения. В то же время, было выявлено значительное улучшение функции -клетки к концу 12-ти недельного периода приема метформина пациентами с ИНСД. Исследования in vitro на животных показали, что метформин вызывает улучшение 2-ой фазы инсулинового ответа на гипергликемию. Тем не менее, основной терапевтический эффект метформина на гомеостаз глюкозы опосредован не повышением концентрации инсулина, а улучшением чувствительности к инсулину, как на периферии, так и на уровне печени. Механизм улучшения метформином чувствительности к инсулину обусловлен усилением инсулин-опосредованного перехода GluT 4 транспортеров глюкозы в плазменные мембраны микросом. Препарат улучшает чувствительность к инсулину путем повышения связывания с рецепторами при уменьшении их количества. На пострецепторном уровне метформин может влиять на следующие события: аутофосфорилирование рецептора, его тирозинкиназную и сигнальную активность и на ключевые ферменты, контролирующие действие инсулина на транскрипцию, трансляцию и глюкорегуляторные пути.
препарат название разовая доза
(мг/день)сут. доза
(мг/день)Т 1/2
(час)действие
(час)Фенформин DBI
DBI TD25
5025-150 3 6
12Метформин Glucophage 500 250-1500 3 6 Буформин Silubin 100 100-300 2 6 БИГУАНИДЫ МЕХАНИЗМ ДЕЙСТВИЯ:
Побочные эффекты и токсичность:
- повышение утилизации глюкозы путем анаэробного гликолиза
- уменьшение продукции глюкозы печенью
- уменьшение всасывания глюкозы в желудочно-кишечном тракте
- увеличение потребления глюкозы в мышечной и жировой ткани
- усиление действия инсулина
- увеличение числа рецепторов к инсулину на поверхности клеток
- увеличение числа мест транспорта глюкозы в инсулинчувствительных тканях
желудочно- кишечные расстройства (анорексия, тошнота, рвота, диарея, металлический или горький привкус), снижение веса, лактацидоз.Противопоказаниями к назначению бигуанидов являются:
Комбинированная терапия метформин/сульфаниламиды - последний шанс отсрочить инсулинотерапию у пациентов со "вторичным отказом" на сульфаниламидные препараты. Сочетание этих препаратов вызывает снижение базальной гликемии на 20-40%. Столь выраженный эффект обусловлен различными точками приложения препаратов: повышение выработки инсулина и подавление продукции глюкозы печенью сульфаниламидами сочетается с повышением периферической, инсулин-опосредованной утилизации глюкозы. Возможно, сульфаниламиды начинают работать на фоне снижения инсулинорезистентности и улучшения действия инсулина. Кроме того, нивелируется эффект глюкозотоксичности.
- инсулинзависимыи сахарный диабет (ИЗСД),
- диабетический кетоацидоз,
- заболевания печени и почек,
- легочно-сердечная недостаточность,
- беременность,
- острые инфекционные заболевания,
- алкоголизм.
Исследования, проведенные в нашей клинике показали, что терапия метформином (глюкофаж) в сочетании с манинилом в течение 4 недель у больных со вторичной резистентностью к сульфаниламидным препаратам приводила к достоверному снижению инсулинемии до уровня контрольных значении. Одновременно было отмечено достоверное снижение концентрации общего холестерина за счет фракции холестерина ЛПНП (ХС ЛПНП) и холестерина ЛПОНП (ХС ЛПОНП), уровень триглицеридов снизился на 40%.
Снижение соотношения атерогенных и антиатерогенных апобелков апоВ/апоА1 и улучшение фосфолипидного состава мембран эритроцитов в этом исследовании свидетельствовало об эффективности воздействия комбинированной терапии метформином и сульфаниламидами на атерогенную дислипидемию.
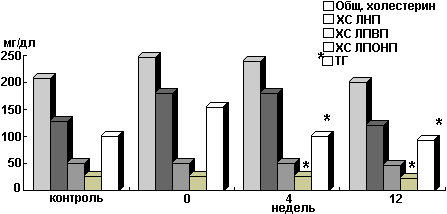
Динамика липидного профиля у пациентов с ИНСД, с "вторичной неудачей".Инсулинотерапия ИНСД
Инсулинотерапия до сих пор остается наиболее противоречивым аспектом лечения больных ИНСД. Это обусловлено, с одной стороны, отсутствием единой концепции в отношении этиологии и патогенеза ИНСД и продолжающимся спором о том, где находится первичный дефект - на уровне секреции инсулина или активности его на периферическом уровне, логично ли лечение инсулином пациентов, которые являются тучными и гиперинсулинемическими, с другой стороны, нет критериев гарантии эффективности этого вида терапии.
Есть ситуации, когда легко говорить о необходимости назначения экзогенного инсулина на длительный срок либо временно.
Длительная инсулинотерапия ИНСД показана при:
Целью является достижение соответствующего ситуации уровня гликемического контроля, который опеределяется с учетом возраста пациента, сопутствующих заболеваний, риска инсулинотерапии. Безопасный уровень контроля - цель лечения больных ИНСД в возрасте старше 70 лет с жизненным прогнозом менее 10 лет, с тяжелой макроангиопатией, при наличии трудностей в самоконтроле и наблюдении (факторы, делающие инсулинотерапию опасной). Средний уровень гликемического контроля рекомендован для пациентов в возрасте 50-70 лет с жизненным прогнозом более 15 лет, с начальными или стабильными признаками микро- или макроангиопатии. Оптимальный уровень контроля должен быть достигнут у пациентов в возрасте до 50 лет, с признаками выраженной нейропатии либо прогрессирущеи ретинопатии.
- наличии противопоказаний к назначению препаратов сульфонилмочевины и бигуанидов,
- первичной или вторичной резистентности к сахароснижающим сульфаниламидным препаратам,
- тяжелых поздних осложнениях диабета (высокая степень ретинопатии, выраженная периферическая нейропатия, особенно ее болевая форма, прогрессирующая нефропатия).
Показания к временной инсулинотерапии при ИНСД следующие:
Согласно Европейскому консенсусу по диабету, инсулин должен назначаться "не слишком рано и не слишком поздно", чтобы избежать связанных с гипергликемией симптомов и поздних осложнений сахарного диабета, которые вызываются хроническим дисбаллансом в углеводном, липидном и белковом метаболизме. Одним из критериев необходимости начала инсулинотерапии является уровень гликемии, которая делется на четыре класса:
- хирургические вмешательства, сопровождающиеся общим наркозом,
- сопутствующая кортикостероидная терапия,
- тяжелые заболевания инфекционного типа с повышенной температурой, интеркуррентные заболевания или стресс, приводящие к увеличению контринсулярных гормонов и потребности в инсулине,
- нарушения всасывания из- за длительного приема оральных гипогликемизирующих препаратов,
- необходимость достижения нормогликемии при явных признаках инсулинового дефицита (полиурия, жажда, потеря в весе) либо симптомах тяжелой нейропатии.
При гликемии более 240 мг% инсулинотерапия рекомендована всегда. В остальных случаях требуется оценка многих характеристик, относящихся к пациенту, прежде, чем вопрос о начале лечения инсулином будет решен. Эти характеристики: вес тела (нормальный, избыточный и стабильный, избыточный и нарастающий); жизненный прогноз; наличие, характер и тяжесть мико- и макроваскулярных осложнений либо нейропатии; недостаточность предшествующего лечения; наличие тяжелых сопутствующих заболевании, при которых инсулинотерапия сопровождается высоким риском.
- 110-140 мг%,
- 141- 200 мг%,
- 201- 240 мг%,
- более 240 мг%.
В случае сомнений о целесообразности инсулинотерапии, необходимо убедиться в снижении инсулинсекреторной активности В-клеток в ответ на стимуляцию глюкагоном. Тест не может проводиться на фоне декомпенсации диабета, поскольку гипергликемия оказывает дополнительный токсический эффект на В-клетки. Это может привести к ложному снижению секреторного ответа на стимуляцию. Инсулинотерапия в течение нескольких дней для коррекции метаболического дисбалланса не повлияет на уровень С-пептида при проведении теста. Оценка глюкагонового теста (1 мг глюкагона внутривенно с исследованием уровня С-пептида сыворотки крови до и через 6 мин. после инъекции): концентрация С-пептида натощак выше 0,6 нмоль/л и выше 1,1 нмоль/л после стимуляции свидетельствует о достаточной секреторной активности. Уровень стимулированного глюкагоном С-пептида плазмы 0,6 нмоль/л и менее свидетельствует о безусловной потребности в экзогенном инсулине. Однако, глюкагоновый тест не позволяет судить о степени инсулинорезистентности. Это значит, что, несмотря на наличие достаточной эндогенной продукции инсулина, терапия экзогенным инсулином может стать необходимой. Противопоказания к глюкагоновому тесту: феохромоцитома, тяжелая гипертензия.
Стратегия инсулинотерапии при ИНСД. Клинический опыт показывает, что после длительной "неудачной" терапии сульфаниламидами, требуется достаточно продолжительный период инсулинотерапии для коррекции метаболических нарушении, в особенности дислипидемии. Обычно используется комбинация высокоочищенных препаратов инсулина животного происхождения и человеческих инсулинов длительного и короткого действия (таб. 5). Помимо состоянии, требующих длительной госпитализации, больным ИНСД без ожирения может проводиться инсулинотерапия в двухразовом режиме. Как правило, инсулин вводится перед завтраком и ужином. Начальная доза базального инсулина определяется из рассчета 0,2- 0,5 ед./кг веса, в последующем коррегируется по гликемии натощак (1 ед. инсулина на каждые 1,1 ммоль/л, превышающие 7,7 ммоль/л). При необходимости, вторая инъекция базального инсулина может быть перенесена на более позднее время (22.00). Доза инсулина короткого действия определяется из рассчета 1 ед. на каждые 1,7 ммоль/л постпрандиальной гликемии выше 7,8 ммоль/л (J.A. Galloway). В более простых случаях могут использоваться комбинированные перпараты инсулина с фиксированным соотношением инсулина продленного и короткого действия.
Таблица 5.
Препараты инсулина.* в скобках указано соотношение инсулинов короткого и промежуточного действия
Название препарата Видовая специфичность Характер действия (час.) начало макс. общая длительн. 1 2 3 4 5 Препараты инсулина короткого действия Актрапид
АктрапидЧМ
Актрапид ЧМ (пенфилл)
Альт-Н-инсулин
Велозулин (пенфилл)
Инсулрап
Инсуман-РапидЧМ
Инсуман-Рапид ЧМ (пенфилл)
Илетин регуляр I
Илетин регуляр II
Максирапид ВО-С
Н-Инсулин
Н-Инсулин (пенфилл)
Хоорап (пенфилл)
Хумулин Рсвиной
человеч.
человеч.
человеч.
человеч.
свиной
человеч.
человеч.
смешан.
свиной
свиной
человеч.
человеч.
человеч.
человеч.0,5
0,5
0,5
0,5
0,5
0,5
0,3
0,3
0,5
0,5
0,5
0,5
0,5
0,5
0,52-3
1-3
1-3
2-3
1-3
2-3
3-4
3-4
2-3
2-3
2,5-5
1-2
1-2
2-3
1-36-8
6-8
6-8
6-8
5-8
6-8
6-8
6-8
6-8
6-8
7-8
5-8
5-8
6-8
5-7Препараты инсулина промежуточного действия Инсуман-БазальЧМ
Инсуман-Базаль ЧМ (пенфилл)
Инсулонг
Инсулатард
Инсулатард (пенфилл)
Ленте
Ленте ВО-С
Монотард МК
МонотардЧМ
ПротафанЧМ
Протафан ЧМ (пенфилл)
Семиленте МК
Семиленте ВО-С
Хуминсулин Базал (НПХ)
Хумулин Н (изофан)
Хумулин Лчеловеч.
человеч.
смешан.
человеч.
человеч.
говяжий+смешан.
свиной
свиной
человеч.
человеч.
человеч.
свиной
свиной
человеч.
человеч.
человеч.0,5-1,5
0,5-1,5
1,5-2,0
1,0-1,5
1,0-1,5
1,5-2,0
2,0
1,5-2,0
2,0-2,5
1,0-1,5
1,0-1,5
1,5-2,0
1,0-1,5
0,5-1,0
1,0
2,5-2,08-10
8-10
8-16
4-12
4-12
8-16
6-12
8-12
7-15
4-12
4-12
6-8
4-7,5
2-10
2-8
4-1620-22
20-22
20-22
16-24
16-24
20-22
24
18-24
18-24
16-24
16-24
8-12
8-12
18-20
18-20
24Препараты инсулина длительного действия Ультраленте
Ультраленте ВО-С
УльтратардЧМ
Хумулин Уговяжий
свиной
человеч.
человеч.6-8
1-3
3-4
312-18
12-17
8-24
3,5-1824-26
24-30
24-28
24-28Смешанные препараты инсулина Депо-Н15-Инсулин (15/85)*
Депо-Н-Инсулин (25/75)
Инсуман-Комб ЧМ (50/50)
Инсуман-Комб ЧМ (50/50) (пенфилл)
Инсуман-Комб ЧМ (25/75)
Инсуман-Комб ЧМ (25/75) (пенфилл)
Инсуман-Комб ЧМ (15/85)
Инсуман-Комб ЧМ (15/85) (пенфилл)
Микстард ЧМ 10 (10/90) (пенфилл)
Микстард ЧМ 20 (20/80) (пенфилл)
Микстард ЧМ 30 (30/70) (пенфилл)
(Актрафан ЧМ)
Микстард ЧМ 40 (40/60) (пенфилл)
Микстард ЧМ 50 (50/50) (пенфилл)
Хумулин M1 (10/90)
Хумулин M2 (20/80)
Хумулин М3 (30/70)
Хумулин M4 (40/60)человеч.
человеч.
человеч.
человеч.
человеч.
человеч.
человеч.
человеч.
человеч.
человеч.
человеч.человеч.
человеч.
человеч.
человеч.
человеч.
человеч.0,5-1
0,5-1
0,3-0,5
0,3-0,5
0,5-1,5
0,5-1,5
1,5
1,5
0,5
0,5
0,50,5
0,5
0,5
0,5
0,5
0,51-6
3-6
3-5
3-5
4-6
4-6
4-8
4-8
2-8
2-8
2-82-8
2-8
1,5-9
1,5-8
1,5-8,5
1-811-20
12-18
12-14
12-14
14-16
14-16
18-220
18-20
12-24
12-24
12-2412-24
12-24
16-18
14-16
14-15
14-15Однако, практика показала, что достижение около- или нормогликемии при ИНСД- часто иллюзорная цель. Лишь 10-20% пациентов на фоне двухразового введения инсулина имеют уровень глюкозы в крови, рекомендуемый NIDDM Policy Group. Особенно сложна эта задача при большой длительности заболевания и развитии вторичной сульфамидорезистентности. Режим многократных инъекций инсулина в краткосрочном или в длительном применении наиболее привлекателен. Преимущества инсулинотерапии этого вида состоит в относительно свободном по времени распределении приемов пищи, быстром и оптимальном гликемическом контроле. Этот вид терапии действует на основные патогенетические аномалии ИНСД, кроме того, максимально быстрый и эффективный гликемический контроль прерывает порочный круг "гипергликемия - глюкозотоксичность - инсулинорезистентность - гипергликемия". Многочисленные исследования показали значительное уменьшение базальной продукции глюкозы печенью и улучшение утилизации глюкозы периферическими тканями, как на фоне короткого, так и длительного применения режима интенсифицированной инсулинотерапии у пациентов с ИНСД. При этом, краткосрочная трехнедельная инсулинотерапия имеет наиболее выраженные и сохраняющиеся после отмены инсулинотерапии положительные реакции: снижение продукции глюкозы печенью на 32-75%, увеличение скорости периферической утилизации глюкозы на 70%, увеличение среднего 2-часового инсулинового ответа на глюкозу в 6 раз. Значительным препятствием на пути использования этого режима является хроническая гиперинсулинемия, ассоциирующаяся с повышенным риском атеросклероза. Базальная и постпрандиальная гиперинсулинемия - однозначный итог многих исследований, проводивших оценку этого режима инсулинотерапии с определением уровня св.ИРИ, или с использованием клэмп-методики. Однако, остается невыясненным вопрос, является ли гиперинсулинемия в результате введения экзогенного инсулина таким же фактором риска атерогенеза, как эндогенно повышенный уровень инсулина у пациентов с ИНСД.
В этом плане представляется интересной оценка эффекта интенсивной инсулинотерапии на атерогенные параметры липидного метаболизма. По данным литературы, режим многоразовых инъекций инсулина вызывает антиатерогенные сдвиги в липопротеидном спектре плазмы у пациентов с ИНСД: уровень ЛПОНП и триглицеридов снижается. Исследования эффективности краткосрочной (3 нед.) и длительной (12 нед.) интенсивной инсулинотерапии у больных ИНСД со "вторичным отказом" на ПСМ, проведенные в нашей клинике (Л.П. Иванова, 1994, В.З. Топчиашвили, 1995), показали возможность оптимальной коррекции атерогенной дислипидемии: снижение уровня триглицеридов, общего холестерина, холестерина ЛПНП и ЛПОНП, восстановление нормального соотношения апобелков плазмы.
Комбинированная терапия инсулин/ПСМ. В начале 80-х годов значительно возрос интерес к комбинированной терапии инсулином и сульфаниламидами, как альтернативе монотерапии инсулином у пациентов с ИНСД со "вторичным отказом" на ПСМ. Теоретическим обоснованием этого вида терапии явилось следующее:
Большинство авторов объясняют эффект комбинированной терапии увеличением эндогенной секреции инсулина. Механизм "возобновления" утерянного эффекта сульфаниламидов у больных со "вторичной неудачей", возможно, обусловлен увеличением числа клеточных инсулиновых рецепторов, улучшением периферической утилизации глюкозы и снижением продукции глюкозы печенью, достаточными для снижения гипергликемии и устранения влияния глюкозотоксичности на -клетки, которые в результате вновь обретают способность отвечать на сульфаниламиды. Теоретически, комбинация инсулина с сульфаниламидами должна приводить к снижению уровня циркулирующего инсулина при таком же или сниженном уровне гликемии, за счет меньшей дозы экзогенного инсулина. Тем не менее, метаанализ статей, посвященных изучению эффекта комбинированной терапии, показал преобладание данных о сохранении повышенного уровня свободного инсулина на фоне этого вида терапии. Таким образом, повышение эндогенной секреции инсулина, по-видимому, компенсирует сокращение экзогенной дозы инсулина, ограничивая возможности снижения инсулинемии у пациентов с ИНСД.
- эндогенный инсулин, стимулированный сульфаниламидами, транспортируется непосредственно в печень;
- небольшие дозы инсулина, требуемые при комбинированной терапии, не приводят к гиперинсулинемии;
- уменьшается риск гипогликемии для пациентов;
- восстанавливается чувствительность к ПСМ у пациентов на начальных стадиях "вторичной неудачи";
- мотивация больных к инсулинотерапии улучшается при одноразовом режиме инъекции инсулина.
Нет единого мнения о преимуществах использования того или иного вида инсулинового дополнения в комбинации с препаратами сульфонилмочевины. Некоторые авторы рекомендуют использовать однократное введение инсулина продленного действия в дозе 0,2-0,3 ед./кг и среднюю терапевтическую дозу ПСМ, при этом не выявлено преимуществ утренней либо вечерней инъекции инсулина. Хотя теоретически введение базального инсулина перед сном позволяет достичь максимального подавления продукции глюкозы печенью и нормализовать гликемию натощак. Наши краткосрочные исследования эффективности различных режимов инсулинотерапии в комбинации с ПСМ показали преимущества введения инсулина короткого действия перед основными приемами пищи с точки зрения улучшения стимулированной секреции инсулина и периферической утилизации глюкозы.
По мнению H.E. Lebovitz, увеличение стоимости комбинированного лечения на 30% и скромное клиническое отличие его от моноинсулинотерапии ограничивает применение этого вида сахароснижающей терапии у больных ИНСД. Комбинированное лечение инсулин/ПСМ должно быть использовано в случаях неудовлетворительного гликемического контроля при двухразовом введении инсулина в дозе 70 ед./сут. или более 1 ед./кг. У 30% таких пациентов будет достигнуто улучшение гликемического контроля. Не оправдана комбинированная терапия при гликемии менее 10 ммоль/л и суточной потребности в инсулине менее 40 ед..
Контроль и самоконтроль за течением сахарного диабета и проводимой терапией.
САМОКОНТРОЛЬ -
основа успешного лечения, профилактики декомпенсации и осложнений сахарного диабета.Система самоконтроля включает
Развитие системы самоконтроля является на сегодняшний день одним из важных элементов в лечении сахарного диабета и профилактики его осложнении. Колебания уровня гликемии зависят от многих причин. Эмоции, незапланированные физические нагрузки, погрешности в диете, инфекции, стресс - те факторы, которые заранее предвидеть и учесть невозможно. При этих обстоятельствах без самоконтроля компенсировать сахарный диабет практически невозможно. Пациент должен уметь и иметь возможность исследовать гликемию до и после приема пищи, в условиях физической нагрузки и необычной ситуации, проанализировать субъективные ощущения, оценить полученные данные и принять правильное решение при необходимости коррекции сахароснижающей терапии. Самоконтроль за течением заболевания предусматривает высокий уровень образованности в вопросах причин и следствии проявлений диабета, терапевтических мероприятий. Это возможно только при условии налаженной и четко отработанной системы обучения больных в амбулаторных и стационарных учреждениях диабетологической помощи. Организация "школ для больных сахарным диабетом" и учебных центров - необходимое звено в системе управления этим хроническим заболеванием.
- знание больным особенностей клинических проявлений и терапии заболевания,
- контроль за диетой,
- контроль за показателями гликемии, глюкозурии и массы тела,
- коррекцию сахароснижающей терапии.
Только комплексное лечение больных ИНСД с использованием диетотерапии, адекватных физических нагрузок, медикаментозной гипогликемизирующей терапии и методов самоконтроля может способствовать профилактике поздних осложнении диабета, сохранению трудоспособности и продлению жизни больных.
| Февраль 1999 г. |