Опубликовано в журнале: Journal of Clinical Oncology, 21: No 7 (2003)
Рандомизированное испытание плотнодозной по сравнению с вводимой по обычному графику, а также последовательной по сравнению с одновременной комбинированной химиотерапии для послеопера- ционного адъювантного лечения больных с положительным по лимфоузлам первичным раком молочной железы: первое сообщение об испытании Интергруппы С9741 и Группы CALGB 9741
М.Л. Цитрон, Д.А. Берри, К. Чирринконе, К. Худис, Э.П. Вайнер, У.Дж. Градишар, Н.Е. Дэвидсон, С. Мартино, Р. Ливингстон, Дж.Н. Ингл, Э.А. Перез, Дж. Карпентер, Д. Херд, Дж.Ф. Холланд, Б.Л. Смит, К.И. Сартор, Э.Х. Леуниг, Дж. Абрамс, Р.И. Шильски, Х.Б. Мусс и Л. Нортон
Цель работы.
С использованием факторной схемы 2 х 2 мы исследовали адъювантную химиотерапию у женщин с раком молочной железы (при наличии пораженных подмышечных лимфатических узлов) с целью сравнения последовательного применения схемы доксорубицин (А), паклитаксел (Т) и циклофосфамид (С) со схемой одновременного применения доксорубицина и циклофосфамида (АС) и последующим применением паклитаксела (Т) в отношении критериев бессимптомного выживания (БСВ) и общего выживания (ОВ); дополнительные задачи заключились в (1) определении того, улучшается ли БСВ и ОВ при увеличении плотности дозы и (2) сравнении токсических эффектов.
Больные и методы.
2005 больных женщин было рандомизировано на получение одной из следующих схем: (I) последовательно А х 4 (дозы) -> Т х 4 -> С х 4 с интервалом в три недели; (II) последовательно А х 4 -> Т х 4 -> С х 4 с интервалом в две недели с филграстимом; (III) одновременно AC x 4 -> T x 4 каждые три недели, или (IV) одновременно AC x 4 -> T x 4 каждые две недели с филграстимом.
Результаты.
Анализ, предписанный протоколом, проводился при медианном сроке наблюдения, составлявшем 36 месяцев: 315 больных имели рецидив заболевания или скончались; неудачный исход лечения ожидался у 515 больных. Плотнодозное лечение улучшало результаты по первичному критерию БСВ (отношение риска RR=0.74 р=0.010) и ОВ (RR=0.69; р=0.013). БСВ за четырехлетний срок составляло 82% для плотнодозных схем и 75% для других схем. Между одновременными и последовательными схемами различий по БСВ и ОВ не отмечено. Не наблюдалось взаимодействия между плотностью дозы и последовательностью применения. Тяжелая нейтропения отмечалась более редко у больных, получавших плотнодозные схемы.
Выводы.
Плотность дозы значительно улучшает клинический результат, несмотря на меньшее, по сравнению с ожидаемым, числом событий на данный срок.
Последовательная химиотерапия столь же эффективна как и одновременная.
* * *
Успехи адъювантной химиотерапии при первичном операбельном раке молочной железы явились результатом с одной стороны применения эффективных препаратов, а с другой результатом применения принципов комбинированной химиотерапии, лежащих в основе современной онкологии [1, 2]. Попытки распространить эти принципы на лечение рака молочной железы за счет значительного повышения доз препаратов до настоящего времени оказывались безуспешными [3, 4]. Действительно, для трех наиболее эффективных препаратов – доксорубицина (А), циклофосфамида (С) и паклитаксела (Т) – уровни доз, превышающие 60 мг/м2, 600 мг/м2 и 175 мг/м2 (на протяжении трех часов), соответственно, не обладают большей эффективностью [5-7].
В данной статье мы сообщаем об исходных результатах проспективного рандомизированного испытания, координировавшегося Группой В по раку и лейкозам (CALGB) под руководством Интергруппы по молочной железе Национального института рака (INT C9741). В этом испытании опробованы две новые концепции, основанные на экспериментальных данных и математическом подходе. Эти концепции, а именно плотность дозы и последовательная терапия, используют в качестве основы и дополнительно развивают теорию комбинированной химиотерапии [8]. Мотивом настоящего сообщения послужило статистически достоверное улучшение, связанное с повышением плотности дозы, на момент анализа, определенный в протоколе.
Поаышение плотности дозы означает применение препаратов с меньшим интервалом времени между моментами их введения. Данный подход основан на наблюдении, что в экспериментальных моделях данная доза всегда убивает определенную относительную долю, а не определенное абсолютное число экспоненциально растущих раковых клеток [9]. Поскольку кинетика роста опухолей человека вообще и опухолей молочной железы в частности обычно описывается неэкспоненциальной кинетикой Гомперца, данная модель была распространена и на такие ситуации [10-14]. Динамика роста опухолевых клеток в период между циклами циторедукции является более быстрой в ограниченных по объему опухолевых моделях, характеризующихся динамикой Гомперца по сравнению с экспоненциальными моделями.Высказывалось предположение, что более частое применение цитотоксического препарата окажется более эффективным способом для сведения к минимуму остаточной опухолевой нагрузки по сравнению с наращиванием дозы (Л. Нортон, рукопись представлена для публикации). В испытании INT С9741 плотнодозный график достигается за счет использования гранулоцитного колониестимулирующего фактора (филграстима), позволяющего повторное применение препаратов А, Т и С один раз в две недели при оптимальных уровнях, вместо обычной схемы с трехнедельными интервалами.
Последовательная химиотерапия означает использование препаратов поочередно, а не одновременно. Этот подход не оспаривает ту точку зрения, что для максимального подавления роста опухолей, состоящих из клеток, гетерогенных по чувствительности к препаратам, требуется несколько препаратов [2]. Эта концепция основана на гипотезе, что для медленно растущих опухолей, таких как большинство опухолей молочной железы, более важным является сохранение плотности дозы, а не использование комбинации, особенно если эта комбинация является более токсичной и требует снижения дозы или увеличения сроков между введением препаратов. Если плотность дозы одинакова при схеме последовательной комбинированной химиотерапии и одновременной химиотерапии, теоретические соображения показывают, что терапевтические результаты должны быть также одинаковыми, даже если последовательная схема введения оказывается менее токсичной [8] (Л. Нортон, рукопись представлена для публикации).
БОЛЬНЫЕ И МЕТОДЫ
Настоящее испытание Интергруппы, координированное CALGB с участием ECOG, SWOG и NCCTG, было открыто для включения больных в период между сентябрем 1997 г. и мартом 1999 г. Задача заключалась в лечении женщин с первичной аденокарциномой молочной железы (включая метапластические и двусторонние поражения) при отсутствии метастазов помимо гистологически затронутых подмышечных лимфатических узлов (стадии Т0-T3, N1/2, M0) [15]. Первичное лечение включало удаление всей опухоли с помощью сегментной мастэктомии (ХХХ) плюс иссечение подмышечного лимфатического узла; другой вариант включал модифицированную радикальную мастэктомию, выполненную таким образом, чтобы по краю разреза не оставалось микроскопических или макроскопических признаков инвазивной опухоли. Требуемые лабораторные данные ограничивались определением исходного уровня билирубина, который должен был находиться в нормальных пределах, определенных для соответствующего учреждения, и перед каждым курсом химиотерапии (включая первый курс) определение содержания гранулоцитов (≥1000/мкл) и тромбоцитов (≥100000/мкл). У больных, которые соответствовали критериям включения в испытание, также проводилась радиография грудной клетки и выполнялось ЭКГ обследование. Все больные предоставили в письменном виде заявление о своем согласии на участие в испытании, которое соответствовало всем федеральным, местным и необходимым для лечебного учреждения правилам.
Предназначенная для лечения негоспитализированных больных, химиотерапия (Рис. 1) проводилась внутривенно, причем ее начинали в пределах 84 дней после выполнения первичной хирургической операции. В исследовании использовалась факторная схема 2х2 для оценки влияния двух факторов, связанных с интенсивностью дозы (2 недели и 3 недели) и последовательности лечения (сравнение одновременного и последовательного применения препаратов), а также для оценки возможного взаимодействия между ними. Больных с одинаковой вероятностью направляли на один из четырех режимов лечения: (I) доксорубицин 60 мг/м2 раз в три недели на протяжении четырех курсов с последующим введением паклитаксела в дозе 175 мг/м2 раз в три недели на протяжении четырех курсов; (II) доксорубицин в дозе 60 мг/м2 раз в две недели на протяжении четырех курсов с последующим применением паклитаксела в дозе 175 мг/м2 каждые две недели на протяжении четырех курсов с последующим применением циклофосфамида в дозе 600 мг/м2 раз в две недели на протяжении четырех курсов с использованием филграстима в 3-10-й дни каждого курса (всего семь доз) в дозе 5 мкг/кг, что могло быть округлено до общей дозы, составляющей 300 или 480 мкг; (III) доксорубицин в дозе 60 мг/м2 плюс циклофосфамид в дозе 600 мг/м2 раз в три недели на протяжении четырех курсов с последующим применением паклитаксела в дозе 175 мг/м2 раз в три недели на протяжении четырех курсов; (IV) доксорубицин в дозе 60 мг/м2 плюс циклофосфамид в дозе 600 мг/м2 раз в две недели на протяжении четырех курсов с последующим применением паклитаксела в дозе 175 мг/м2 раз в две недели на протяжении четырех курсов с использованием филграстима в 3-10-й дни каждого курса в дозе 5 мкг/кг, что могло быть округлено до общей дозы, составляющей 300 или 480 мкг. Режим III представлял собой наилучшую группу по протоколу INT С9344; в последнем испытании эту схему сравнивали с четырьмя курсами схемы АС, вводимой каждые три недели, после чего не следовало применения паклитаксела [16]. Режим II представлял собой наиболее необычную дозовую схему, поскольку она являлась как плотнодозной, так и последовательной, ранее в концептуальном плане исследовался Hudis и соавт. [17].
После каждого применения химиопрепаратов проводили полный анализ форменных элементов крови. Если содержание гранулоцитов составляло менее 1000/мкл или содержание тромбоцитов менее 100 000/мкл на запланированный день лечения, проведение химиотерапии откладывали до тех пор, пока не достигались указанные минимальные уровни. Если задержка составляла более трех недель, вступали в контакт с руководителем испытания. Изменения дозы химиотерапии обсуждались с руководителем испытания. Когда из-за токсичности были показаны изменения, дозу препарата снижали ступеньчато по 25% в соответствии со степенью токсичности.
Лучевая терапия в тех случаях, когда она использовалась, проводилась после завершения химиотерапии. Хотя рекомендации касательно этой методики были включены в письменный протокол, исследователям разрешалось следовать рекомендациям, существовавшем в каждом из участвовавших в испытании учреждений. Было рекомендовано, но не требовалось в обязательном порядке, чтобы лечение тамоксифеном в дозе 20 мг/день начиналось в пределах 12 недель после завершения химиотерапии и продолжалось в течение пяти лет у всех больных в состоянии до менопаузы с опухолями, дающими положительный анализ на гормональные рецепторы; такая схема также должна была применяться у всех больных после менопаузы безотносительно к их рецепторному статусу.
Продолжительность выживания без признаков заболевания, представлявшая собой основной конечный критерий испытания, определялась от момента начала участия в испытании до появления местного рецидива, отдаленного рецидива или летального исхода в отсутствие рецидива, в зависимости от того, что наступало раньше.
Распространение заболевания на контралатеральную молочную железу, наблюдавшееся одновременно с местным распространением и/или появлением заболевания в другой отдаленной локализации считалось рецидивом; однако проявление заболевания в контралатеральной молочной железе при отсутствии местного или отдаленного рецидива считалось вторым первичным заболеванием. Все случаи второго первичного заболевания, безотносительно к локализации, считались побочными эффектами, а не неудачными результатами в отношении выживания в отсутствие признаков болезни.
Выжившие больные с отсутствием признаков заболевания учитывались на срок, на который существовала последняя информация относительно того, что у них не было признаков первичного рака молочной железы. Вторичный конечный критерий, а именно общее время выживания (ОВ), измерялось от момента начала участия в испытании до летального исхода от любой причины; выжившие больные учитывались на дату последнего контакта. Летальный исход в результате острого миелогенного лейкоза (ОМЛ), миелодисплатического синдрома (МДС) считался связанным с лечением. Количество больных, участвовавших в испытании, составляло 1584 человека за 22 месяца, причем исходный анализ испытания выполнялся через три года после завершения набора больных в испытание. Это обеспечивало 90%-ную разрешающую способность для выявления 33%-ного различия в отношении риска любого из двух основных эффектов, считая, что процент событий был равен таковой характеристике, наблюдавшейся в проводившемся ранее испытании Интергруппы (CALGB) [5]. Для моделирования и оценки связи между временем выживания без признаков болезни и общим временем выживания, с одной стороны, и факторами лечения и клиническими параметрами, с другой, использовалась пропорциональная регрессия отношения риска по Коксу с использованием критерия χ2 по Вальду. Для сравнения распределений событий во времени использовались графики по Каплану-Мейеру. Для сравнения двух или большего числа отношений использовался табличный метод анализа. 95%-ные доверительные интервалы (ДИ) переменных, характеризующих время до наступления события, использовалисьв соответствии с методом Хосмера и Лемешоу [18]. Все значения Р являются двусторонними. Классификация токсических эффектов была основана на расширенных обычных критериях токсичности, использованных в испытании CALGB. Информацию о больных собирали на стандартных формулярах, использовавшихся в испытании CALGB, отделом оперативной обработки данных испытания CALGB, находившемся в г. Дархем, штат Северная Каролина, и эти данные вводили в базу данных CALGB. Данные были обновлены на май 2002 г.
В соответствии с политикой, сформулированной Национальным институтом рака, мониторинг исследования выполнялся независимым комитетом по мониторингу данных и безопасности. Протокол испытания предписывал трехлетний срок наблюдения после включения последнего больного в испытание, и на тот момент комитет по мониторингу данных и безопасности открыл результаты для анализа комитетом по молочной железе CALGB. Исследование было начато в сентябре 1999 г., и его первое рассмотрение с целью мониторинга проведено в ноябре 1999 г.
Последующие пересмотры осуществлялись через каждые шесть месяцев до июня 2002 г., когда комитет по мониторингу данных и безопасности решил опубликовать данные.
Структурированный промежуточный план анализа, включенный в протокол, строго соблюдался. Этот план определял время проведения анализов, скорректированные значения Р и альфа-затратную функцию.
РЕЗУЛЬТАТЫ В период с сентября 1997 г. по март 1999 г. в испытание на добровольной основе было включено 2005 женщин из групп CALGB (41%), ECOG (30%), SWOG (16%) и NCCTG (13%). Общее количество было более высоким, чем запланировано (1584 больных), что отражало попытку компенсировать более высокие, по сравнению с ожидаемыми, темпы набора больных. Тридцать две больных вообще не получали лечения в соответствии с протоколом. 1973 больных (более 98%), которые получали лечение, являются основой настоящего сообщения (Таблица 1). Медиана возраста больных составляла 50 лет, у 65% опухоли были положительными по эстрогеновым рецепторам (ЭР- положительные), медиана числа пораженных лимфатических узлов была равна 3, а у 12% больных число пораженных подмышечных лимфатических узлов составляло десять или более. Схемы лечения были уравновешены по отношению к указанным и всем прочим основным переменным, относящимся к периоду до лечения.
Максимальное и медианное время наблюдения составляло 5 лет и 3 года, соответственно. После медианного времени наблюдения, составлявшего 36 месяцев, у 315 больных отмечался рецидив заболевания или они скончались; для сравнения укажем, что число ожидаемых неудачных результатов составляет 515 человек, исходя из допущения, что в обеих группах процент отмеченных неудачных результатов должен быть таким же, какой мы наблюдали для CALGB 8541 [5]. Меньшее число неудачных результатов по сравнению с ожидаемым отчасти объясняется быстрым темпом набора больных, а отчасти более благоприятным ходом заболевания у всех женщин, участвовавших в испытанию, по сравнению с тем. что наблюдалось в предшествующих испытаниях CALGB [5, 16].
Как указано в Таблице 2, время БСВ (бессимптомное выживание) было достоверно увеличенным для плотнодозных схем (II и IV) по сравнению со схемами один раз в три недели (I и III; отношение риска (RR) равно 0,74; Р=0,010). Эффект плотности дозы оставался статистически достоверным даже после введения поправок на число положительных лимфатических узлов, размеры опухоли, статус в отношении менопаузы и статус опухоли в отношении ЭР. Последовательность лечения не коррелировала с БСВ (Р=0,58), также не было получено указаний на взаимодействие между плотностью дозы и последовательностью лечения (Р=0,40). На Рисунках 2А, 3А и 4А приведены основные эффекты плотности дозы и последовательности лечения, а также отсутствие взаимодействия между этими двумя факторами.
Полученные путем оценки проценты БСВ (и соответствующие 95%-ные доверительные интервалы) для плотнодозных схем и обычных схем с введением препарата один раз в три недели составляли 97 % (95%-ный ДИ от 96,8% до 97,1%) и 95% (95%-ный ДИ от 94,8% до 95,2%) через год, 91 % (95%-ный ДИ от 90,6% до 91,4%) и 87% (95%-ный ДИ от 86,5% до 87,5%) через два года, 85 % (95%-ный ДИ от 84,5% до 85,5%) и 81% (95%- ный ДИ от 80,3% до 81,7%) через три года и 82 % (95%-ный ДИ от 80,7% до 83,3%) и 75% (95%-ный ДИ от 73,7% до 76,2%) для срока в четыре года. Первые два результата (как абсолютные цифры, так и относительная разность) мало изменятся в ходе дальнейшего наблюдения. Причина этого заключается в том, что все больные участвовали в испытании более двух лет, и для срока в один год полные данные имеются для 99% больных, а для срока в два года - для 92% больных. Общая выживаемость (ОВ) для срока три года составляла 92% (95%-ный ДИ от 91,7% до 92,3%) для плотнодозных схем и 90% (95%-ный ДИ от 89,6% до 90,4%) для схем, в которых лечение проводилось с интервалом в три недели. Относительное снижение риска рецидивирования за счет использования плотнодозного графика составляло 28% через одиг год, 13% через два года, 50% через три года и 52% через четыре года. Хотя эти последние оценки характеризуются большими значениями стандартных ошибок (СО), этот результат показывает, что преимущества использования плотнодозного графика продолжают сохраняться и при более длительных сроках наблюдения.
Общее относительное снижение риска за счет использования плотнодозного графика лечения составляло 19% для ЭР-положительных опухолей и 32% для ЭР- отрицательных опухолей. Это различие за счет статуса в отношении ЭР (взаимодействие между ЭР и лечением) не является статистически достоверным. Не отмечалось различий в характере местного рецидивирования в связи с любым из двух факторов лечения (плотность дозы или последовательность применения препаратов), несмотря на наличие различий в сроке между хирургической операцией и местной лучевой терапией (от 19 до 37 недель).
В Таблице 3 показано, что ОВ достоверно увеличивалась на плотнодозных схемах (RR=0,69; Р=0,13) даже после введения поправок на стандартные клинические переменные на момент до лечения, о чем ранее уже упоминалось. Последовательность лечения не давала достоверной корреляции с ОВ (Р=0,48). Не отмечалось взаимодействия между плотностью и последовательностью лечения (Р=0,013). На Рис. 2Б и 3Б показаны взаимоотношения между ОВ и плотностью лечения и ОВ и последовательностью применения препаратов, соответственно. На Рис. 4Б иллюстрируется отсутствие взаимодействия между указанными двумя факторами.
Локализации первого рецидива приведены в Таблице 4. Хотя данное испытание не было спланировано для формального сравнения среди групп, общий характер неудачных исходов является сходным для разных использованных режимов лечения.
Для 1962 больных имелись стандартные данные токсических эффектов, не относящихся к кроветворению, степеней 3-5 (Таблица 5). Детальные данные в отношении задержки применения дозы, фактически полученной дозы препарата, переливания крови, госпитализации и осложнений имелись для 412 больных, получивших более 3973 курсов лечения (Таблица 6). Летальных исходов, связанных с лечением, во время лечения отмечено не было. На протяжении первых шести месяцев лечения по протоколу отмечался только один летальный исход; причина смерти, а именно инфаркт церебрального сосуда, была сочтена не имеющей отношения к лечению. Число случаев задержки курса лечения было относительно небольшим: от 7% на схемах I и II до 8% и 6% на схемах III и IV, соответственно. Что касается курсов, в отношении которых произошла задержка, 38% случаев задержки на схемах, когда курсы проводились с трехнедельными интервалами, было результатом гематологической токсичности; соответствующая цифра для схем, применявшихся раз в две недели, составляла 15% (Р<0,0001). Число случаев снижения дозы было невелико (Таблица 7). В целом, только 3% больных подвергалось госпитализации в связи с фебрильными состояниями, связанными с нейтропенией. Гранулоцитопения степени 4 (<500/мкл) чаще отмечалась в группах, получавших курсы лечения с трехнедельными интервалами, по сравнению с плотнодозными схемами (33% и 6%; Р<0,01). Хотя 13% больных, получавших плотнодозную схему IV с одновременным применением препаратов, была проведена, по крайней мере, одна трансфузия тромбоцитарной массы, в группе, получавшей последовательное лечение с трехнедельными интервалами (I) трансфузий не было, а их число для каждой из двух других схем составляло менее 4% (Р=0,002). Рвота степени 3 или более сильная наблюдалась достоверно чаще при использовании одновременного приема препаратов, чем для последовательных схем (7% и3%; Р=0,0002).
Было зарегистрировано шесть летальных исходов, связанных с лечением (Таблица 8), все они отмечались в период от 23 до 41 месяца после начала лечения. В одном случае причиной была кардиомиопатия, связанная с применением доксорубицина, в одном случае причиной был МДС, а в четырех случаях ОМЛ, все они были распределены между четырьмя схемами лечения без какой-либо группировки.
До настоящего времени о поздней выраженной кардиотоксичности, требовавшей лечения сообщалось менее чем для 2% больных. Больные, получавшие схемы один раз в три недели, имели несколько более высокую частоту поздней кардиотоксичности, по сравнению с больными, получавшими лечение с интервалом в две недели (2% и 1%; Р=0,11). Тяжелая нейротоксичность после проведения химиотерапии, в целом, была редкой, однако чаще отмечалась в группе одновременной химиотерапии, по сравнению с последовательными схемами (4% и 2%; Р=0,0050).
У 58 больных было зарегистрировано повторное появление первичных опухолей (Таблица 9), включая 11 случаев ОМЛ или МДЛ (в т.ч. с летальным исходом), которые были диагностированы в сроки от 10 до 42 месяцев после включения в испытание; отмечалось 17 случаев инвазивного рака молочной железы и три случая карциномы протока молочной железы in situ, все они распределялись среди четырех использовавшихся схем лечения без какой-либо группировки. Частота ОМЛ или МДС в расчете на трехлетний срок составляла 0,18%. Это значение близко к тому, что было описано для предыдущего исследования Интергруппы (0,17%) у сходного контингента больных и при аналогичной медиане срока наблюдения (16). Филграстим не оказывал влияния на частоту лейкозов. Плотнодозная химиотерапия достоверно снижала частоту рака в контралатеральной молочной железе (0,3% и 1,5%, соответственно; Р=0,0004).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее проведенные испытания показали, что добавление новых эффективных лекарственных препаратов последовательно к схемам адъювантной терапии может улучшать выживаемость у больных с ранними стадиями рака молочной железы (16, 19).
Кроме того, как предсказывается теорией, последовательная химиотерапия давала лучшие результаты по сравнению с строго попеременным характером применения препаратов (14, 20). Опубликованное недавно испытание последовательного применения схемы АС (А->С) по сравнению с одновременным применением АС для адъювантного лечения, продемонстрировало отсутствие каких-либо терапевтических различий. При последовательном применении отмечалась более высокая токсичность, однако в этом испытании были созданы намеренно большие различия между группами в отношении использованных уровней доз каждого из препаратов [21]. Интерпретация этого испытания осложняется соображениями, связанными с зависимостью между дозой и эффектом и кажущимся отсутствием повышения положительного результата для комбинации А и С в дозах, более высоких, чем определенные уровни [5, 6].
Проспективное рандомизированное сравнение последовательной комбинированной химиотерапии с одновременной комбинированной химиотерапией с применением одних и тех же препаратов при одних и тех же уровнях доз и одинаковых плотностях доз ранее никогда не проводилось. В испытании INT С9741 это сравнение достигалось путем испытания схемы АС->Т по сравнению со схемой А->Т->С, причем дополнительным обстоятельством было то, что каждая схема испытывалась при двух различных значениях плотности дозы в рамках схемы 2х2.
Через три года после завершения набора больных в испытание общее число рецидивов при определявшемся по протоколу анализе было меньше, чем ожидалось. Мы высказываем предположение, что это может быть отчасти связано с более широким использованием тамоксифена в настоящем испытании по сравнению с испытанием CALGB 8541 и возможно также связано с изменением стадий (внутри стадий) в результате лучшего скрининга с помощью маммографии. У больных, получавших лечение стандартной схемой АС->Т с интервалом в три недели в испытании С9741 отмечалось меньше рецидивов в соответствующий срок наблюдения по сравнению с больными, получавшими стандартную схему АС->Т в испытании 9344, о чем сообщали Henderson и соавт. [16].
Данные по БСВ в настоящем испытании были значительно продвинутыми через один год и два года наблюдения, так, что статистически достоверное улучшение в результатах за счет повышения плотности дозы на сроки один год и два года не исчезнет при более длительных сроках наблюдения. Однако наблюдаемое преимущество, связанное с повышением выживания в результате повышения плотности дозы, отмечается в сроки после двух лет, и поэтому, вероятно, изменятся в большей степени, чем изменятся цифры для БСВ. С другой стороны, преимущества в плане ОВ развиваются позже, чем преимущества в плане БСВ, что биологически понятно и придает дополнительный вес наблюдаемому улучшению в плане общего выживания.
Преимущества использования плотнодозного режима в отношении БСВ и ОВ не сопровождались повышением токсичности. Использование филграстима в плотнодозных схемах приводило к статистически достоверному снижению токсичности в отношении гранулоцитов. Однако низкий процент госпитализации и отсутствие летальности во время проведения химиотерапии являются иллюстрацией безопасности всех четырех схем лечения. Низкий процент сепсиса, связанного с нейтропенией, также говорит в поддержку безопасности использования базового содержания гранулоцитов, равного 1000/мкл (а не традиционного значения, равного 1500/мкл) при проведении химиотерапии. Использование этого более низкого предела также может объяснять относительную редкость случаев задержки при проведении лечения.
В настоящее время полученные данные находятся в согласии с математическими предсказаниями относительно того, что плотность дозы повышает терапевтические результаты и что последовательная химиотерапия при поддержании плотности дозы сохраняет эффективность при снижении токсичности. Следует, однако, сделать несколько оговорок. Результаты вполне могут быть специфическими в отношении лекарственного препарата и заболевания; максимальный срок наблюдения, составляющий пять лет, все еще является относительно небольшим, и связанные с лечением характер позднего рецидивирования (включая местное рецидивирование) и токсические эффекты могут еще проявиться. Кроме того, пока не установлено твердо значение преимуществ в отношении ОВ при длительных сроках наблюдения для плотнодозной схемы. Результаты нашего настоящего испытания также ограничивает то обстоятельство, что данные по проценту облучения для различных групп лечения пока еще не сведены воедино.
Следует обратить серьезное внимание на соотношение между затратами и преимуществами, поскольку использование филграстима повышает затраты. По сравнению со стандартной схемой лечения, он может повысить стоимость проведения химиотерапии на тысячи долларов. Другие отрицательные моменты, связанные с влиянием филграстима, могут включать легкие/умеренные формы миалгий и артралгий, а также неудобство, связанное с необходимостью проведения инъекций в течение семи дней на протяжении курса.
Статистически достоверные преимущества в отношении БСВ и ОВ, наблюдавшиеся для плотнодозных схем, заслуживают дальнейшего исследования. Онкологи должны рассмотреть значение настоящего испытания для клинической практики в контексте полученных данных. Настоящий массив данных будет отслеживаться и далее с применением стандартных статистических методов, и в будущем будут опубликованы дальнейшие отчеты.
Наши результаты указывают на интересные направления будущих исследований.
Например, последовательная плотнодозная терапия с использованием одного препарата может позволить быстрое включение новых лекарственных препаратов в терапевтические схемы, к таким препаратам могут относиться и биологические агенты.
Укорочение интервалов между курсами (в частности, начало повторного лечения немедленно после того, как содержание гранулоцитов достигает уровня 1000/мкл, а не использование фиксированного временного интервала) также может быть предметом дополнительного исследования. Необходимо также проанализировать вопросы качества жизни для больных, получающих такие схемы лечения. Далее, исследование, касающееся биологической этиологии роста в соответствии с кинетикой Гомперца и исследование молекулярных механизмов пертурбаций такого роста может быть использовано для предложения новых, эмпирически проверяемых вариантов манипуляции дозовых режимов.
Литература
1. Fisher B: From Halsted to prevention and beyond: Advances in the management of breast cancer during the twentieth century. Eur J Cancer 35:1963-1973, 1999
2. DeVita VT Jr, Young RC, Canellos GP: Combination versus single agent chemotherapy: A review of the basis for selection of drug treatment of cancer. Cancer 35:98-110, 1975
3. Peters WP, Rosner G, Vredenburgh J, et al: Updated results of a prospective, randomized comparison of two doses of combination alkyating agents as consolidation after CAF in high-risk primary breast cancer involving ten or more axillary lymph nodes: CALGB 9082/SWOG 9114/ NCIC MA-13. Proc Am Soc Clin Oncol 20:21a, 2001 (abstr 81)
4. Crown JP, Lind M, Gould A, et al: High-dose chemotherapy with autograft support is not superior to cyclophosphamide, methotrexate and 5-FU following doxorubicin induction in patients with breast cancer and four or more involved axillary lymph nodes. Proc Am Soc Clin Oncol 21:42, 2002 (abstr 166)
5. Budman DR, Berry DA, Cirrincione CT, et al: Dose and dose intensity as determinants of outcome in the adjuvant treatment of breast cancer: The Cancer and Leukemia Group B. J Natl Cancer Inst 90:1205-1211, 1998
6. Fisher B, Anderson S, DeCillis A, et al: Further evaluation of intensified and increased total dose of cyclophosphamide for the treatment of primary breast cancer: Findings from National Surgical Adjuvant Breast and Bowel Project B-25. J Clin Oncol 17:3374-3388, 1999
7. Winer E, Berry D, Duggan D, et al: Failure of higher dose paclitaxel to improve outcome in patients with metastatic breast cancer—Results from CALGB 9342. Proc Am Soc Clin Oncol 117:388, 1998 (abstr 101)
8. Norton L: Theoretical concepts and the emerging role of taxanes in adjuvant therapy. Oncologist 3:30-35, 2001 (suppl)
9. Skipper HE: Laboratory models: Some historical perspectives. Cancer Treat Rep 70:3-7, 1986
10. Norton L, Simon R, Brereton JD, et al: Predicting the course of Gompertzian growth. Nature 264:542-545, 1976
11. Norton L, Simon R: The growth curve of an experimental solid tumor following radiotherapy. J Natl Cancer Inst 58:1735-1741, 1977
12. Norton L, Simon R: Tumor size, sensitivity to therapy and the design of treatment protocols. Cancer Treat Rep 61:1307-1317, 1977
13. Norton L: A Gompertzian model of human breast cancer growth. Cancer Res 48:7067-7071, 1988
14. Norton L: Implications of kinetic heterogeneity in clinical oncology. Semin Oncol 12:231-249, 1985
15. Beahrs OH, Henson DE, Hutter RVP, et al (eds): American Joint Committee on Cancer Manual for Staging of Cancer (ed 4). Philadelphia, PA, JB Lippincott, 1992, p 149
16. Henderson IC, Berry DA, Demetri GD, et al: Improved outcomes from adding sequential pacitaxel but not from escalating doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer. J Clin Oncol (in press)
17. Hudis C, Seidman A, Baselga J, et al: Sequential dose-dense doxo-rubicin, paclitaxel, and cyclophosphamide for resectable high-risk breast cancer: Feasibility and efficacy. J Clin Oncol 17:93-100, 1999
18. Hosmer DW, Lemeshow S: Applied Logistic Regression. New York, NY, Wiley, 1989, pp 42-44
19. Perloff M, Norton L, Korzun AH, et al: Postsurgical adjuvant chemotherapy of stage II breast carcinoma with or without crossover to a non-cross-resistant regimen: A Cancer and Leukemia Group B study. J Clin Oncol 14:1589-1598, 1996
20. Bonadonna G, Zambetti M, Valagussa P: Sequential or alternating doxorubicin and CMF regimens in breast cancer with more than three positive nodes: Ten year results. J Am Med Assoc 273:542-547, 1995
21. Haskell CM, Green SJ, Sledge GW Jr, et al: Phase III comparison of adjuvant high-dose doxorubicin plus cyclophosphamide (AC) versus sequential doxorubicin followed by cyclophosphamide (A-.C) in breast cancer patients with 0-3 positive nodes (Intergroup 0137). Proc Am Soc Clin Oncol 21:36a, 2002 (abstr 142)Таблица 1. Характеристики контингента больных и переменные, зарегистрированные до лечения, в зависимости от схемы
Характеристики
I
II
III
IV
Число
больных%
Число
больных%
Число
больных%
Число
больных%
Всего лечилось
484
100
493
100
501
100
495
100
Стратификация
Число положительных лимфатических узлов
1-3
287
59
292
59
301
60
293
59
4-9
139
29
143
29
142
28
145
29
10+
57
12
58
12
57
11
57
11
Иссечение «сторожевого» узла
1
<1
0
0
1
<1
0
0
Демографические данные
Возраст
<40 лет
64
13
75
15
84
17
75
15
40-49 лет
172
36
172
35
175
35
168
34
50-59 лет
166
34
149
30
161
32
163
33
60-69 лет
70
14
86
17
64
13
78
16
70+ лет
12
3
11
2
17
3
11
2
Статус в отношении менопаузы
До
2411
50
237
48
241
49
238
48
После
235
48
249
51
254
50
247
50
Отсутствует
8
2
7
1
6
1
10
2
Статус в отношении ЭР
Отрицательный
163
34
175
35
164
33
160
32
Положительный
313
64
311
63
327
65
325
66
Данные отсутствуют
8
2
7
2
10
2
10
2
Размер опухоли
≤ 2 см
185
38
212
43
194
39
199
40
> 2 см
289
60
271
55
292
58
287
58
Данные отсутствуют
10
2
10
2
15
3
9
2
Хирургическая операция
Удаление сегмента МЖ
162
33
173
35
185
37
187
37
Мастэктомия
312
65
306
62
300
60
301
61
Прочее
7
1
10
2
11
2
4
1
Неизвестно
3
1
4
1
5
1
3
1
Тамоксифен
Получали
339
70
350
71
337
67
353
71
Не получали
145
30
143
29
164
33
142
29
Получали
Пременопаузальные
160
33
156
32
149
30
153
31
Постменопаузальные
173
36
189
38
186
37
192
38
С неизвестным статусом
6
1
5
1
2
<1
8
2
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей) ЭР=эстрогеновый рецепторТаблица 2. Модель пропорционального риска Кокса с многими переменными: бессимптомная выживаемость (N=1973)
Переменная
Сравнение по отношению риска*
Отношение риска
95%-ный ДИ
Р
Число положительных лимфоузлов**
1 и 10
0,45
от 0,57 до 0,44
<0,0001
Размер опухоли в см***
2 и 5
0,65
от 1,27 до 0,78
<0,0001
Статус в отношении менопаузы
После и до
0,92
от 1,17 до 0,74
0,54
Статус в отношении ЭР
Положительный и отрицательный
0,30
от 0,38 до 0,23
<0,0001
Последовательность
Одновременное и последовательное
0,93
от 1,17 до 0,74
0,58
Плотность
Раз в 2 недели и раз в 3 недели
0,74
от 0,93 до 0,58
0,10
Взаимодействие между плотностью и последовательностью
0,40
*Первая категория обозначает группу с более высоким риском неудачи
**В анализах использовались значения квадратного корня
***Девяносто один процент больных с ЭР+ опухолями получали тамоксифен. Поэтому преимущества положительного статуса по ЭР осложняются за счет тамоксифена.
Таблица 3. Модель пропорционального риска Кокса с многими переменными: общая выживаемость (N=1973)
Переменная
Сравнение по отношению риска*
Отношение риска
95%-ный ДИ
Р
Число положительных лимфоузлов**
1 и 10
0,42
от 0,57 до 0,32
<0,0001
Размер опухоли в см***
2 и 5
1,49
от 0,67 до 0,52
0,0019
Статус в отношении менопаузы
После и до
0,90
от 1,21 до 0,66
0,50
Статус в отношении ЭР
Положительный и отрицательный
0,17
от 0,24 до 0,12
<0,0001
Последовательность
Одновременное и последовательное
0,89
от 1,20 до 0,66
0,48
Плотность
Раз в 2 недели и раз в 3 недели
0,69
от 0,92 до 0,50
0,013
Взаимодействие между плотностью и последовательностью
0,13
*Первая категория обозначает группу с более высоким риском неудачи
**В анализах использовались значения квадратного корня
***Девяносто один процент больных с ЭР+ опухолями получали тамоксифен. Поэтому преимущества положительного статуса по ЭР осложняются за счет тамоксифена.Таблица 4. Локализация первого рецидива в зависимости от схемы лечения
Характеристики
I
II
III
IV
Число
больных%
Число
больных%
Число
больных%
Число
больных%
Всего неудачных исходов
93
100
67
100
86
100
69
100
Локализация рецидива
Только местные
23
25
18
27
19
22
14
20
Только отдаленные
58
62
44
66
56
65
46
67
Одновременно местные и отдаленные
12
13
5
7
11
13
9
13
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитакселкаждые две недели (см. текст в отношении деталей)
Таблица 5. Основные токсические эффекты, наблюдавшиеся в ходе применения протокола
Схема
Степень токсичности
Всего
3*
4**
5***
Число
больных%
Число
больных%
Число
больных%
Лейкоциты
I
2
0
4
1
0
0
479
II
0
0
1
0
0
0
490
III
3
1
57
11
0
0
500
IV
1
0
28
6
0
0
493
Тромбоциты
I
0
0
1
0
0
0
479
II
0
0
0
0
0
0
490
III
2
0
0
0
0
0
500
IV
1
0
3
0
0
0
493
Трансфузия тромбоцитов
I
0
0
0
0
0
0
479
II
0
0
0
0
0
0
490
III
0
0
0
0
0
0
500
IV
0
0
0
0
0
0
493
Гемоглобин
I
0
0
0
0
0
0
479
II
0
0
1
0
0
0
490
III
1
0
0
0
0
0
500
IV
0
0
1
0
0
0
493
Гранулоциты/ сегментоядерные
I
0
0
113
24
0
0
479
II
1
0
14
3
0
0
490
III
0
0
214
43
0
0
500
IV
1
0
46
9
0
0
493
Тошнота
I
22
5
1
0
0
0
479
II
34
7
1
0
0
0
490
III
41
8
3
1
0
0
500
IV
41
8
0
0
0
0
493
Рвота
I
10
2
4
1
0
0
479
II
14
3
4
1
0
0
490
III
32
6
8
2
0
0
500
IV
18
4
12
0
0
0
493
Понос
I
5
2
1
1
0
0
479
II
8
1
4
1
0
0
490
III
7
1
5
0
0
0
500
IV
5
1
0
0
0
0
493
Стоматит
I
5
1
0
0
0
0
479
II
4
1
2
0
0
0
490
III
14
3
0
1
0
0
500
IV
9
2
4
0
0
0
493
Сердечная деятельность
I
5
1
1
0
0
0
479
II
4
1
0
0
0
0
490
III
1
0
1
0
0
0
500
IV
0
0
1
0
0
0
493
Прочие кардиологические эффекты
I
2
0
0
0
0
0
479
II
0
0
0
0
0
0
490
III
0
0
0
0
0
0
500
IV
1
0
0
0
0
0
493
Флебиты/тромбозы
I
3
1
0
0
0
0
479
II
4
1
0
0
0
0
490
III
3
1
0
0
0
0
500
IV
4
1
0
0
0
0
493
Сенсорные нарушения
I
21
4
0
0
0
0
479
II
19
4
1
0
0
0
490
III
25
5
2
0
0
0
500
IV
19
4
0
0
0
0
493
Моторные нарушения
I
4
1
0
0
0
0
479
II
4
1
0
0
0
0
490
III
8
2
1
0
0
0
500
IV
5
1
0
0
0
0
493
Боль
I
19
4
0
0
0
0
479
II
33
7
1
0
0
0
490
III
31
6
3
0
0
0
500
IV
46
9
1
0
0
0
493
Кожные проявления
I
8
2
1
0
0
0
479
II
15
3
3
0
0
0
490
III
2
0
0
0
0
0
500
IV
11
2
1
1
0
0
493
Миалгии/артралгии
I
23
5
0
0
0
0
479
II
25
5
0
1
0
0
490
III
25
5
2
0
0
0
500
IV
26
5
0
0
0
0
493
Инфекции
I
14
3
1
0
0
0
479
II
19
4
0
0
0
0
490
III
27
5
0
0
0
0
500
IV
13
3
2
0
0
0
493
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей)
*Тяжелый токсический эффект
**Токсический эффект, угрожающий жизни
**Токсический эффект, приведший к летальному исходу
Таблица 6. Осложнения в ходе лечения в зависимости от схемы лечения
Осложнения
I
II
III
IV
Число
больных%
Число
больных%
Число
больных%
Число
больных%
Общее число больных*
103
100
101
100
104
100
104
100
Снижение дозы
Во время введения доксорубицина
7
7
5
5
1
1
3
3
Во время применения циклофосфамида
1
1
3
3
5
5
5
5
Во время применения паклитаксела
1
1
7
7
4
4
5
5
Трансфузия эритроцитарной массы
0
0
10
2
15
3
64
13
Госпитализации по поводу фебрильной нейтропении
14
3
10
2
25
5
10
2
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей)
*Общее число больных, по которым получены данные.Таблица 7. Снижение дозы в зависимости от схемы лечения
Снижение дозы
I
II
III
IV
Число
больных%
Число
больных%
Число
больных%
Число
больных%
Всего больных, по которым имеются данные
103
100
101
100
104
100
104
100
Во время введения доксорубицина
7
7
5
5
1
1
3
3
Во время применения циклофосфамида
1
1
3
3
5
5
5
5
Во время применения паклитаксела
1
1
7
7
4
4
5
5
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей)Таблица 8. Летальные исходы, связанные с лечением (n=6)
Схема
Время выживания (месяцы)
Причина смерти
I
30
Сердечная недостаточность
I
40
ОМЛ
I
41
ОМЛ
II
23
ОМЛ
III
30
МДС
III
39
Инфекция на фоне ОМЛ
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.
Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей)
Сокращения. ОМЛ=острый миелолейкоз; МДС=миелодиспластический синдром.Таблица 9. Новые случаи первичных опухолей в зависимости от использованной схемы лечения
Всего лечилось
484 (100%)
493 (100%)
501 (100%)
495 (100%)
Всего с новой первичной опухолью
16 (3%)
16 (3%)
12 (2%)
14 (3%)
Контралатеральная молочная железа
9
2
6
1
Карцинома протока
1
1
0
1
Рак шейки матки
1
0
0
1
Рак яичника
0
1
0
0
Рак эндометрия
0
1
0
1
ОМЛ/МДС
2
3
4
2
Базальные/плоскоклеточные опухоли
0
3
1
2
Меланома
1
1
0
1
Опухоль легкого
0
2
1
0
Опухоль щитовидной железы
0
0
0
2
Опухоль толстого кишечника
0
0
0
1
Опухоль тонкого кишечника
0
0
0
1
Опухоль мочевого пузыря
0
0
0
1
Опухоль почки
2
0
0
0
Опухоль поджелудочной железы
0
1
0
0
Опухоль гипофиза
0
1
0
0
Примечание. Схема I: последовательно доксорубицин ->паклитаксел->циклофосфамид -> каждые три недели.
Схема II: последовательно доксорубицин ->паклитаксел-> циклофосфамид каждые две недели.
Схема III: одновременно доксорубицин и циклофосфамид каждые три недели с последующим применением паклитаксела каждые три недели.Схема IV: одновременно доксорубицин и циклофосфамид каждые две недели, затем паклитаксел каждые две недели (см. текст в отношении деталей)
Сокращения. DCIS=карцинома протока in situ; ОМЛ=острый миелолейкоз; МДС=миелодиспластический синдром.Рис. 1. Схема лечения
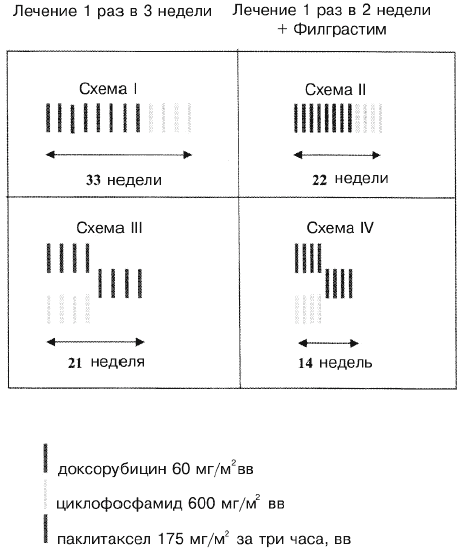
Рис. 2. (А) бессимптомная выживаемость в зависимости от плотности дозы; (В) общая выживаемость в зависимости от плотности дозы.
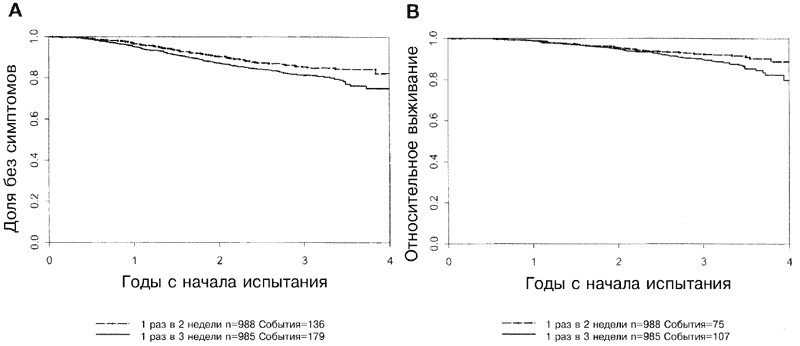
Рис. 3.(слева). (А) бессимптомная выживаемость в зависимости от последовательности; (В) общая выживаемость в зависимости от последовательности.
Рис. 4. (справа). (А) бессимптомная выживаемость в зависимости от группы лечения; (В) общая выживаемость в зависимости от группы лечения. 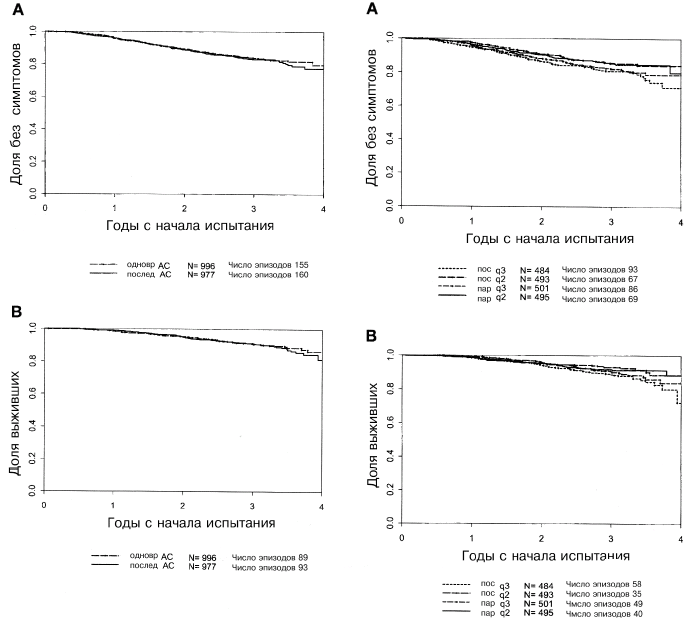
| Январь 2004 г. |